
CHEMIA OGÓLNA
CHEMIA OGÓLNA
Wykład 5

AGH WIMiR, wykład z chemii ogólnej
2
CHEMIA ROZTWORÓW
CHEMIA ROZTWORÓW
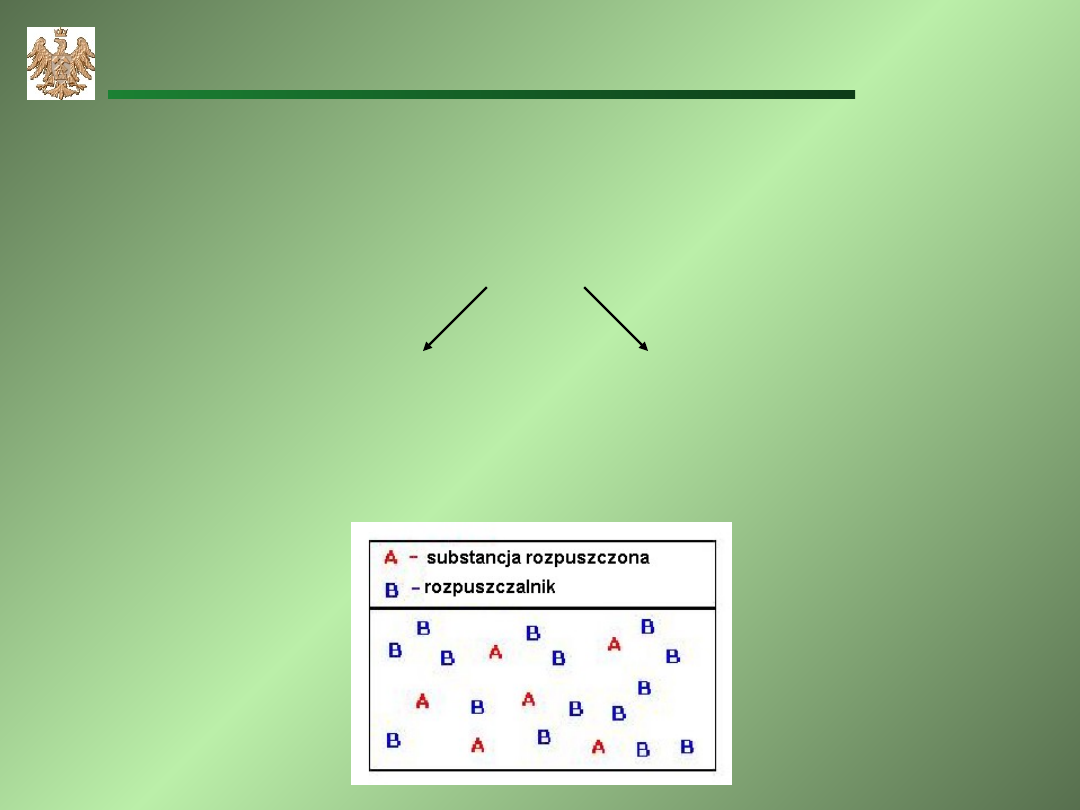
Roztwór
Roztwór – homogeniczna mieszanina składająca się z
jednej lub więcej substancji rozpuszczonych w
rozpuszczalniku.
AGH WIMiR, wykład z chemii ogólnej
3
Rodzaje roztworów
Rodzaje roztworów
substancja rozpuszczona
stopy metali
wilgoć
w drewnie
wodór
w platynie
ciało
stałe
słodkie
napoje
herbata
wódka
etanol w wodzie
napoje
gazowane
CO
2
w wodzie
ciecz
dym
popiół w
powietrzu
wilgoć
woda w
powietrzu
powietrze
O
2
i inne gazy w
N
2
gaz
ciało stałe
ciecz
gaz
ro
zp
u
s
zc
za
ln
ik

AGH WIMiR, wykład z chemii ogólnej
4
STĘŻENIA
STĘŻENIA
Stężenia podaje skład roztworów.
Rodzaje stężeń
Rodzaje stężeń
• procent wagowy, stężenie procentowe,
• procent objętościowy,
• ułamek molowy,
• stężenie molowe,
• stężenie normalne .

AGH WIMiR, wykład z chemii ogólnej
5
Procent wagowy (stężenie procentowe)
Procent wagowy (stężenie procentowe) – podaje
ilość jednostek wagowych (np. gramów) substancji
rozpuszczonej
w
100
jednostkach
(gramach)
wagowych roztworu.
%
%
100
m
m
m
%
100
m
m
C
%
ru
r
rozp
s
ru
r
s
p
w
%
w
– procent wagowy, lub C
p
– stężenie procentowe,
m
s
– masa substancji rozpuszczonej,
m
r–ru
– masa roztworu,
m
rozp
– masa rozpuszczalnika.

AGH WIMiR, wykład z chemii ogólnej
6
Przykład:
Przykład:
Obliczyć stężenie procentowe roztworu przygotowanego
przez rozpuszczenie 25g NaCl w 150g wody.
Dane:
m
s
=25g,
m
rozp
=150g.
Rozwiązanie:
%
28
,
14
%
100
g
175
g
25
%
100
g
150
g
25
g
25
%
w

AGH WIMiR, wykład z chemii ogólnej
7
Procent objętościowy
Procent objętościowy – podaje ilość jednostek
objętości substancji rozpuszczonej w 100 jednostkach
objętości roztworu.
%
%
100
v
v
v
%
100
v
v
%
ru
r
rozp
s
ru
r
s
v
%
v
– procent objętościowy,
v
s
– objętość substancji rozpuszczonej,
v
r–ru
– objętość roztworu,
v
rozp
– objętość rozpuszczalnika.

AGH WIMiR, wykład z chemii ogólnej
8
Jaki jest procent objętościowy roztworu, jeżeli 40cm
3
etanolu rozpuszczono w 60cm
3
wody?
Dane:
v
s
= 40cm
3
,
v
rozp
= 60cm
3
.
Rozwiązanie:
%
40
%
100
cm
100
cm
40
%
100
cm
60
cm
40
cm
40
%
3
3
3
3
3
v
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
9
Ułamek molowy
Ułamek molowy – podaje stosunek ilości moli
jednego ze składników do sumy ilości moli wszystkich
składników w roztworze.
i
2
1
s
i
i
s
s
n
...
n
n
n
n
n
x
x
s
– ułamek molowy,
n
s
– ilość moli składnika,
n
1,2,..,i
– ilość moli składnika „i”,
1
x
i
i

AGH WIMiR, wykład z chemii ogólnej
10
Rozwiązanie:
Ile wynosi ułamek molowy NaCl jeżeli 10g tej soli
rozpuszczono w 150g wody?
Dane:
m
NaCl
= 10g,
m
H2O
= 150g.
i
i
i
M
m
n
mol
g
45
.
58
mol
g
45
.
35
mol
g
23
M
NaCl
mol
17
.
0
mol
g
45
.
58
g
10
n
NaCl
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
11
mol
g
18
mol
g
16
mol
g
1
2
M
O
H
2
mol
33
.
8
mol
g
18
g
150
n
O
H
2
02
.
0
mol
17
.
0
mol
33
.
8
mol
17
.
0
x
NaCl
NaCl
O
H
x
1
x
2
98
.
0
02
.
0
1
x
O
H
2

AGH WIMiR, wykład z chemii ogólnej
12
Stężenie molowe
Stężenie molowe – podaje ilość moli substancji
rozpuszczonej w 1dm
3
roztworu.
3
s
s
M
dm
mol
v
M
m
v
n
C
C
M
– stężenie molowe,
n –ilość moli substancji rozpuszczonej,
v – objętość roztworu,
m
s
– masa substancji rozpuszczonej,
M
s
–masa molowa substancji rozpuszczonej.

AGH WIMiR, wykład z chemii ogólnej
13
Rozwiązanie:
Ile gramów CaCl
2
należy odważyć, aby przygotować
2dm
3
3.5 molowego roztworu?
Dane:
C
M
= 3.5mol/dm
3
,
v
r–ru
= 2dm
3
v
M
n
v
n
C
M
mol
7
dm
2
dm
mol
5
.
3
n
3
3
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
14
Cl
Ca
CaCl
M
2
M
M
2
mol
g
98
.
110
mol
g
45
.
35
2
mol
g
08
.
40
M
2
CaCl
x
mol
7
g
98
.
110
CaCl
mol
1
2
g
779
g
86
.
778
g
98
.
110
7
x

AGH WIMiR, wykład z chemii ogólnej
15
Stężenie normalne
Stężenie normalne – podaje ilość gramo–
równoważników substancji rozpuszczonej w 1dm
3
roztworu.
3
s
s
s
N
dm
wal
v
G
m
v
g
C
C
N
– stężenie normalne,
g
s
–ilośc gramorównoważników substancji,
v – objętość roztworu,
m
s
– masa substancji,
G
s
– gramorównoważnik.

AGH WIMiR, wykład z chemii ogólnej
16
Gramorównoważnik
Gramorównoważnik – ilość gramów substancji
powiązana z oddaniem lub przyjęciem jednego mola,
elektronów. Inaczej – masa molowa podzielona przez
ogólną wartościowość dodatnią lub ujemną.
wal
g
2
M
G
SO
H
s
s
4
2
wal
g
3
M
G
PO
H
s
s
4
3
Kwasy
Kwasy – gramorównoważnik jest równy masie
molowej podzielonej przez ilość atomów wodoru.
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
17
wal
g
2
M
G
)
OH
(
Ca
s
s
2
wal
g
3
M
G
)
OH
(
Al
s
s
3
Wodorotlenki
Wodorotlenki – gramorównoważnik jest równy masie
molowej podzielonej przez ilość grup wodorotlenowych.
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
18
wal
g
1
2
M
G
SO
K
s
s
4
I
2
wal
g
3
2
M
G
)
SO
(
Al
s
s
3
4
III
2
wal
g
1
1
M
G
Cl
Na
s
s
I
Sole
Sole – gramorównoważnik jest równy masie molowej
podzielonej przez ilość atomów metalu pomnożoną przez
jego wartościowość.
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
19
Rozwiązanie:
Ile gramów Ca(HCO
3
)
2
znajduje się w 0.5dm
3
roztworu
2–normalnego?
Dane:
C
N
= 2wal/dm
3
,
v
sol
= 0.5dm
3
v
G
N
m
v
G
m
C
s
s
s
s
N
wal
g
2
1
M
G
2
)
3
HCO
(
Ca
2
3
II
)
HCO
(
Ca
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
20
)
M
3
M
M
(
2
M
M
o
C
H
Ca
)
HCO
(
Ca
2
3
)
mol
g
16
3
mol
g
01
.
12
mol
g
1
(
2
mol
g
08
.
40
M
2
3
)
HCO
(
Ca
mol
g
1
.
162
M
2
3
)
HCO
(
Ca
wal
g
05
.
81
2
1
.
162
G
2
3
)
HCO
(
Ca
g
26
.
20
dm
5
.
0
wal
g
05
.
81
dm
wal
5
.
0
m
3
3
s

AGH WIMiR, wykład z chemii ogólnej
21
ROZPUSZCZNIE
ROZPUSZCZNIE
Roztwory powstają przez rozpuszczanie substancji w
rozpuszczalniku w wyniku:
• reacji chemicznych,
• solwatacji,
• dyspersji.

AGH WIMiR, wykład z chemii ogólnej
22
Rozpuszczanie w wyniku reakcji
Rozpuszczanie w wyniku reakcji
Rozpuszczająca się substancja reaguje z cząsteczkami
rozpuszczalnika lub innej, wcześniej rozpuszczonej
substancji, tworząc nowy związek chemiczny.
2
2
H
ZnCl
HCl
2
Zn
3
2
2
2
CO
H
O
H
CO
4
3
2
5
2
PO
H
2
O
H
3
O
P
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
23
Rozpuszczanie w wyniku
Rozpuszczanie w wyniku
solwatacji
solwatacji
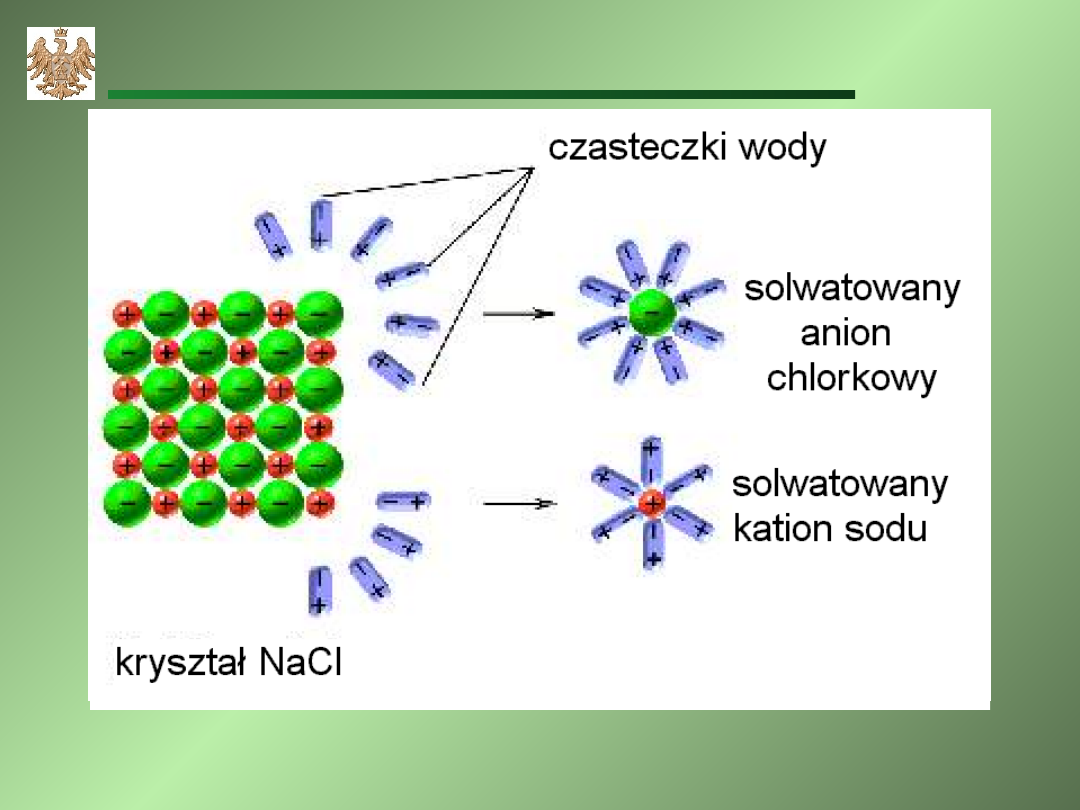
Solwatacja
Solwatacja
(hydratacja)
(hydratacja) – polega na otaczaniu
cząsteczek rozpuszczającej się substancji przez
cząsteczki rozpuszczalnika (wody).
AGH WIMiR, wykład z chemii ogólnej
24
Rozpuszczanie soli kuchennej w wodzie

AGH WIMiR, wykład z chemii ogólnej
25
Rozpuszczanie w wyniku dyspersji
Rozpuszczanie w wyniku dyspersji
Dyspersja
Dyspersja – mieszanie się dwóch substancji w
wyniku dyfuzji i oddziaływań międzycząsteczkowych,
zachodzi głównie w gazach.

AGH WIMiR, wykład z chemii ogólnej
26
Rozpuszczalność
Rozpuszczalność
Rozpuszczalność –
Rozpuszczalność – ilość substancji rozpuszczonej w
określonym rozpuszczalniku w określonych warunkach
temperatury i ciśnienia.
Roztwór w stanie równowagi z osadem (taki, w którym
nie można rozpuścić więcej substancji) nazywamy
nasyconym.

AGH WIMiR, wykład z chemii ogólnej
27
Maksymalną rozpuszczalność często wyraża się
jako maksymalne stężenie (stężenie roztworu
nasyconego) i wyraża się w gramach na 100 g
rozpuszczalnika.
g
100
g
m
m
s
rozp
s
s
s
s
– rozpuszczalność,
m
s
– masa substancji,
m
rozp
– masa rozpuszczalnika.
AGH WIMiR, wykład z chemii ogólnej
28
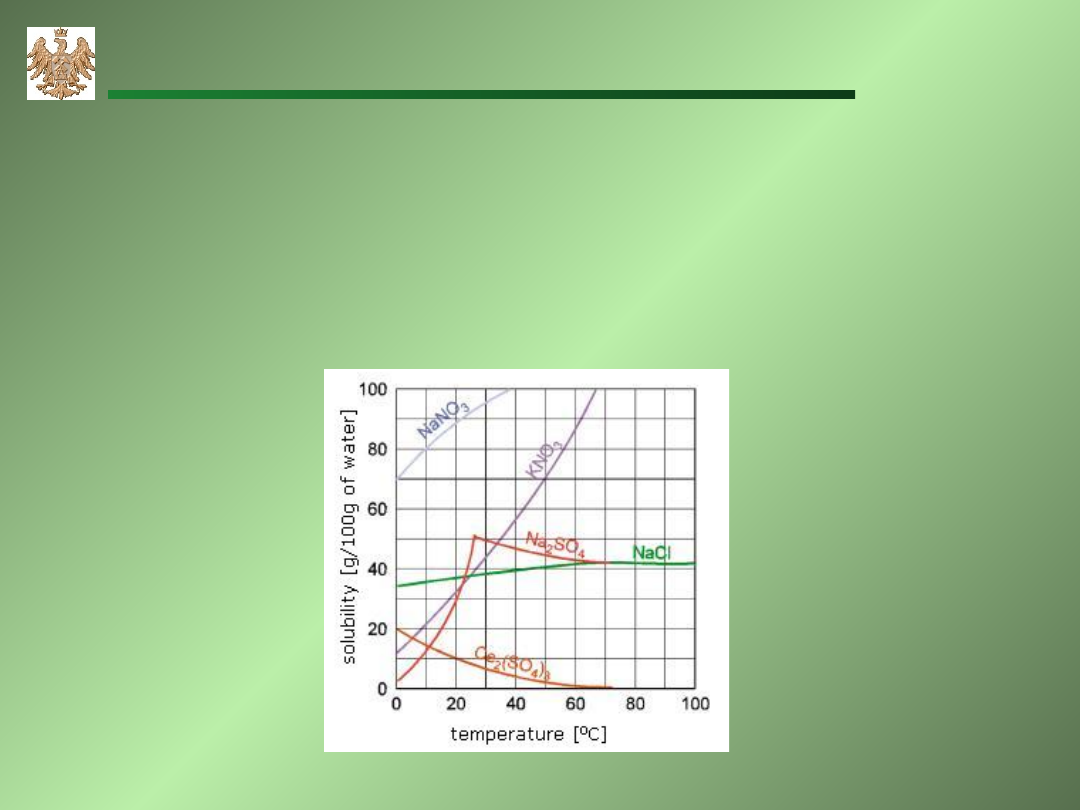
Wpływ temperatury
Wpływ temperatury
Wpływ temperatury zależny jest od efektu
cieplnego procesu rozpuszczania:
H<0 T - s, H>0 T - s.
Wpływ temperatury na rozpuszczalność niektórych soli.

AGH WIMiR, wykład z chemii ogólnej
29
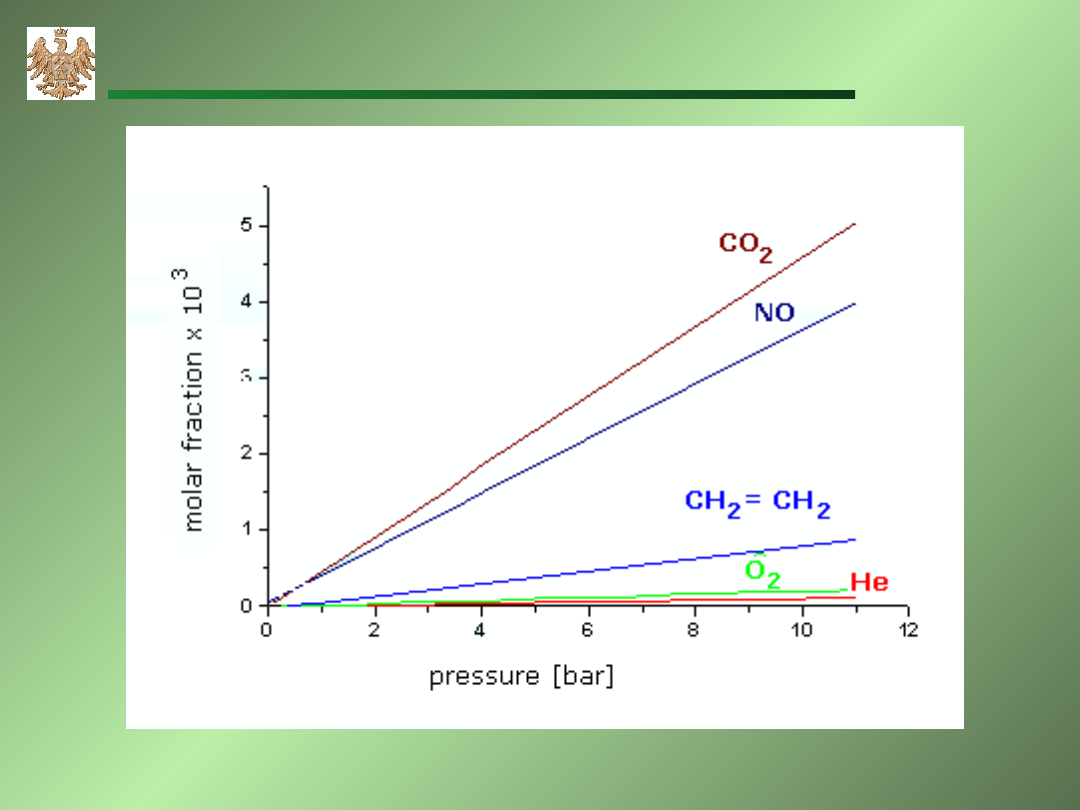
Wpływ ciśnienia
Wpływ ciśnienia
Wpływ ciśnienia na stężenie gazu rozpuszczonego
Prawo Henry’ego:
W stałej temperaturze ilość rozpuszczonego gazu
jest proporcjonalna do ciśnienia cząstkowego gazu w
równowadze z cieczą.
i
i
x
k
p
AGH WIMiR, wykład z chemii ogólnej
30
Wpływ ciśnienia cząstkowego na rozpuszczalność gazów w wodzie
AGH WIMiR, wykład z chemii ogólnej
31
Fizykochemiczne właściwości
Fizykochemiczne właściwości
roztworów
roztworów
roztwory
doskonałe
rzeczywiste
siły międzycząsteczkowe
A-B = A-A i B-B
siły międzycząsteczkowe
A-B > A-A i B-B

AGH WIMiR, wykład z chemii ogólnej
32
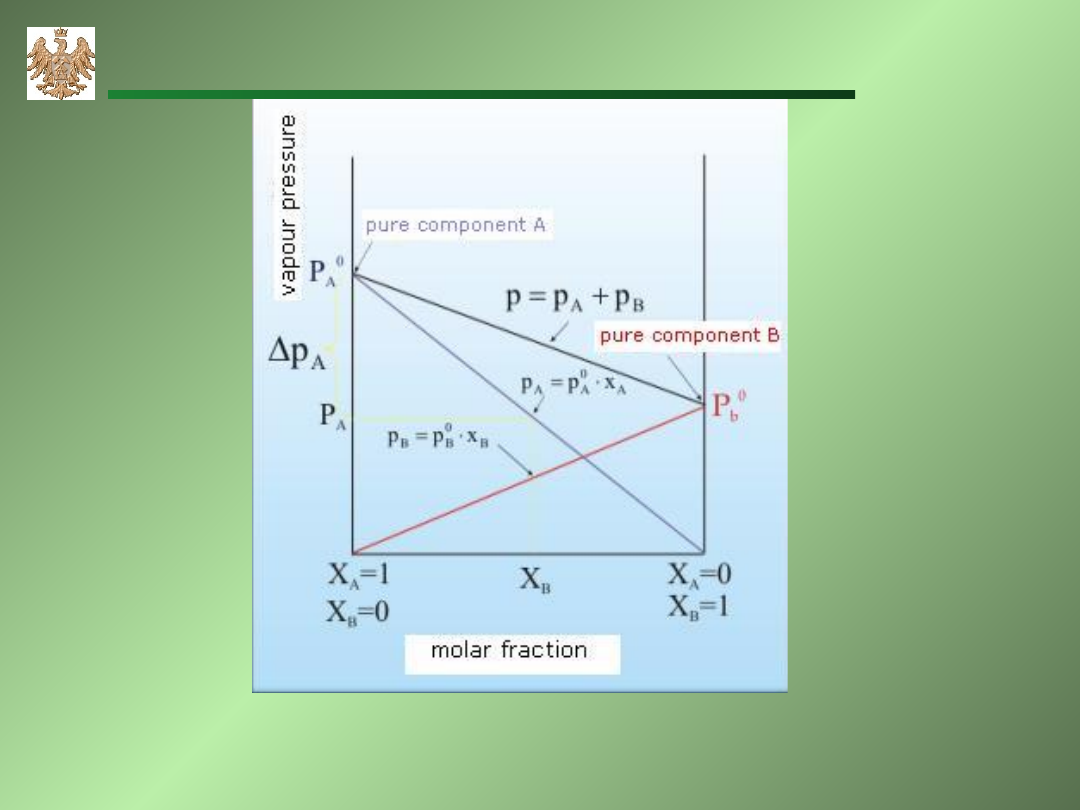
Prawo
Prawo
Raoult
Raoult
a
a
–
–
ciśnienie par
ciśnienie par
prawo Raoulta
prawo Raoulta – podaje, że ciśnienie cząstkowe par
składnika nad roztworem jest proporcjonalne do
ciśnienia, jakie wykazywałby czysty składnik oraz jego
ułamka molowego.
i
0
i
i
x
p
p
p
i
– ciśnienie pary składnika „i”,
p
0
i
– ciśnienie par nad czystym składnikiem „i”,
x
i
– ułamek molowy składnika „i”,
p – ciśnienie całkowite nad roztworem.
i
i
0
i
x
p
p
AGH WIMiR, wykład z chemii ogólnej
33
Zależność ciśnienia par składników nad roztworem
od składu roztworu idealnego.

AGH WIMiR, wykład z chemii ogólnej
34
Temperatura wrzenia i krzepnięcia
Temperatura wrzenia i krzepnięcia
roztworu
roztworu
Wzrost
stężenia
roztworu
powoduje
podniesienie
temperatury wrzenia i obniżenie temperatury krzepnięcia
sol
s
s
E
m
E
b
m
M
m
K
C
K
T
sol
s
s
c
m
c
s
m
M
m
K
C
K
T
K
E
– stała ebulioskopowa,
C
m
– stężenie molarne,
K
C
– stała krioskopowa.

AGH WIMiR, wykład z chemii ogólnej
35
Dyfuzja
Dyfuzja
Proces
dyfuzji
Proces
dyfuzji
–
proces
polegający
na
przemieszczaniu się substancji z obszaru o wyższym
stężeniu do obszaru o niższym stężeniu.
Dyfuzja barwnika w wodzie

AGH WIMiR, wykład z chemii ogólnej
36
C
A
D
v
v – prędkość dyfuzji,
A – powierzchnia,
D – współczynnik dyfuzji,
C – gradient stężenia.
RT
E
0
a
e
D
D
D
0
– maksymalny współczynnik dyfuzji (dla nieskończonej T),
E
a
– energia aktywacji,
T – temperatura,
R – stała gazowa.

AGH WIMiR, wykład z chemii ogólnej
37
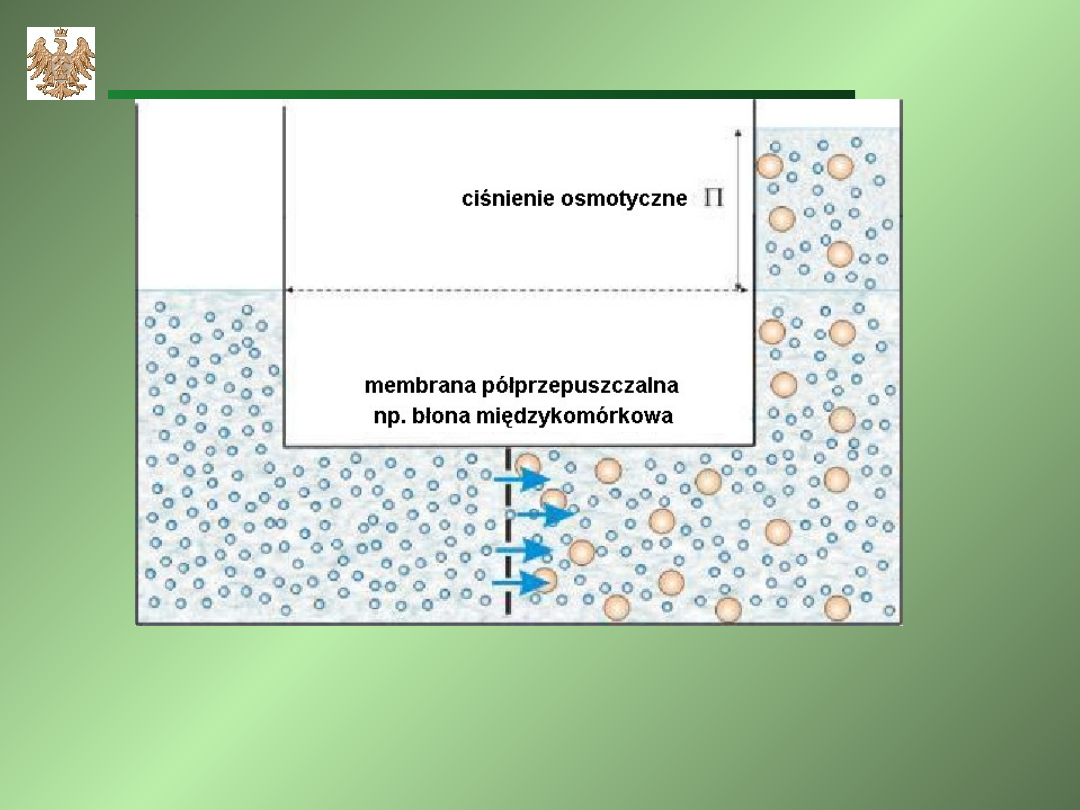
Osmoza
Osmoza
Osmoza
Osmoza - dyfuzja cząsteczek rozpuszczalnika przez
membranę
półprzepuszczalną,
oddzielającą
dwa
roztwory różniące się potencjałami chemicznymi.
Różnica potencjałów chemicznych wynika z różnicy
składu (stężenia) roztworów.
Błona półprzepuszczalna musi być przepuszczalna dla
rozpuszczalnika, a nieprzepuszczalna dla substancji
rozpuszczonej. Proces ten powoduje gradient ciśnienia
po obu stronach membrany.
AGH WIMiR, wykład z chemii ogólnej
38
RT
C
– ciśnienie osmotyczne,
C – gradient stężenia.

AGH WIMiR, wykład z chemii ogólnej
39
Dysocjacja
Dysocjacja
Dysocjacja
Dysocjacja – rozpad cząsteczek na jony pod
wpływem rozpuszczalnika.
Dysocjujące cząsteczki nazywamy
elektrolitami
elektrolitami.
Mają one zdolność przewodzenia prądu.
m
n
m
n
nB
mA
B
A
n
m
Cl
H
HCl
2
4
3
3
4
2
SO
3
Al
2
)
SO
(
Al
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
40
Stopień dysocjacji –
Stopień dysocjacji – zdolność substancji do
dysocjacji – stosunek ilości cząsteczek dysocjujących
do ogólnej ilości cząsteczek w roztworze.
0
zd
n
n
n
zd
– ilość cząsteczek zdysocjowanych,
n
0
– całkowita ilość cząsteczek w roztworze.
1 – mocne elektrolity,
< 0.1– słabe elektrolity,
0.1< < 1 – elektrolity średniej mocy.

AGH WIMiR, wykład z chemii ogólnej
41
Stała dysocjacji –
Stała dysocjacji – stała równowagi reakcji dysocjacji.
m
n
m
n
nB
mA
B
A
n
m
n
m
B
A
n
B
m
A
d
c
c
c
K
– stężenia jonów,
n
m
B
A
c
– stężenie cząsteczek niezdysocjowanych.
m
n
B
A
c
,
c
K
d
– stała dysocjacji,

AGH WIMiR, wykład z chemii ogólnej
42
Prawo rozcieńczeń Ostwalda
Prawo rozcieńczeń Ostwalda
Prawo rozcieńczeń Wilhelma Ostwalda
Prawo rozcieńczeń Wilhelma Ostwalda podaje
zależność stałej dysocjacji od stopnia dysocjacji i
stężenia. prawo to stosuje się wyłącznie do
elektrolitów słabych (<0,1).
1
c
K
2
d
K
d
– stała dysocjacji,
c – stężenie elektrolitu,
– stopień dysocjacji.

AGH WIMiR, wykład z chemii ogólnej
43
Aktywność
Aktywność
Aktywność –
Aktywność – inaczej stężenie rzeczywiste podaje ilość
cząsteczek w roztworze i oddziaływania pomiędzy nimi.
i
i
i
c
f
a
a
i
– aktywność składnika „i”,
f
i
– współczynnik aktywności składnika „i”,
c
i
– stężenie składnika „i”.
Dla roztworów rozcieńczonych f
i
1, więc a
i
= c
i
.

AGH WIMiR, wykład z chemii ogólnej
44
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności
Dla
trudnorozpuszalnych
soli
mianownik
w
wyrażeniu na stałą dysocjacji można przyjąć za
wartość stałą.
,
c
c
c
K
n
m
B
A
n
B
m
A
d
.
const
c
n
m
B
A
n
m
B
A
d
c
K
L
L – iloczyn rozpuszczalności.
n
B
m
A
c
c
L

AGH WIMiR, wykład z chemii ogólnej
45
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności – iloczyn stężeń jonów
trudno rozpuszczalnej soli w jej roztworze nasyconym w
określonych warunkach. (T,P).
2
4
2
4
SO
Ca
CaSO
2
4
2
4
SO
Ca
CaSO
c
c
L
I
2
Pb
PbI
2
2
2
I
Pb
PbI
c
c
L
2
2
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
46
Teorie kwasów i zasad
Teorie kwasów i zasad
Teoria Arrheniusa
Teoria Arrheniusa
Kwasy
Kwasy – substancje dysocjujące z wydzieleniem
jonu hydroniowego H
3
O
+
(jon H
+
w rzeczywistości
istnieje zawsze w towarzystwie cząsteczki wody).
Zasady
Zasady – substancje dysocjujące z wydzieleniem
jonu wodorotlenowego OH
-
.
n
3
2
n
R
O
nH
O
nH
R
H
Kwas
nOH
Me
)
OH
(
Me
n
n
Zasada

AGH WIMiR, wykład z chemii ogólnej
47
Kwasa
Kwasa –donor protonu (H
+
).
Zasada
Zasada – akceptor protonu (H
+
).
Istnieją pary kwasowo–zasadowe
Teoria Brønsteada i Lowry’ego
Teoria Brønsteada i Lowry’ego
H
zasada
kwas
H
OH
O
H
2
H
O
H
O
H
2
3
H
NH
NH
3
4
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
48
Teoria Lewisa
Teoria Lewisa
Kwas
Kwas – akceptor pary elektronowej ,
Base
Base – donor pary elektronowej.
produkt
zasada
kwas
3
3
3
3
NH
B
F
NH
BF
4
3
AlCl
Cl
AlCl
Przykład:
Przykład:

AGH WIMiR, wykład z chemii ogólnej
49
Miara kwasowości – pH
Miara kwasowości – pH
H
OH
O
H
2
Woda dysocjuje w bardzo niewielkim stopniu:
14
OH
H
O
H
10
c
c
L
2
H
c
log
pH
0< pH < 14 – pH skala

AGH WIMiR, wykład z chemii ogólnej
50
substancja
pH
kwas z baterii
kwas żołądkowy
napój typu cola
ocet
sok pomarańczowy
piwo
kwaśny deszcz
kawa
herbata
zdrowa skóra człowieka
mleko
czysta woda
krew
woda morska
mydło stałe
depilator w kremie
wybielacz
0.5
1.5 – 2.0
2.5
2.9
3.5
4.5
<5.0
5.0
5.5
5.5
6.5
7.0
7.34 – 7.45
8.0
9.0 – 10.0
11.0
12.5

AGH WIMiR, wykład z chemii ogólnej
51
Pomiar pH przeprowadza się za pomocą:
• wskaźników – związków, najczęściej organicznych,
które zmieniają zabarwienie ze zmianą pH (lakmus,
BBT, fenoloftaleina, oranż metylowy, itp.)
• papierki wskaźnikowe – bibuła nasączona kilkoma
wskaźnikami, zmieniająca barwę w zależności od pH,
Skala pH dla papierków wskaźnikowych
• pH – metru z elektrodą szklaną.

AGH WIMiR, wykład z chemii ogólnej
52
Zasada działania pH–metru
Zasada działania pH–metru
2
H
e
2
H
2
H
0
H
/
H
H
/
H
c
ln
F
2
RT
E
E
H
H
/
H
c
log
F
2
RT
303
.
2
E
pH
059
.
0
E
H
/
H

AGH WIMiR, wykład z chemii ogólnej
53
Hydroliza
Hydroliza
Hydrolysis
Hydrolysis – reakcja jonów soli z wodą.
Sole mocnych kwasów i mocnych zasad
Sole mocnych kwasów i mocnych zasad
nie ulegają hydrolizie.
nie ulegają hydrolizie.
Przykład:
Przykład:
Cl
H
OH
Na
O
H
Cl
Na
2
H
OH
O
H
2
dysocjacja wody

AGH WIMiR, wykład z chemii ogólnej
54
nH
R
OH
Me
O
nH
R
Me
m
n
2
m
n
Sale mocnych kwasów i słabych zasad:
Przykład:
Przykład:
2
4
4
2
2
4
4
SO
H
2
OH
NH
2
O
H
2
SO
NH
2
odczyn po hydrolizie kwaśny
pH < 7

AGH WIMiR, wykład z chemii ogólnej
55
Sole słabych kwasów i mocnych zasad:
R
H
mOH
Me
O
mH
R
Me
m
n
2
m
n
Przykład:
Przykład:
3
2
2
2
3
CO
H
OH
2
K
2
O
H
2
CO
K
2
odczyn po hydrolizie zasadowy
pH > 7

AGH WIMiR, wykład z chemii ogólnej
56
R
H
OH
Me
O
xH
R
Me
m
n
2
m
n
Sole słabych kwasów i słabych zasad:
Przykład:
Przykład:
S
H
)
OH
(
Fe
O
H
2
S
Fe
2
2
2
2
2
odczyn po hydrolizie obojętny
pH 7
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
Wyszukiwarka
Podobne podstrony:
wyklad7 pps
wyklad3 pps
wyklad2 pps
wyklad6 pps
wyklad8 pps
wyklad7 pps
wyklad3 pps
Lachu opracowanie otwarte Kerto me edit, INNE, WYKŁADY Lach, pps na 17 czerwca
Pedagogika specjalna 31.05.2011 WYKŁAD, Studia, PPS
19.04.2011Podstawy pedagogiki specjalna wykład, Studia, PPS
kololach2, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
Lachu opracowanie otwarte Kerto, INNE, WYKŁADY Lach, 1 i 2 kolokwium - różne wersje, PPS
PPS I KOLOKWIUM, INNE, WYKŁADY Lach, 1 i 2 kolokwiu
więcej podobnych podstron