
PRZYGOTOWANIE PRÓBEK
DO ANALIZY
Dr Agnieszka Chałabis-Mazurek
Uniwersytet Przyrodniczy w Lublinie
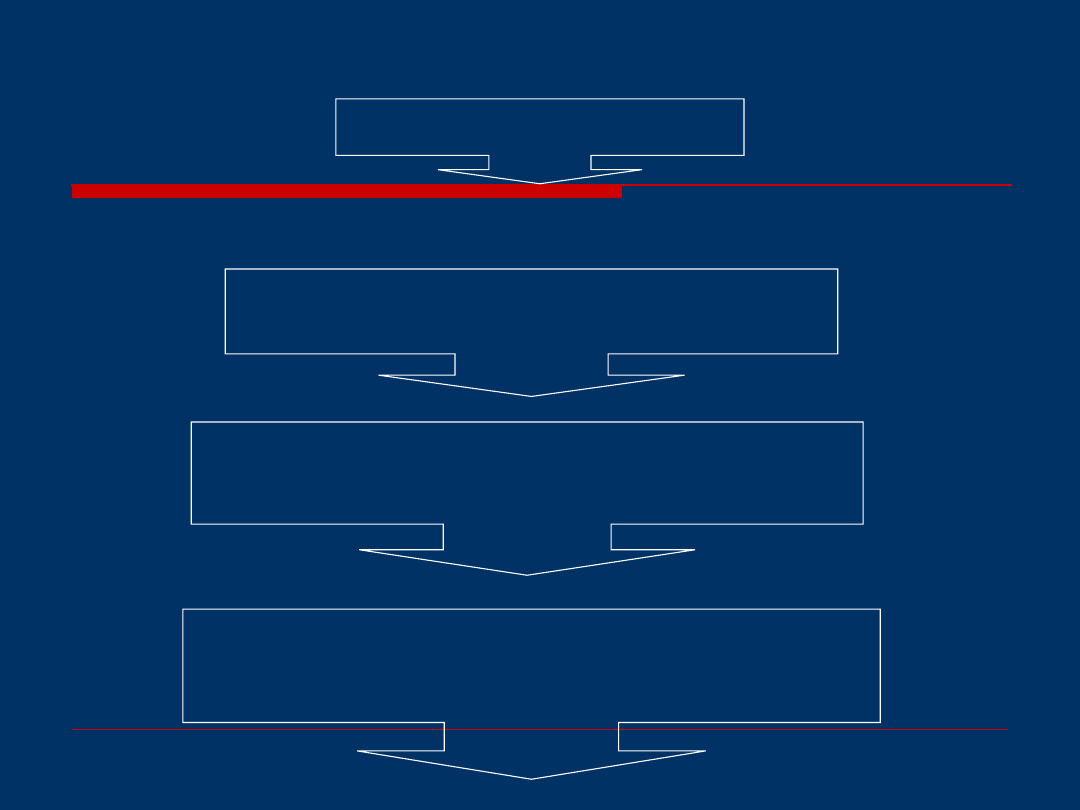
Schemat dowolnej procedury
analitycznej
TRANSPORT I PRZECHOWYWANIE PRÓBEK
Stabilizacja, konserwacja
POBIERANIE PRÓBEK
PRZYGOTOWANIE PRÓBEK DO ANALIZY
izolacja , wzbogacanie, frakcjonowanie, oczyszczanie,
derywatyzacja
ANALIZA
rozdzielanie analitów;
analiza jakościowa i ilościowa
Pierwotna i wtórna obróbka pobranej
próbki

Od momentu pobrania do momentu analizy
próbki, w szczególności próbki wód, mogą
zmieniać swoje właściwości na wskutek
zachodzących procesów chemicznych, fizycznych
i biologicznych. Oznaczane parametry mogą się
więc różnić od rzeczywistych, powodując, że
próbka staje się
niereprezentatywna!!!!!

Źródła potencjalnych zmian składu próbki
1. Reakcje chemiczne.
2. Procesy fizykochemiczne.
3. Procesy biochemiczne.
4. Reakcje fotochemiczne.

Do najważniejszych reakcji chemicznych i procesów
fizykochemicznych zachodzących w próbce można
zaliczyć :
• Reakcje chlorowania.
Powód: wolny chlor (np.: w przypadku wody uzdatnianej
metodą chlorowania).
Może on reagować z obecnymi w próbce związkami
organicznymi tworząc chlorowcopochodne organiczne.
• Depolimeryzacja.
Substancje spolimeryzowane mogą ulegać
depolimeryzacji lub odwrotnie może dochodzić do
polimeryzacji związków prostych.

Do najważniejszych reakcji chemicznych i procesów
fizykochemicznych zachodzących w próbce można
zaliczyć :
• Zmiana pH.
Powód: absorpcja CO2 z powietrza
Skutek: obniżenie pH oraz twardości wody
(w wyniku wytrącania się węglanu wapnia).
• Reakcje hydrolizy związków chemicznych i
kompleksów.
• Strącanie i współstrącanie.

•
Reakcje utleniania.
Powód: tlen rozpuszczony w próbce lub tlen
zawarty w powietrzu atmosferycznym.
Reakcjom utleniania ulegają metale na niższych stopniach
utlenienia (przykład: utlenianie jonów Fe (II) do Fe (III)), związki
nieorganiczne np.: cyjanki, jodki, siarczki, siarczyny oraz związki
organiczne.
• Reakcje redukcji.
W obecności substancji organicznych, takich jak np.:
jony S2- i Fe2+, chrom (VI) może ulegać redukcji do
chromu (III)

• Utlenianie
Prowadzi do zaniżenia początkowej wartości
stężenia substancji lotnych.
• Adsorpcja
Dotyczy metali rozpuszczonych lub w postaci
koloidalnej oraz niektórych związków
organicznych np. WWA
Zachodzi na ściankach naczynia lub na
cząstkach zawiesiny występującej w próbce.
Jest związana z ich rozpuszczalnością w wodzie
oraz wartością współczynnika podziału oktanol
-woda (Kow).

Reakcje biochemiczne
Powód: bakterie, glony i inne organizmy wodne
• biodegradacja
• bioutlenienie

Reakcje fotochemiczne
Wiele substancji może podlegać reakcjom
katalizowanym przez światło. Fotochemiczna
degradacja
(fotoliza)
jest najważniejszym – obok
biologicznej degradacji – procesem przemiany lub
rozpadu molekuł związków organicznych w wodzie.

CEL PRZYGOTOWANIA PRÓBKI
Głównym celem przygotowania próbki jest:
• selektywna izolacja analitów;
• oczyszczanie ekstraktu;
• wzbogacanie;
Etap przygotowania próbki ma także na celu
frakcjonowanie (oczyszczanie) lub/i
derywatyzację (konwersję chemiczną) analitów.

Operacje przygotowania próbek
środowiskowych do analizy:
• konserwacja
• transport i przechowywanie
• obróbka fizyczna
• obróbka chemiczna
• izolacja i wzbogacanie analitów

Konserwacja próbek jako sposób zapobiegania
niekorzystnym procesom i reakcjom w próbce.
Nie ma jednego
uniwersalnego
sposobu na
zachowanie stałego składu analizowanego
materiału.
Należy pamiętać, że metoda konserwacji powinna
być zharmonizowana z różnymi technikami
analitycznymi, które będą wykorzystywane
na etapie oznaczeń końcowych.

Konserwacja nieinwazyjna (fizykalna)
1. Dobór odpowiedniego pojemnika oraz jego
przygotowanie.
Pojemnik stosowany do przechowywania próbki oraz
jego zamknięcie nie powinny powodować wtórnego
zanieczyszczenia próbki, a także
adsorbować oznaczane składniki.

Do oznaczeń pestycydów, herbicydów, WWA, PCB
oraz innych związków organicznych nie zaleca się
stosowania pojemników wykonanych z tworzyw
sztucznych (z wyjątkiem PTFE) - adsorpcja analitów
na ściankach!
Wniosek: stosować wyłącznie naczynia szklane. W
celu zdezaktywowania powierzchni naczyń zaleca
sięprzeprowadzenie silanizacji.

Do oznaczeń metali nie zaleca się stosowania
pojemników szklanych (mogą adsorbować
ślady metali).
Wniosek: stosować pojemniki z tworzyw
sztucznych.

2. Napełnianie pojemników
Jeśli w próbce wody będą oznaczane parametry
fizykochemiczne, zaleca się całkowite
napełnianie pojemników, tak aby
pod powierzchnią wody pod korkiem nie
powstały żadne pęcherzyki powietrza
(z wyjątkiem próbek, które w następnych
etapach przechowywania będą zamrażane).
Całkowite napełnianie butli dotyczy również
lotnych organicznych zanieczyszczeń.

3. Konserwacja termiczna
Schłodzenie czyli obniżenie temperatury i
przechowywanie próbki w temperaturze niższej niż
ta, w której była pobierana.
Schłodzenie próbki do temperatury od 2 do 5°C
oraz przechowywanie jej w ciemnościach jest
skutecznym sposobem konserwowania próbki
podczas transportu do laboratorium.
Zamrażanie próbki do temperatury -20°C
pozwala wydłużyć okres przechowywania w
porównaniu do maksymalnego okresu jej
schłodzenia. Jednakże ten sposób konserwacji
wzbudza wiele kontrowersji i dyskusji.

Wstępna filtracja lub wirowanie próbki.
Wynik: spowalnia wszelkie procesy biologiczne,
chemiczne i fizykalne ! Nie eliminuje ich !
Sączenie przez różnego rodzaju sączki bibułowe,
filtry bibułowe czy wirowanie umożliwia usunięcie
z próbek zawiesiny, osadu, glonów i innych
mikroorganizmów. Filtracja próbki przez filtr
posrebrzany o średnicy porów 0,45 μm umożliwia
usunięcie z wody planktonu oraz komórek
bakteryjnych, co w znaczny sposób zwiększa
okres jej przechowywania.

5. Naświetlanie za pomocą promieniowania UV.
Taki zabieg jest stosowany w celu sterylizacji,
czyli usunięcia organizmów żywych z matrycy
próbki.
Metoda ta może mieć zastosowanie w przypadku
oznaczeń związków łatwo ulegających
biodegradacji czy bioutlenieniu.

Konserwacja inwazyjna (chemiczna)
poprzez dodatek do próbek niewielkiej ilości
odczynników chemicznych.
Do najważniejszych metod chemicznego utrwalania
próbek wody zaliczyć można:
1. dodatek kwasów,
2. dodatek siarczynów,
3. dodatek rozpuszczalników,
4. dodatek jonów toksycznych metali,
5. dodatek azydków,
6. dodatek formaldehydu
i innych.

Odczynniki chemiczne należy wprowadzi
bezpośrednio do naczynia przed pobraniem
próbki lub te bezpośrednio po jej pobraniu.

1. Zakwaszenie próbki.
Zakwaszenie próbki do pH około 2 poprzez
dodatek kwasu solnego, siarkowego lub
azotowego.
• zapobiega procesom wytrącania się osadów
(np.: tlenków i wodorotlenków metali),
• zapobiega flokulacji i kompleksowaniu
niektórych składników próbki
• zapobiega i hamuje wzrost i aktywność
biologiczną mikroorganizmów.

2. Dodatek biocydów.
Związki chemiczne, które zatrzymują lub spowalniają
aktywność biologiczną mikroorganizmów, są nazywane
biocydami.
Do najczęściej stosowanych biocydów należą:
• Chlorek rtęci(II) (HgCl2) - bardzo skuteczny środek
utrwalający, hamujący wzrost bakterii w próbkach
wodnych; stosowany jest w bardzo szerokim zakresie
stężeń najczęściej od 1 do 500 μg/cm3.
• Chloroform - środek spowalniający przebieg procesów
biologicznych w próbce. Zapobiega chemicznej hydrolizie
i biologicznej degradacji związków poprzez ekstrakcję
analitów oraz toksyczność dla mikroorganizmów (np.
fosforoorganicznych pestycydów).
• Formaldehyd. spowalnia aktywność biologiczną
mikroorganizmów
• Tymol.

Konserwacja fizykochemiczna
W przypadku wielu analitów organicznych
etap przechowywania próbek jest zastępowany
przechowywaniem koncentratów uzyskanych
po procesie izolacji i wzbogacenia.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
5 Przygotowanie próbek do analizy chromatograficznej
bez żywności 17 Ogólne zasady pobierania i przygotowywania próbek do mikrobiologicznych metod badawc
1 przygotowanie probekPrzygotowanie próbek do oznaczania ilościowego analitów metodami
Cele metod przygotowania próbek
Materiałoznawstwo - Sposoby przygotowania próbek, PG inżynierka, Semestr 2, Materiałoznawstwo-labork
Przygotowanie probek metalograficznych, POLITECHNIKA ŚLĄSKA
przygotowanie probek
ZASADY I METODY POBIERANIA I PRZYGOTOWYWANIA PRÓBEK DO ANALIZY
Raport TECHNIKA LABORATORYJNA, BŁĘDY W ANALIZIE INSTRUMENTALNEJ, POBIERANIE I PRZYGOTOWANIE PRÓBEK Ś
5 Przygotowanie próbek do analizy chromatograficznej
I przygotowanie mas ogniotrwalych i zaformowanie próbek, Technologia ceramiki
sensoryka przygotowanie i podawanie probek
4 Przygotowanie półfabrykatów
Przygotowanie PRODUKCJI 2009 w1
jak przygotowac i przeprowadzic pokaz kosmetyczny1
więcej podobnych podstron