
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
1/20
Struktury
Struktury
atomowe i molekularne (cząsteczkowe)
atomowe i molekularne (cząsteczkowe)
• Podstawowy składnik materiałów - atom, jon, cząsteczka
(pojedyncze atomy/cząsteczki, gazy, kryształy, ciecze, materiały amorficzne...)
• Opis i zrozumienie możliwe dzięki:
- fizyce a) kwantowej
b) atomowej
c) molekularnej
d) fazy skondensowanej
- chemii [ a), b), c), ...]
• Plan wykładu:
I.
Struktura atomów i cząsteczek
II.
Oddziaływanie atomów (molekuł) z promieniowaniem EM
III.
Główne metody badania struktur atom.-mol.
• Materiały do wykładu (prezentacje + zadania) w internecie:
IF UJ www.if.uj.edu.pl
Zakład Fotoniki
http://fotonika.if.uj.edu.pl/qnog/index_pl.htm
• Kwantowa fizyka - podstawa inżynierii stanów kwantowych
(komputery kwantowe, kryptografia kwantowa)
• Optyka i elektronika kwantowa + „material science” – podstawa fotoniki
(zastosowanie światła do przekazu i PRZETWARZANIA informacji)

Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
2/20
Zalecane podręczniki:
H. Haken, H. Ch. Wolf „Atomy i kwanty”, PWN, 2002 (2
wyd.)
H. Haken, H. Ch. Wolf „Fizyka molekularna z elementami
chemii kwantowej”, PWN, 1998.
Paweł Kowalczyk „Fizyka cząsteczek. Energie i widma”,
PWN,2000.
I.W. Sawieliew „Kurs Fizyki, t.3”, PWN, 1989.
R. Eisberg, R. Resnick „Fizyka kwantowa”, PWN, 1983.
+ wybrane artykuły w czasopismach „Postępy Fizyki”, „Świat Nauki”,
strony internetowe, itp..
W. Demtröder „Spektroskopia laserowa”, PWN, 1993.
Bernard Ziętek, „OPTOELEKTRONIKA”, Wyd.UMK, Toruń
2004
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
3/20
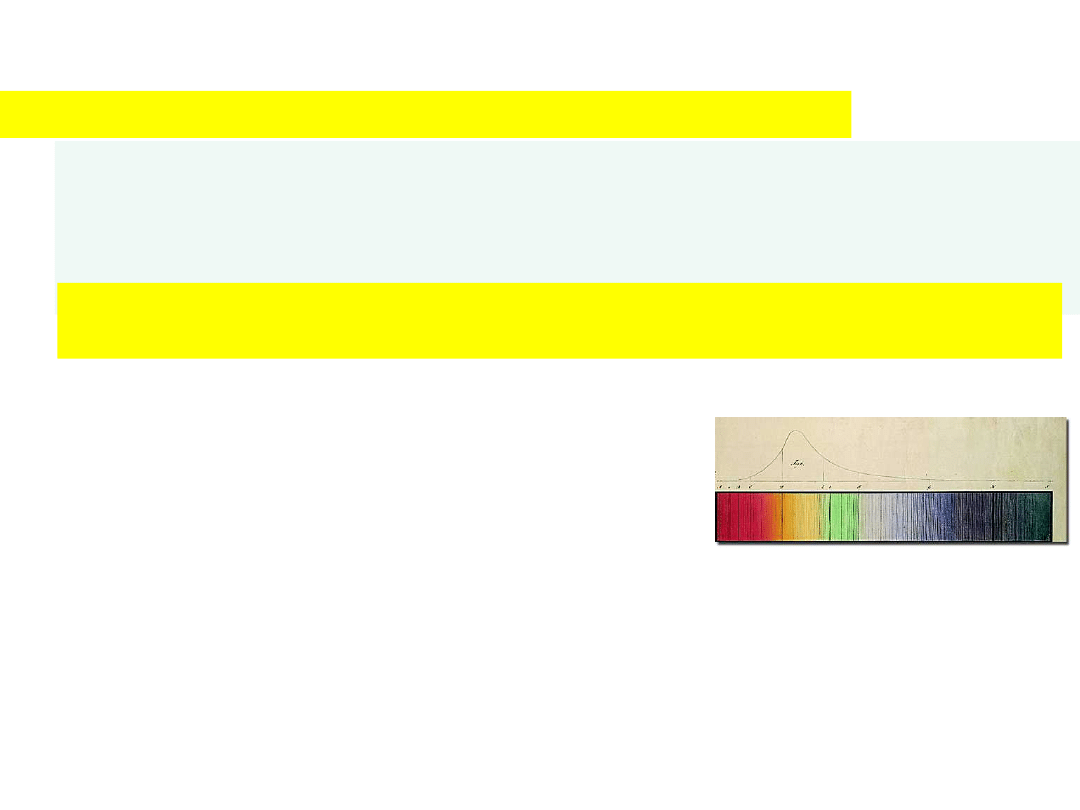
W
W
idmo wod
idmo wod
oru
oru
obserwacje:
1802 Wollaston, 1814 Fraunhofer – widmo słoneczne
1884 Balmer – 4 linie z widma Fraunhofera;
= (9/5)k, (4/3)k, (25/21)k, (9/8)k,
gdzie
k=364,56 nm
serie widmowe
= 1/ = (1/4 – 1/n
2
)
1889 Rydberg
= C(1/n
2
– 1/m
2
)
Geneza
Geneza
rozwoju f
rozwoju f
izyki
izyki
atomowej
atomowej
- poszukiwanie wytłumaczenia danych doświadczalnych
(analiza widmowa: 1817 - linie Fraunhofera w widmie słonecznym,
dyskretne widma źródeł światła laboratoryjne i
astronomiczne)
- rozwój techniki pomiarowej (nowe dane):
pryzmat (Newton), spektrometry: pryzmat., siatkowe (1817 -
Fraunhofer), interferometry, lasery, ...
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
4/20
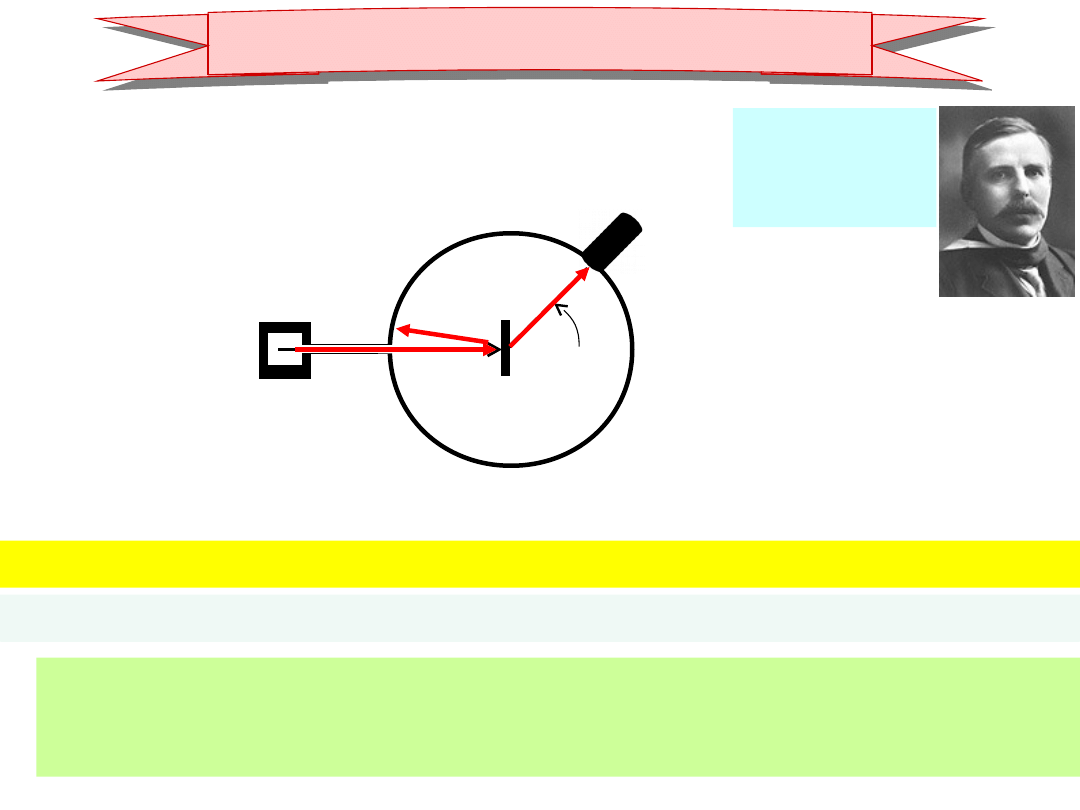
dośw. Ernsta Rutherforda
(~1910)
1871-1937
Nobel 1908
(Chemia)
źródło cząstek
(jądra He)
detektor cząstek
Folia metal.
• rozproszenie:
cząstka naładowana odpychające oddziaływanie kulombowskie
• silne wsteczne rozprosz. silne oddz. silne polaładunek ~ punktowy
• brak odrzutu atomów folii ładunki rozpraszające w ciężkich „obiektach”
~ cała materia folii skupiona w ciężkim jądrze
atomy = ciężkie jądra naładowane dodatnio o b. małych rozmiarach
(~ 10
-14
m << rozmiar atomu ~ 10
-10
m )
Pocz
Pocz
ą
ą
tek
tek
„
„
nowo
nowo
ż
ż
ytnej
ytnej
”
”
f. atomowej
f. atomowej
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
5/20
model
model
Bohra:
Bohra:
1913
1913
-
-
.
1 stacjonarne stany elektronu w atomie, w
których elektron nie promieniuje; mr=nħ
(ħ=h/2)
2. zmiana stanu zachodzi skokowo przez
absorpcję (emisję) promieniowania o częstości
=(E
1
-E
2
)/h
konsekwencje:
n
n
= Z
0
0
/n
n
0
0
= e
2
/ħ
E
E
n
n
= - (Z
2
/n
n
2
2
K
K
2
2
)E
I
E
I
=
K
Kme
4
/2ħ
2
= en. jonizacji = 13,6
eV
stała Rydberga:
R
R =
K
K
2
2
me
4
/2ħ
2
r
r
n
n
= n
n
2
2
a
a
0
0
/Z
a
a
0
0
= ħ
2
/me
2
= 0,052 nm (0,52 Å)
Niels Bohr (1885-
1967)
Nobel 1922
K
K 1/
(4
0
)
Postulaty:
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
6/20
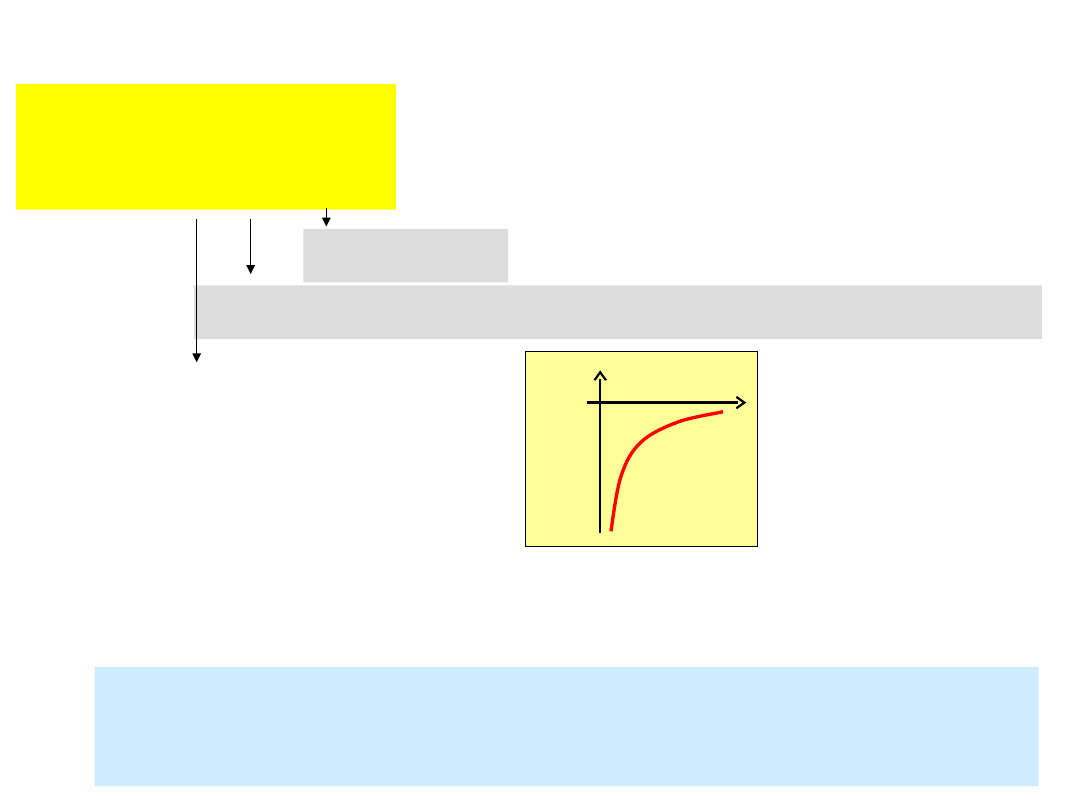
sens poziomów
Bohra
postulat Bohra nie tłumaczy stabilności
atomów
jako stanów stacjonarnych
(odpowiadających minimum
energii)
klasycznie
całkowita
energia E = T
klas
+ V
klas
T
klas
= ½ m
2
=
|
równowaga sił:
m
2
/r
0
= e
2
/r
0
| = ½ e
2
/r
0
E = - ½ e
2
/r
0
V
klas
= - e
2
/r
0
E(r
0
)
0
.
głęboki dół potencjał
– elektron spada na jądro!
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
7/20
V= -e
2
/r
najkorzystniej gdy r 0 ,
Stabilność atomu wg. mechaniki
kwantowej:
ale relacja nieokreśloności wymaga, że gdy el.
zlokalizowany w
obszarze o promieniu r
0
, r r
0
, p ħ/r
0
(niezerowy
pęd)
gdy pęd niezerowy, niezerowa en.
kinetyczna
T T
min
= (p)
2
/2m =
ħ
2
/2mr
0
2
E = T + V
minimum E
min
= T
min
+ V występuje dla r
0
= ħ
2
/me
2
= a
0
stabilny atom
T
min
V
r
0
a
0
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
8/20
z mechaniki kwantowej wiemy, że r p ħ
aby klasyczne orbity i kręt miały sens trzeba p << p, r << r,
czyli (r/r)(p/p)
<< 1
postulaty Bohra
sprzeczne
z dotychczasową fizyką
elektron krążący emituje (przyspieszane ładunki promieniują
)
i powinien spaść na jądro
sprzeczność
ale r p ħ (r p)/rp ħ/rp
mvr = pr = nħ
, czyli (r p)/rp 1/n
nie można mówić o zlokalizowanych orbitach (w sensie klas.)
(chyba że n>>1 – stany
rydbergowskie)
- pojęcie orbity
?
?

Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
9/20
Mechanika kwantowa o poziomach energetycznych
atomu
atomy z Z elektronami w mechanice kwantowej
H
CM
=p
2
/2 - K Ze
2
/r
m
e
M/(m
e
+M), K 1/(4
0
)
C/r
C/r potencjał kulombowski i centralny
+ 2/ħ(E-C/r)
0
• z założenia centralności
możliwość faktoryzacji na część radialną i kątową
r,R(r)Y()
• warunki rozwiązalności 3 liczby kwantowe:
n
= 1, 2, ...
l = 0, 1, 2, ..., n-1
-l m l
równ. Schrödingera:
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
10/20
n rozwiązanie części radialnej:
E
n
=-C
2
/2 ħ
2
n
2
=-Z
2
/n
2
Rhc
R =
K
2
me
4
/2ħ
2
- stała Rydberga
(najdokładniej wyznaczona stała
fundamentalna)
Rhc = 13,6 eV - energia jonizacji
atomu wodoru w stanie
podstawowym
14 eV
10
5
0
1
2
1
,
5
1
0
2
,
6
9
7
3
9
5
0
9
3
8
6
5
6
,3
4
8
6
4
3
4
4
1
0
3
9
7
3
8
9
3
8
3
,5
3
8
0
1
8
7
5
1
2
8
2
1
0
9
4
1
0
0
5
9
5
4
,6 4
0
5
0
2
6
3
0
7
4
0
0
seria
Balmer
a
seria Lymana
s.
Paschen
a
B
ra
c
k
e
tt
a
P
fu
n
d
a
n=
2
n=
1
n=
3
n=
4
n=
5
n=
Fizyczna interpretacja liczb kwantowych
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
11/20
l,
m
rozwiązanie cz. kątowej:
Y
l, m
(, )
e
im
ciągłość f. fal. wymaga by całkowita wielokrotność
zmieściła się na obwodzie orbity (prom. D) kwantyzacja: 2D=m
dł. fal materii (de Broglie) =h/p
t
(p
t
- skł. styczna p)p
t
D = L
z
= mħ
skł. krętu może mieć tylko wartości skwant.: L
z
=0, ħ, 2ħ,
3ħ, ...
skwantowana też długość L (wartość L
2
): l(l +1) ħ
2
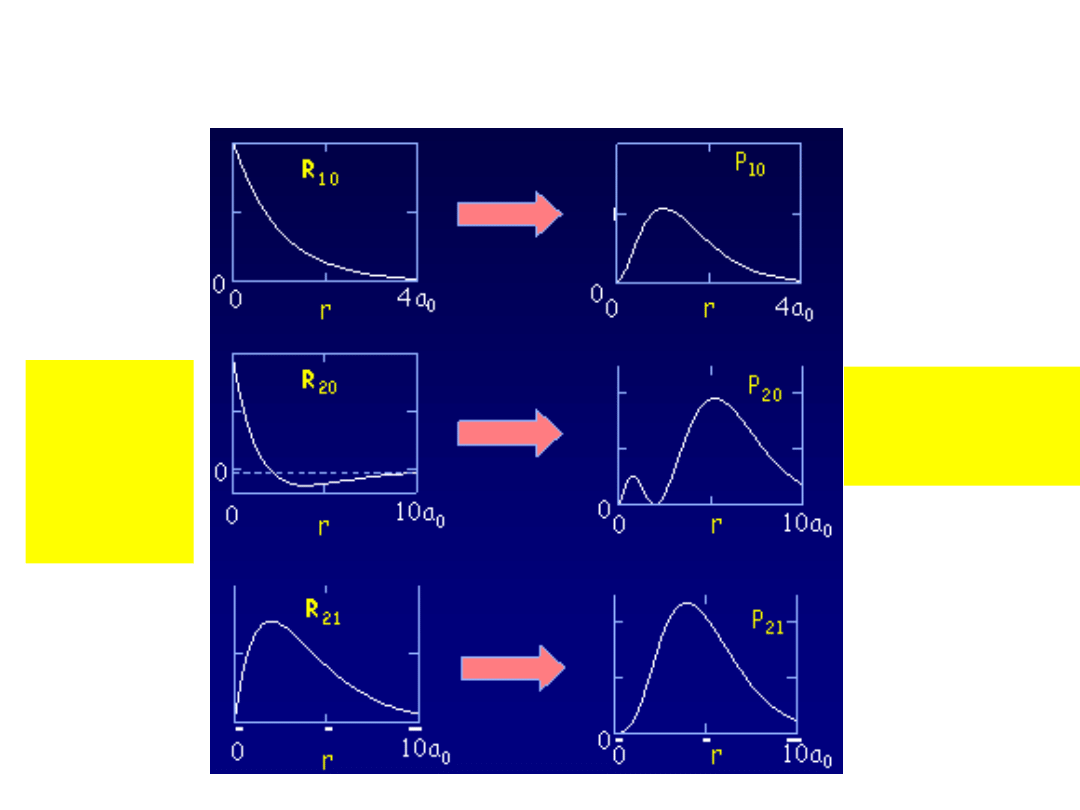
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
12/20
Funkcje falowe
liczba
przejść
R
nl
przez
zero=n-
l
-
1
prawdopod.
radialne
P(r)dr=|R|
2
r
2
dr
a) radialne
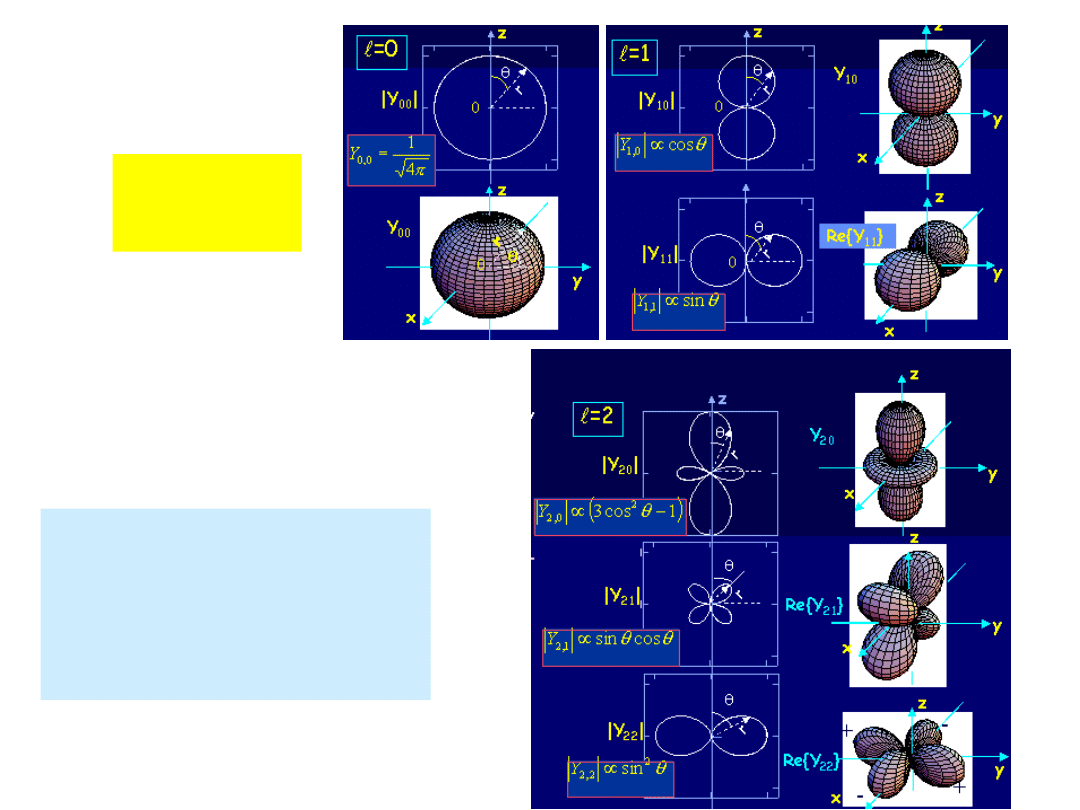
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
13/20
Funkcje falowe
P()=|
Y()|
ważne dla zachowania
się atomów w
zewnętrznych polach i
dla zrozumienia
symetrii cząsteczek
b) kątowe
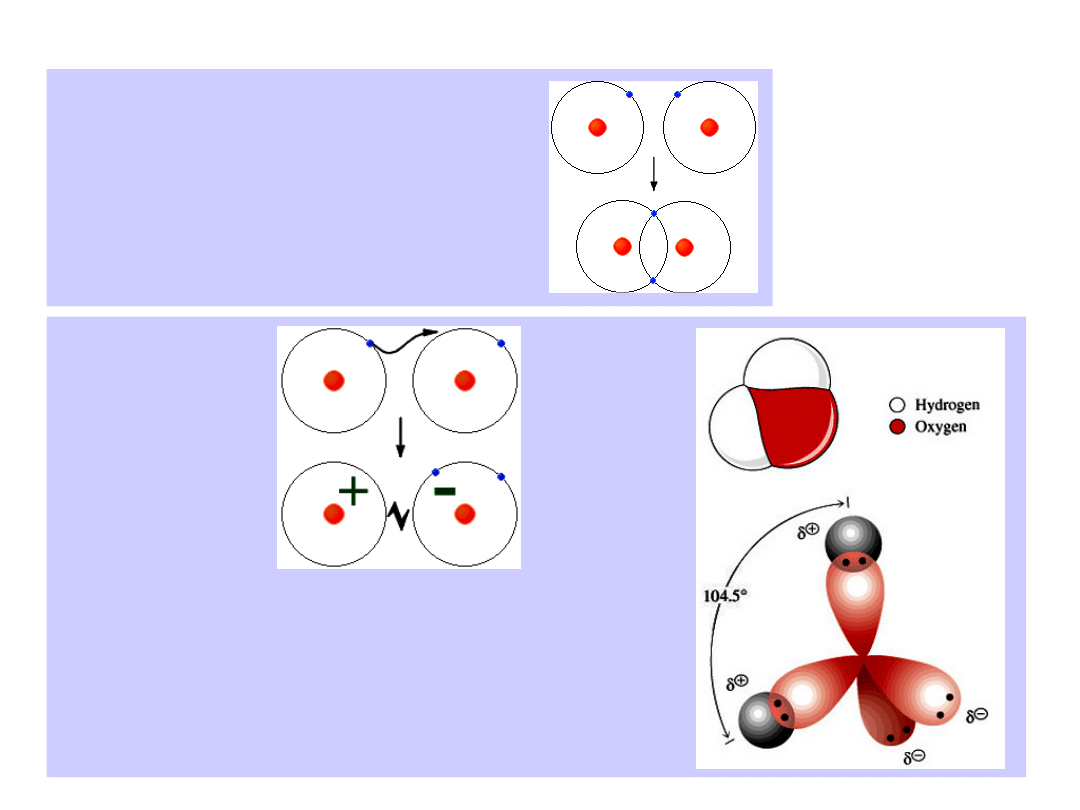
Wojciech Gawlik – Struktury Atomowe i Molekularne,
2005/06 , Wykład 1
14/20
Wiązania chemiczne
a) kowalencyjne (np. H
2
+
, H
2
)
b) jonowe
przykład: H
2
O
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
Wyszukiwarka
Podobne podstrony:
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
WYKŁAD 5. Elektronowa struktura atomu, chomikowe, WYKŁADY z Chemii
WYKŁAD 7 MODEL I STRUKTURA KOPALNI
ŚrodkiTransportu Dalekiego wykład 7a
Algorytmy wyklady, Elementarne struktury danych
wyklad 4c Struktura spoleczna Polski po transformacji
MP Wykład 7A Prognozowanie na podstawie modelu ekonometrycznego
Wykład 1 Ujęcie strukturalno formalne pedagogiki
wyklad 4b Struktura spoleczna Inteligencja
wykład 7a
wykład 4a Struktura społeczna Klasa średnia
Zarządzanie Wykład VII- Struktury organizacyjne
więcej podobnych podstron