
Synteza i badania
Synteza i badania
biologiczne dimerycznych
biologiczne dimerycznych
analogów fragmentu
analogów fragmentu
ubikwityny
ubikwityny
mostkowanych za pomoc
mostkowanych za pomoc
ą
ą
glikoli polietylenowych
glikoli polietylenowych

Cel pracy:
Cel pracy:
• Optymalizacja warunków syntezy dimerycznych oraz
monomerycznych analogów fragmentu ubikwityny
mostkowanych za pomocą glikoli polietylenowych
LEDGRTLSDY
LEDGRTLSDY
PEG jednorodny
PEG niejednorodny
• Oczyszczenie zsyntezowanych związków.
• Określenie immunomodulatorowych właściwości
otrzymanych związków.
Kierunki działania
Kierunki działania
ubikwityny -
ubikwityny -
ubikwitynacja
ubikwitynacja
•
działanie
działanie
immunomodulatorowe
immunomodulatorowe
•
związanie, a następnie
związanie, a następnie
prezentowanie nieprawidłowo
prezentowanie nieprawidłowo
funkcjonującego białka
funkcjonującego białka
proteasomowi w celu jego proteolizy
proteasomowi w celu jego proteolizy
•
regulacja cyklu komórkowego,
regulacja cyklu komórkowego,
•
białko szoku termicznego, białko
białko szoku termicznego, białko
stresu,
stresu,
•
komponent PHF w chorobach
komponent PHF w chorobach
neurodegeneracyjnych,
neurodegeneracyjnych,
•
regulacja ekspresji genów,
regulacja ekspresji genów,
utrzymanie struktury chromatyny,
utrzymanie struktury chromatyny,
•
białko transferowe,
białko transferowe,
•
białka typu UCRP,
białka typu UCRP,
stymulacja różnicowania
limfocytów T oraz B
immunofilina
aktywność
immunosupresorowa
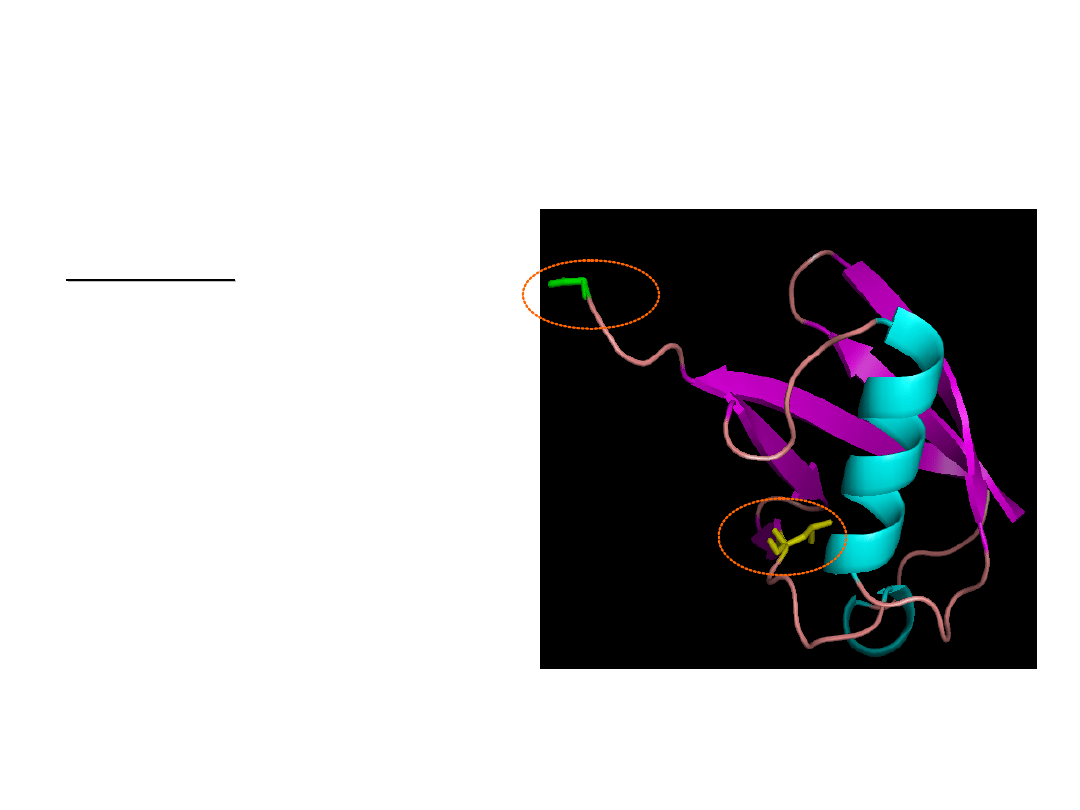
Struktura
Struktura
trzeciorzędowa
trzeciorzędowa
ubikwityny
ubikwityny
Funkcja:
Funkcja:
nieodwracalna,
nieodwracalna,
selektywna destrukcja
selektywna destrukcja
białek
białek
odwracalna,
odwracalna,
posyntetyczna
posyntetyczna
modyfikacja białek
modyfikacja białek
Gly-76
Gly-76
Lys-48
Lys-48
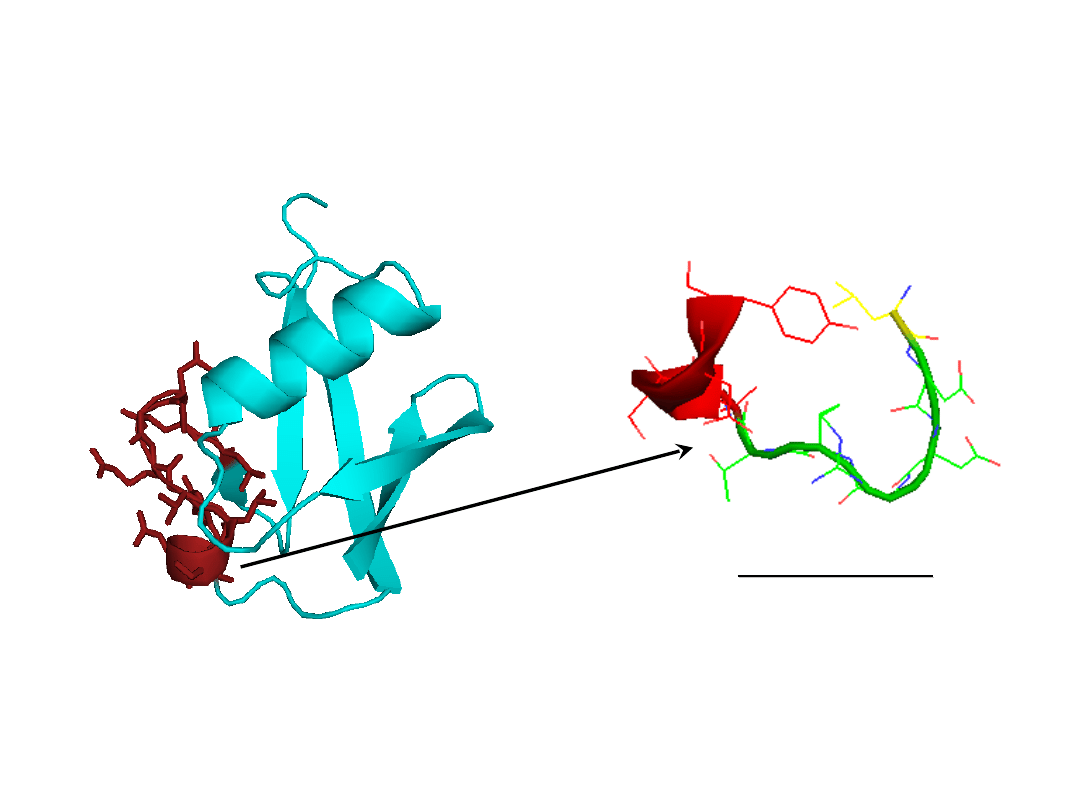
Działanie
Działanie
immunomodulatorow
immunomodulatorow
e
e
Struktura ubikwityny z wyeksponowanym
Struktura ubikwityny z wyeksponowanym
fragmentem wykazującym aktywność
fragmentem wykazującym aktywność
immunomodulatorową (50-59)
immunomodulatorową (50-59)
LEDGRTLSDY
LEDGRTLSDY
Dimeryzacja
Dimeryzacja
glikolem
glikolem
polietylenowym
polietylenowym
H
2
N-LEDGRTLSDY-OH
•
dobrze rozpuszczalne w wodzie
i rozpuszczalnikach
organicznych
• nietoksyczne, nie wykazują
cytotoksyczności
• nie wykazują immunogenności
• zwiększenie stabilności związku
• zmniejszona degradacja przez enzymy
metaboliczne
• zmniejszenie lub eliminacja
immunogenności
•wzrost rozpuszczalności oraz
biodostępności
• podwyższa walory farmakologiczne
HO-(CH
2
CH
2
-O)
n
-CH
2
-CH
2
-OH
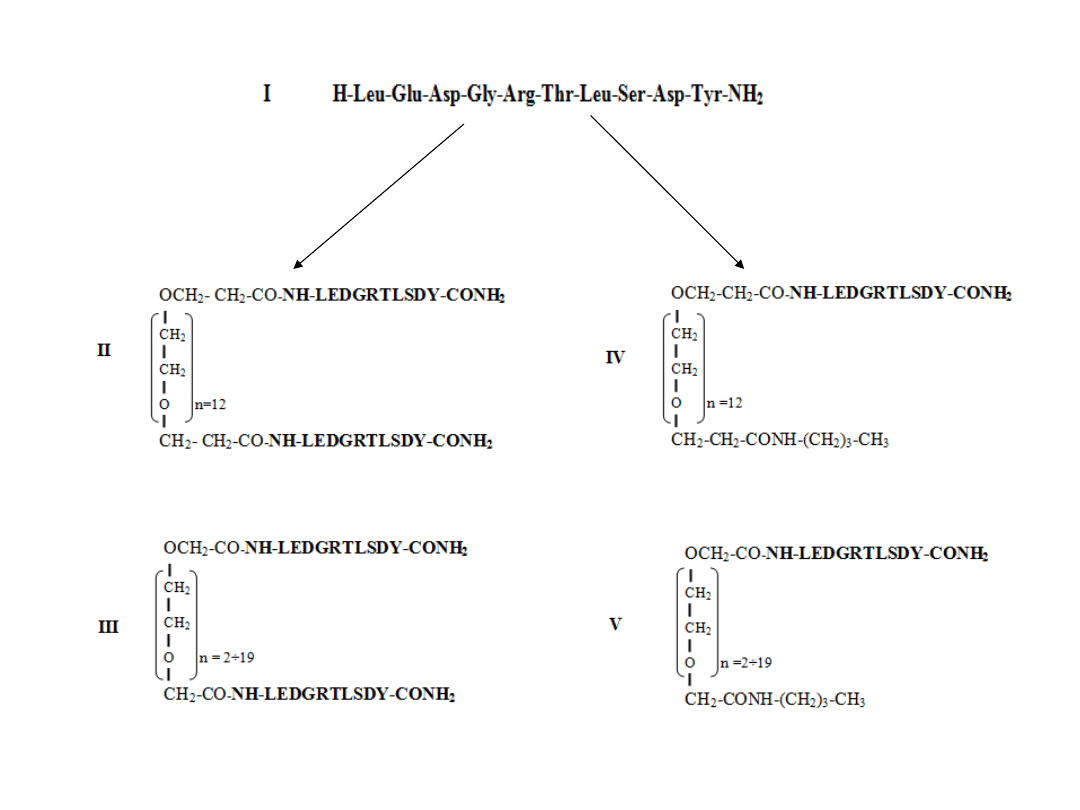
Peptydy
Peptydy
dimeryczne
dimeryczne
Peptydy
monomeryczn
e
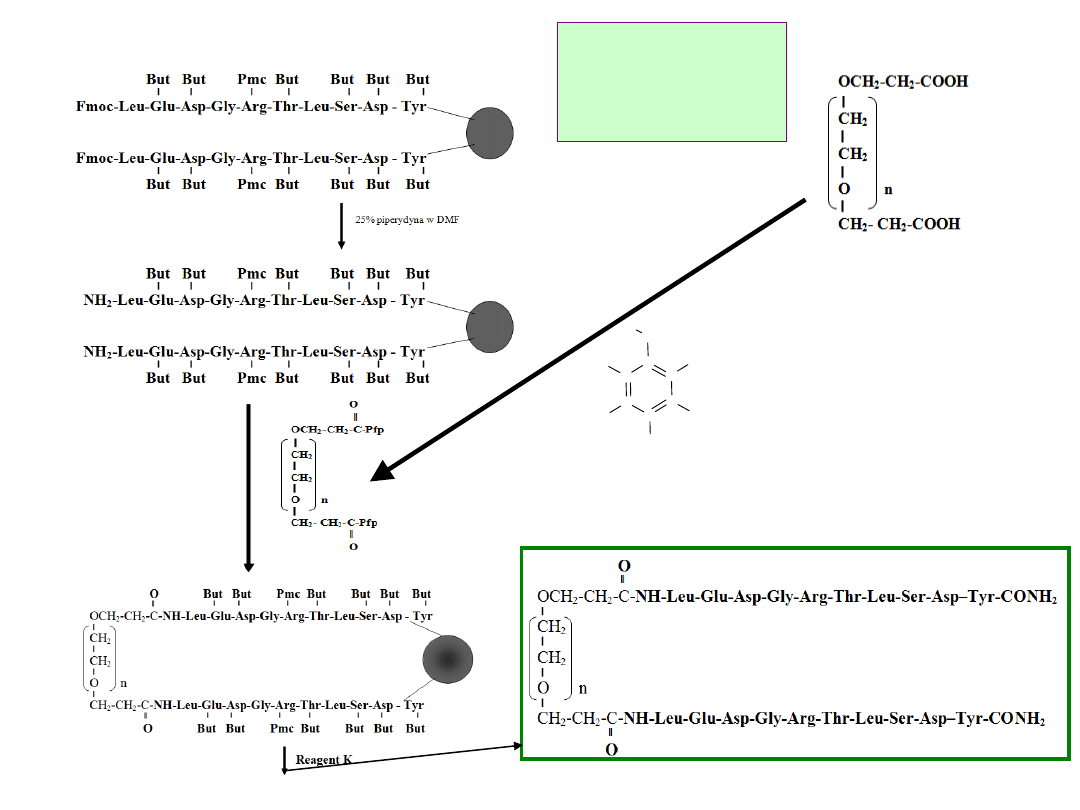
F
F
F
F
F
O
C
C
C
C
C
C
H
DIE
A
,
DCC
Schemat
Schemat
procesu
procesu
dimeryzacji
dimeryzacji
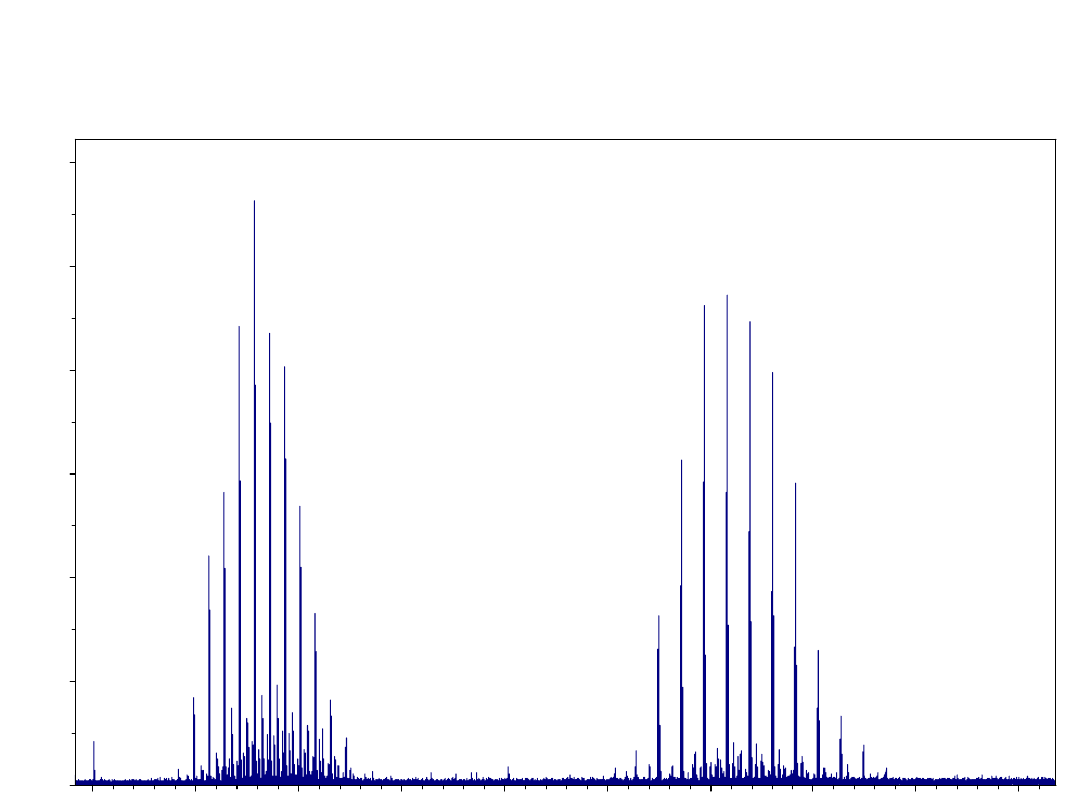
958.4706
3+
1203.1398
1415.1938
2+
800
900
1000
1100
1200
1300
1400
1500
1600
1700 m/z
0.0
0.2
0.4
0.6
0.8
1.0
8
x10
Intens.
Wysokorozdzielcze widmo MS dimerycznego peptydu
mostkowanego glikolem niejednorodnym
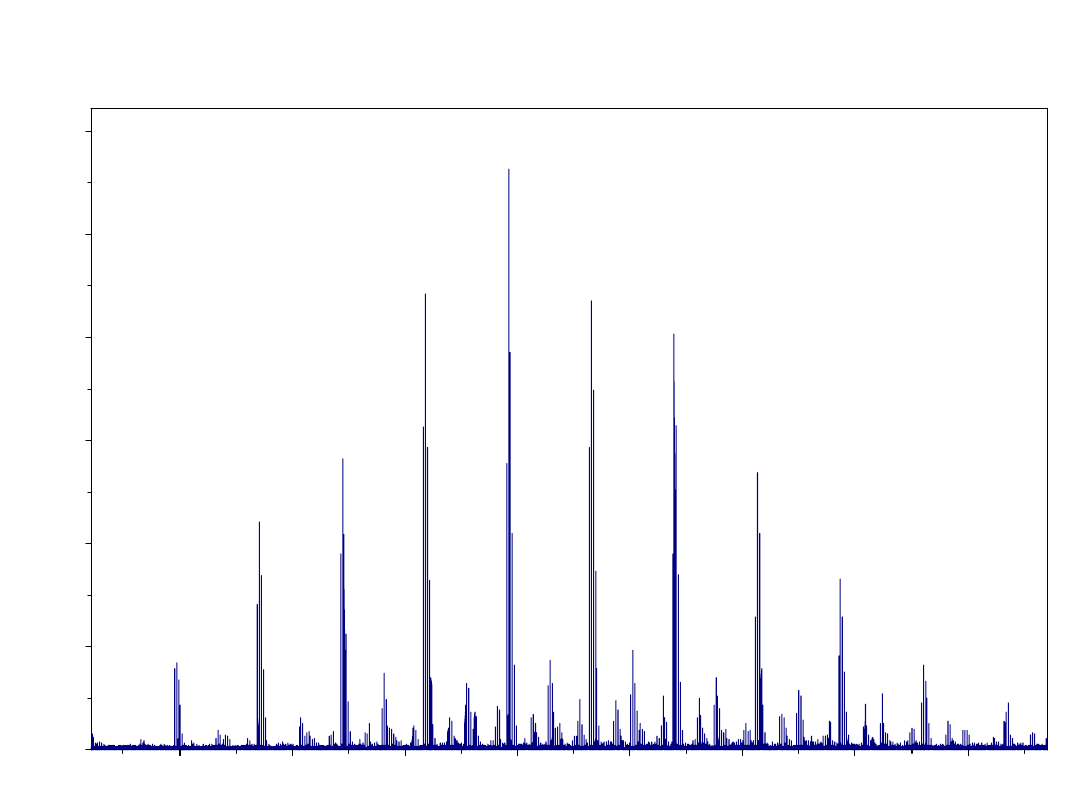
899.7695
3+
907.0967
914.4444
3+
921.7717
929.1206
3+
936.4467
3+
943.7956
3+
958.4706
3+
965.7984
3+
973.1462
3+
980.4733
3+
987.8218
3+
1002.4980
3+
1009.8247
3+
1017.1740
3+
1031.8500
3+
1046.8593
900
920
940
960
980
1000
1020
1040
m/z
0.0
0.2
0.4
0.6
0.8
1.0
8
x10
Intens.
n = 10
n = 9
n = 8
n = 7
n = 6
n = 11
n = 12
n = 13
n = 14
n = 15
n = 16
2H
+
+
Na
+
2H
+
+ Na
+
2H
+
+ Na
+
2H
+
+ Na
+
2H
+
+ Na
+
2H
+
+ Na
+
Wysokorozdzielcze widmo MS dimerycznego peptydu
mostkowanego glikolem niejednorodnym – seria [MH
3
]
3+
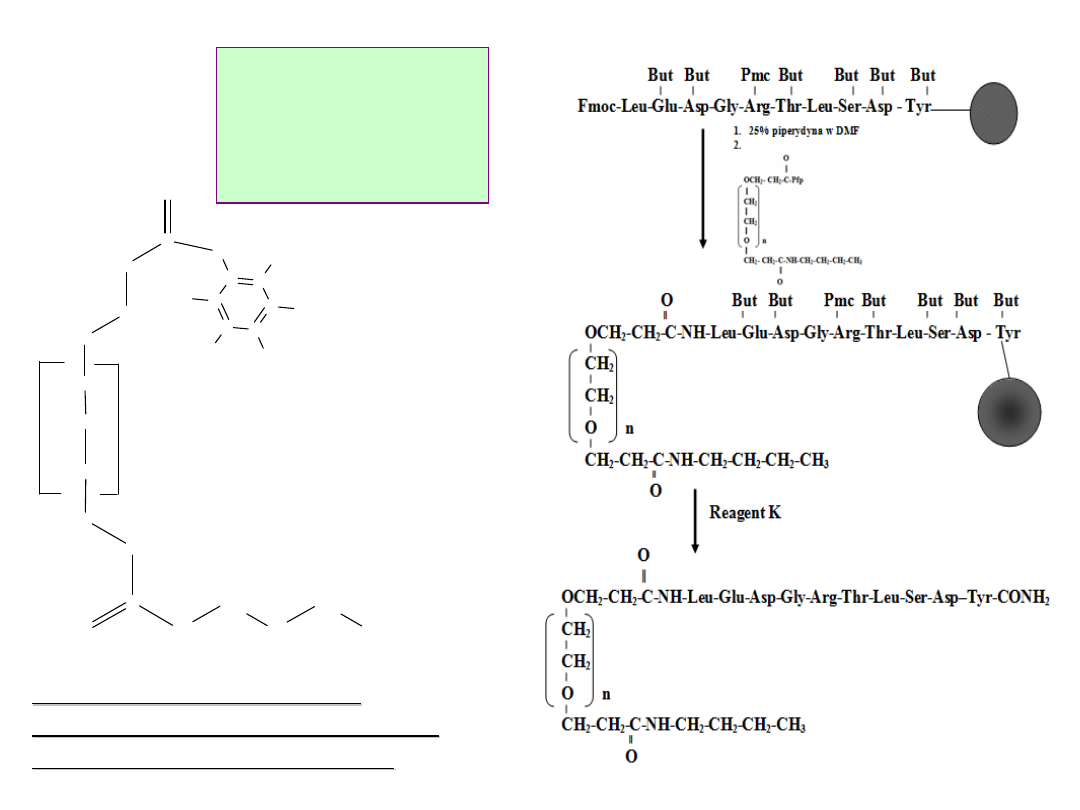
Schemat
Schemat
procesu
procesu
monomeryzacj
monomeryzacj
i
i
, DIEA
Struktura amidoestru
Struktura amidoestru
dikarboksylowego analogu
dikarboksylowego analogu
glikolu polietylenowego
glikolu polietylenowego
CH
2
CH
2
C
H
2
O
CH
2
C
H
2
O
F
F
F
F
F
O
C
C
C
C
C
C
C
H
2
O
C
CH
3
CH
2
CH
2
CH
2
NH
O
C
12
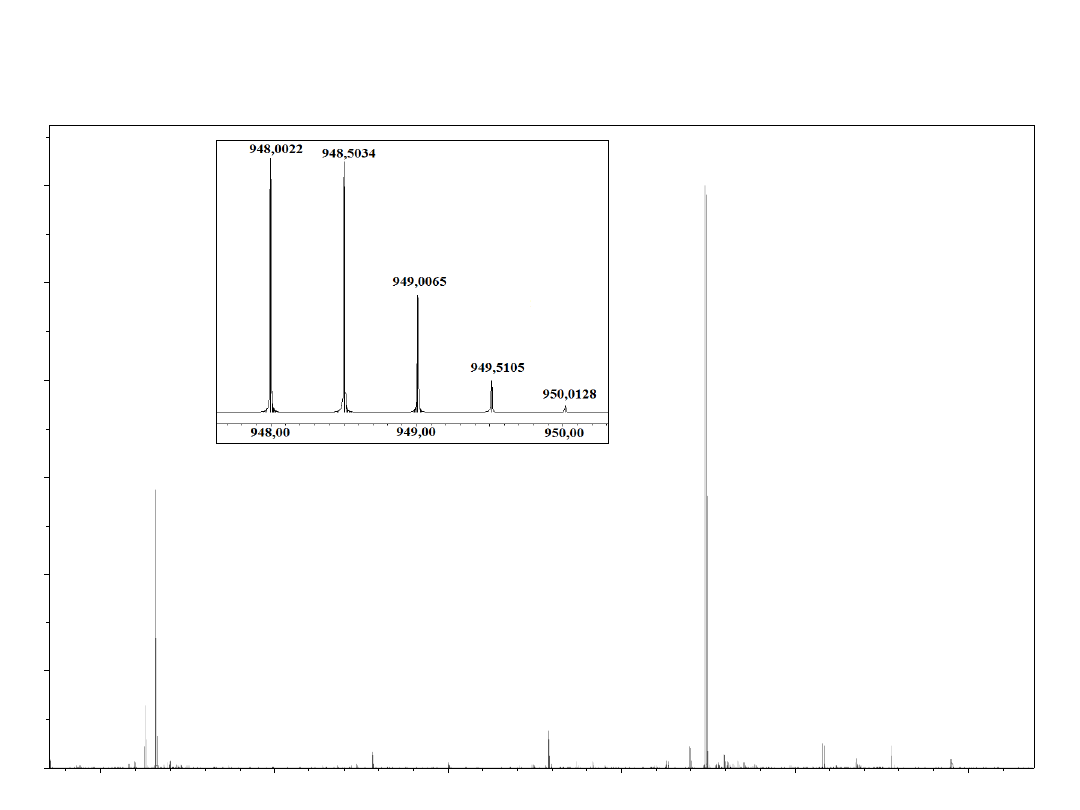
6 3 2 . 3 3 9 1
3 +
7 5 6 . 9 3 1 6
2 +
8 5 7 . 9 6 1 4
2 +
9 4 8 . 0 0 2 8
2 +
' 1 0 1 5 . 5 1 7 9
3 +
1 0 5 4 . 4 8 4 6
1 +
6 0 0
7 0 0
8 0 0
9 0 0
1 0 0 0
1 1 0 0
m / z
0 . 0
0 . 2
0 . 4
0 . 6
0 . 8
1 . 0
1 . 2
9
x 1 0
I n t e n s .
M
obl.
= 1894,0021
g/mol
M
dośw
. = 1894,0158
g/mol
Wysokorozdzielcze widmo MS monomerycznego
peptydu mostkowanego glikolem jednorodnym
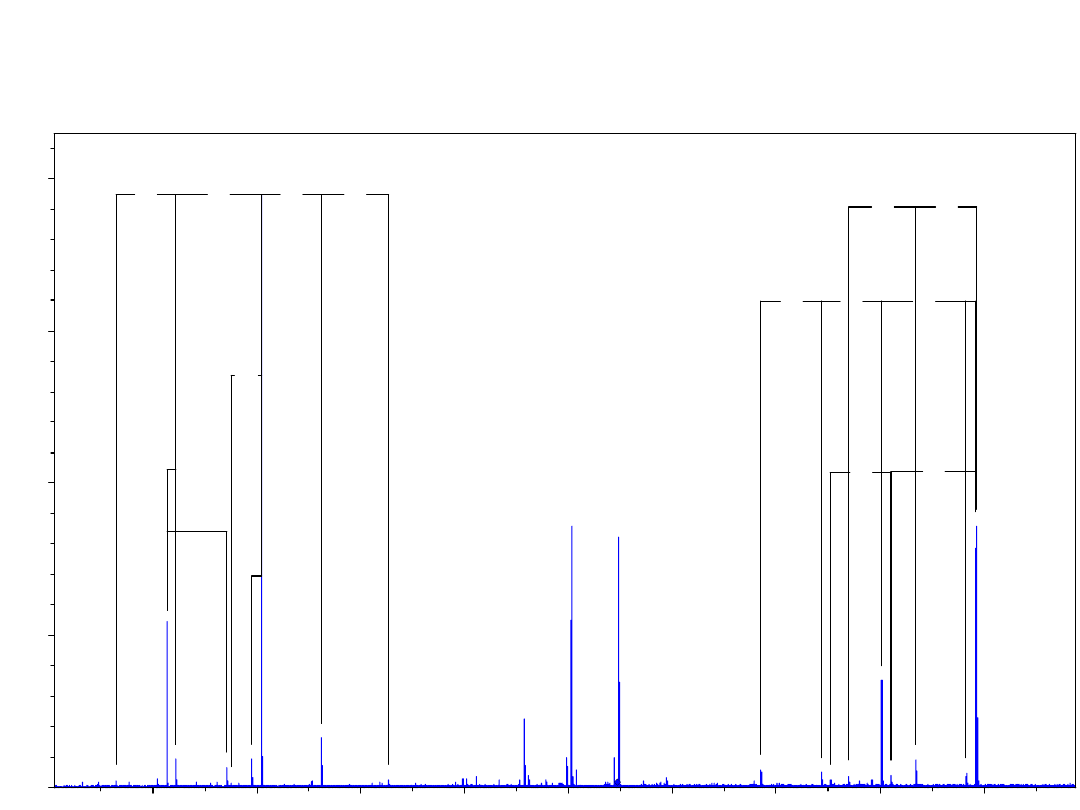
Widmo fragmentacyjne MS/MS-CID dimerycznego peptydu
mostkowanego glikolem jednorodnym PEG(LEDGRTLSDY-NH
2
)
2
dla jonu
m/z 1495,2341 ([MH
2
]
2+
) - energia kolizji 45eV
630.3194
1+
811.3923
1+
926.4192
1+
'1314.6448
2+
'1405.1809
2+
'1495.7172
2+
1768.8813
1+
1883.9430
1+
1998.9674
1+
2180.0459
1+
D
E
G
D
18.0163
E
D
D
Y
Y
D
Y
D
18.0099
18.0104
D - 0.0004
600
800
1000
1200
1400
1600
1800
2000
2200
m/z
0
1
2
3
4
8
x10
Intens.
y
8
y
7
y
9
y
6
b
9
b
3
b
2
b
9
b
8
b
2
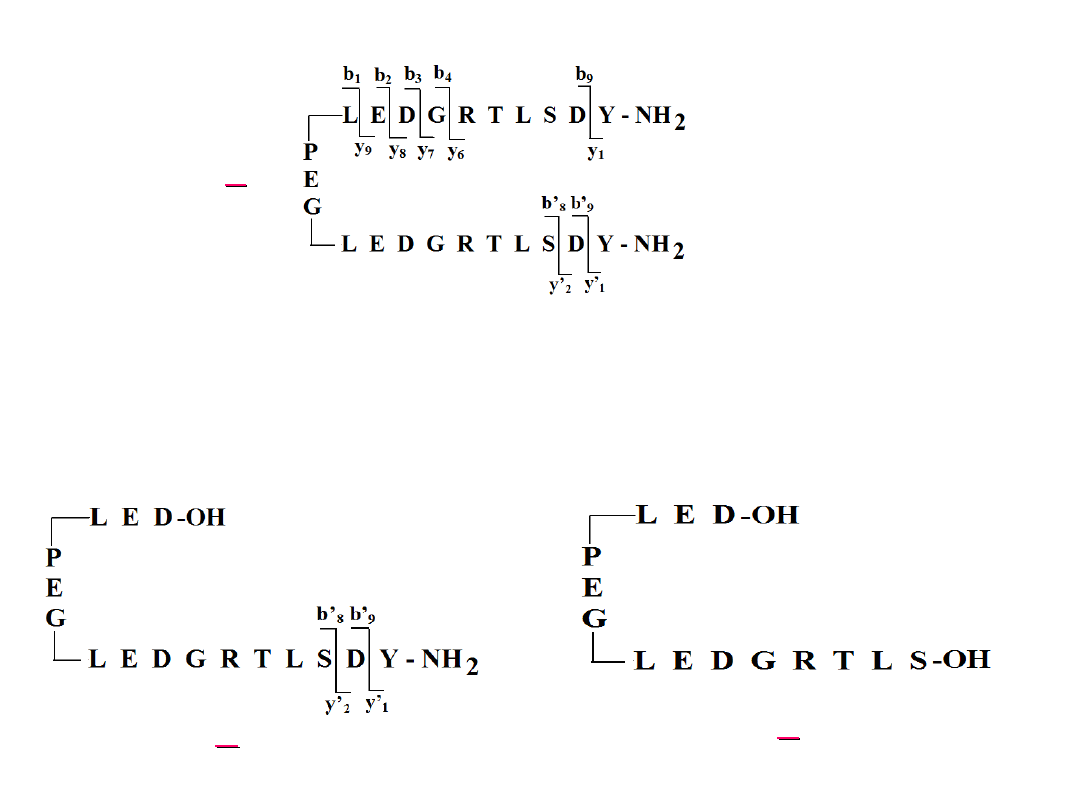
Schemat fragmentacji peptydu II (A) oraz jego etapy
fragmentacji (B i C)
(jon m/z 1495,2341, energia kolizji 45eV)
A
A
C
C
B
B
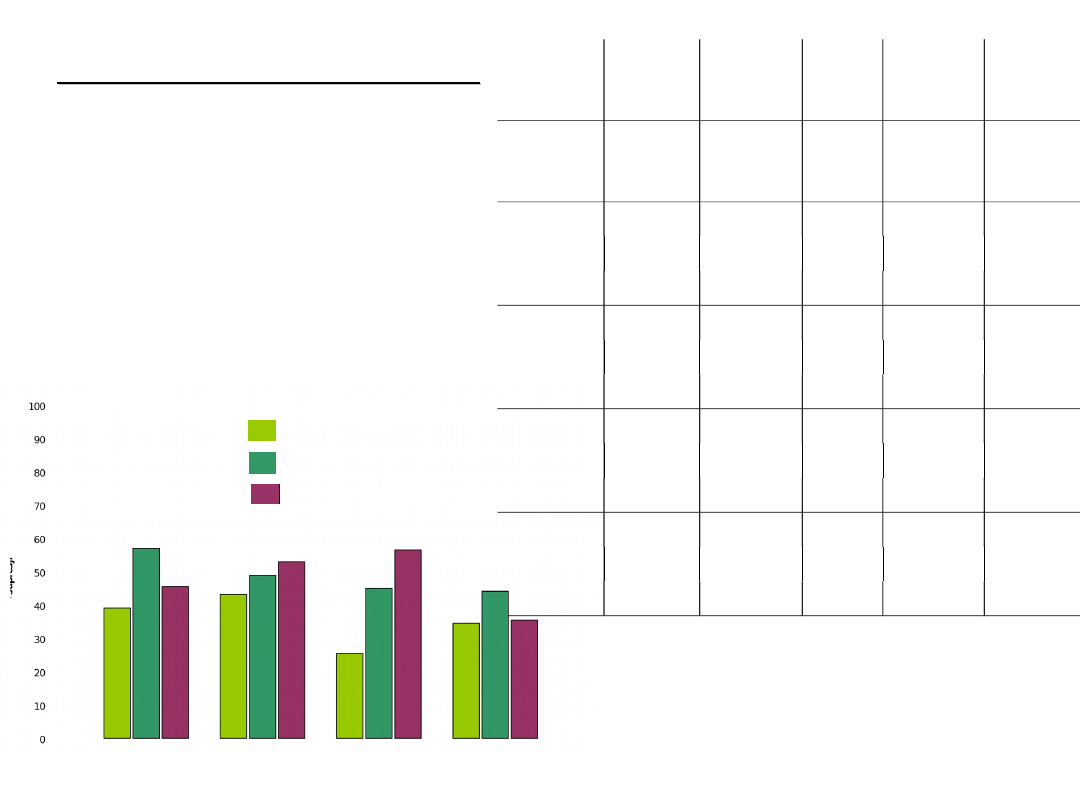
Wyniki badań biologicznych
Wyniki badań biologicznych
–
–
badanie humoralnej
badanie humoralnej
odpowiedzi immunologicznej*
odpowiedzi immunologicznej*
•
test Jernego
• określenie liczby AFC
produkujących IgM
peptyd
dawka
(μg)
AFC
(średni
a)
SE
P (test
studen
ta)
%
supres
ji
Próbka
kontrol
na
1000,00
37,42
I
1
609,25
35,01
0,0001
39
10
430,00
26,46
0,0001
57
100
545,00
45,00
0,0001
46
II
1
568,25
29,95
0,0001
43
10
511,00
41,56
0,0001
49
100
470,00
23,80
0,0001
53
IV
1
745,00
20,62
0,0008
26
10
550,00
64,55
0,0001
45
100
435,00
33,04
0,0001
57
Ubikwit
yna
1
654,50
25,69
0,0001
35
10
559,00
15,62
0,0001
44
100
645,50
75,35
0,0001
35
1 μg
10 μg
100
μg
Peptyd
I
Peptyd
II
Peptyd
IV
Ubikwity
na
*Instytut Immunologii i Terapii
Doświadczalnej Polskiej
Akademii Nauk we Wrocławiu;
Zakład prof. M. Zimeckiego

Podsumowani
e
• Zsyntezowałam, oczyściłam oraz potwierdziłam
strukturę nowych dimerycznych analogów
immunomodulatorowego fragmentu ubikwityny
– Zsyntezowałam, oczyściłam oraz potwierdziłam
strukturę monomerycznych analogów
immunomodulatorowego fragmentu ubikwityny
• Zbadanie właściwości immunomodulatorowych
otrzymanych peptydów*
– Zastosowanie łącznika glikolu polietylenowego wpływa
na wzrost hamowania humoralnej odpowiedzi
immunologicznej
– Dimeryzacja immunomodulatorowego fragmentu (50-
59) ubikwityny powoduje wzrost immunosupresji
peptydu
*Instytut Immunologii i Terapii Doświadczalnej Polskiej Akademii Nauk we
Wrocławiu; Zakład prof. M. Zimeckiego
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
SYNTEZA I BADANIE WŁAŚCIWOŚCI KATIONOWEJ ŻYWICY JONOWYMIENNEJ, CHEMIA, Synteza i badanie wł. żywicy
kwasy i pochodne Synteza kwasu?etylosalicylowego1
kwasy i pochodne Synteza?nzoesanu?nylu reakcja estryfikacji
kwasy i pochodne Synteza pochodnych kwasów karboksylowych – estrów
Badania mikroflory pochodzenia zwierzęcego
Test do badania poziomu analizy i syntezy słuchowej wyrazów-Styczek(1), Pedagogika
kwasy i pochodne Synteza octanu etylu
Badanie poziomu analizy i syntezy wzrokowej ucznia
Wybrane próby do badania analizy i syntezy słuchowej wyrazów, oligofrenopedagogika - różne materiały
Badanie wybranych właściwości fizykochemicznych polieteroli jako substratów do syntezy poliuretanów
POLSKIE BADANIA Z ZAKRESU STATYSTYKI JĘZYKOZNAWCZEJ. PRÓBA SYNTEZY, Polska statystyka
6 Zastosowanie pochodnych do badania własności funkcji
kwasy i pochodne Synteza kwasu?etylosalicylowego1
Starożytni Ariowie pochodzą z Syberii największe badania DNA
Test do badania poziomu analizy i syntezy głoskowej wg J Nowak(1)
Starożytni Ariowie pochodzą z Syberii największe badania DNA
3 ćwiczenia BADANIE asfaltów
BADANIEepipelne
BADANIA 3
więcej podobnych podstron