
Pierwiastki bloku d
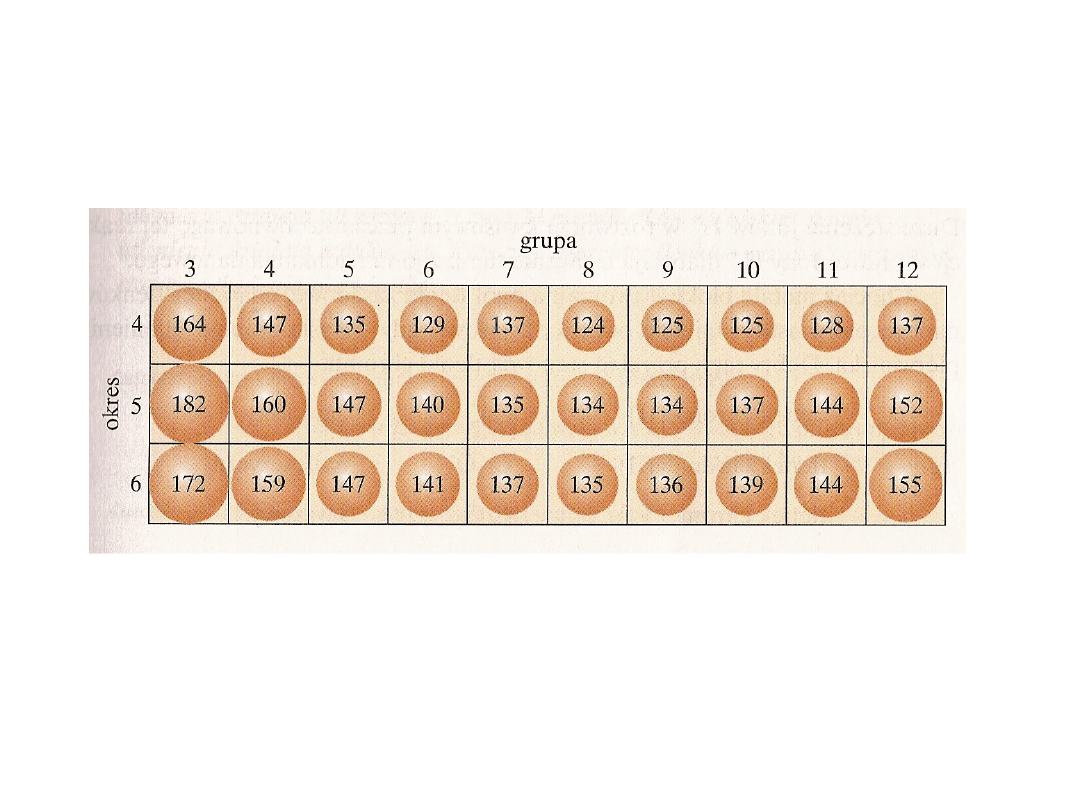
Rozmiary atomów
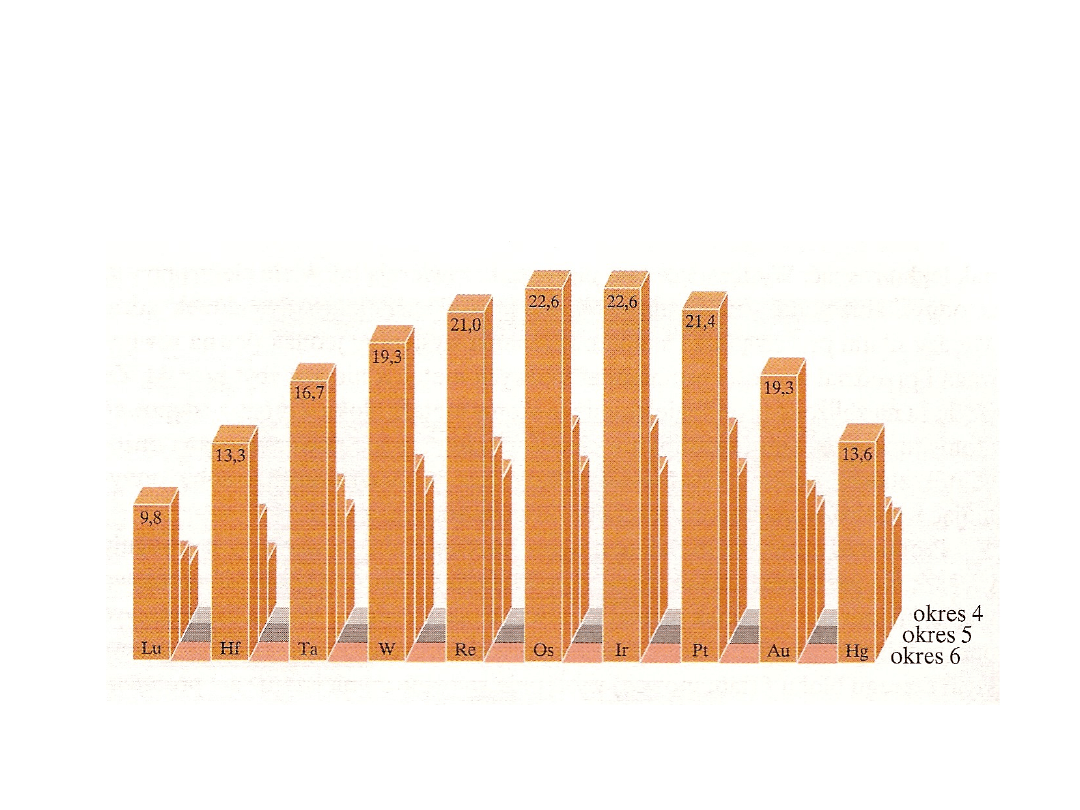
Kontrakcja lantanowcowa
Skutki
– Podobne energie solwatacji i energie sieci związków tworzonych przez
jony
– Łatwość tworzenia stopów
– Bardzo duża gęstość pierwiastków 6 okresu
– Mała aktywność chemiczna np. złota i platyny
2
3
4
5
Ca
2+
- 99
Sc
3+
- 70
Ti
4+
- 68
V
5+
- 59
Sr
2+
- 113
Y
3+
- 90
Zr
4+
- 74
Nb
5+
- 69
Ba
2+
- 135
La
3+
- 106
Hf
4+
- 75
Ta
5+
- 68
Ogólne właściwości
Duża gęstość (jedynie Sc i Ti mają gęstości < 5 g/cm
3
)

Ogólne właściwości
• Wysokie temperatury topnienia i wrzenia (wyjątek stanowią
pierwiastki grupy 12)
• Aktywność chemiczna na ogół:
– w okresach maleje przy przejściu z lewej strony w prawą
– w grupach maleje przy przesuwaniu się w dół grupy
• Energie jonizacji zmieniają się w bardzo szerokim zakresie:
La – 541 kJ/mol (zbliżona do litu) Hg – 1007 kJ/mol
• Związki są na ogół barwne

Właściwości magnetyczne
• Poza pierwiastkami grupy 12 atomy posiadają niesparowane elektrony.
Mają więc właściwości
paramagnetyczne

Właściwości magnetyczne
• Niektóre pierwiastki (np.
żelazo, kobalt
) i związki (np.
Fe
3
O
4
) mają
właściwości
ferromagnetyczne

Właściwości katalityczne
• Ag
+
- katalizują reakcje utleniania jonami S
2
O
82-
• FeSO
4
+ H
2
O
2
–
odczynnik Fentona
– katalizuje utlenianie alkoholi do
aldehydów (Fe
2+
+ H
2
O
2
→ Fe
3+
+ OH
-
+
HO
*
)
• Pd
– katalizator reakcji uwodorniania
• Pt/PtO
– katalizuje procesy redukcji
• Pt
– synteza NH
3
, utlenianie SO
2
do SO
3
• Pt/Rh
– utlenianie amoniaku do NO
• Ni
– katalizator procesów redukcji
• Cu/V
– utlenianie cykloheksanonu do kwasu adypinowego
• Cu
– otrzymywanie (CH
3
)
2
SiCl
2
(substrat do otrzymywania silikonów)
• TiCl
4
– katalizator Zieglera-Nafty
– stosowany w procesach polimeryzacji
Struktury elektronowe i stopnie utlenienia pierwiastków I-
szego szeregu metali bloku d
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
d
1
s
2
d
2
s
2
d
3
s
2
d
5
s
1
d
5
s
2
d
6
s
2
d
7
s
2
d
8
s
2
d
10
s
1
d
10
s
2
+1
+1
+2
+2
+2
+2
+2
+2
+2
+2
+2
+2
+3
+3
+3
+3
+3
+3
+3
+3
+3
+4
+4
+4
+4
+4
+4
+4
+5
+5
+5
+5
+5
+6
+6
+6
+7
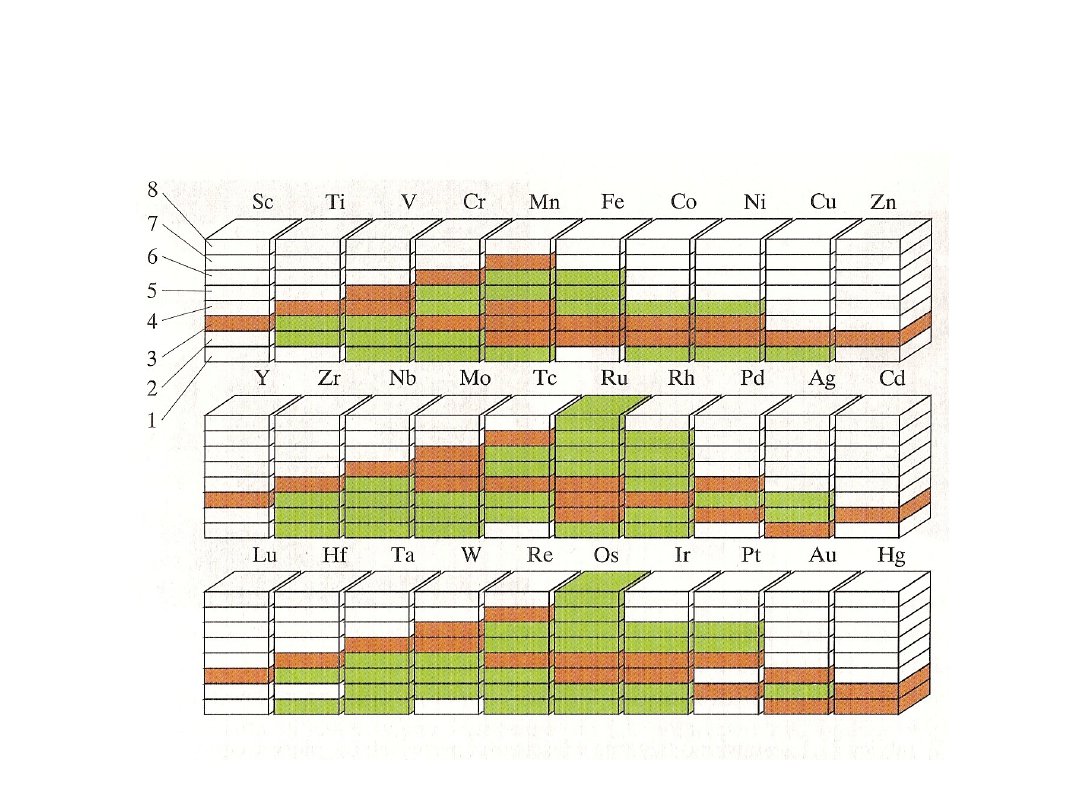
Stopnie utlenienia

Niestandardowe stopnie utlenienia niektórych
pierwiastków w związkach
• Nienormalnie niskie stopnie utlenienia są stabilizowane w
kompleksach przez ligandy takie jak:
CO, NO
+
, dipirydyna
, zdolne
do tworzenia słabych wiązań
a silnych wiązań
przykłady:
Ni(CO)
4
, Cr(dpy)
3+
• Nienormalnie wysokie stopnie utlenienia stabilizowane są przez
małe, niepolaryzowalne, silnie elektroujemne jony dysponujące
wolnymi parami elektronowymi
np. F
-
, O
2-
przykłady:
MnF
3
, MnO
4-
, CrO
3

Zdolność do tworzenia kompleksów
W porównaniu z jonami metali grup głównych:
• jony metali bloku d mają na ogół mniejsze promienie i silniej
przyciągają ligandy
• w wyniku oddziaływania pola elektrostatycznego ligandów na
elektrony znajdujące się na orbitalach d jonu metalu dochodzi do
zniesienia degeneracji podpoziomu d i pojawia się dodatkowy
czynnik stabilizujący kompleks –
ESPK

Związki niestechiometryczne
Powstają zwykle gdy metal bloku d łączy się z pierwiastkiem grupy
XVI.
Powodami powstawania takich związków są:
– zmienna wartościowość jonu metalu
– defekty sieci krystalicznej związku
Przykłady:
FeO Fe
0.94
O – Fe
0.86
VSe VSe
0.98
– VSe
1.2
Pierwiastki pierwszego szeregu od skandu do niklu
Grupa 11 i 12

Tytan
• Jest dość rozpowszechniony. Pod tym względem zajmuje IX
miejsce.
Główny minerał to TiO
2
– rutyl
• Typowe stopnie utlenienia w związkach
+4 i +3
• Posiada
unikalne
właściwości o dużym znaczeniu praktycznym:
– jest bardzo twardy
– ma wysoką temperaturę topnienia
– w normalnych temperaturach (dzięki pasywacji) jest bardzo odporny na
korozję (jest lepszy niż stal nierdzewna)
– jest prawie dwukrotnie lżejszy od żelaza

Tytan
Zastosowania:
– budowa silników odrzutowych i turbin gazowych
– budowa statków
– aparatura dla przemysłu chemicznego
– dodatek stopowy do stali
– materiał na implanty
– niektóre metaloorganiczne związki tytanu wiążą azot z powietrza i
przekształcają go w NH
3
– TiO
2
jest cenionym białym pigmentem – biel tytanowa
– tytanoceny badane są pod kątem zastosowania w terapiach
przeciwnowotworowych
Tytan
Otrzymywanie
TiO
2
C
Cl
2
TiCl
4
1. Metoda Krolla
TiCl
4
+ 2 Mg
2 MgCl
2
+ Ti
800
o
C
argon
2. Metoda J CJ
TiCl
4
+ 4 Na
4 NaCl + Ti
temp.
argon
3. Elektroliza stopionego TiCl
3
z dodatkiem NaCl i KCl w atmosferze argonu
Oczyszczanie:
1. Przetapianie w atmosferze argonu
2. Metoda van-Arkela
Ti + 2 I
2
TiI
4
Ti + 2 I
2
50 - 250
o
C
1400
o
C
drut wolframowy
3. Topienie strefowe

Wanad
• Własnościami fizycznymi i odpornością na korozję przypomina
tytan.
• Jest jednak pierwiastkiem rzadkim
• Występuje na stopniach utlenienia od +2 do +5. Na stopniach
utlenienia +2 i +3 tworzy proste jony. Na wyższych jony złożone
np. VO
2+
.
• Metody otrzymywania:
– aluminotermia V
2
O
3
+ 2 Al → 2 V + Al
2
O
3
– redukcja VCl
3
metalicznym sodem
– redukcja VCl
4
magnezem (metoda Krolla)
– piroliza jodków (metoda van Arkela)
– elektroliza stopionych fluorokompleksów

Wanad
• Zastosowania:
• Dodatek stopowy do stali (zwiększa twardość)
• Składnik przemysłowych katalizatorów używanych w reakcjach
utleniania:
– Naftalen → kwas ftalowy
– Toluen → aldehyd benzoesowy
• V
2
O
5
jest podstawowym katalizatorem reakcji utleniania SO
2
do
SO
3
w przemysłowej metodzie otrzymywania H
2
SO
4

Chrom
Stopnie utlenienia:
• Nietypowa konfiguracja elektronowa
3d
5
4s
1
sugeruje możliwość tworzenia
związków na stopniu utlenienia
+1
. Jedyny dobrze znany związek na tym
stopniu to kompleks
[Cr(dpy)
3
]ClO
4
• Stopień
+2
, o ile nie jest ustabilizowany w formie kompleksu, jest nietrwały, a
związki na tym stopniu mają bardzo silne właściwości redukujące.
• Najtrwalszym stopniem utlenienia jest
+3
. Na tym stopniu chrom tworzy
zarówno wolne jony jak i liczne kompleksy.
• Związki na stopniu utlenienia
+6
wykazują silne właściwości utleniające,
szczególnie w środowisku kwaśnym.

Chrom
Zastosowania:
• W niskich temp. chrom jest niereaktywny –
ulega pasywacji
. Z
tego powodu jest wykorzystywany do galwanicznego wytwarzania
powłok ochronnych (antykorozyjnych) na żelazie i innych
metalach.
• Dodatek do stali – zapewnia jej nierdzewność
• Duże znaczenie w wielu dziedzinach chemii i przemysłu
chemicznego mają chromiany i dichromiany jako utleniacze.

Chrom
Otrzymywanie:
• FeCr
2
O
4
+ 4 C → Fe +
2 Cr
+ 4 CO
żelazochrom
• 2 FeCr
2
O
4
+ 2 Na
2
CO
3
+ 7/2O
2
→ 2 Na
2
Cr
2
O
7
+ Fe
2
O
3
+ 2 CO
2
Na
2
Cr
2
O
7
+ 2 C → Cr
2
O
3
+ Na
2
CO
3
+ CO
Cr
2
O
3
+ 2 Al → Al
2
O
3
+
2 Cr

Molibden i wolfram
• dodatek
molibdenu i wolframu
do stali daje bardzo twarde stopy
stosowane do wyrobu narzędzi tnących
• wolfram
ma najwyższą wśród metali temp. topnienia 3410
o
C i jest
używany do wyrobu elementów grzejnych i włókien żarówek
• MoS
2
jest doskonałym smarem
• Mo
jest składnikiem wielu katalizatorów
• Mo
jest jedynym metalem przejściowym II i III-ego szeregu, który
jest biopierwiastkiem

Mangan
Stopnie utlenienia:
• W pierwszym szeregu metali przejściowych ma największą
rozpiętość stopni utlenienia.
• Najtrwalszy jest stopień utlenienia
+2
. Mangan na tym stopniu
utlenienia występuje w postaci wolnych jonów oraz kompleksów.
W roztworach stopień ten jest trwały tylko w środowisku kwaśnym
i obojętnym. W środowisku zasadowym łatwo utlenia się do MnO
2
.
• Dobrze znane są związki na stopniu utlenienia
+4
i
+7
–
MnO
2
i
MnO
4-
. Charakteryzują się one silnymi właściwościami
utleniającymi.
• Stopnie
+3
i
+6
są termodynamicznie nietrwałe i wykazują
tendencję do samorzutnego dysproporcjonowania.
Mn
3+
może być
ustabilizowany w formie kompleksów.

Mangan
Zastosowania:
• Metaliczny mangan dodawany jest jako składnik stopowy do stali.
Poprawia on jej wytrzymałość
MnO
2
• otrzymywanie KMnO
4
• wyrób ogniw Leclanche’go i baterii litowo-jonowych
• utleniacz w chemii organicznej
KMnO
4
• otrzymywanie sacharyny
• otrzymywanie kwasu askorbinowego (witamina C)
• otrzymywanie kwasu nikotynowego
• dezynfekcja wody
• odczynnik miareczkujący w chemii analitycznej

Biologiczna rola manganu
• Czterordzeniowy kompleks manganu jest głównym składnikiem
kompleksu uwalniającego tlen (OEC) w fotosystemie II roślin
zielonych.
• Kompleks manganu stanowi centrum aktywne SOD II – enzymu
katalizującego dysproporcjonowanie anionorodnika
ponadtlenkowego w mitochondriach:
2 H
+
+ 2 O
2-.
→ H
2
O
2
+ O
2
• Kompleksy manganu sterują przemianami katecholamin w mózgu.
Triada żelazowców
Konfiguracja
elektronowa
Temp.
topnienia
Temp.
Wrzenia
Energia
jonizacji
[eV]
Potencjał
układu
Me
2+
/Me
o
Fe
3 d
6
4 s
2
1535
2700
7.90
-0.44
Co
3 d
7
4 s
2
1490
2900
7.86
-0.28
Ni
3 d
8
4 s
2
1450
2700
7.63
-0.25
Duże podobieństwo właściwości fizycznych i chemicznych.
• trwałość stopnia utlenienia +2
• zróżnicowana trwałość stopnia utlenienia +3
• zdolność do trwałego magnesowania się –
ferromagnetyzm
• zdolność do tworzenia kompleksów
• znaczenie biologiczne

Żelazo
• Rozpowszechnienie – bardzo duże. (IV miejsce).
Znanych jest kilkaset minerałów, z których można je łatwo
otrzymać przez redukcję węglem. Najważniejsze pod względem
użytkowym to:
Fe
2
O
3
– hematyt
Fe
3
O
4
– magnetyt
FeCO
3
– syderyt
• Bardzo powszechne minerały siarczkowe (np. piryt) nie nadają się
do bezpośredniej przeróbki na żelazo.
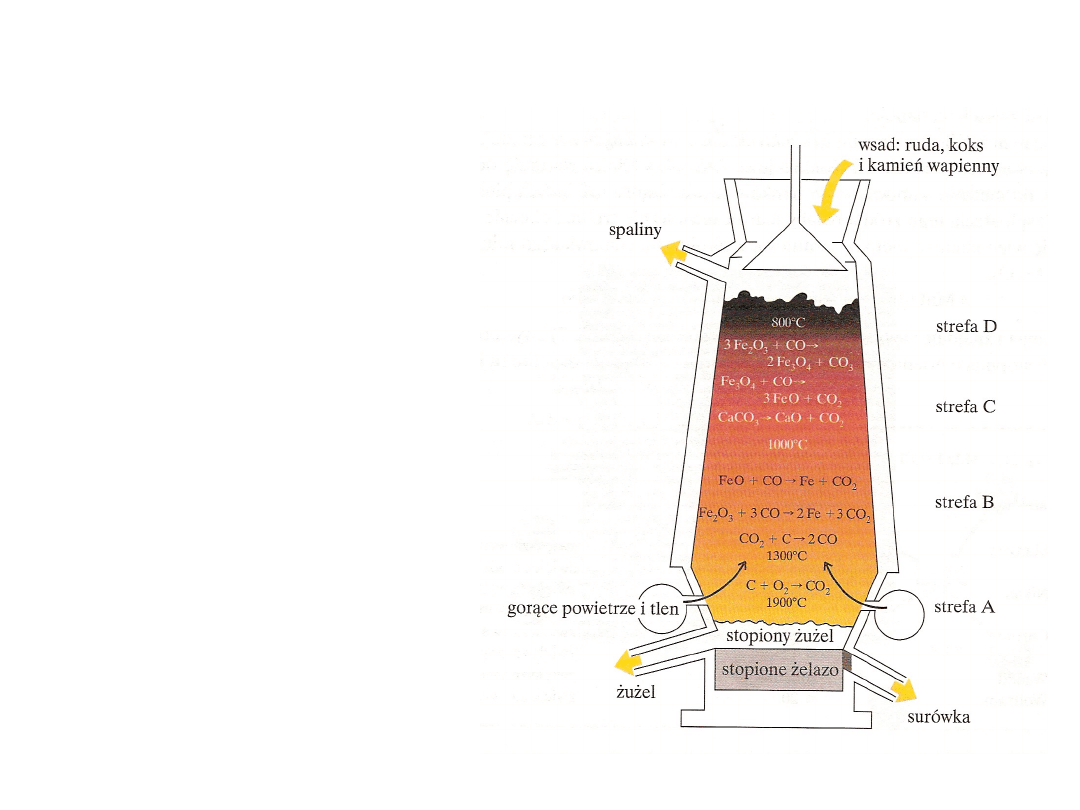
Żelazo
Otrzymywanie w procesie
wielkopiecowym:
C + O
2
→ CO
2
C + CO
2
→ 2 CO
3 Fe
2
O
3
+CO → 2 Fe
3
O
4
+ CO
2
Fe
3
O
4
+ CO → 3 FeO + CO
2
FeO + CO →
Fe
+ CO
2
CaCO
3
→ CaO + CO
2
CaO + SiO
2
→ CaSiO
3
Skład surówki: 4% C, 2% Si, ślady
siarki, 1% fosforu, mangan
Surówka po przetopieniu daje
żeliwo.

Żelazo
Otrzymywanie stali
• Metoda Bessemera-Tomasa
• Metoda Martena
Wpływ węgla na właściwości stali:
Typ stali
Zawartość węgla
w %
Właściwości i zastosowania
Niskowęglowa
<0,15
Miękka i plastyczna - druty
Miękka
od 0,15 do 0,25
Kable, gwoździe, łańcuchy,
podkowy
Średniowęglowa
od 0,20 do 0,60
Dźwigary, szyny, konstrukcje
Wysokowęglowa
od 0,61 do 1,5
Noże, żyletki, narzędzia tnące i
wiertnicze

Żelazo
Właściwości:
• Metal dość aktywny. Łatwo reaguje z kwasami nieutleniającymi wypierając
z nich wodór.
2 H
+
+ Fe → Fe
2+
+ H
2
• Podstawowe stopnie utlenienia to
+2
i
+3
.
• Wolne jony na stopniu utlenienia
+2
są trwałe tylko w środowisku
kwaśnym. W środowisku obojętnym i zasadowym ulegają utlenieniu do
stopnia
+3
. Dodatek zasady do roztworu jonów
Fe
2+
powoduje wytrącenie
się
Fe(OH)
2
który pod działaniem powietrza łatwo się utlenia.
4 Fe(OH)
2
+ O
2
+ 2 H
2
O → 4 Fe(OH)
3
• Jony
Fe
3+
w wodzie łatwo hydrolizują:
Fe
3+
+ H
2
O ↔ Fe(OH)
2+
+ H
+
K = 0.007
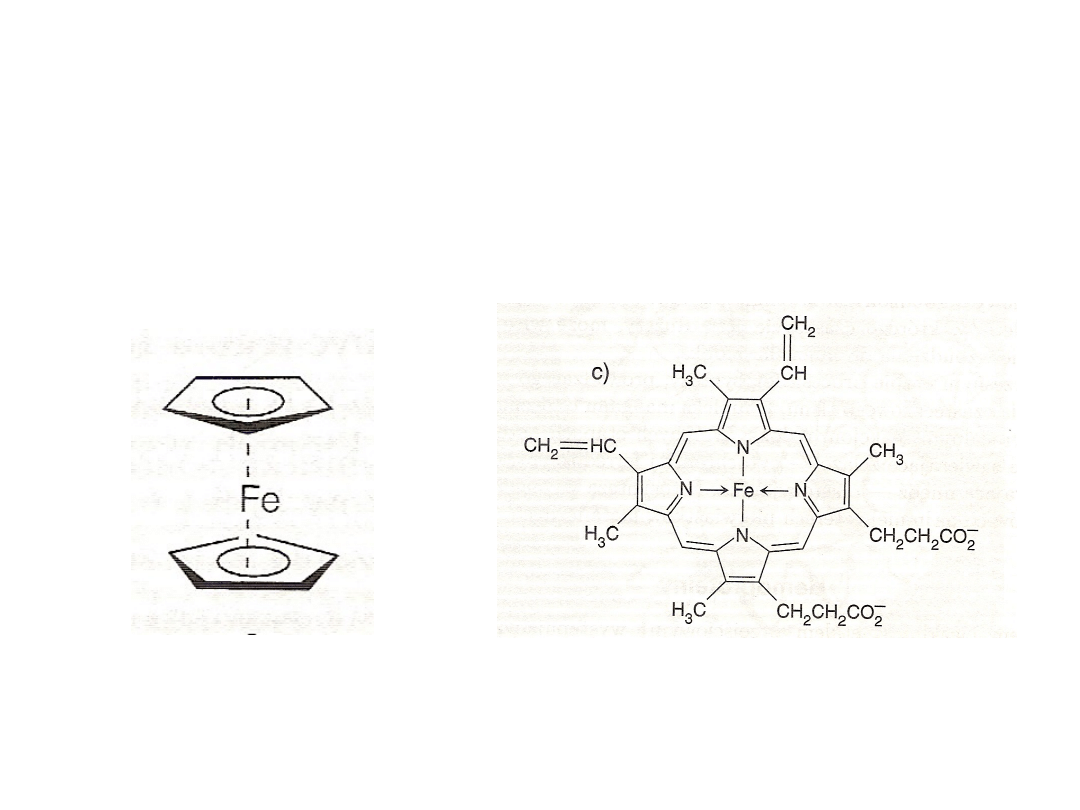
Żelazo
Kompleksy
• Fe(SCN)
63-
wykrywanie i oznaczanie F
3+
• Fe(dpy)
32+
wykrywanie i oznaczanie Fe
2+

Żelazo
Korozja (fakty)
• Rdza jest uwodnionym tlenkiem żelaza(III)
• Korozja zachodzi bardzo szybko przy jednoczesnym działaniu wody
i powietrza
• Korozję przyspieszają:
– jony wodorowe
– styczność żelaza z metalami mniej aktywnymi
– obecność rdzy
– obecność w wodzie elektrolitów
• Korozja biegnie szybciej przy ograniczonym dostępie powietrza

Żelazo
Korozja - postulowany mechanizm:
4 Fe → 4 Fe
2+
+ 8 e
8 H
+
+ 8e → 8 H
8 H + 2 O
2
→ 4 H
2
O
4 Fe
2+
+ O
2
+ (4+2x) H
2
O → 2 (Fe
2
O
3
*xH
2
O) + 8 H
+
Sposoby zabezpieczania przed korozją:
• Powłoki ochronne:
– smary
– polimery
– fosforanowanie i malowanie
– powlekanie metalami
• bardziej aktywnymi (chrom, cynk)
• mniej aktywnymi (cyna)
• Ochrona katodowa

Kobalt
• Jest znacznie mniej rozpowszechniony od żelaza. Występuje w
postaci siarczków i arsenków.
• W związkach występuje na stopniach utlenienia
+2
i
+3
.
• W porównaniu z Fe stopień utlenienia
+3
jest znacznie mniej
trwały E
oCo(III)/Co(II)
=
+1.84 V
• Na obu stopniach utlenienia tworzy liczne kompleksy.
Niektóre z nich mają znaczenie biologiczne np.
witamina B
12
.
• Metaliczny kobalt ma właściwości ferromagnetyczne i stosuje się
go do wyrobu rdzeni elektromagnesów.
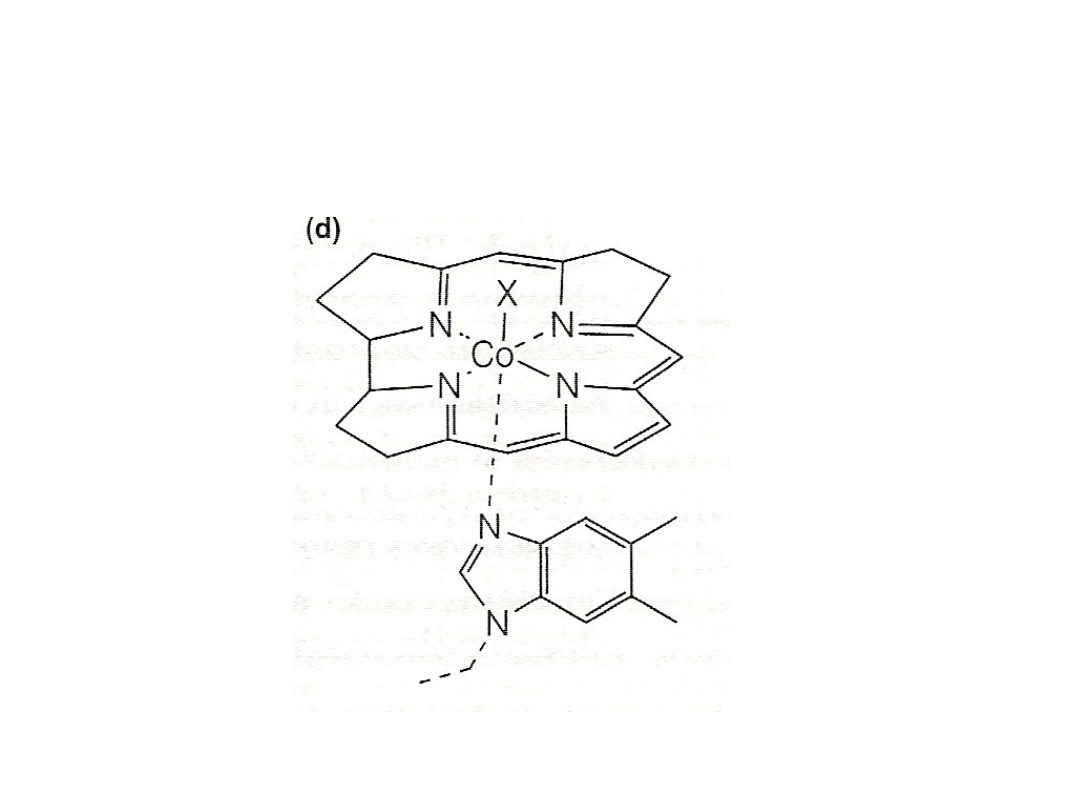
Witamina B
12

Nikiel
• Występuje w postaci siarczków jako
uboga domieszka rud żelaza. Przed
przetwarzaniem rudy niklu trzeba
wstępnie wzbogacać w procesie
flotacji, a następnie spiekania.
• Czysty nikiel otrzymuje się metodą
Monda:
– Ni + 4 CO → Ni(CO)
4
(temp. 80
o
)
– destylacja pod zmniejszonym
ciśnieniem
– Ni(CO)
4
→ Ni + 4 CO (temp. 200
o
)

Nikiel
Zastosowania:
– Stopy z żelazem (zapewnia im wytrzymałość i odporność na
korozję)
– Stopy z Cu (produkcja monet)
– Powlekanie powłokami ochronnymi (niklowanie)
– Elektrody do elektroutleniania związków organicznych w
środowiskach zasadowych
– Do wyrobu akumulatorów i baterii
Podobnie jak żelazo i kobalt tworzy liczne kompleksy.
Występuje głównie na stopniu utlenienia +2
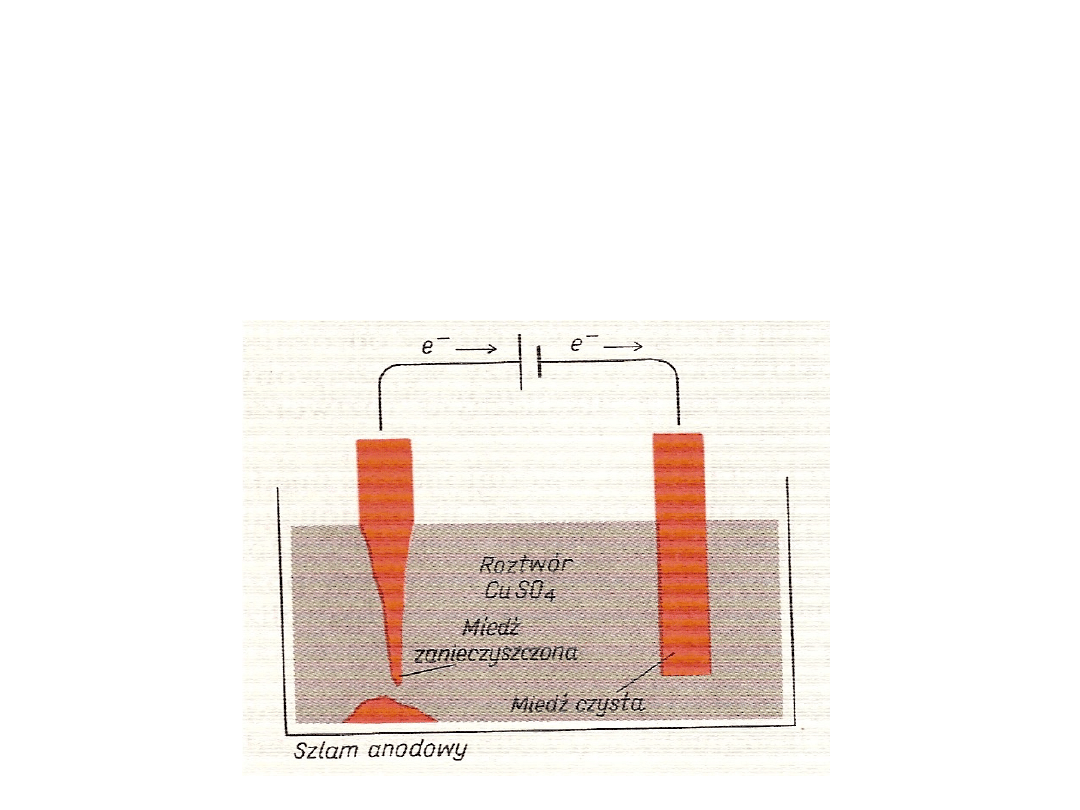
Miedź
Występuje w postaci rodzimej i licznych rud siarczkowych
Czysty metal otrzymuje się w procesie elektrorafinacji.
Fe
2+
/Fe E
o
= - 0.44 V
Cu
2+
/Cu E
o
= + 0.34 V
Ag
+
/Ag E
o
= +0.80 V

Miedź
• Miedź metaliczna jest:
– kowalna
– ciągliwa
– świetnie przewodzi prąd
– mało reaktywna (nie reaguje z kwasami nieutleniającymi)
– na powietrzu pokrywa się zielonym nalotem zwanym patyną
(zasadowy węglan)
• W związkach występuje na stopniach utlenienia
+2
i
+1
.
Jony
Cu
+
są jednak termodynamicznie nietrwałe i łatwo
dysproporcjonują:
2 Cu
+
↔ Cu
2+
+ Cu

Miedź
• Jony miedzi tworzą liczne kompleksy, w tym także o znaczeniu
biologicznym – kompleksy zawierające jony miedzi są składnikami
centrów aktywnych wielu enzymów katalizujących reakcje red-oks
(
azuryny, plastocyjaniny
).
Zastosowania:
– Elektrotechnika i elektronika
– Stopy (
mosiądze i brązy
)
– CuSO
4
*5H
2
O
– środek grzybobójczy i bakteriobójczy

Srebro
Występuje jako domieszka w rudach miedzi i ołowiu.
Otrzymywanie:
4 Ag + 8 CN
-
+ 2 H
2
O + O
2
→ 4 Ag(CN)
2-
+ 4 OH
-
4 OH
-
+ Zn
o
+ 2 Ag(CN)
2-
→ 2 Ag
o
+ 4 CN
-
+ Zn(OH)
42-
W związkach występuje głównie na stopniu utlenienia +1
E
oAg(I)/Ag
= +0.8 V
Zastosowania:
– wyroby jubilerskie
– halogenki srebra (poza AgF) są światłoczułe i mają zastosowanie w
fotografii
– wyrób szkieł fotochromowych
Procesy zachodzące w fotografii
Naświetlanie
– powstanie obrazu utajonego:
Br
-
→ Br
o
+ e
Ag
+
+ e → Ag
o
częściowe przeniesienie ładunku we współdziałaniu z defektem
węzłowym
Wywoływanie
:
redukcja uaktywnionych cząsteczek AgBr

Procesy zachodzące w fotografii
Utrwalanie
– usuwanie nie naświetlonych cząsteczek
AgBr
:
AgBr + 2 S
2
O
32-
↔ [Ag(S
2
O
3
)
2
]
3-
+ Br
-
Otrzymuje się w ten sposób negatyw fotografii czarno-białej.
Fotografie barwne
otrzymuje się używając warstw emulsji, które
oprócz halogenku srebra zawierają odpowiedni barwnik, uczulający
warstwę na jedną z trzech podstawowych barw: niebieską, zieloną
lub czerwoną.
Każda warstwa jest następnie wywoływana oddzielnie.
Barwy
negatywów
stanowią barwy dopełniające
barw rzeczywistych
.

Szkła fotochromowe
Otrzymywanie:
Surowce potrzebne do otrzymania szkła borokrzemianowego stapia się
z dodatkiem soli srebra(I) i miedzi(I).
Podczas ochładzania szkła
powstają krystality soli o rozmiarach ~ 10 nm.
Są one tak małe że nie rozpraszają ani nie pochłaniają światła
widzialnego. Szkło wydaje się więc przezroczyste i bezbarwne.
Zasada działania:
Światło ultrafioletowe
wywołuje reakcję:
Ag
+
+ Cu
+
↔ Ag
o
+ Cu
2+
W jej wyniku
szkło ciemnieje
.
Pod nieobecność
światła ultrafioletowego
reakcja ulega odwróceniu
i szkło
staje się z powrotem
bezbarwne.

Cynk
• Występuje głownie w postaci
ZnS
– sfaleryt
• Otrzymywanie:
ZnS + 3/2 O
2
→ ZnO + SO
2
ZnO + C →
Zn
+ CO
• Jest metalem dość aktywnym. Z kwasów nieutleniających wypiera
wodór.
• Występuje na stopniu utlenienia
+2
.
• Jego tlenek i wodorotlenek są amfoteryczne:
ZnO + 2 H
+
→ Zn
2+
+ H
2
O
ZnO + 2 OH
-
+ H
2
O → [Zn(OH)
4
]
2-
• Jest ważnym
biopierwiastkiem
. Jego jony wbudowane są w centra
aktywne wielu enzymów katalizujących reakcje
kwasowo – zasadowe
w organizmach

Cynk
• Zastosowania:
– Metal
• Do otrzymywania mosiądzu (stop cynku z miedzią) i innych cennych
stopów
• Do pokrywania żelaza (blachy ocynkowane)
– Związki
• ZnS
–
składnik cenionego białego pigmentu zwanego litoponem (ZnS +
BaSO
4
)
– do wytwarzania ekranów fluoryzujących
• ZnO
– w medycynie (maść cynkowa)
– fotoprzewodnik w kopiarkach

Rtęć
• Jedynym pospolitym minerałem jest siarczek HgS – cynober.
• Wolną rtęć można otrzymać przez prażenie siarczku na powietrzu:
HgS + O
2
→ Hg + SO
2
• Właściwości:
– w normalnej temperaturze jest ruchliwą cieczą o połysku metalicznym
– w odróżnieniu od innych metali charakteryzuje się dość dużą opornością elektryczną
– jest odporna na działanie powietrza
– rozszerza się równomiernie ze wzrostem temperatury – termometry i barometry
– Ciekła rtęć rozpuszcza wiele metali (np. złoto, srebro, metale alkaliczne) tworząc
amalgamaty. Cechą charakterystyczną amalgamatów jest obniżona aktywność
metalu rozpuszczonego w rtęci. Np. amalgamat sodu reaguje z wodą bardzo powoli.
Niektóre amalgamaty mają znaczenie praktyczne. Np. amalgamat srebra służy do
wypełniania ubytków w zębach.

Rtęć
• Właściwości cd.
– mimo stosunkowo wysokiej oporności ciekłą rtęć wykorzystuje się do
wyrobu elektrod. Elektrody takie wykorzystuje się w elektrochemii,
elektroanalizie i przemyśle chemicznym. Cechą charakterystyczną elektrod
Hg jest bardzo wysoki nadpotencjał wydzielania wodoru.
Przykłady wykorzystania:
• otrzymywanie NaOH przez elektrolizę wodnego roztworu NaCl
• polarografia
– w związkach występuje na stopniach utlenienia
+1
i
+2
.
– na stopniu
+1
tworzy jony
Hg
22+
,
w których dwa jony
Hg
+
połączone są ze
sobą wiązaniem kowalencyjnym (
Hg
22+
jest diamagnetyczny)
– jony
Hg
22+
mają bardzo podobne właściwości do jonów Ag
+
. Rożni je
zachowanie się w obecności amoniaku:
AgCl + 2 NH
3
→ [Ag(NH
3
)
2
]
+
+ Cl
-
Hg
2
Cl
2
+ 2 NH
3
→ HgNH
2
Cl + Hg + NH
4+
+ Cl
-

Rtęć
• Właściwości cd.
– Połączenia
Hg
na obu stopniach utlenienia mają dość wyraźne
właściwości utleniające:
2 Hg
2+
+ 2e ↔ Hg
22+
E
o
= + 0.92 V
Hg
22+
+ 2e ↔ 2 Hg
o
E
o
= + 0.79 V
– Związki rtęci na stopniu
+2
bardzo często są kowalencyjne
np.
HgCl
2
– Hg chętnie tworzy
związki metaloorganiczne

Toksyczność rtęci
• Metaliczna Hg nie jest bardzo toksyczna.
• Trujące są natomiast
pary Hg
i jej
związki
, szczególnie
lotne związki
metaloorganiczne
• Ponieważ Hg jest stosowana w przemyśle na dużą skale, dużego
znaczenia nabiera problem
skażenia środowiska
. Jeżeli nawet odpady
poprodukcyjne odprowadzane są w formie osadów trudno
rozpuszczalnych, to mogą być one przetwarzane przez bakterie np. na
(CH
3
)
2
Hg
i przedostawać się do łańcuchów pokarmowych zwierząt.
(Zatoka Minamata)
• Masowym źródłem skażenia środowiska Hg jest także spalanie węgla.
Rocznie spala się ponad 10
9
tony węgla, co oznacza wprowadzenie do
atmosfery ponad 5000 ton Hg

Platynowce
• Analogicznie do żelazowców platynowce tworzą triady:
V okres –
Ru, Rh i Pd
-
platynowce lekkie
VI okres –
Os, Ir, Pt
-
platynowce ciężkie
• Wykazują duże podobieństwo w grupach:
Ru – Os, Rh – Ir, Pd – Pt
• Rozpowszechnienie w przyrodzie jest niewielkie:
Pt
– 5*10
-5
%
pozostałe
na poziomie 1*10
-5
%
• Metody otrzymywania są słabo opisane ze względu na tajemnice
producentów

Platynowce
• Właściwości:
– Srebrzysto-białe metale
– Gęstości
• 12 – 12.4 g/cm
3
lekkie
• 21.4 – 22.6 g/cm
3
ciężkie
– Bardzo wysokie temperatury topnienia
– Ru, Rh, Os i Ir
są bardzo twarde
– Wszystkie poza
Rh
są kruche
– Ogólne właściwości chemiczne są zbliżone
• Metale szlachetne o bardzo małej reaktywności
• Są odporne na działanie stężonych kwasów – tylko niektóre rozpuszczają się w
wodzie królewskiej
• Tworzą wodorki metaliczne – (szczególnie
pallad)
• Tworzą liczne stopy
• W podwyższonych temp. reagują z fluorem, tlenem, chlorem, siarką i fosforem
• Tworzą liczne kompleksy, a niektóre także związki metaloorganiczne
Platynowce
• Zastosowania:
– W przemyśle chemicznym do budowy reaktorów odpornych na korozję i wysokie
temperatury
– Do katalizowania wielu reakcji
– Do wyrobu elektrod
– Do wyrobu termometrów oporowych
– W jubilerstwie i zdobnictwie
– Niektóre kompleksy Pt i Ru wykazują aktywność antynowotworową i są
cenionymi lekami stosowanymi w chemioterapii
cis-diaminadichloroplatyna(II)
Pt
Cl
Cl
NH
3
NH
3

Metody otrzymywania metali
• Znanych jest wiele chemicznych metod otrzymywania metali. Ich
przemysłowe zastosowanie zależy od:
– Chemicznych i fizycznych właściwości substratów
– Pożądanej czystości metalu
– Możliwości wykorzystania produktów ubocznych
– Stopnia uciążliwości dla środowiska
– Dostępności odpowiednich tanich źródeł energii
• Wiele rud wymaga wzbogacenia. Można do tego wykorzystywać różnice:
– gęstości poszczególnych składników
– zdolności do tworzenia amalgamatów
– właściwości magnetycznych
– rozpuszczalności w ługach lub kwasach
– zwilżalności

Metody otrzymywania metali
• Rudy tlenkowe mogą być przerabiane bezpośrednio.
• Rudy siarczkowe, ze względu na szkodliwy wpływ siarki na właściwości
metalu, muszą być wstępnie przetworzone na tlenki.
MeS + 3/2 O
2
→ MeO + SO
2
(np. Fe, Pb, Zn)
• Proces przeróbki tlenków polega na ich redukcji do metalu. Jako reduktory
stosuje się najczęściej C, CO lub H
2
. Stosuje się też inne metale.
MeO + C → Me + CO
MeO + CO → Me + CO
2
MeO + H
2
→ Me + H
2
O
Me
1
O + Me
2
→ Me
1
+ Me
2
O
Metody otrzymywania metali
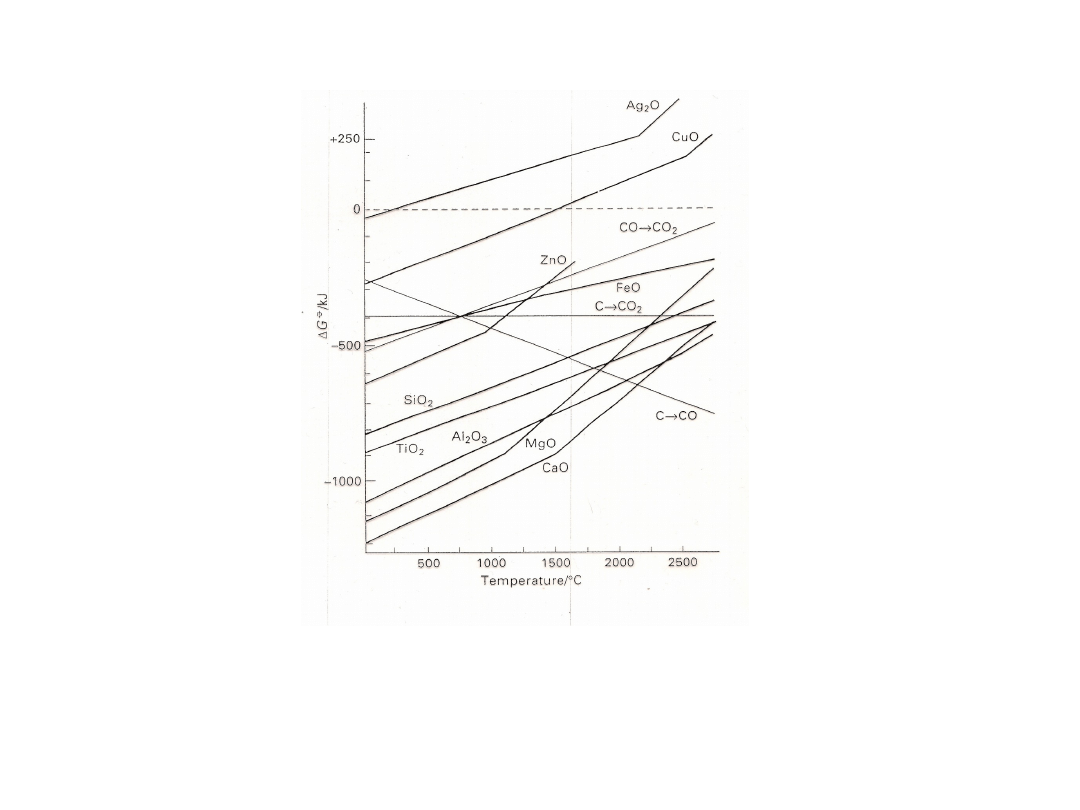
• Nie zawsze reakcje takie są termodynamicznie możliwe. Warunkiem
koniecznym zajścia reakcji jest ujemna zmiana swobodnej entalpii.
• Redukcja wodorem:
MeO + H
2
Me + H
2
O
G
G
tw.H2O
G
tw.MeO
=
G
Me + 1/2 O
2
+ H
2
G
tw.MeO
G
tw.H2O
Metody otrzymywania metali
• Redukcja węglem
G
G
tw.MeO
G
tw.CO
MeO + C
Me + CO
Me + 1/2 O
2
+ C
G
G
tw.CO
G
tw.MeO
=
Metody otrzymywania metali
• Redukcja CO
G
G
tw.MeO
G
tw.CO2
MeO + CO
Me + CO
2
Me + O
2
+ C
G
G
tw.CO
G
tw.MeO
= G
tw.CO2
G
tw.CO
Metody otrzymywania metali
• Redukcja innym metalem
G
G
tw.Me1O
G
tw.Me2O
Me
1
O + Me
2
Me
1
+ Me
2
O
Me
1
+ 1/2 O
2
+ Me
2
G =
G
tw.Me1O
G
tw.Me2O
Metody otrzymywania metali
• Przykłady redukcji innym metalem:
V
2
O
5
+ 5 Ca → 2
V
+ 5 CaO
Fe
2
O
3
+ 2 Al → 2
Fe
+ Al
2
O
3

Oczyszczanie metali - rafinacja
• Utlenianie tlenem aktywnych chemicznie zanieczyszczeń.
(otrzymywanie stali)
• Rafinacja elektrolityczna (Cu, Ag, Au, Ni, Sn)
• Rafinacja sucha
– Metoda van Arkela
Ti + 2 I
2
→ TiI
4
TiI
4
→ Ti + 2 I
2
– Metoda Monda
Ni + 4 CO → [Ni(CO)
4
]
[Ni(CO)
4
] → Ni + 4 CO
• Topienie strefowe
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
Wyszukiwarka
Podobne podstrony:
Pierwiastki bloku S
Charakterystyki pierwiastków bloku p i d
Pierwiastki bloku s, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Arkusz WSiP Właściwości pierwiastków bloku d
Pierwiastki bloku d id 357405 Nieznany
Pierwiastki bloku energetycznego d
PIERWIASTKI BLOKU D
AS V właściwości pierwiastków bloku s i p M komentarz
AS V właściwości pierwiastków bloku s i p M
Pierwiastki bloku s
Pierwiastki bloku p
Budowa Układu Okresowego Pierwiastków
więcej podobnych podstron