
Bakterie atypowe
Riketsje
Bakterie spiralne
dr n. med. Monika Bigos

Bakterie atypowe
Chlamydiae sp.
• Gram-ujemne, pleomorficzne (coccus-like)
• Ściana komórkowa: peptydoglikan (-), LPS (+)
• Bezwzględne pasożyty wewnątrzkomórkowe
(rosną wyłącznie w hodowlach tkankowych i na zarodkach kurzych)
• Ubogie metabolicznie
• Złożony cykl namnażania
(barwienie met. Giemsy)
:
ciałka elementarne/podstawowe – purpurowe
ciałka ciałka retikularne/siateczkowate – niebieskie
Cechy wirusów u Chlamydia sp.
• Niewielkie rozmiary rzędu 0,2-1,5µm
• Wyłącznie wewnątrzkomórkowy cykl rozwojowy
• Brak możliwości wytwarzania energii metabolicznej
• Tworzenie wtrętów cytoplazmatycznych

Bakterie atypowe
Chlamydiae sp.
Czynniki zjadliwości
• Wewnątrzkomórkowe pasożytowanie
• Hamowanie powstawania fagolizosomów
Istotne gatunki
• Ch. pneumoniae (droga kropelkowa – infekcje dróg
oddechowych)
• Ch. psittaci (zoonoza – papuzica)
• Ch. trachomatis (droga kontaktów seksualnych – jaglica,
ziarniniak weneryczny, niegonokokowe zapalenie cewki moczowej,
zapalenie szyjki macicy, zapalenie najądrzy i jajników, zapalenie
spojówek z utratą wzroku – u noworodków);
!!! świadomość dróg transmisji; tetracykliny i makrolidy (4 tyg.)

Chlamydia
trachomatis
A, B, C – trachoma, keratoma
D-K – cervicitis, endometritis, epididymitis, conjunctivitis, infant
pneumonia, nongonococcal urethritis, proctitis, salpingitis
L1-L3 – lymphogranuloma venerum

Bakterie atypowe
Chlamydiae sp. – diagnostyka
Ch. trachomatis: wymaz z cewki mocz., szyjki macicy, jamy nos.-gardł.
(dzieci), spojówek i odbytu (dzieci);
Ch. pneumoniae: wymaz z gardła, jamy nos.-gardł., plwocina
Hodowle kom. (McCoya, Hep-2, Hela229) – wtręty cytoplazmatyczne
Barwienie met. Giemsy
Zakaża się 2-3 hodowle szybko! (nie przechowywać w 4ºC)
Serologia!!!
Ag rodzajowo-specyficzny: LPS,
Ag gatunkowo-swoisty: białka błony MOMP
• OWD
• IF bezpośr.
• EIA, ELISA
W ostrych zakażeniach serologii nie stosuje się
Zawsze podwójne surowice! (bo infekcje są powszechne, a IgG pozostają przez
wiele lat)
Biologia molekularna (amplifikacja, hybrydyzacja)

Met. barwienia
Giemsy/Romanowskiego
• Wysuszony preparat utrwala się w alko holu metylowym
70% lub absolutnym przez 2min.
• Barwi się następnie barwnikiem Giemsy rozcieńczonym w
proporcji 2 krople barwnika na 1 ml buforu fosforanowego o
pH 7,0-7,2 lub destylowaną H
2
O przez 30min.

Bakterie atypowe
Mycoplasma sp.
• Bakterie pleomorficzne (ziarniako-pałeczki, kształt butelkowaty;
150-250nm)
• Ściana kom. (-), trójwarstwowa błona cytoplazmatyczna
• Oporne na beta-laktamy
• Podłoża ze sterolami (kolonie w kształcie sadzonego jaja)
Istotne gatunki
• M. pneumoniae
• M. hominis
• U. urealyticum
Czynniki zjadliwości
• Adhezyjne białka błony zewnętrznej (P1)
• Wbudowywanie Ag bakteryjnych w błony kom.
(reakcje autoagresji)
• Wydzielanie rodników tlenowych

M. pneumoniae (transmisja kropelkowa)
•Inkubacja ok. 20 dni, zapalenie płuc, oskrzeli, ucha środkowego,
tchawicy (powikłania: OUN, stawy i nerki, niedokrwistość
hemolityczna, odczyny skórne – bo powstają kompleksy
immunologiczne)
M. hominis, U. urealyticum
•Ureazo(+)
•Transmisja poprzez kontakt seksualny
•Kolonizują drogi moczowo-płciowe
•Gorączka połogowa, nierzeżączkowe zapalenie cewki moczowej,
ostre zapalenie nerek
Leczenie i zapobieganie
•Świadomość dróg transmisji
•Makrolidy i tetracykliny
Bakterie atypowe
Mycoplasma sp.

Bakterie atypowe
Mycoplasma sp. – diagnostyka
• Plwocina, wymaz/popłuczyny z j. nos.-gardł./drzewa oskrz./dróg mocz.-płc.
• Otrzymany płyn przesącz się przez filtry 220-450nm
• Podłoża wzbogacone surowicą końską i wyciągiem drożdżowym (PPLO, agar SP
z glc, Mycoplasma Agar Base
(wzrost 7-28dni)
+ zwierzęta lab.
(szczury bawełniane,
chomiki syryjskie – po 2tyg. odoskrzelowe zapalenie płuc)
• Test biochemiczne
M. pneumoniae: glc(+), ksyl(+), man(+), mal(+), dkst(+), lac(-); hemoliza
beta;
Ureaplasma sp.: man(-), arg(-), tetrazolium(-), ure(+))
• Serologia!!!
(hodowla to za mało) – niestety serologia obarczona dużymi
błędami!
Test zahamowania wzrostu przez Ab homologiczne
Immunoblotting z Ab monoklonalnymi
Immunofluorescencja kolonii na agarze
OWD! (w Polsce)
EIA, ELISA
Szybkie testy lateksowe
Zawsze parzyste surowice w 2-tygodniowych odstępach
(w 2. tyg. pneumonitis miano Ab najwyższe)
• PCR
Rickettsiaceae
• Pleomorficzne pałeczko-ziarniaki (0,5-2,0µm)
• W ścianie komórkowej LPS i peptydoglikan
• Obligatoryjne patogeny wewnotrzkomórkowe
• Przenoszone przez
pchły i kleszcze
(Rickettsia sp. i Ehrlichia sp.)
lub
drogą kropelkową
– Coxiella sp.
Patogeneza riketsjoz:
namnażanie w śródbłonku naczyń w miejscu wniknięcia (1 tydz.);
drogą krwi trafiają do węzłów chłonnych, namnażają się w
makrofagach (1-2 tyg.);
rozsiew w całym organizmie (zapalenie naczyń krwionośnych,
wysypki/wybroczyny podskórne z martwicą tkanek
okołonaczyniowych, zakrzepicą i obrzękiem;
wstrząs endotoksyczny i hipowolemiczny)

Riketsjozy = choroby wysypkowe zwykle z wysoką gorączką
R. prowazeki – dur plamisty epidemiczny
R. rickettsi – gorączka plamista Gór Skalistych
R. typhi – dur plamisty endemiczny
R. tsutsugamushi – dur zaroślowy
C. burnettii – gorączka Q (objawy grypopodobne/zapalenie
płuc)
E. chaffeensis – erlichioza (z leukopenią, trombocytopenią)
Rickettsiaceae

• Krew/surowica
• Hodowla i izolacja – rzadko (na worku żółtkowym jaja kurzego,
hodowle kom.)
• Barwienie met. Giemsy
(
riketsje – czerwone
,
komórki zakażone – niebieskie
)
Serologia!!!
• IF bezpośr. i pośr. (Ag pochodzą z poszczególnych gatunków riketsji)
• Odczyn Weil-Felixa (Ag z Proteus sp.)
• Odczyn Weigla (Ag to żywe riketsje)
• ELISA, EIA
• PCR
Zapobieganie i leczenie
• Profilaktyka nieswoista (kontrola zakażeń wśród wektorów)
• Szczepienia
• Tetracykliny i chloramfenikol
Rickettsiaceae –
diagnostyka

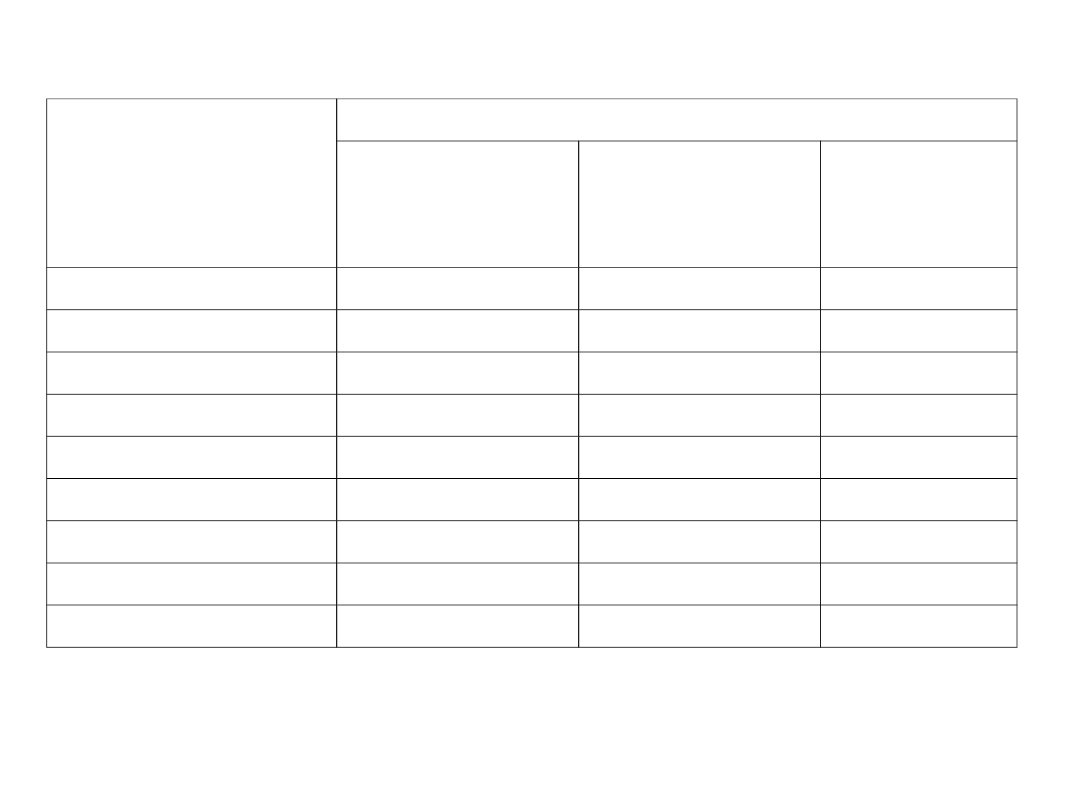
Antibodies against:
Weil-Felix test
Agglutination with
Proteus vulgaris OX19
strain
Agglutination with
Proteus vulgaris OX2
strain
Agglutination with
Proteus vulgaris
OXK strain
Rickettsia prowazekii
++
±
-
Rickettsia typhi
++
-
-
Rickettsia tsutsugamushi
-
-
++
Rickettsia rickettsii
+
+
-
Rickettsia conorii
+
+
-
Rickettsia australis
+
+
-
Rickettsia sibirica
+
+
-
Rickettsia akari
-
-
-
Coxiella burnetii
-
-
-

• Spirochaetaceae (Treponema sp., Borrelia sp.)
Leptospiraceae (Leptospira sp.)
• Spiralne, Gram-ujemne (0,2x50µm)
• Bardzo ruchliwe
• Hodowla często trudna
• Tlenowe/wzgl. beztlenowe/ścisłe beztlenowce
• Skręty bardziej lub mniej ścisłe
Bakterie spiralne

Istotne gatunki
T. pallidum – kiła (brak możliwości namnażania)
T. pertenue – malinica (brak możliwości namnażania)
T. carateum – pinta (brak możliwości namnażania)
T. orale, T. denticola, T. vincenti – bytują w jamie ustnej
Czynniki zjadliwości
• Adhezyny (w tym fibronektyna), ruch
• Antygeny słabo immunogenne
• Po połączeniu z komórkami endotelialnymi naczyń
krwionośnych rozwija się stan zapalny
Treponema sp.

Transmisja: kontakt bezpośredni (kontakty seksualne), łożysko
• Kiła I-rzędowa (wrzód twardy – ulcus durum)
• Kiła II-rzędowa:
osutka kiłowa (skórna: exanthema i błon śluzowych:
enanthema); kłykciny płaskie (condyloma lata), łysienie
plackowate/kiłowe
• Kiła III-rzędowa (kilaki – gummata; zmiany degeneracyjne w
układzie nerwowym i mięśniowo-stawowym)
T. pallidum

Triada Hutchinsona!!!

T. pallidum – diagnostyka
• W I etapie kiły wczesnej brak Ab więc:
wymaz z głębszych warstw wrzodu twardego i barwienie bezpośr.:
Ciemne pole
Mikroskopia kontrastowo-fazowa
Tusz chińskie (barwienie negatywowe)
IF
• Później serologia!!!
(II etap kiły wczesnej, kiła późna, wrodzona,
utajona: wykrywanie antyfosfolipidowych Ab IgG i IgM indukowanych
przez T. pallidum i reagujących krzyżowo z kardiolipiną serca wołu
(odczyt na ciemnym tle,
bad. jakościowo-ilościowe))
Nieswoiste/niekrętkowe testy
• Kłaczkujące/flokulacyjne (VDRL i RPR)
• Odczyn Wassermana (OWD)
Swoiste/krętkowe testy (aby wykluczyć wyniki fałszywie (+) i
(-))
• FTA-ABS – bad. jakościowe (IF w wersji absorpcyjnej)
• FTA – bad. ilościowe
• MHA-TP (mikrohemaglutynacja)
• TPI (odczyn unieruchamiania krętków (rzadko)
• PCR
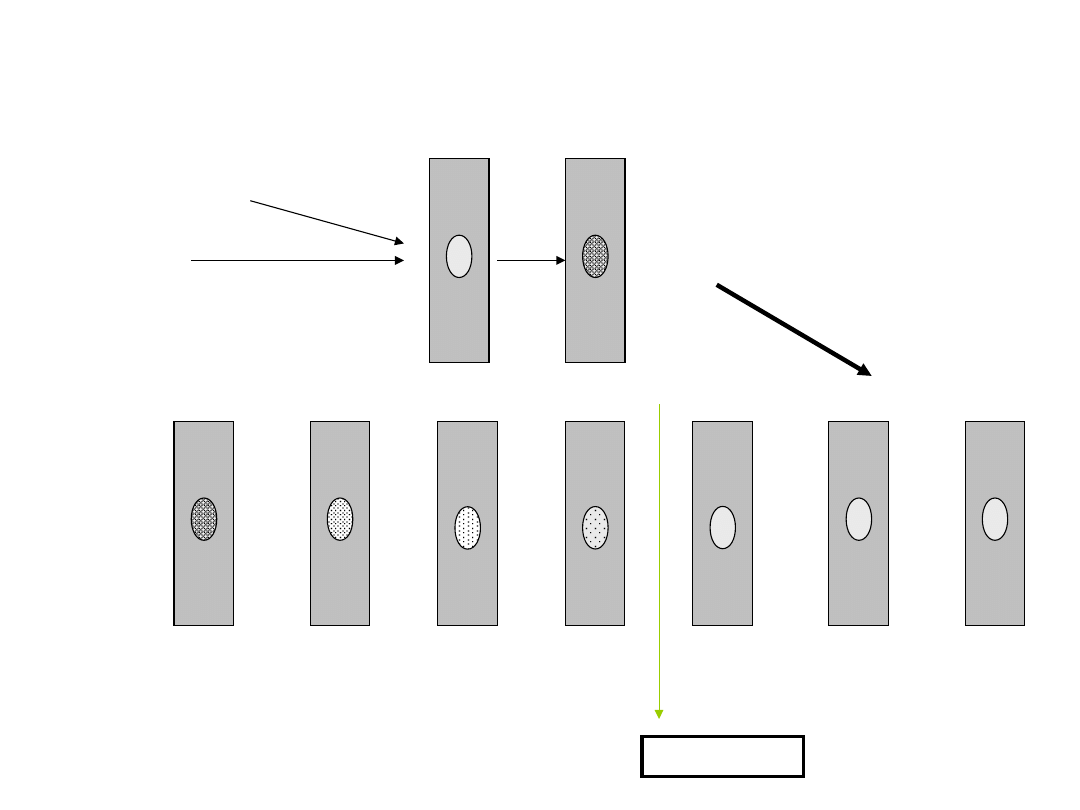
VDRL test
Patient’s
serum 0,6ml
Ag:
cardiolipi
n
positive
I step
II step
Cardiolipi
n antigen
+
serum
dilutions
1:2 1:4 1:8 1:16 1:32 1:64
1:128
TEST TITRE

Zapobieganie i leczenie
•Świadomość dróg transmisji
•Leczenie jak najwcześniejszej fazy zakażenia
•Penicylina (kilka dawek)
T. pallidum

Borrelia sp.
• Rosną na specjalnych podłożach wzbogaconych
lub w błonie kosmówkowo-omoczniowej zarodka kurzego
• Bardzo zmienne antygenowo
• Gryzonie jako rezerwuar
• Przenoszone przez kleszcze z rodzaju Ixodes
• Zdolność ruchu rotacyjnego (7-10 rzęsek)
• Trzy genogatunki (Europa, Ameryka Płn., Japonia)
Czynniki zjadliwości
• LPS (toksyczny)
• Białka powierzchniowe
• Zmienność antygenowa

B. burgdorferi – borelioza z Lyme
• Wektor – kleszcze z gatunku Ixodes dammini
• Zapadalność: późna wiosna do wczesnej jesieni
• Powinowactwo do mięśnia sercowego, stawów, śródbłonka
naczyń, ścięgien, nerek i wątroby
• Inkubacja – do 1 m-ca
• Borelioza z Lyme – rumień wędrujący (erythema migrans),
bakteriemia, zapalenie mięśnia sercowego, stawów, objawy
neurolog.
B. reccurentis – dur powrotny
(bakteriemia z gorączką – wielokrotne nawroty)
Rezerwuar – gryzonie; wektory – kleszcze i wszy
Borrelia sp.

Zapobieganie i leczenie
• Profilaktyka nieswoista (odpowiednie ubrania, repelenty)
• Szczepienia
• Tetracykliny, amoksycylina, makrolidy, penicyliny (ok. 3
tyg.)
Borrelia sp.

B. reccurrentis –
diagnostyka
Barwienie świeżej krwi z okresu gorączkowego
(met. Giemsy lub ciemne pole)
Serologia – dużo reakcji falszywie (+) lub (-) – tylko jako
potwierdzenie rozpoznania klinicznego i mikrobiologicznego!
• Aglutynacja z żywymi bakteriami
• IF pośr., EIA, ELISA
• OWD z Ag z hodowli
PCR
Hodowla trudna i rzadko podejmowana (podłoże wg. Noguchiego z
wysiękowym płynem ludzkim, kawałkiem świeżej jałowej nerki
królika, świeżą ludzką krwią i cytrynianem sodu – pod parafiną)

B. burgdorferi –
diagnostyka
• Badanie kliniczne!
• Wymaz ze zmiany skórnej, PMR, maź stawowa
• Preparat bezpośredni (ciemne pole, met. Giemsy, met.
Grama)
Serologia!!!
• ELISA
• Western-blot (do potwierdzenia)
• Stosowane Ag: rekombinanty, sonikaty komórek B.
burgdorferi, izolowane frakcje białkowe B. burgdorferi
• Hodowla i izolacja: bez znaczenia
(trudna i często zakończona niepowodzeniem)

L. interrogans
• Rezerwuar – zwierzęta (psy, koty, szczury – mocz);
woda (długo zachowują żywotność), gleba
• Wnikanie przez mikrouszkodzenia skóry i błon śluzowych i
drogą krwi rozsiewają się po całym organizmie
• Leptospiroza (zoonoza)
• Zakażenie bezobjawowe
• Leptospiroza bezżółtaczkowa
(objawy grypopodobne, powiększenie wątroby i śledziony)
• Leptospiroza z żółtaczką
(uszkodzenie śródbłonka
naczyń krwionośnych, powiększenie wątroby)

Zapobieganie i leczenie
Profilaktyka nieswoista (odzież ochronna, deratyzacja)
Szczepionki z inaktywowanych bakterii
Penicylina, streptomycyna, tetracykliny, erytromycyna
L. interrogans

L. interrogans –
diagnostyka
• Bezpośrednie badanie świeżego moczu (ciemne pole) lub rozmaz z
odwirowanego osadu moczu (IF: badanie jakościowe „jest/nie ma”
oraz rozpoznanie typu serolog.)
• 5 dni od zakażenia – rozmaz z krwi (met. Giemsy lub ciemne pole),
przy czym we krwi i PMR mało bakterii, dlatego namnażanie:
Płynne podłoże Korthofa (sól i surowica)/Stuarta/Fletchera (2m-
ce)
Podłoże półstałe (27-30st.C/5-6 dni): kolonie 1-3µm
• Met. zalecana przez WHO (b. czuła!):
oznaczanie Ab antyleptospirowych w reakcji z żywymi lub
formalinowanymi Ag
Aglutynacja mikroskopowa w ciemnym polu (pow. 200-300x)
OWD
Testy lateksowe
• PCR
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
Suicydologia WWL 10
GIELDA WWL 5.07.2012 godz.13.10, V ROK, Choroby Wewnętrzne
ZROBIONEGIELDA WWL 5 07 2012 godz 13 10
10 Suicydologia WWL 10id 11112 pptx
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
10 dźwigniaid 10541 ppt
wyklad 10 MNE
Kosci, kregoslup 28[1][1][1] 10 06 dla studentow
10 budowa i rozwój OUN
10 Hist BNid 10866 ppt
POKREWIEŃSTWO I INBRED 22 4 10
Prezentacja JMichalska PSP w obliczu zagrozen cywilizacyjn 10 2007
więcej podobnych podstron