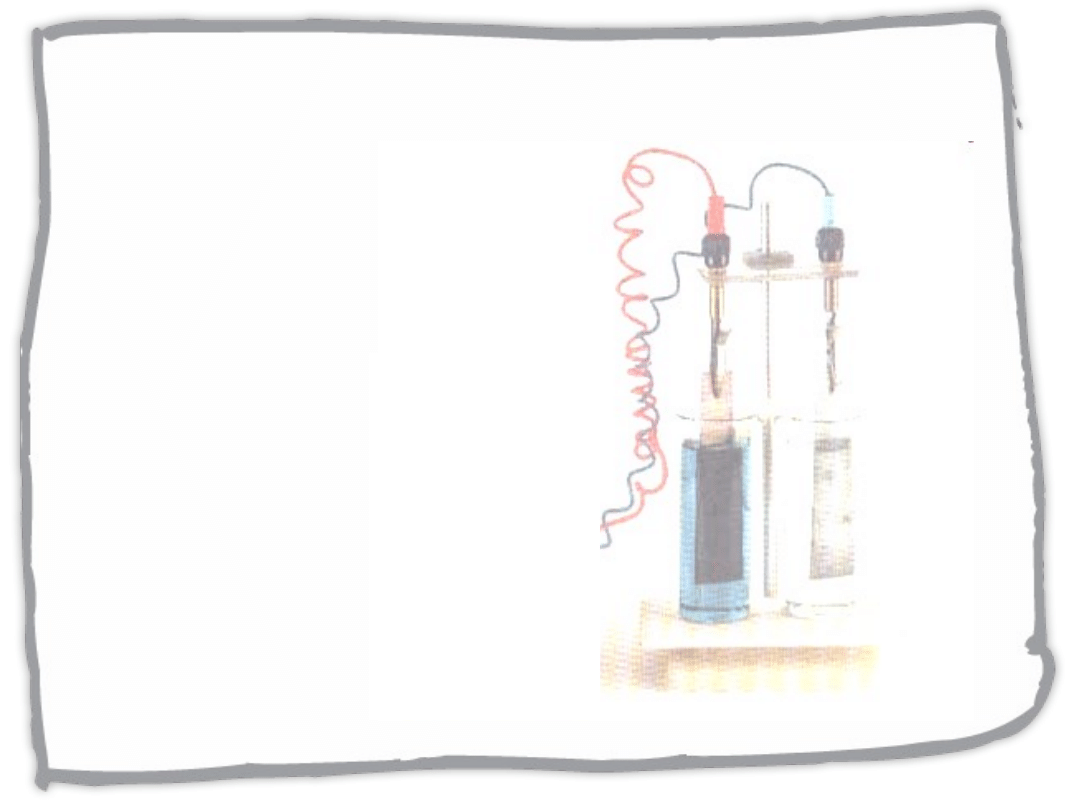
Ogniwa
galwaniczne
Ogniwa
galwaniczne

2
Siła elektromotoryczna
ogniwa
Siła elektromotoryczna ogniwa, SEM, jest miarą
zdolności reakcji ogniwa do spowodowania
przepływu elektronów przez obwód. SEM ogniwa
definiuje się jako różnicę potencjałów elektrody
dodatniej (o wyższej wartości potencjału E
katoda
) i
ujemnej (E
anoda
) dla ogniwa otwartego, czyli
takiego, w którym obwód elektryczny nie jest
zamknięty, a opór między biegunami ogniwa jest
nieskończenie wielki.
SEM = E
katoda
- E
anoda
Siła elektromotoryczna ogniwa, SEM, jest miarą
zdolności reakcji ogniwa do spowodowania
przepływu elektronów przez obwód. SEM ogniwa
definiuje się jako różnicę potencjałów elektrody
dodatniej (o wyższej wartości potencjału E
katoda
) i
ujemnej (E
anoda
) dla ogniwa otwartego, czyli
takiego, w którym obwód elektryczny nie jest
zamknięty, a opór między biegunami ogniwa jest
nieskończenie wielki.
SEM = E
katoda
- E
anoda

3
Siła elektromotoryczna
ogniwa
Umówiono się, że będzie się porównywać SEM
ogniw galwanicznych w warunkach
standardowych. Dla tych warunków wartość SEM
nazywana jest standardową siłą
elektromotoryczną.
SEM
= E
o
(katoda)
- E
o
(anoda)
Fe
(s)
|Fe
2+
(aq)
||Ag
+
(aq)
|Ag
(s)
SEM = 1,24 V

4
Ogniwo galwaniczne
Zasada działania ogniw galwanicznych
polega na wykorzystaniu uwolnionych
w trakcie reakcji chemicznej
elektronów, będących nośnikiem
energii przekazywanej na sposób
elektryczny.
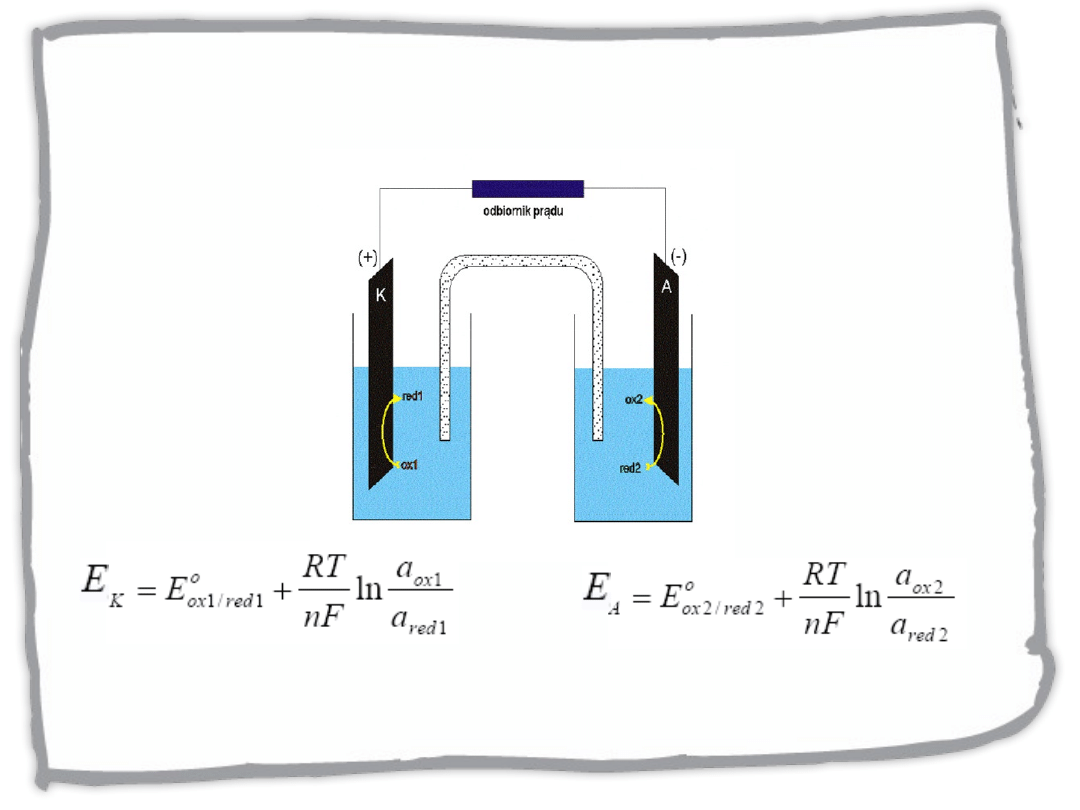
5
Ogniwo galwaniczne
SEM = E
katoda
- E
anoda
6
ogniwa
WTÓRNE
odwracalne
PIERWOTNE
nieodwracaln
e
ogniwo Volty
ogniwo Daniela
ogniwo cynkowo-
manganowe
ogniwo cynkowo-
powietrzne
ogniwo litowe
akumulator kwasowo-ołowiowy
(Pb)
akumulator niklowo-kadmowy
(NiCd)
akumulator niklowo-
wodorkowy (NiMH)
akumulator alkaliczny
manganowy MnO
2
akumulator litowo-jonowy (Li-
Ion)
akumulator litowo-polimerowy
7
Ogniwa pierwotne
i wtórne
PIERWOTNE
WTÓRNE
Nieodwracalne zużycie
elektrod
Odzysk elektrod – przez
dostarczenie energii
elektrycznej odtwarza się stan
utlenienia i strukturę
elektrody
Proces anodowy i katodowy
odnoszą się do konkretnej
elektrody, zachodzą tylko raz
Reakcje katodowe i anodowe
powtarzają się przemiennie na
obu elektrodach w cyklu
ładowanie-rozładowanie
Elektrody metaliczne
(jednorazowe)
Produkty mogą być
rozpuszczalne w elektrolicie
Substraty i produkty
pozostają w fazie elektrody
Minimalizowanie zmian w
strukturze i kształcie elektrod
8
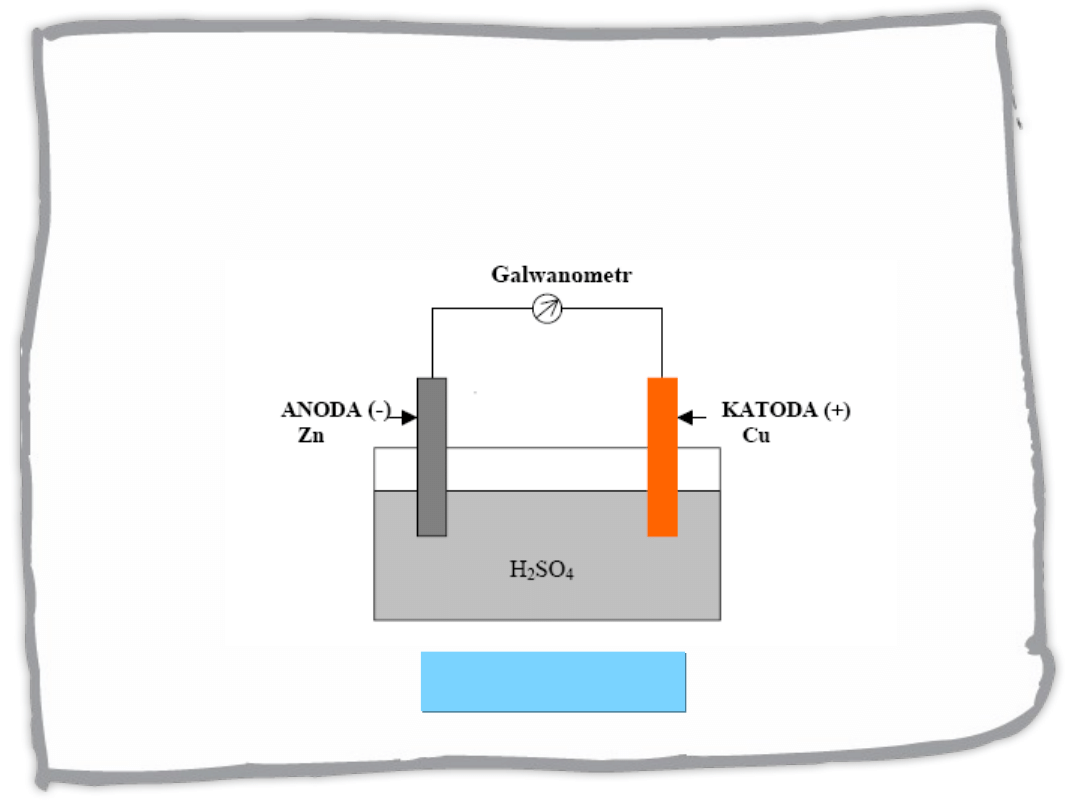
Ogniwo nieodwracalne: ogniwo
Volty
Zn | H
2
SO
4
|
Cu

9
Ogniwo nieodwracalne: ogniwo
Volty
Przebieg procesów
elektrodowych :
Anoda : Zn
0
– 2e
-
→ Zn
2+
Katoda : 2H
+
+ 2e
-
→ H
2
0
Sumarycznie : Zn + H
2
SO
4
→
ZnSO
4
+ H
2
10
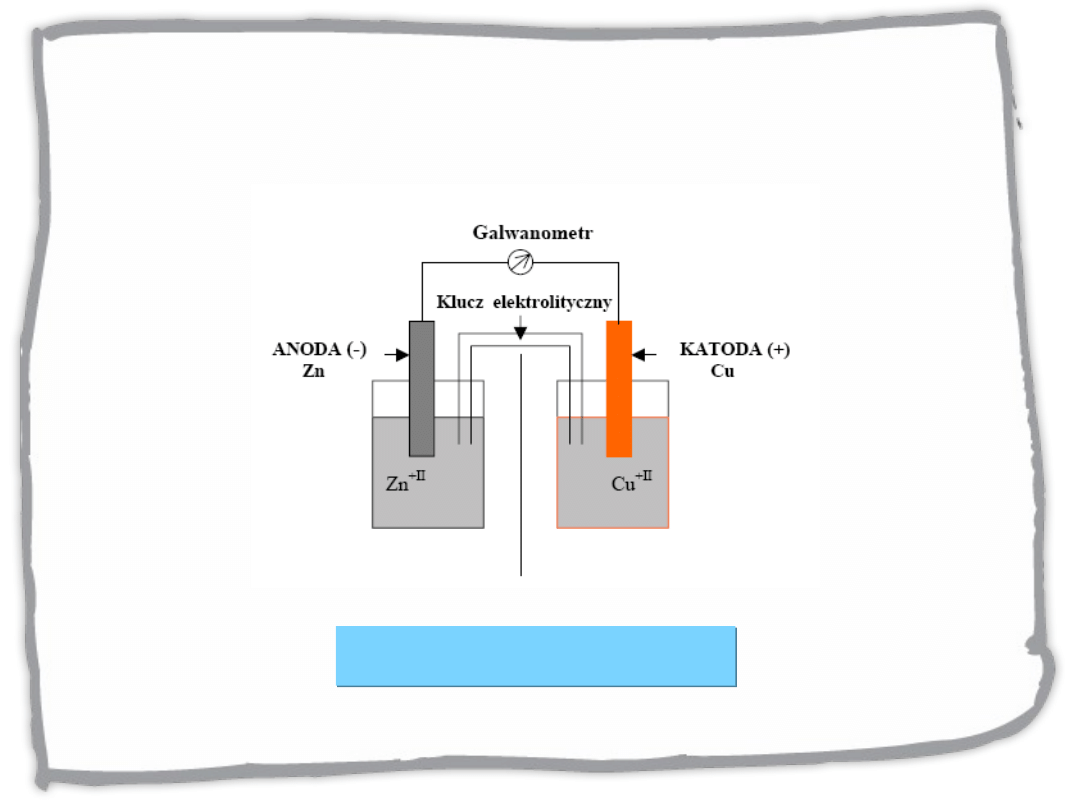
Ogniwo Daniella
Zn | ZnSO
4
|| CuSO
4
| Cu

11
Ogniwo Daniella
Przebieg procesów
elektrodowych :
Anoda : Zn
0
– 2e
-
→ Zn
2+
Katoda : Cu
2+
+ 2e
-
→ Cu
0
Sumarycznie : Zn + CuSO
4
→
ZnSO
4
+ Cu

12
Inne przykłady
Cynkowo-manganowe:
A: Zn
0
→ Zn
2+
+2e
-
K: 2MnO
2
+ 2H
+
+ 2e
-
→ Mn
2
O
3
+H
2
O
Cynkowo-powietrzne:
A: 2Zn
0
→ 2Zn
2+
+4e
-
K: O
2
+2H
2
O + 4e
-
→ 4OH
-
Litowe Li/CuS, Li/MnO
2
, Li/SOCl
2
A: 2Li
0
→ 2Li+ + 2e-
K: Cu
2+
+ 2e
-
→Cu
0
13
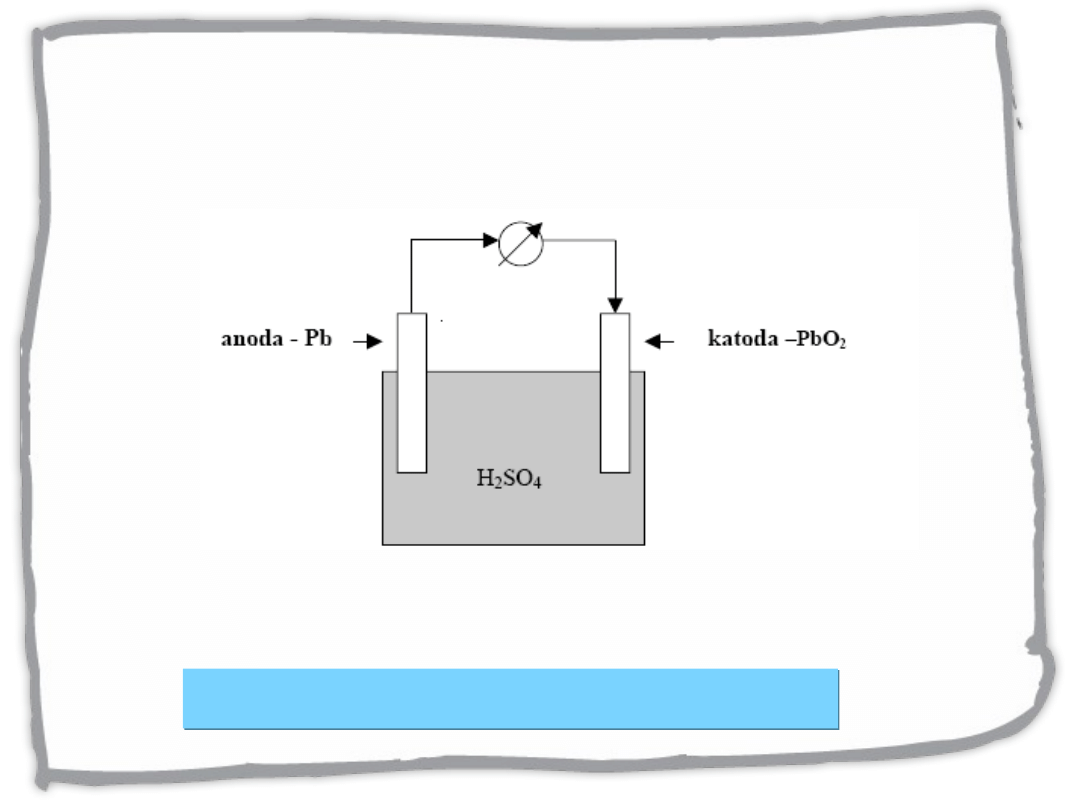
Ogniwa odwracalne: akumulator
ołowiowy
– rozładowanie
Anoda : Pb
0
→ Pb
2+
+ 2e
-
Katoda : PbO
2
+ 4H
+
+2e
-
→ Pb
2+
+ 2 H
2
O
Pb + PbO2 + 2 H2SO4 2 PbSO4 +
2 H2O
14
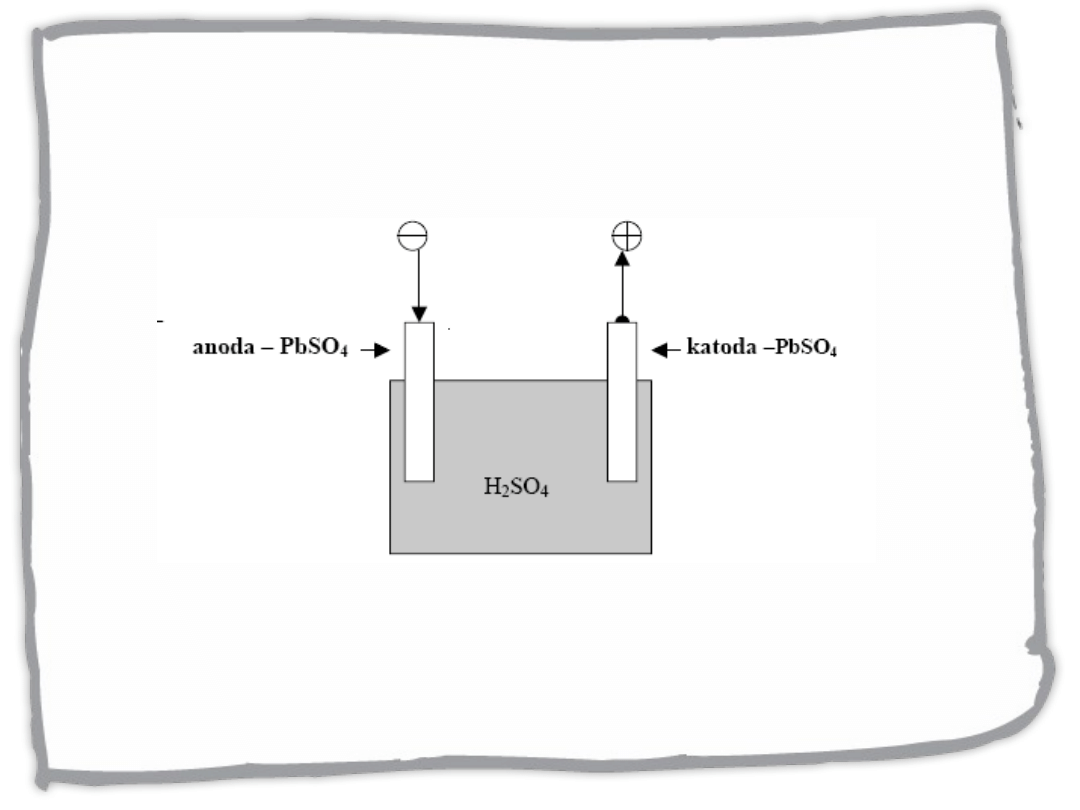
Ogniwa odwracalne: akumulator
ołowiowy
- ładowanie
Anoda : Pb
2+
+ 2e
-
→ Pb
0
Katoda : Pb
2+
+ 2 H
2
O → PbO
2
+ 4H
+
+2e
-
15
Inne przykłady
•
Niklowo-kadmowy
Cd | KOH | NiOOH | Ni
Cd + 2NiOOH + 2H
2
O
2Ni(OH)
2
+Cd(OH)
2
•
Niklowo-wodorkowy
A: NiOOH + 2H
2
O + e → Ni(OH)
2
+ OH
-
K: H
2
+ 2OH
-
→ 2 H
2
0 +2e
-
•
Niklowo-żelazowy
Fe | KOH | NiOOH | Ni
Fe + 2NiOOH +
2H
2
O
2Ni(OH)
2
+Fe(OH)
2
•
Cynkowo-srebrowy Zn | KOH+K
2
ZnO
2
| AgO |
Ag
2Zn + 2AgO + 4KOH
2K
2
ZnO
2
+ 2Ag +
2H
2
0
rozł
.
ład
.
rozł
.
ład
.
rozł
.
ład
.

16
Ogniwa paliwowe
Ogniwo paliwowe to
ogniwo generujące
energię elektryczną z
reakcji utleniania stale
dostarczanego do niego z
zewnątrz paliwa. W
odróżnieniu od ogniw
galwanicznych, w których
energia wytwarzanego
prądu musi zostać
wcześniej zgromadzona
wewnątrz tych urządzeń,
ogniwa paliwowe nie
muszą być wcześniej
ładowane.
Rys. Bezpośrednie
ogniwo metanolowe
ustawione w
przezroczystym
opakowaniu
17
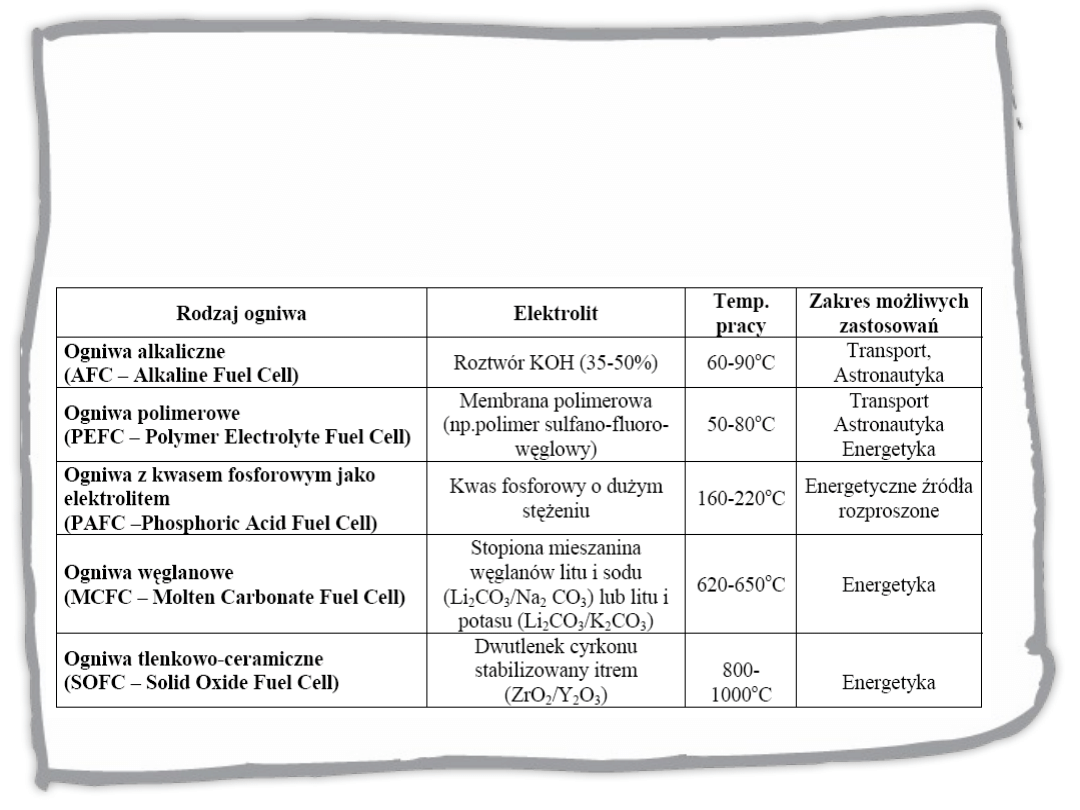
Ogniwa paliwowe
Rodzaje ogniw
paliwowych
18
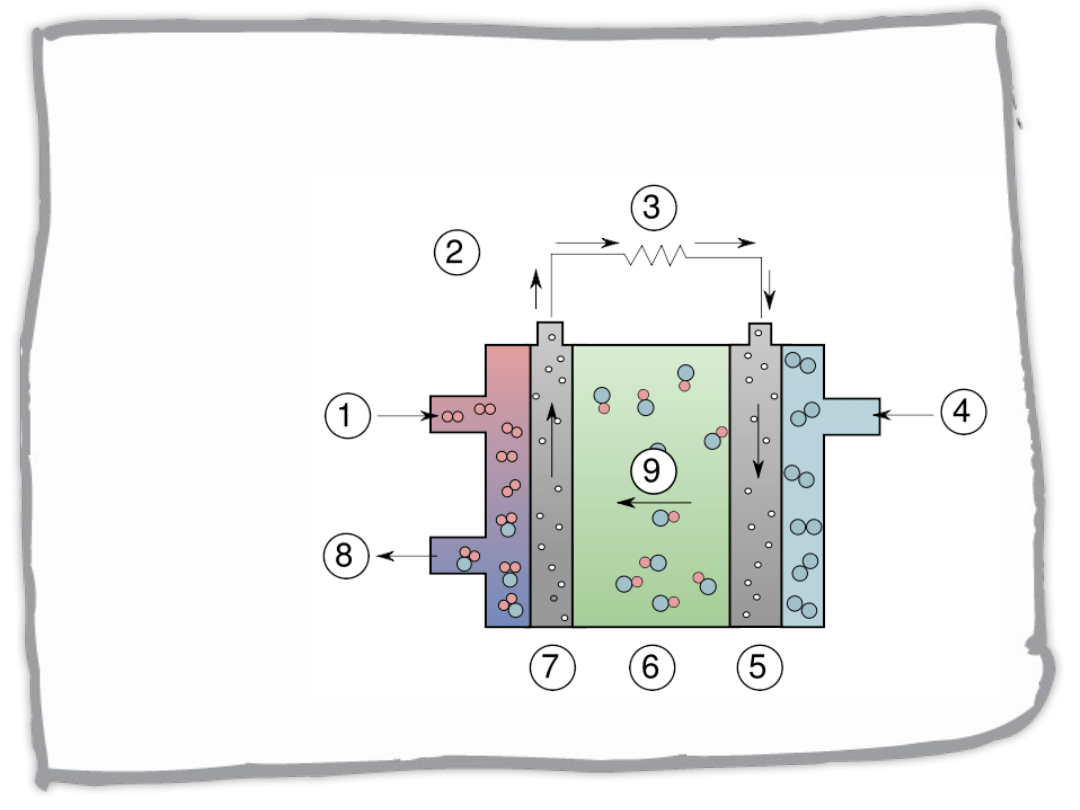
Ogniwa paliwowe
– ogniwo wodorowo-tlenowe
(1) - wodór
(2) - przepływ
elektronów
(3) -
ładowanie
(odbiornik
energii)
(4) - tlen
(5) - katoda
(6) - elektrolit
(7) - anoda
(8) - woda
(9) - jony
hydroksylowe
19
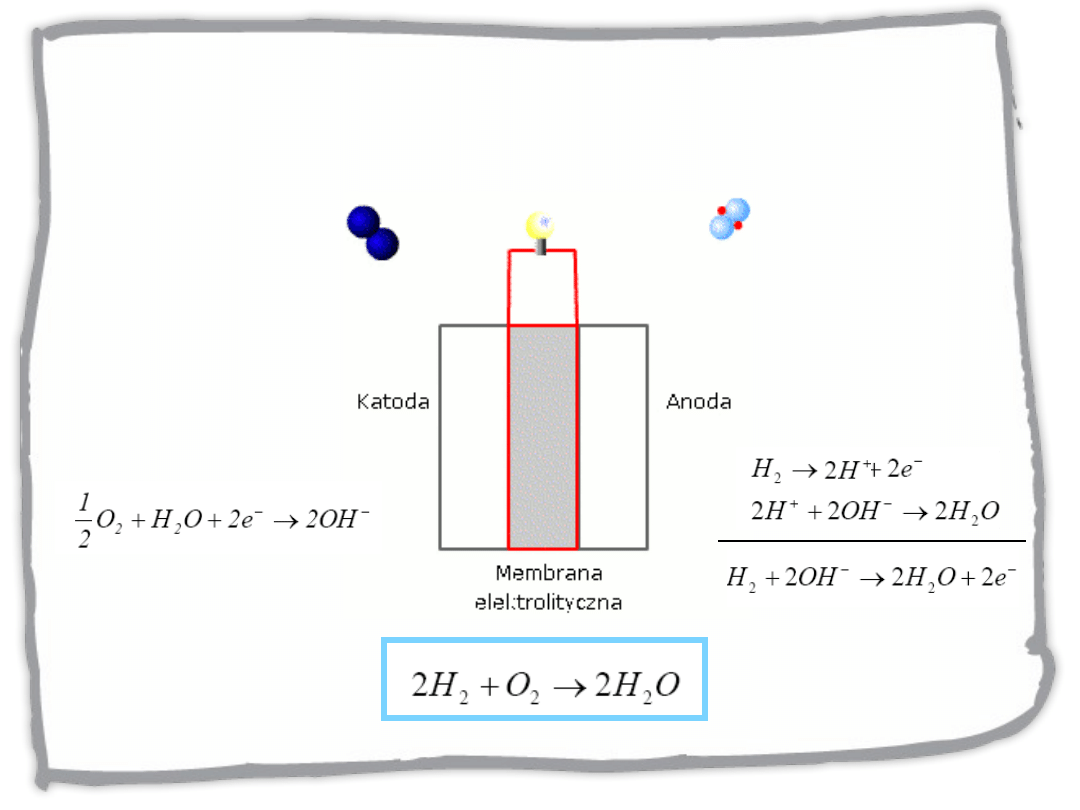
Ogniwa paliwowe
– ogniwo wodorowo-tlenowe

20
Ogniwa paliwowe
Najważniejsze zastosowania
:
energetyka,
sondy i statki kosmiczne,
systemy zasilania awaryjnego,
dostarczanie energii w miejscach pozbawionych
dostępu do sieci energetycznej,
urządzenia mobilne – telefony komórkowe,
palmtopy, notebooki,
samochody na wodór,
roboty mobilne – autonomiczne roboty wykonujące
prace serwisowe (sprzątanie) lub transportowe.

21
Ogniwa paliwowe
zalety
:
nie zanieczyszczają powietrza
proces produkcji nie zmienia chemicznej natury
elektrod oraz wykorzystywanych elektrolitów
nie muszą być wcześniej ładowane
wady
:
duży koszt produkcji ogniw
wysoki koszt paliwa do ogniw
ciągle mała sprawność

22
Koniec

23
BIBLIOGRAFIA
J. Kuryłowicz, Elektrochemia, PWN, Warszawa 1980
H. Scholl, T. Błaszczyk, P. Krzyczmonik, Elektrochemia.
Zarys teorii i praktyki, Łódź 1998
W. Libuś, Z. Libuś, Elektrochemia, PWN, Warszawa 1987
H. Drulis, Ogniwa paliwowe: nowe kierunki rozwoju,
Wiadomości Chemiczne, 2005, ISBN: 8322920849
Współczesne chemiczne źródła prądu, prof. dr hab. Andrzej
A. Czerwiński, http://www.wsipnet.pl/kluby/chemia.html?
kto=648&id=5514&par=648
T.J. Chmielniak, Ogniwa paliwowe w układach
energetycznych małej mocy, Instytut Maszyn i Urządzeń
Energetycznych, Politechnika Śląska, Gliwice,
http://www.itc.polsl.pl/centrum/kogen/materialy/art10.pdf
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
ogniwa galwaniczne, Chemia, Prezentacje
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
8 TERMODYNAMIKA OGNIWA GALWANICZNEGO
Siła elektromotoryczna ogniwa galwanicznego, Studia, Politechnika
Z Ogniwa galwaniczne
09 Ogniwa galwaniczne
11 ogniwa galwaniczne
Ogniwa galwaniczne, chemia, elektrochemia
ogniwa galwaniczne, ₪₪ CHEMIA
Ogniwa galwaniczne, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
OGNIWA GALWANICZNE SIŁA ELEKTROMOTORYCZNA OGNIW GALWANICZNY
Chemiczne źródła energii elektrycznej Ogniwa galwaniczne
OGNIWA GALWANICZNE i SZEREG NAPIĘCIOWY METALI
Podstawy chemii Cw 8 Ogniwa galwaniczne
Ogniwa galwaniczne Volta
więcej podobnych podstron