OGNIWA
GALWANICZNE
Ogniwo galwaniczne – urządzenie w którym wytwarzany jest prąd
elektryczny (strumień elektronów) dzięki przebiegowi samorzutnej
reakcji chemicznej red-ox czyli reakcji utleniania i redukcji. Ogniwem
galwanicznym jest bateria.
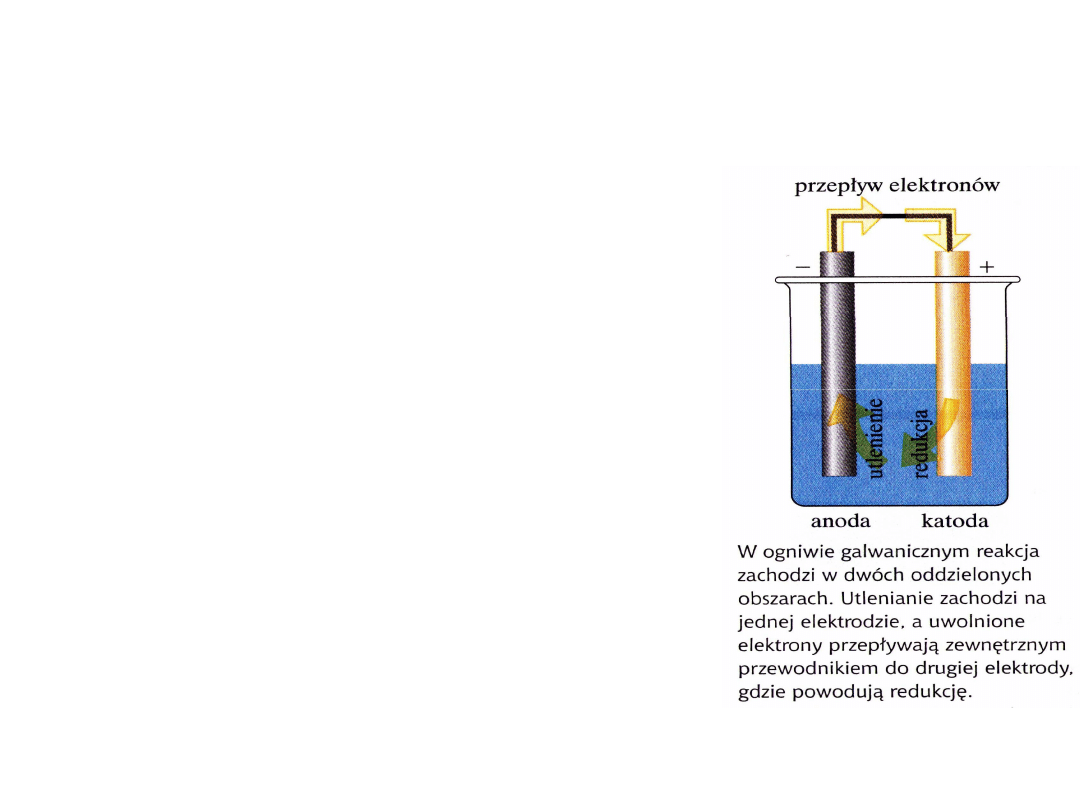
Budowa ogniwa
galwanicznego
Elektrody – metaliczny
przewodnik
(np.: Zn,
Cu, Pt, C
(grafit)
)
Elektrolit – przewodnik jonowy
(rozwór wodny soli metalu np.
CuSO
4
, ZnSO
4
Reakcje red-ox czyli reakcje połówkowe utleniania
i redukcji zachodzą w różnych obszarach ogniwa i
nazywamy je reakcjami elektrodowymi
Utlenianie zachodzi na
anodzie Redukcja zachodzi
na katodzie
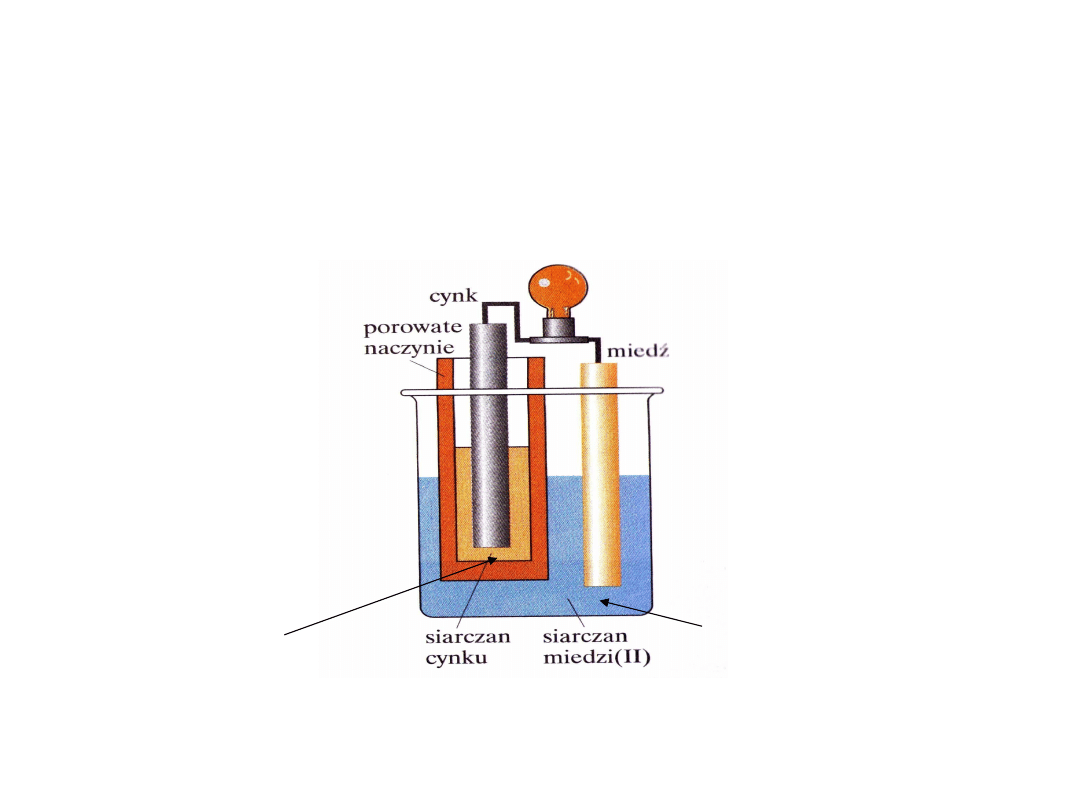
- Metaliczny cynk (blaszka
cynkowa) znajduje się w
roztworze soli cynku (ZnSO
4
) i
nie styka się z miedzią i
roztworem soli miedzi
(CuSO
4
)
Komora 1 biegun ‘’-
‘’
(-) Anoda Zn
(s)
- 2e
Zn
2+
Komora 2 biegun ‘’+’’
(+) Katoda Cu
2+
+ 2e Cu
(s)
Elektrony płyną od atomów
Zn do jonów Cu
2+
ale przez
zewnętrzny obwód (drut i
żarówkę)
W ogniwie galwanicznym samorzutna reakcja chemiczna powoduje
uwalnianie elektronów na anodzie, miejscu utleniania i ich przepływ do
katody, miejsca redukcji.
Pierwsze ogniwo zostało wynalezione przez angielskiego chemika Johna Daniella
(1836r.)
Zn
(s)
+ Cu
2+
(aq)
→ Zn
2+
(aq)
+
Cu
(s)
Reakcja jest
samorzutna
Zn
(s)
- 2e Zn
2+
Utlenienie powoduje
uwolnienie elektronów,
utleniane cząstki
uwalniają z anody
elektrony
Cu
2+
+ 2e
Cu
(s)
Redukcja powoduje
pobranie elektronów ,
cząstki ulegające redukcji
pobierają elektrony od
katody
Gdy zamykamy obwód
elektryczny elektrony z
anody podążają przez
obwód elektryczny (np.:
poruszają silniczek,
zapalają żarówkę) w
kierunku katody.
to anoda (utlenianie)-
tędy elektrony
opuszczają ogniwo
to katoda (redukcja)- tędy
elektrony wchodzą do
ogniwa

Sposób zapisu
ogniw
1. Znaki elektrod : anoda (-) , katoda (+)
2. Elektrody metaliczne zanurzone w roztworach swych soli np.: w
ogniwie Daniella gdzie mamy Zn w ZnSO
4
a Cu w CuSO
4
:
Zn
(s)
Zn
2+
(aq)
Zn
(s)
- 2e Zn
2+
Cu
2+
+ 2e
Cu
(s)
Cu
2+
(aq)
Cu
(s)
Obowiązuje porządek w
zapisie
substrat produkt
Każda linia pionowa oznacza zetknięcie
faz, w tym przypadku faza stała
(metal) i roztwór.
3. Jeśli ogniwo jest zapisane H
+
(aq)
H
2(g)
Pt
(s)
Reakcja (wymiana elektronów zachodzi między H
+
a H
2
(dwie różne
fazy) , natomiast Pt-platyna stanowi elektrodę, ale nic się z nią nie
dzieje
4. Jeśli ogniwo jest zapisane Fe
3+
(aq)
, Fe
2+
(aq)
Pt
(s)
Jony które są redukowane oraz utleniane znajdują się w tej
samej fazie, a do ich rozdzielenia używamy przecinka
Pt – platyna stanowi elektrodę ale nic się z nią nie
dzieje
C(gr)- elektroda jest grafit ale nie ulega on reakcji
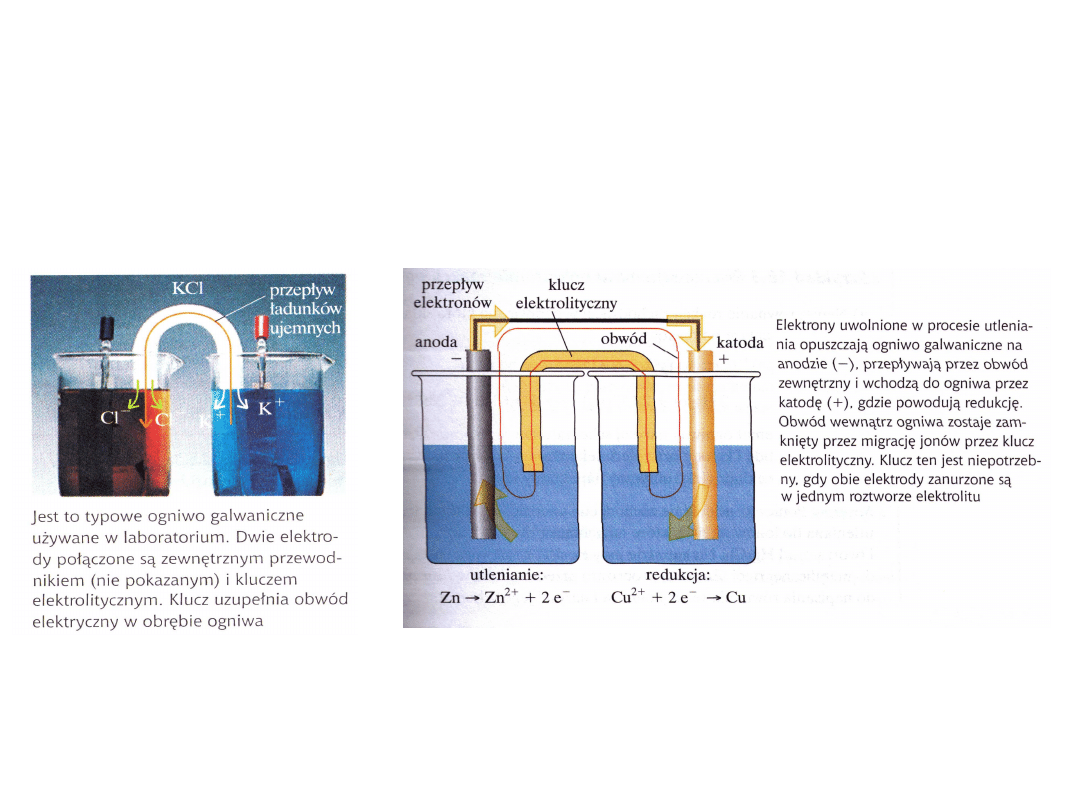
Zapis całego ogniwa składa się z dwóch półogniw
Anoda(utlenianie) │ katoda(redukcja)
Ogniwo Daniella ma zapis : Zn(s)│ Zn
2+
(aq)
│ Cu
2+
(aq)
│Cu
(s)
W celu zamknięcia obwodu (ale nie mieszania się roztworów w których
zachodzi utlenianie i redukcja) stosuje się klucz elektrolityczny (mostek
solny). Szklana u-rurka wypełniona żelem zawierającym stężony roztwór
soli.
Symbolem klucza
elektrolitycznego
jest ║
pełny zapis ogniwa z kluczem
elektrolitycznym
Zn(s)│ Zn
2+
(aq)
║ Cu
2+
(aq)
│Cu
(s)

SEM siła elektromotoryczna
ogniwa
SEM mierzymy za pomocą elektronicznego
woltomierza.
SEM = potencjał katody – potencjał
anody
W ogniwie Daniella
Zn(s)│ Zn
2+
(aq)
║ Cu
2+
(aq)
│Cu
(s
SEM = 1,1V
SEM = E
o
katody
– E
o
anody
SEM= +0,34 – (- 0,76) = 1,1V
Anoda
Zn
(s)
/Zn
2+
E
o
zn/zn2+
= -0,76
Katoda Cu
2+
/Cu
E
o
Cu2+/Cu
= +0,34
Wartość potencjałów odczytujemy z
Tabeli pt. Szereg elektrochemiczny
metali
Standardowe potencjały
elektrod
Skąd wiadomo że E
o
Zn/Zn2+
= - 0,76 ???
Stan standardowy gazu : jest to czysty
gaz pod ciśnieniem 1atm, a stanem
standardowym dla roztworu jest roztwór o
stężeniu 1 mol/dm
3
.
Standardowe potencjały elektrod oznacza się E
o.
Przyjmuje się, że potencjał elektrody
wodorowej wynosi 0.
2H
+
(aq)
+ 2e H
2(g)
E
o
H+/H2
=0
Elektrody wodorowej używamy do zdefiniowania standardowych potencjałów
wszystkich innych elektrod. Np.: aby wyznaczyć potencjał standardowy elektrody
cynkowej, mierzymy siłę elektromotoryczną ogniwa, w którym jedna elektrodą
jest elektroda cynkowa a drugą elektroda wodorowa: Zn
(s)
Zn
2+
(aq)
║H
+
(aq)
H
2(g)
Pt
(s)
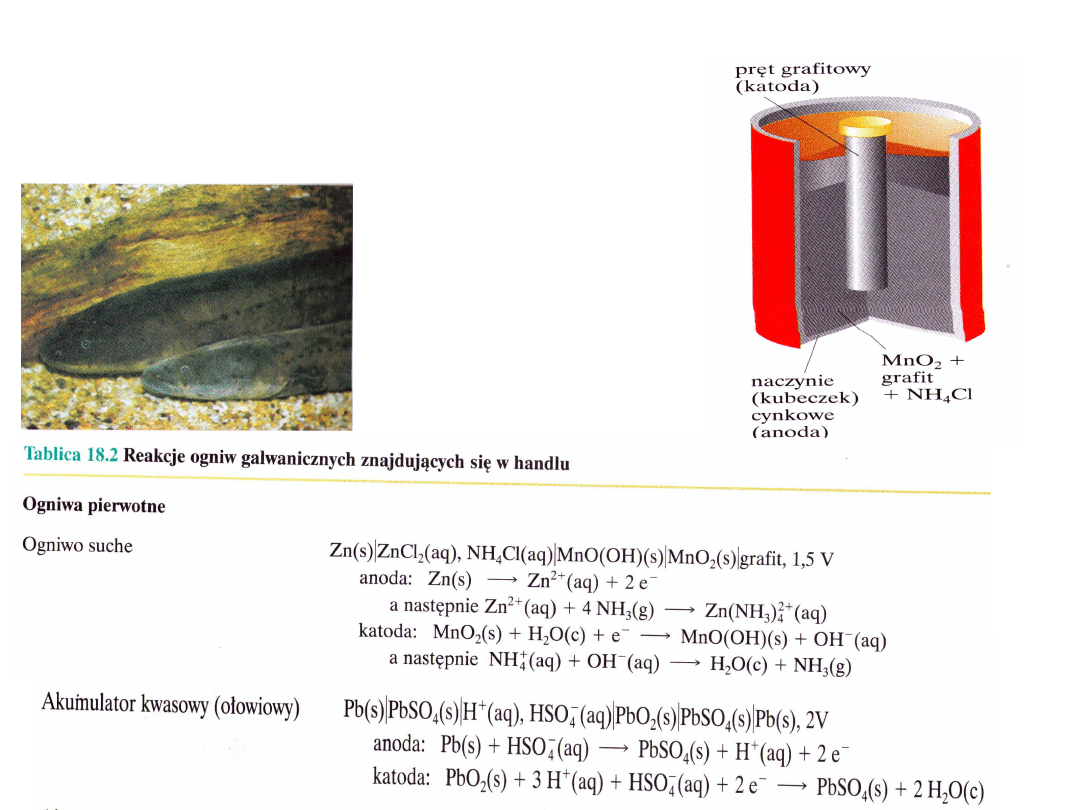
Ogniwa stosowane w
praktyce
Ogniwa pierwotne – nieregenerowalne, elektryczność
wytwarzana jest z substancji chemicznych zamkniętych w
ogniwie
Ogniwa wtórne – akumulatory, musza zostać
naładowane
przed użyciem i są
regenerowane
Ogniwo suche – bateria, (1,5V)
Węgorz elektryczny żyje
w Amazonce, na dł. 1 m
wytwarza różnice
potencjałów 700V
Document Outline
Wyszukiwarka
Podobne podstrony:
ogniwa galwaniczne, Chemia, Prezentacje
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
8 TERMODYNAMIKA OGNIWA GALWANICZNEGO
Siła elektromotoryczna ogniwa galwanicznego, Studia, Politechnika
Ogniwa galwaniczne
09 Ogniwa galwaniczne
11 ogniwa galwaniczne
Ogniwa galwaniczne, chemia, elektrochemia
ogniwa galwaniczne, ₪₪ CHEMIA
Ogniwa galwaniczne, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
OGNIWA GALWANICZNE SIŁA ELEKTROMOTORYCZNA OGNIW GALWANICZNY
Chemiczne źródła energii elektrycznej Ogniwa galwaniczne
OGNIWA GALWANICZNE i SZEREG NAPIĘCIOWY METALI
Podstawy chemii Cw 8 Ogniwa galwaniczne
Ogniwa galwaniczne Volta
więcej podobnych podstron