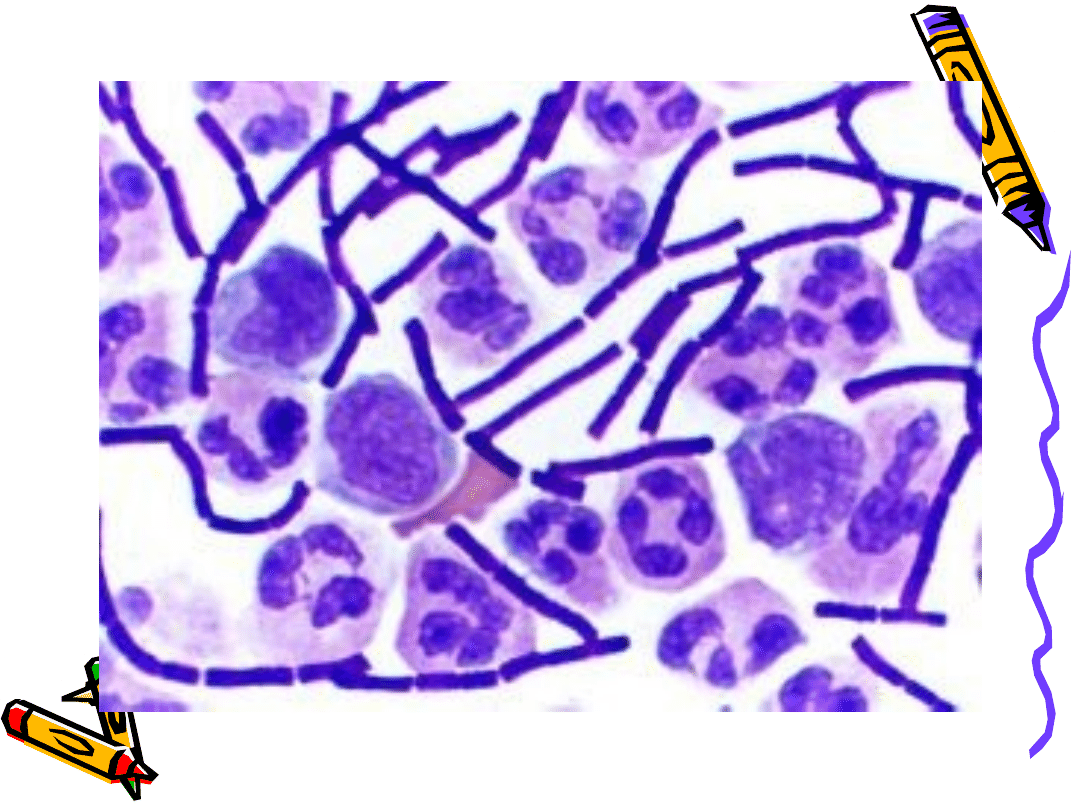
Barwienie bakterii:
Aby zaobserwować bakterie w mikroskopie
świetlnym, ocenić właściwie ich wielkość,
kształt, niektóre cechy morfologiczne,
należy je zabarwić.
Bakterie słabo załamują promienie
świetlne. Związki stosowane do barwienia
to głównie sole. Najczęściej stosuje się
barwniki o charakterze zasadowym, w
którym barwny jest kation.Barwniki
obojętne lub kwaśne są stosowane
znacznie rzadziej.
Do najczęściej stosowanych
barwników należą:
• błękit metylenowy,
• fiolet krystaliczny,
• fuksyna zasadowa,
• fuksyna kwaśna,
• safranina,
• zieleń malachitowa.
Barwienie bakterii ogólnie
Barwienie bakterii ogólnie
można podzielić na:
można podzielić na:
Barwienie bakterii ogólnie
Barwienie bakterii ogólnie
można podzielić na:
można podzielić na:
proste
proste
(stosuje się jeden barwnik)
(stosuje się jeden barwnik)
złożone
złożone
(stosuje się kolejno kilka barwników. Pozwala to
(stosuje się kolejno kilka barwników. Pozwala to
wyszczególnić w badanym preparacie bakterie gram
wyszczególnić w badanym preparacie bakterie gram
dodatnie i gram ujemne, różnią się one budową ściany
dodatnie i gram ujemne, różnią się one budową ściany
komórkowej a co za tym idzie-zdolnością do
komórkowej a co za tym idzie-zdolnością do
przepuszczania barwnika).
przepuszczania barwnika).
W zależności od stosowanych barwników,
można wyróżnić 3 sposoby barwienia:
barwienie pozytywowe - polegające na
zabarwieniu komórek, podczas gdy tło zostaje
bezbarwne; może być proste lub złożone,
barwienie negatywowe - uzyskanie kontrastu
między ciemnym tłem a nie zabarwionymi
komórkami; stosowane jest zwykle do barwienia
krętków i otoczek bakterii; wykorzystuje się roztwór
nigrozyny, tuszu chińskiego lub cyjanochiny. Rozmaz
wykonuje się z zawiesiny komórek zmieszanych z
barwnikiem, nie utrwala się, tylko od razu po
wysuszeniu ogląda pod mikroskopem; może być
proste lub złożone,
barwienie pozytywowo-negatywowe -
połączenie powyższych metod, najpierw wykonuje
się barwienie negatywowe, a po wyschnięciu
dobarwia się barwnikiem pozytywowym.
Technika każdego barwienia polega na pokrywaniu
szkiełka podstawowego z naniesionym i
utrwalonym preparatem-barwnikiem na
określony czas,
a następnie spłukiwaniu poszczególnych barwników
wodą przed nalaniem następnych.
Czasami w zależności od przepisu stosuje się także
takie substancje jak alkohol, czy płyn Lugola, a
także podgrzewanie preparatu nad palnikiem.
Preparat po wysuszeniu obserwuje się pod imersją.
Wyróżnić można także barwienie bakterii:
■przyżyciowe (rzadkie)
■pośmiertne (częściej stosowane).
Przyżyciowe:
Stosuje się je np. w celu
odróżnienia komórek żywych od martwych,
stwierdzenia obecności substancji zapasowych,
w badaniu przepuszczalności błony
cytoplazmatycznej.
Polega ono na wprowadzeniu do żywych komórek
nietoksycznego barwnika o dużej kontrastowości.
Używa się barwników o dużym rozcieńczeniu.
Stwierdzono, że bakterie w ten sposób barwione
przestają się rozmnażać.
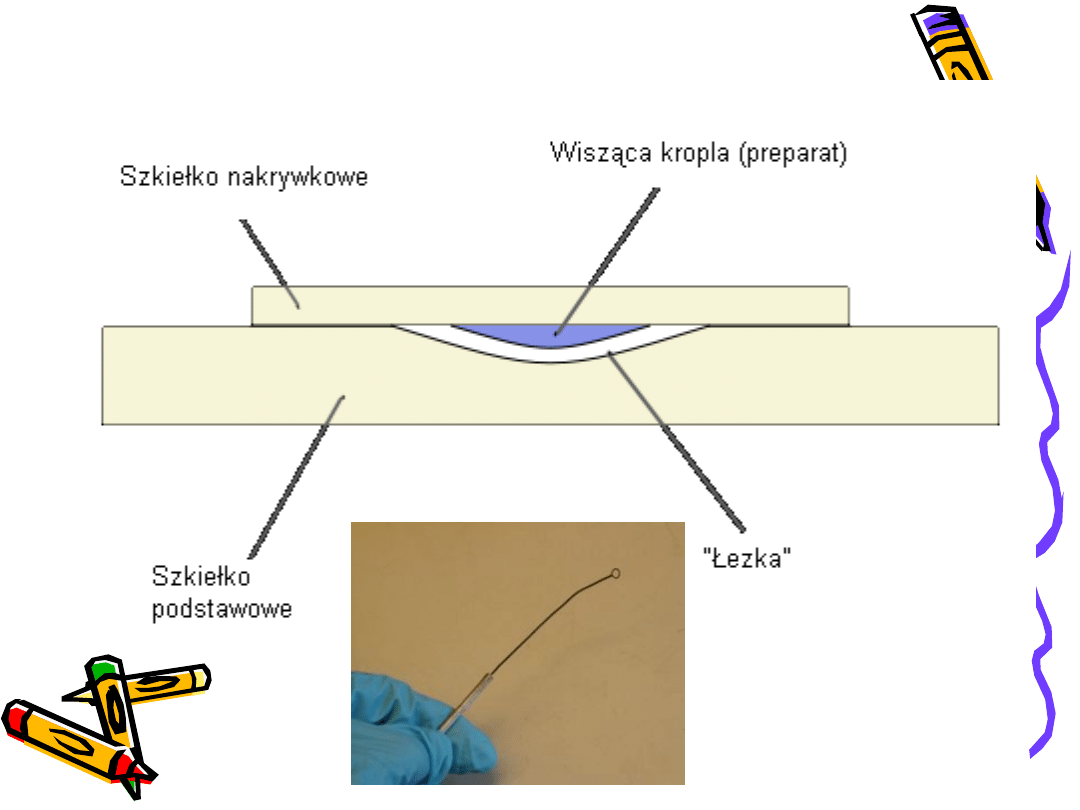
Do przygotowania preparatu barwionego na
„żywo”, na szkiełku przedmiotowym, obok kropli
zawiesiny drobnoustrojów umieszcza się kroplę
barwnika. Obie krople miesza się ezą, przykrywa
szkiełkiem nakrywkowym i po upływie
określonego czasu ogląda pod mikroskopem.
Eza
Technika sporządzania
preparatu utrwalonego
Przed sporządzeniem preparatu należy odtłuścić
szkiełko przedmiotowe, przeciągając parokrotnie nad
płomieniem palnika gazowego. Na dobrze
odtłuszczonym szkiełku kropla wody powinna się
swobodnie rozlewać.
Sporządzanie rozmazu
Na odtłuszczone szkiełko nanosi się kroplę hodowli lub
badanego materiału i sporządza zawiesinę, którą
rozprowadza się ezą na powierzchni szkiełka
przedmiotowego i pozostawia do wyschnięcia na
wolnym powietrzu. Po wysuszeniu rozmaz powinien
być cienki, ledwo widoczny. Wysuszony preparat
utrwala się.
Utrwalanie termiczne:
Polega na kilkukrotnym przesunięciu szkiełka przedmiotowego
z rozmazem nad płomieniem palnika od spodu preparatu,
przerywając kiedy szkło zacznie lekko parzyć.
Utrwalanie chemiczne:
Stosuje się przy badaniu struktur komórkowych.Do tego
utrwalania używa się związków odwadniających, takich jak:
alkohol etylowy, metylowy, mieszanina alkoholu i eteru w
stosunku 1:1, 10- procentowy roztwór formaliny, sublimatu itp.
Utrwalanie chemiczne polega na zalaniu wysuszonego
rozmazu na określony czas utrwalaczem. Następnie utrwalacz
się zlewa i preparat suszy na powietrzu.Używając formaliny
lub sublimatu, należy preparat dobrze przemyć wodą i
wysuszyć.
Metoda Grama
Została opracowana w 1884 roku przez
Duńczyka, Hansa Christiana Grama (1853–
1938). Pozwala ona doświadczalnie
zróżnicować te organizmy na dwie duże grupy
(Gram-dodatnie i Gram-ujemne) ze względu
na różnice w budowie ściany komórkowej oraz,
co za tym idzie, także pewne różnice w
fizjologii i podatności na leki.
Barwienie metodą Grama
odczynniki: fiolet krystaliczny, płyn Lugola, alkohol
etylowy, roztwór fuksyny zasadowej.
1. Nanieść bakterie na szkiełko podstawowe.
W przypadku wykonywania preparatu z hodowli płynnej
wystarczy nanieść na szkiełko kroplę hodowli lub pobrać
odrobinę bakterii jałową ezą (czyli wyżarzoną w płomieniu
palnika) i rozprowadzić zawiesinę na powierzchni szkiełka.
W przypadku wykonywania preparatu z bakterii
wyrosłych na podłożach stałych należy materiał pobrać
jałowa ezą (czyli wyżarzoną w płomieniu palnika),
następnie zawiesić bakterie w kropli soli fizjologicznej
naniesionej na szkiełko podstawowe.
Zabiegi te mają na celu przygotowanie bakterii w postaci
niezbyt gęstej zawiesiny. Po wysuszeniu utrwalamy
preparat przez przeciągnięcie szkiełka podstawowego
nad płomieniem palnika. Należy uważać, żeby nie trwało
to zbyt długo i żeby bakterii nie przypalić!!!
2. Na utrwalone bakterie zakroplić fiolet krystaliczny w
ten sposób by pokrył on powierzchnię, na którą
naniesiono bakterie. Barwnik pozostawić na 2 minuty. Po
tym czasie zmyć fiolet wodą destylowaną.
3. Nanieść płyn Lugola na 1 minutę. Płyn spłukać obficie
najpierw alkoholem etylowym, a później wodą
destylowaną.
4. Nanieść na preparat roztwór fuksyny zasadowej na 40
sekund. Po tym czasie spłukać szkiełko wodą destylowaną
i wysuszyć preparat. Przed umieszczeniem na stoliku
mikroskopu nanieść na szkiełko kroplę olejku
immersyjnego. Oglądać używając obiektywu dającego
stukrotne powiększenie.
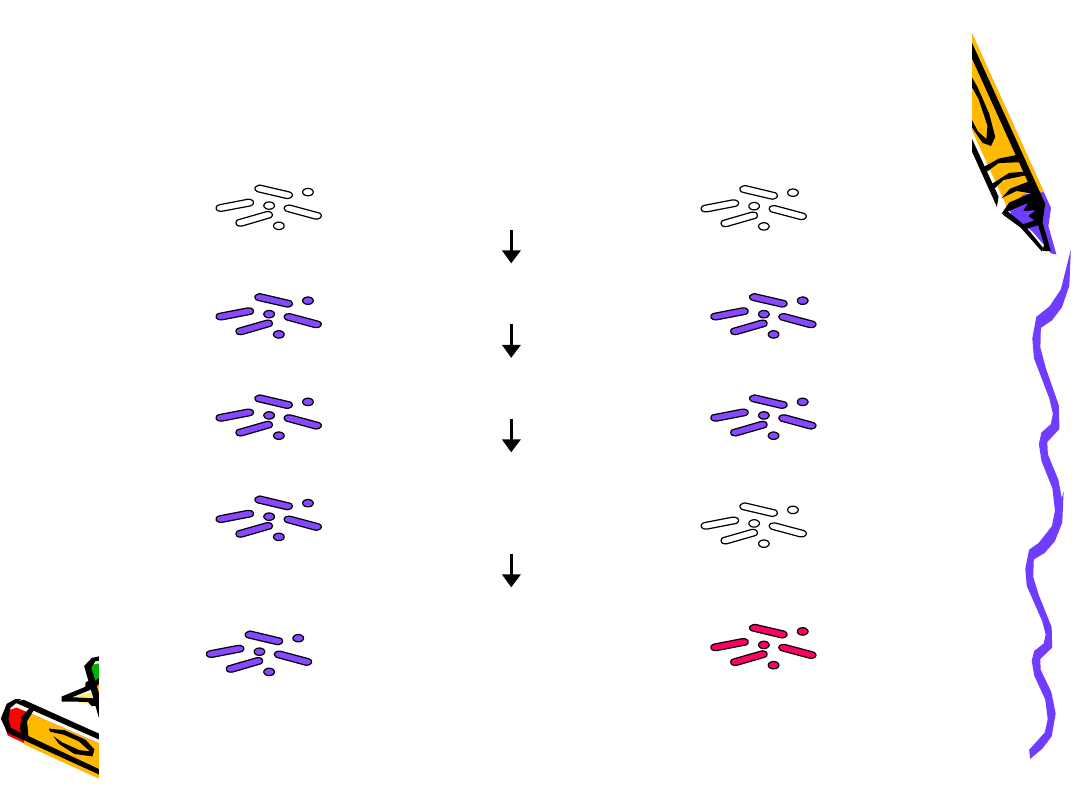
Bakterie
Gram-dodatnie
Bakterie
Gram-ujemne
Schemat barwienia bakterii metodą Grama
Utrwalenie
preparatu
Fiolet krystaliczny
Płyn Lugola
Odbarwienie
roztworem
alkoholu
Fuksyna zasadowa
Barwienie metodą Grama należy przeprowadzać
na hodowlach 18- 24 godzinnych. W starych
komórkach zdolność do tworzenia trwałego
kompleksu z fioletem zmniejsza się.
Bakterie:
G (+) barwią się na kolor
niebiesko-
fioletowy,
G (-) na
czerwono-różowy
Te bakterie których część komórek barwi się na
fioletowo a część na czerwono noszą nazwę
gramozmiennych.
Barwienie przetrwalników
Budowa przetrwalników, a szczególnie obecność
wielowarstwowych błon powoduje, że
przetrwalniki należą do słabo barwiących się i
konwencjonalne metody nie dają efektu. W
zabarwionych komórkach są widoczne jako
bezbarwne obszary. Barwniki mogą przenikać do
wnętrza po podgrzaniu preparatu.
Nieprzepuszczalność ściany przetrwalnika
zapobiega ich odbarwianiu podczas płukania
wodą czy alkoholem. Dlatego stosuje się
barwienie kontrastowe przetrwalników i
komórek wegetatywnych.
Metoda Schaeffera- Fultona
1. Uwalony preparat zalać 5- procentowym wodnym
roztworem zieleni malachitowej na 5 minut, po czym
nie zalewając barwnika, delikatnie podgrzać palnikiem
od spodu preparatu do momentu ukazania się
obłoczka pary. Podgrzewanie powtarza się 3-krotnie,
nie dopuszczając do odparowania barwnika,
2. Po skończonym ogrzewaniu preparat spłukać
delikatnym strumieniem wody w czasie 30 sekund,
3. Preparat dobarwić 0,5- procentowym roztworem
safraniny w czasie 30 sekund,
4.Po zakończonym barwieniu, preparat spłukać
wodą i osuszyć.
Przetrwalniki barwią się na
zielono
, a komórki
wegetatywne na
czerwono
.
Do znanych metod barwienia złożonego należą
metody barwienia bakterii, zawierających w
swych ścianach duże ilości tłuszczu i wosków.
Bakterie te, zabarwione na gorąco barwnikiem,
nie odbarwiają się pod działaniem alkoholu i
silnych kwasów mineralnych. Noszą one nazwę
bakterii alkoholo-kwaso-opornych.
Dla tej grupy najczęściej jest polecana metoda
barwienia prątków Ziehl-Neelsena, w której
podstawowym barwnikiem jest fuksyna
karbolowa.
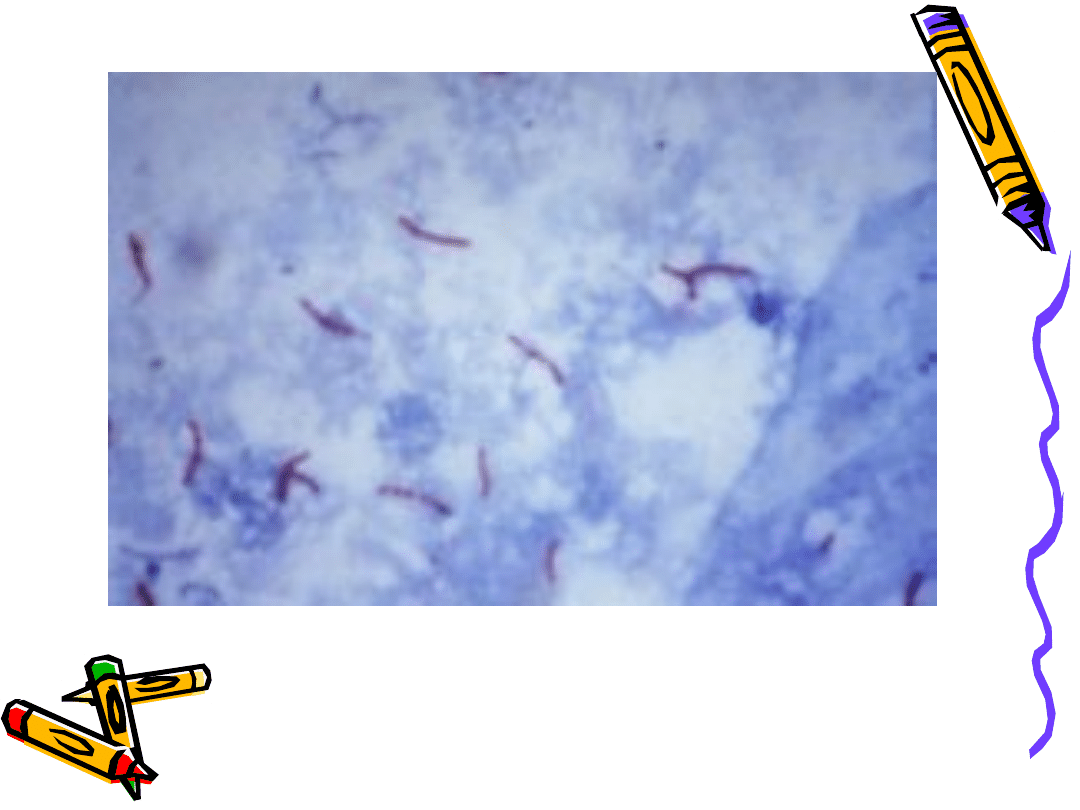
Bakterie gruźlicy zabawione metodą Ziehla-Neelsena
Barwienie otoczek
Polega na barwieniu otoczek bakterii w
celu ułatwienia obserwacji.
Otoczki bakteryjne bardzo trudno
zaobserwować w mikroskopie świetlnym,
bez zastosowania specjalnych metod
barwienia. Jest to związane z tym, jak
otoczki załamują światło. W barwieniu
otoczek stosuje się najczęściej barwienie
negatywne z pewnymi modyfikacjami.
Na szkiełko przedmiotowe nanosi się kroplę
zawiesiny drobnoustrojów i kroplę nigrozyny lub tuszu.
Używając drugiego szkiełka przedmiotowego,
wykonuje się rozmaz i suszy na powietrzu. Preparat po
wyschnięciu jest gotowy do oglądania.
Na ciemnym tle są widoczne jasne komórki z
otoczkami.
Inną metodą jest barwienie różnicujące według
Anthony’ego w modyfikacji Tylera. Rozmaz komórek,
po wysuszeniu na powietrzu i utrwaleniu, barwi się 4-
7 minut fioletem krystalicznym według Anthony’ego-
Tylera. Barwnik zlewa się i preparat zmywa roztworem
siarczanu miedzi. Otoczki przyjmują barwę
niebieskofioletową, a komórki są ciemnoniebieskie.
Barwienie innych
Barwienie innych
substancji zapasowych
substancji zapasowych
Barwienie innych
Barwienie innych
substancji zapasowych
substancji zapasowych
Przy wykrywaniu wolutyny, rozmaz komórek po
Przy wykrywaniu wolutyny, rozmaz komórek po
wysuszeniu i utrwaleniu, barwi się przez kilka
wysuszeniu i utrwaleniu, barwi się przez kilka
sekund błękitem według Lofflera, spłukuje wodą i
sekund błękitem według Lofflera, spłukuje wodą i
suszy. Ziarnistości metachromatyczne barwią się
suszy. Ziarnistości metachromatyczne barwią się
na fioletowo, a komórki na niebiesko.
na fioletowo, a komórki na niebiesko.
Do barwienia glikogenu i granulozy stosuje się
Do barwienia glikogenu i granulozy stosuje się
płyn Lugola. Glikogen barwi się na kolor
płyn Lugola. Glikogen barwi się na kolor
czerwonobrunatny, a granuloza na
czerwonobrunatny, a granuloza na
ciemnoniebieski.
ciemnoniebieski.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
barwienie bakteri
Mikro Klimek-Ochab, Ćwiczenie 7- Barwienie bakterii, Ćwiczenie 5
Wejściówka MIKRO barwienie bakterii, Sprawozdania ATH, Mikrobiologia
Metody barwienia i morfologia komorki bakteryjnej, Nieuporządkowane, Materiały tekstowe
MIKROBIOLOGIA -BAKTERIE(2), BARWIENIE GRAMA:BARWIENIE ZŁOŻONE RÓŻNICUJĄCE
MIKROBIOLOGIA laboratorium 2 Morfologia komorki bakteryjnej. Barwienie zlozone, Studia, OŚ, Mikrobio
Cw 2 Morfologia komórki bakteryjnej Barwienie złożone
Środowisko wodne – miejsce bytowania bakterii z rodzaju Legionella
Morfologia bakterii-barwienie, UM Wrocław - Stomatologia, Mikrobiologia i mikrobiologia jamy ustnej
Metody barwienia i morfologia komrki bakteryjnej, Mikrobiologia
MIKROBIOLOGIA laboratorium 1 Morfologia komorki i kolonii bakteryjnej. Barwienie proste, Studia, OŚ,
Środowisko wodne – miejsce bytowania bakterii z rodzaju Legionella
Cw 2, Morfologia komórki bakteryjnej Barwienie złożone
Budowa komorki bakteryjnej, metody barwienia
ŚCIĄGI, bakterie ściąga z nazw i wymogów bardziej rozbudowana, Rodzina enterobacteriaceaeG(-);palecz
Rodzaje preparatów mikroskopowych, oraz metody ich barwienia
Metody barwienia i morfologia komorki bakteryjnej, Nieuporządkowane, Materiały tekstowe
więcej podobnych podstron