
Wykład 5
2.2. Białka
strukturalne
2. Białka - struktura i
funkcje
http://www.au.poznan.pl/~gralew/dydaktyczne/bialka.ppt#397,9
Struktura kolagenu – drugorzędowa

Kolagen
Jest to zewnątrzkomórkowe białko, które jest
głównym składnikiem włóknistym skóry, kości,
ścięgien, chrząstek i zębów.
Struktura I-rzędowa: ok. 1000 aminokwasów,
Powtarzająca się sekwencja Gly-Pro-Hyp (gdzie
Hyp – hydroksyprolina)
Struktura II-rzędowa: trzy nawinięte na siebie
helisy alfa, cząsteczka ma kształt cylindryczny,
długość 300 nm i średnica 1.5 nm.

Struktura I-rzędowa kolagenu

Struktura II-rzędowa kolagenu
http://www.au.poznan.pl/~gralew/dydakty
czne/bialka.ppt#397,9
,
Struktura kolagenu – drugorzędowa

Pomiędzy nićmi występują wiązania
wodorowe pomiędzy N-H i O=C, na jeden
skręt spirali przypada 3.3 reszty
aminokwasowej, skok spirali wynosi 0.29
nm (tj długość osi przypadającej na jedną
resztę aminokwasową). Hydroksyprolina
(Hyp) jest wytwarzana przez organizmy
ssaków z proliny w reakcji, w której
czynnikiem wiążącym drugi atom tlenu (od
O
2
) jest witamina C (kwas askorbinowy,
askorbinian). Odgrywa on w ten sposób rolę
antyutleniacza.
Brak witaminy C w diecie powoduje, że w
kolagenie zamiast Hyp występuje Pro. Taki
kolagen jest „miękki”; tkanka chrząstna jest
słaba i występują objawy chorobowe
(szkorbut).
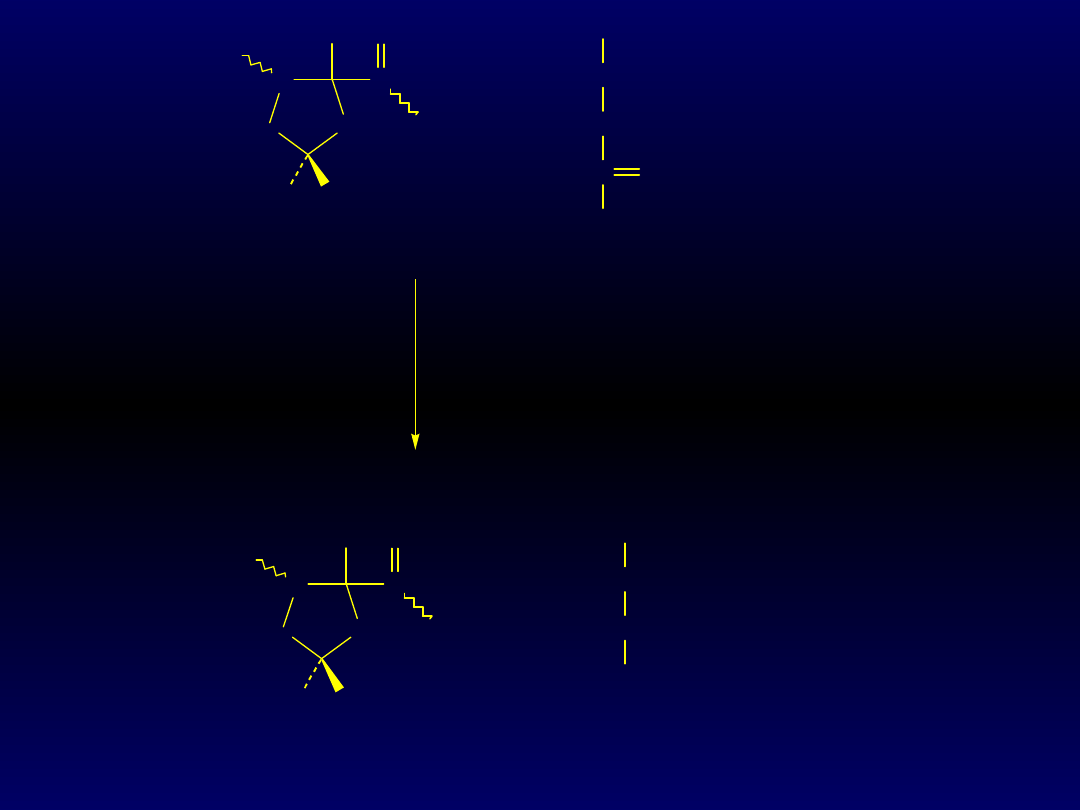
N
CH
2
CH
2
H
C
H
H
O
+ O
2
+
COO-
CH
2
CH
2
C O
COO-
hydroksylaza
prolinowa
+ askorbinian (witamina C)
N
CH
2
CH
2
H
C
OH
H
O
+ CO
2
+
COO-
CH
2
CH
2
COO-
Pro
Hyp
-ketoglutar
an
bursztynian
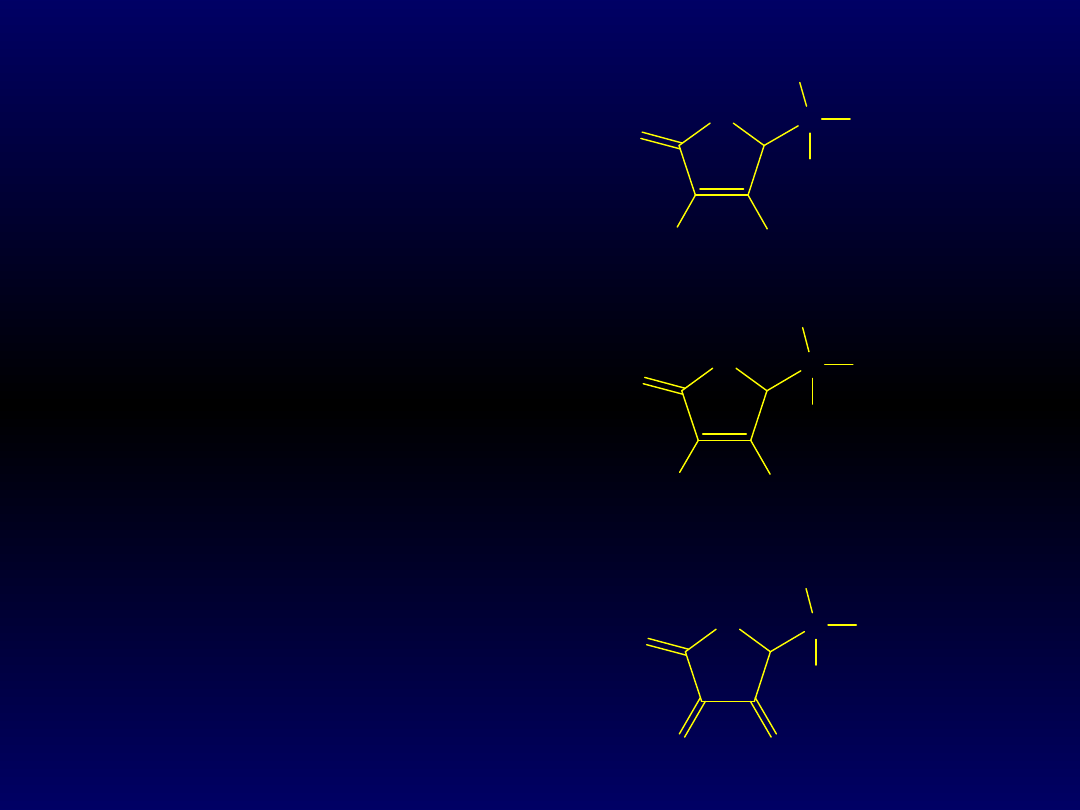
O
O
C
OH
OH
HO
H
CH
2
OH
KWAS
ASKORBINOWY
(WIT. C)
O
O
C
OH
O-
HO
H
CH
2
OH
O
O
C
O
O
HO
H
CH
2
OH
ASKORBINIAN
forma zredukowana
KWAS
DEHYDROKSYASKORBINOWY
forma utleniona

2.3. Białka
transportujące
2. Białka - struktura i
funkcje
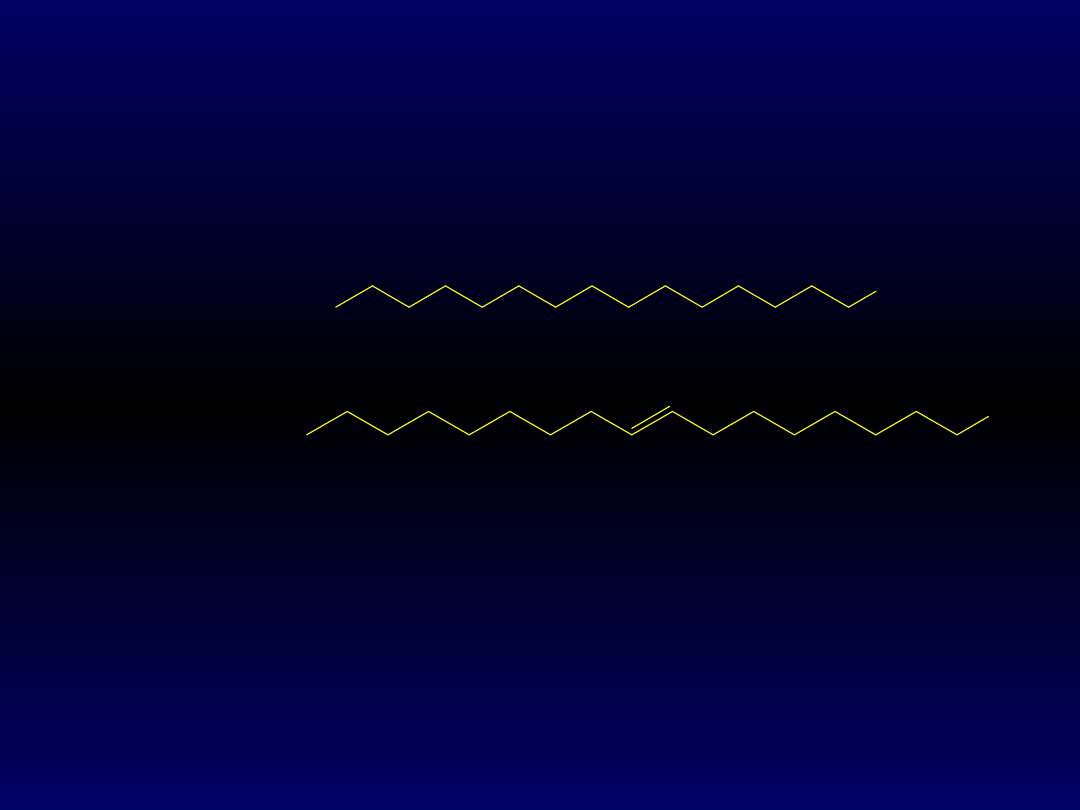
Błony tłuszczowe (lipidowe) składają się z części
hydrofobowej, którą stanowią łańcuchy kwasów
tłuszczowych (palmitynowego – C
16
i oleinowego – C
18
, z
jednym wiązaniem podwójnym):
oraz z gliceryny. Są więc estrami. Dwie grupy
hydroksylowe gliceryny są zestryfikowane kwasami
tłuszczowymi, a trzecia jest zestryfikowana innym
składnikiem: grupą fosforanową (w fosfatydach), grupą
fosfocholinową (fosfatydylocholina) i innymi:
COOH
C
15
H
30
COOH - kwas
palmitynowy
C
17
H
32
COOH - kwas
oleinowy
COOH
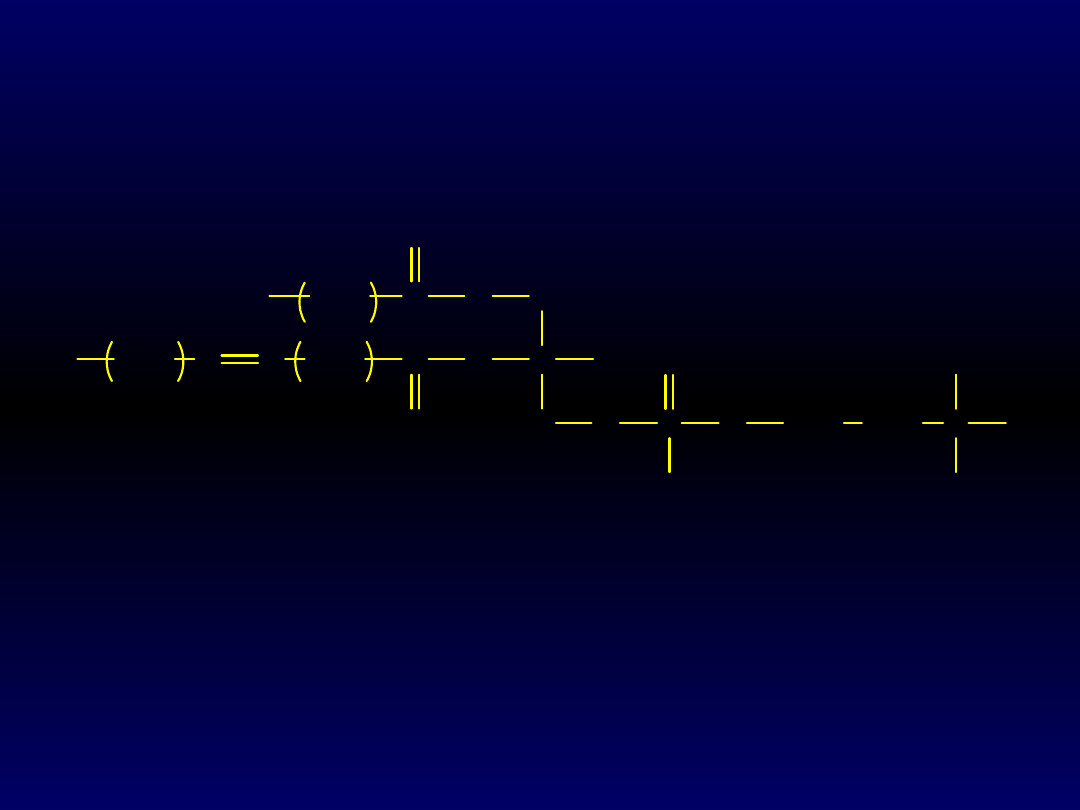
CH
3
CH
2
C
O
O
CH
2
C
H
O
H
2
C
C
O
H
2
C
CH
2
H
3
C
H
C
H
C
O
P
O
O-
O
CH
2
CH
2
N
CH
3
CH
3
CH
3
+
14
7
7
Wzór fosfatydylocholiny
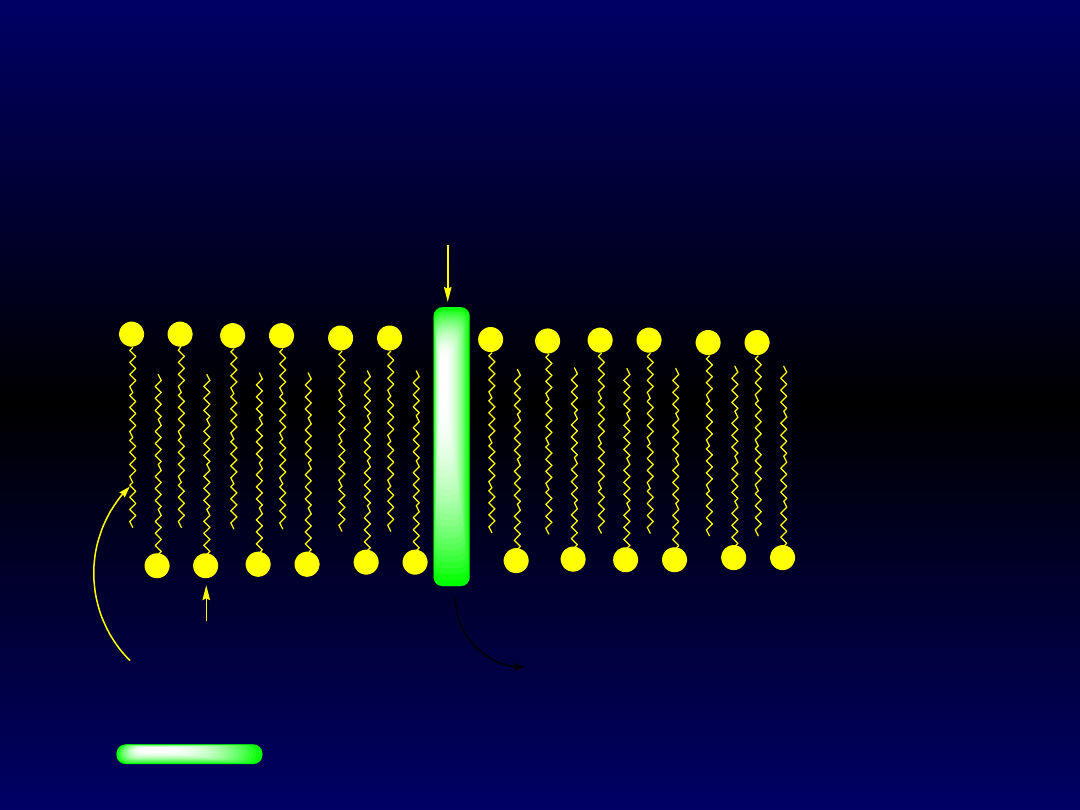
Błony mają charakter warstwy podwójnej, w której reszty
hydrofilowe zwrócone są na zewnątrz błony, a łańcuchy
węglowodorowe do środka. Tak skonstruowane błony są zdolne do
przepuszczania różnych substancji małocząsteczkowych i jonów
dzięki zawartych w nich białkach. Gramicydyna A jest białkiem, które
tworzy kanał do transportu jonów Na
+
.
hydrofilowy koniec fosfolipidu
hydrofobowy ³añcuch fosfolipidu
- dwie cz¹steczki grmicydyny A:
OHCHN-L-Val-Gly-L-Ala-D-Leu-L-Ala-D-Val-L-Val-D-Val-L-Trp-D-Leu-
L-Trp-D-Leu-L-Trp-D-Leu-LTrpCONH(CH
2
)
2
-OH
Na
+

2.4. Hemoglobina –
portret białka
allosterycznego
2. Białka - struktura i
funkcje
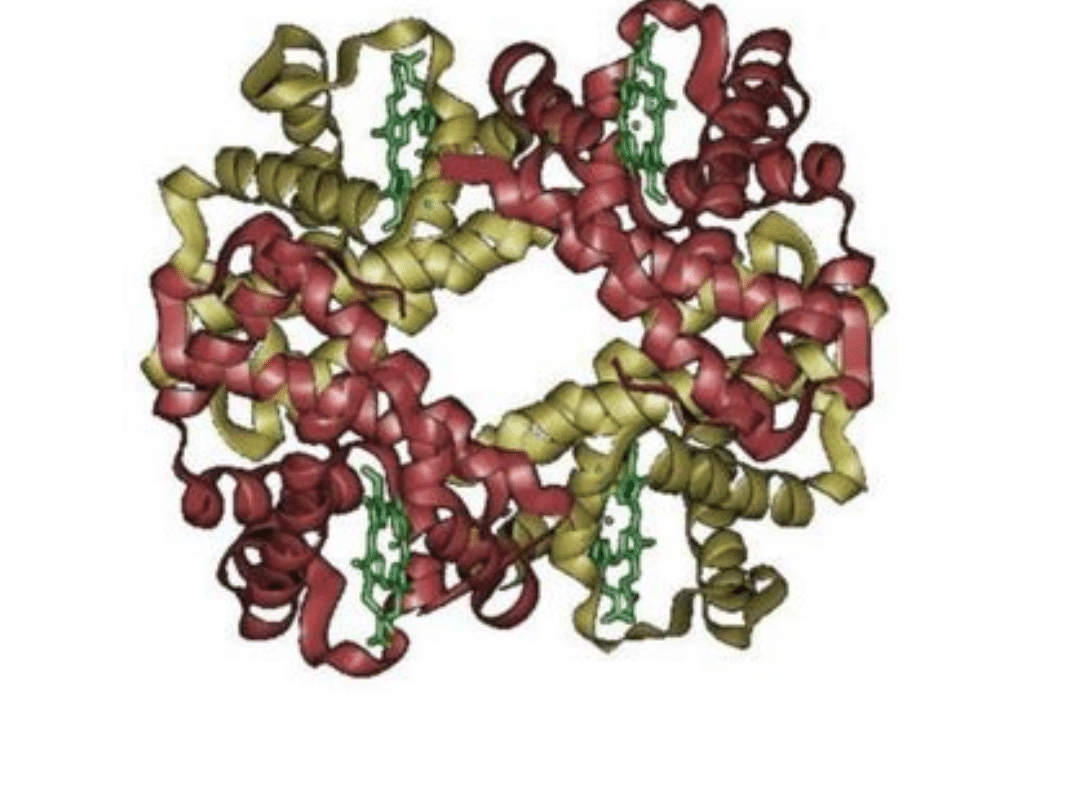
Struktura przestrzenna hemoglobiny. Dwie podjednostki alfa i
dwie podjednostki beta są zaznaczone różnymi kolorami.
Zielony jest hem.
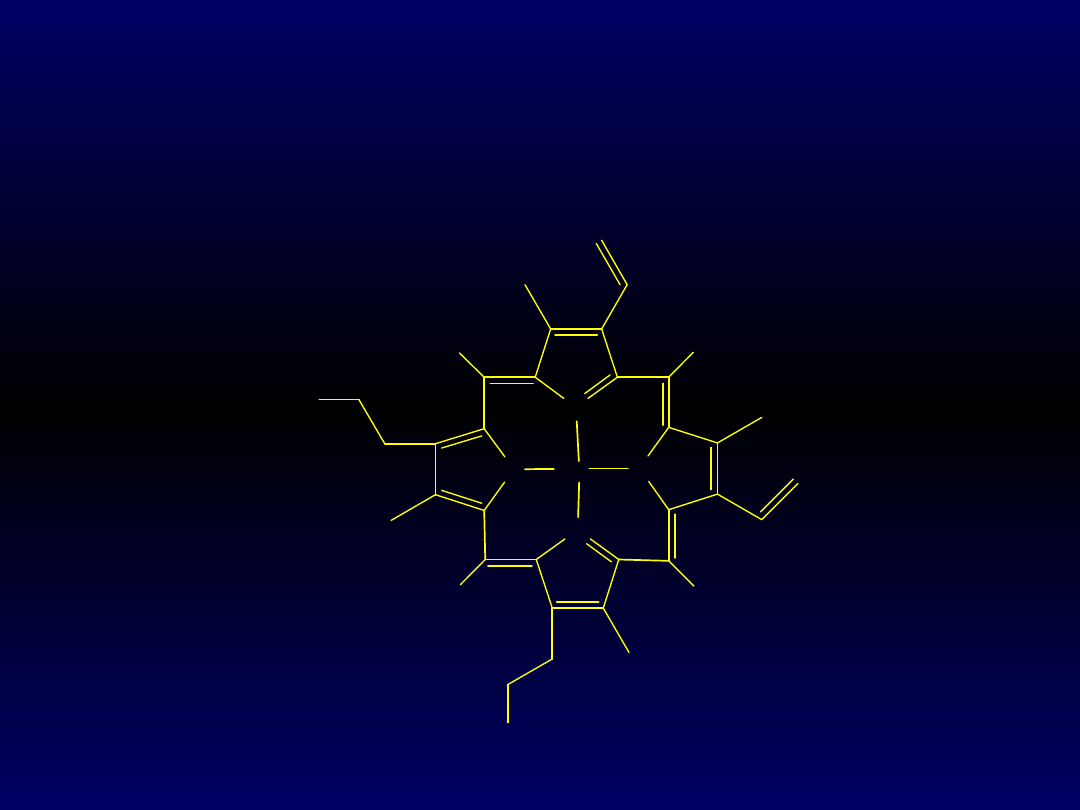
Cząsteczka tlenu jest wiązana przez jon żelaza(II),
który znajduje się w otoczeniu hemowym. Hem jest
tetrapirolowym układem makrocyklicznym, którego
cztery atomy azotu trwale wiążą jony metali
przejściowych; w hemie jest nim żelazo(II/III):
N
N
N
N
H
H
H
H
Fe
COOH
COOH

• Około 75% białkowej częśći hemoglobiny występuje w
postaci helisy a.
• Hemoglobina wiąże odwracalnie tlen.
• W cząsteczce hemoglobiny są cztery hemy w otoczeniu
dwóch podjednostek a i dwóch podjednostek b.
• Wiązanie tlenu wykazuje charakter kooperatywny, tzn
druga cząsteczka tlenu jest wiązania silniej niż pierwsza,
trzecia – silniej niż druga itd..
• Również uwolnienie cząsteczki tlenu od jednej
podjednostki ułatwia uwalnianie tlenu z pozostałych
podjednostek.
• Hemoglobina wiąże także CO
2
i H
+
. Podwyższenie
stężenia zarówno CO
2
jak i H
+
powoduje zmniejszenie
powinowactwa hemoglobiny do tlenu (efekt Bohra)
To ma istotne znaczenie, ponieważ w szybko
metabolizującej tkance, takiej jak czynny mięsień,
wytwarzane są znaczne ilości CO
2
i H
+
(w naczyniach
włosowatych). Te warunki powodują szybkie uwalnianie
tlenu z natlenionej hemoglobiny.
• 2,3-difosfoglicerynian (BPG) – jeden z produktów
glikolizy, silnie wiąże się do hemoglobiny i 26-krotnie
zmniejsza jej powinowactwo do tlenu. Utlenowana
hemoglobina nie wiąże BPG.

O
2
Hb + H
+
+ CO
2
Hb + O
2
O
2
C
H+
w pêcherzykach
p³ucnych
w czynnej metabolizuj¹cej
tkance (np. miêsniowej)
Efekt Bohra

Jednym z modeli opisujących kooperatywność
wiązania tlenu przez hemoglobinę jest model
Monoda, Wymana, Changeux.
Założenia:
(1) Białko może występować w jednej z dwu
konformacji: T lub R; wszystkie podjednostki
muszą być albo T albo R, nie ma form
mieszanych.
(2) Forma T ma małe powinowactwo do tlenu a
forma R – duże.
(3) Wiązanie każdej cząsteczki tlenu zwiększa
prawdopodobieństwo, że wszystkie
podjednostki danej cząsteczki hemoglobiny
wystąpią w formie R.
(4) Wiązanie pierwszej, drugiej, trzeciej i czwartej
cząsteczki O
2
powoduje wzrost stosunku [T]/[R]
od 9000 razy do, odpowiednio: 126, 1.76,
0.025, 0.00035.

Białko hemoglobinowe u
osobników chorych na
anemię sierpowatą jest
genetycznie zmienione;
miejsce kwasu
glutaminowego zastępuje
walina. To powoduje, że
podjednostki inaczej się
łączą, kształt krwinek z tą
hemoglobiną jest sierpowaty,
a powinowactwo do tlenu tej
zmienionej hemoglobiny jest
małe. Osoby te żyją krótko,
organizm jest słabo
natleniony. Organizmy
rzadko dożywają wieku 40
lat.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
03 Sejsmika04 plytkieid 4624 ppt
Choroby układu nerwowego ppt
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
10 dźwigniaid 10541 ppt
03 Odświeżanie pamięci DRAMid 4244 ppt
Prelekcja2 ppt
2008 XIIbid 26568 ppt
WYC4 PPT
rysunek rodziny ppt
1 GEN PSYCH MS 2014id 9257 ppt
więcej podobnych podstron