1
Alkacymetria
Jest
to
grupa
metod
analizy
objętościowej,
pozwalająca
na
określenie zawartości w próbce
kwasów lub zasad. Podstawą jest
reakcja zobojętniania.
*
Jeśli oznaczamy kwasy, titrantem
jest zasada.
*
Jeśli oznaczamy zasady, titrantem
jest kwas.
Titrant
powinien
być
mocnym
elektrolitem.
2
Pojęcia
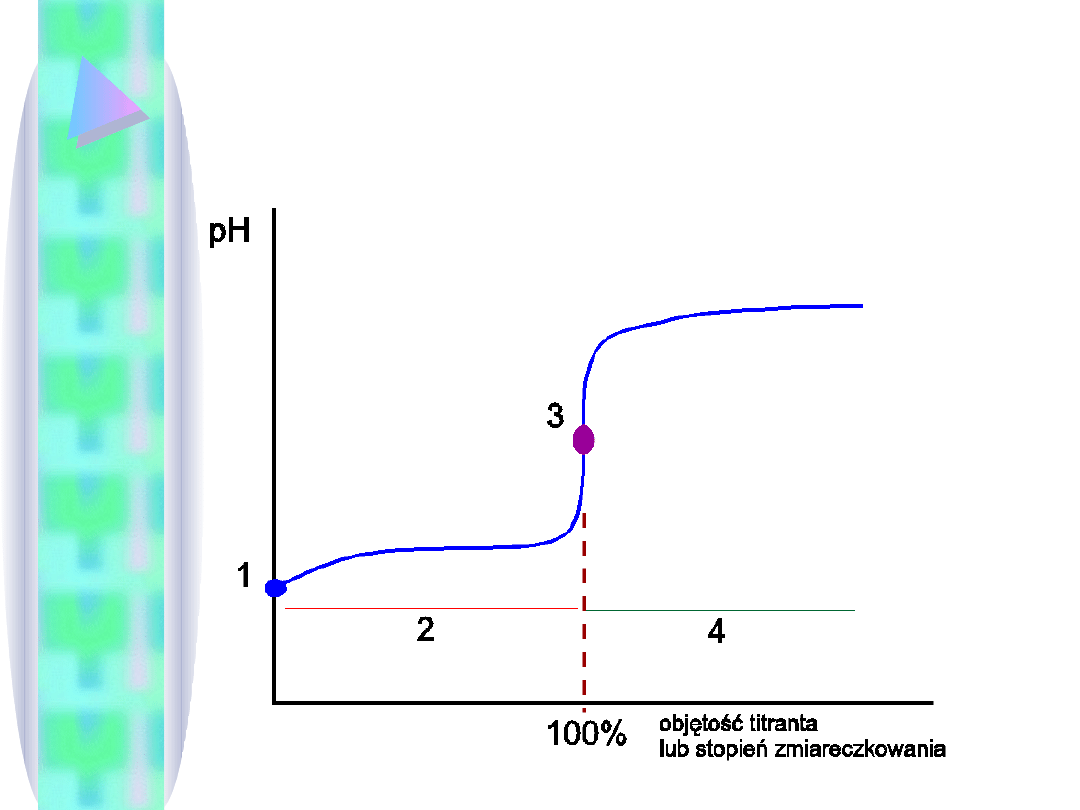
Krzywa miareczkowania :
wykres
pH=f(Vtitranta)
lub
pH=f(st.
zmiareczkowania)
Punkt równoważnikowy (stechiometryczny) :
punkt na krzywej miareczkowania odpowiadający
dodaniu do próbki równoważnej molowo ilości
titranta.
Punkt zobojętnienia :
Punkt na krzywej miareczkowania odpowiadający
zobojętnieniu próbki, tzn. wartości pH=7.
Punkt końcowy :
Punkt
na
krzywej
miareczkowania,
gdy
miareczkowanie uznajemy za zakończone.
3
Krzywe
miareczkowania
alkacymetrycznego
Obliczamy je w czterech etapach:
1.
Przed rozpoczęciem miareczkowania -
roztwór kwasu lub zasady o znanym
stężeniu i mocy.
2.
Bufor lub roztwór kwasu lub zasady o
znanym stężeniu i mocy.
3.
Punkt równoważnikowy (roztwór soli).
4.
Roztwór zasady lub kwasu o znanym
stężeniu i mocy.
4
Krzywa
miareczkowania
alkacymetrycznego
5
Oznaczenia
alkacymetryczne
Typowe oznaczenia alkacymetrycznymi to:
Oznaczenie kwasu solnego mianowaną zasadą (np.
sodową). Wskaźnik: fenoloftaleina (8.2-10.0), czerwień
metylowa (4.2-6.3) lub oranż metylowy (3.1-4.4).
Oznaczenie
mocnej
zasady
(np.
sodowej)
mianowanym roztworem HCl. Wskaźniki j.w.
Oznaczenie kwasu ortofosforowego mianowaną
zasadą. Wskażniki: zieleń bromokrezolowa (3.8-5.4) i
fenoloftaleina lub tymoloftaleina (9.3-10.5).
(W nawiasach podano zakres zmiany barwy
wskaźników).
6
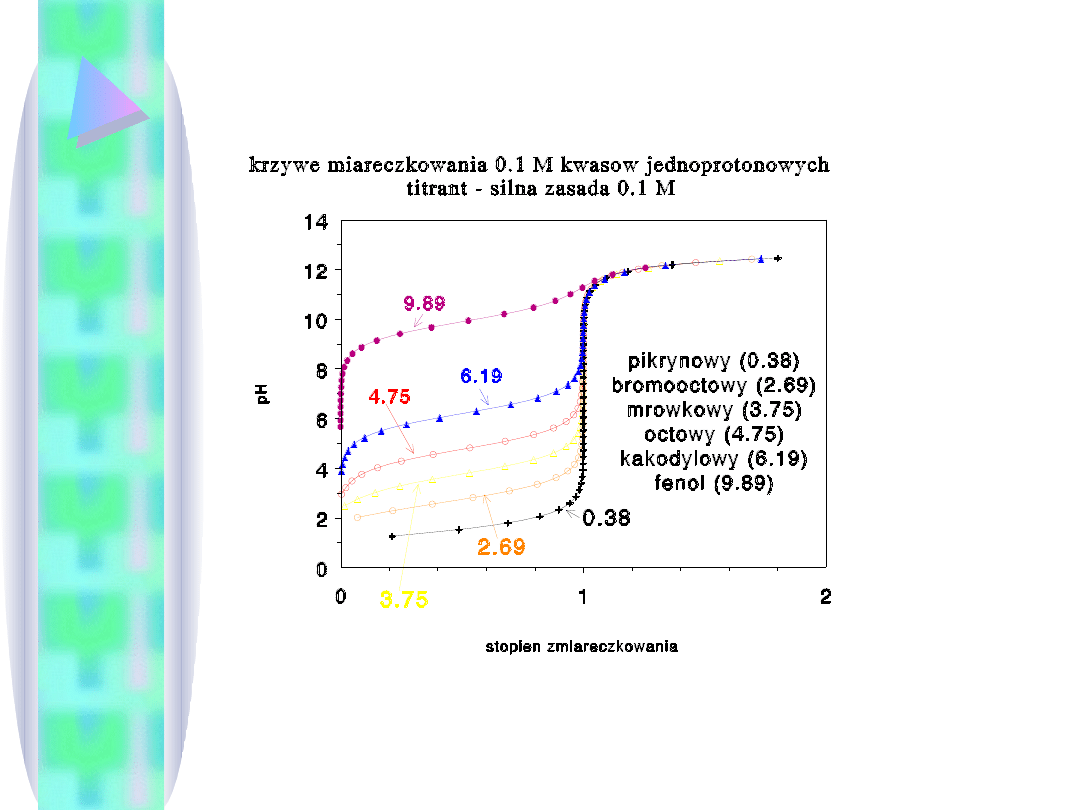
Jak widać, krzywa miareczkowania pozwala stwierdzić, czy
oznaczenie w ogóle jest możliwe (np. dla fenolu nie). W
nawiasach wartości pK
a
kwasów.
Typowe krzywe
miareczkowania
7
Typowe krzywe
miareczkowania
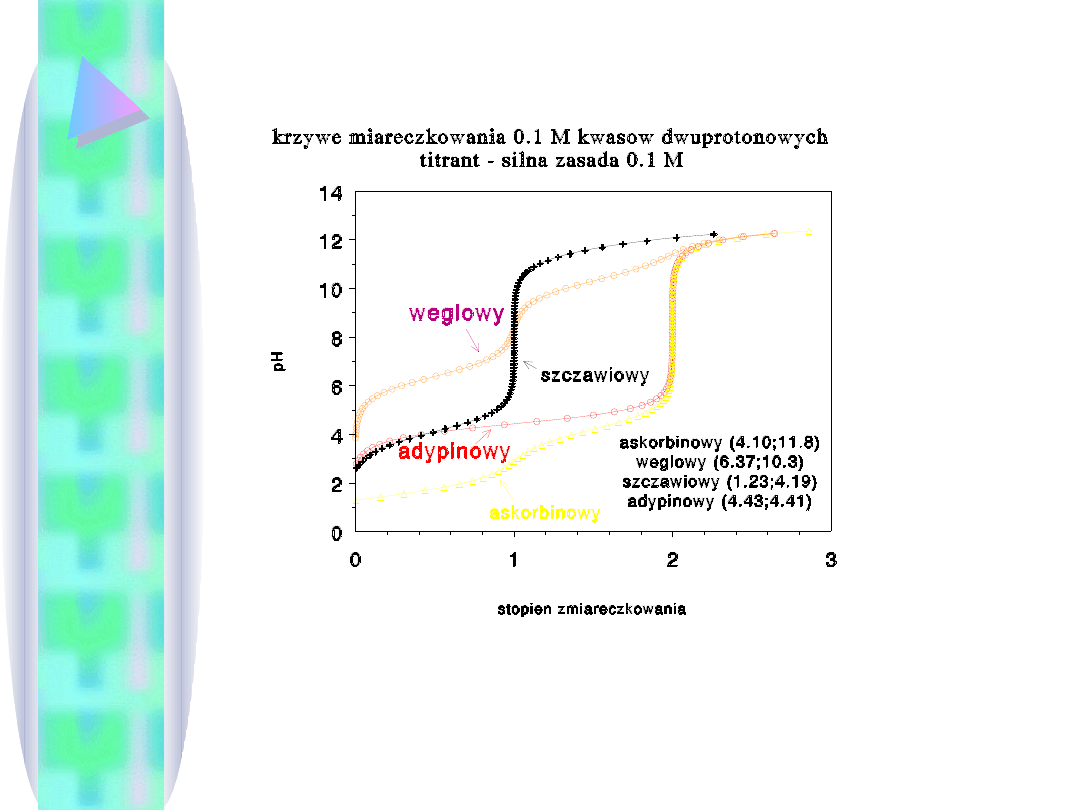
Krzywa miareczkowania pozwala też stwierdzić, który skok
miareczkowania może być zaobserwowany; np. dla H
2
CO
3
żaden,
dla (HCOOH)
2
pierwszy, zaś dla kwasu askorbinowego drugi.
8
Typowe krzywe
miareczkowania

9
Typowe krzywe
miareczkowania
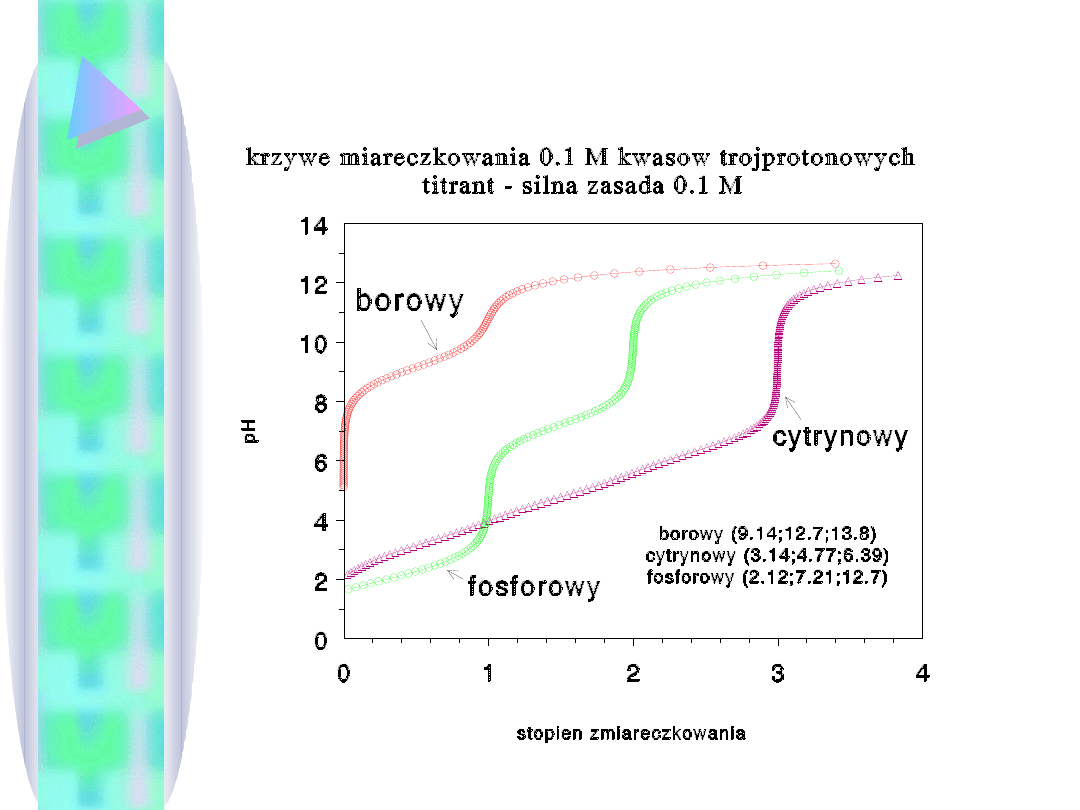
Dobór wskaźnika (wskaźników) - też jest łatwiejszy dzięki krzywej.
10
Skok miareczkowania
Jest to różnica pH w punktach
krzywej
miareczkowania
odpowiadających dodaniu 99.9 oraz
100.1% titranta względem punktu
równoważnikowego.
Skok zależy od mocy próbki i titranta
oraz od ich stężeń.
Document Outline
Wyszukiwarka
Podobne podstrony:
W19 kompleksonometria, wska«niki i krzywe miareczkowania kompleks i
W17 krzywe miareczkowania redox
W19 kompleksonometria, wska«niki i krzywe miareczkowania kompleks i
W17 krzywe miareczkowania redox
Miareczkowanie alkacymetryczne I, Egzamin zawodowy
ANALIZA MIARECZKOWA. ALKACYMERIA, Biochemia, Biochemia
Oznaczenie roztworu zasady metodą miareczkowania alkacymetrycznego, Studia, Semestr II, Chemia, Labo
Sprawozdanie- miareczkowanie alkacymetryczne, Chemia
Oznaczanie azotu amonowego metodą miareczkowania alkacymetrycznego po wstępnej?stylacji
Cw 20 Konduktometryczne miareczkowanie alkacymetryczne
Cw 20 Konduktometryczne miareczkowanie alkacymetryczne
wde w13
W13 Pomiary częstotliwości i czasu ppt
W13 ziemne odbiory i dokładność
MIARECZKOWANIE 4 id 298319 Nieznany
nw asd w13
ANALIZA MIARECZKOWA
więcej podobnych podstron