
1
Miareczkowania red-oks
Są to analizy wolumetryczne, które
wykorzystują reakcje redox (zmianę
stopnia utlenienia substancji).
Titrant jest zwykle utleniaczem, znacznie
rzadziej reduktorem. Rozpatrzymy:
Obliczenia równowag i krzywych
miareczkowania
Wskaźniki i popularne titranty
Metody przygotowania próbek

2
Wyznaczanie punktu
równoważnikowego
Podczas miareczkowania zachodzi
jednocześnie redukcja i utlenianie.
Punkt równoważnikowy wynika ze
stężeń i stopni utlenienia wszystkich
składników reakcji.
A
ox
+ B
red
A
red
+ B
ox
np.:
Ce
4+
+ Fe
2+
Ce
3+
+ Fe
3+

3
Wyznaczanie punktu
równoważnikowego
Dla miareczkowania redox punkt
równoważnikowy to taki, w którym
E
=E
.
Ponieważ wartości potencjałów E
zależą od stężeń, opieramy się na
równaniu Nernsta. Ogólnie (i niezbyt
ściśle) ma ono postać:
E E
n
A
A
ox
red
0
10
0059
.
log
[
]
[
]

4
Wyznaczanie punktu
równoważnikowego
W punkcie równoważnikowym
Skoro w tym punkcie [A
red
]
=[B
ox
] i [B
red
]
=[A
ox
], można powyższe równanie
zredukować do
Zakładamy, że nie ma w układzie innych równowag.
E
n
A
A
E
n
B
B
A
A
ox
red
B
B
ox
red
0
0
0059
0059
.
log
[
]
[
]
.
log
[
]
[
]
E
n E
n E
n
n
PR
A A
B B
A
B
0
0

5
Wyznaczanie punktu
równoważnikowego
Obliczenie E
PR
staje się trudniejsze w
układach bardziej złożonych.
Często trzeba uwzględniać bardziej
złożoną stechiometrię czy obecność
innych jonów, np. H
+
, jak w poniższej
reakcji:
6Fe
+2
+ Cr
2
O
72-
+ 14H
+
6Fe
3+
+ 2Cr
3+
+ 7H
2
O

6
Wyznaczanie punktu
równoważnikowego
Rozważywszy obie reakcje połówkowe
mamy:
V
77
.
0
E
;
]
Fe
[
]
Fe
[
log
2
059
.
0
E
E
0
Fe
/
Fe
2
3
0
Fe
/
Fe
.
rownowazn
2
3
2
3
;
]
H
[
]
Cr
[
]
O
Cr
[
log
6
059
.
0
E
E
14
2
3
2
7
2
0
Cr
2
/
O
Cr
.
rownowazn
3
2
7
2
V
33
.
1
E
0
Cr
2
/
O
Cr
3
2
7
2

7
Wyznaczanie punktu
równoważnikowego
Połączenie tych dwóch wyrażeń daje
[Fe
+2
] = 6
.
[Cr
2
O
72-
]
[Fe
3+
] = 3
.
[Cr
3+
]
7
6
0
0
2 7
2
3
14
3 2
2
E
E
E
CrO
Fe
H
Cr
Fe
rownowazn
Fe
Cr
.
log
[
][
][
]
[
] [
]

8
Wyznaczanie punktu
równoważnikowego
Wówczas:
E
równoważn.
= 1.25 V + 8.46
.
10
-3
log
Zatem dla tej reakcji potencjał w PR
zależy zarówno od [Cr
3+
] jak od pH.
[
]
[
]
H
Cr
14
3
2
E
E
E
H
Cr
rownowazn
Fe
Cr
.
.
log
[
]
[
]
0
0
14
3
6
7
0059
7
2

9
Wyznaczanie punktu
równoważnikowego
Wyjaśnia to, dlaczego zwykle obliczenia
prowadzi się dla 1 M kwasu w
roztworach rozcieńczonych. W tych
warunkach:
E
równoważn.
= 1.25 V + 8.46
.
10
-3
log
i potencjał równoważnikowy zależy
tylko (i to dość słabo) od [Cr
3+
].
1
2
14
3
[
]
Cr

10
Krzywe miareczkowania red-ox
W każdej krzywej miareczkowania
wyróżnia się cztery obszary:
początek - 0% zmiareczkowania
obszar niedomiareczkowania
punkt równoważnikowy
obszar przemiareczkowania
Rozważmy miareczkowanie Fe
2+
za
pomocą Ce
4+
.

11
Krzywe miareczkowania red-ox
0% zmiareczkowania
W odróżnieniu od analogicznego punktu na
krzywej miareczkowania
alkacymetrycznego niewiele można tu
policzyć.
Nie są obecne w układzie jony Ce
3+
i Ce
4+
,
zaś stężenie jonów Fe
3+
jest nieokreślone
(i bardzo małe, teoretycznie =0). Nie
można więc w ogóle obliczyć potencjału
redox tego układu.

12
Krzywe miareczkowania red-ox
Obszar niedomiareczkowania
Tutaj potencjał określa układ Fe
3+
/Fe
2+
.
Korzystamy z równania Nernsta:
Zakładamy, że nie ma w układzie jonów Ce
4+
.
Obliczenia upraszcza wprowadzenie stopnia
zmiareczkowania (np. w procentach).
E
Fe
Fe
0 771 0 059
3
2
.
.
log
[
]
[
]
E
Fe
Fe
0 771 0059
3
2
.
.
log
%
%

13
Krzywe miareczkowania red-ox
Punkt równoważnikowy
Potencjał obliczamy za pomocą
poprzednio wyprowadzonego
równania, tutaj:
E
rownowazn
.
.
.
.
170 0 771
2
124 V

14
Krzywe miareczkowania red-ox
Obszar przemiareczkowania
Całe żelazo zostało utlenione; w układzie
znajdują się jony Ce
4+
i Ce
3+
. Stosunek
ich stężeń określa potencjał:
np. dla 110% zmiareczkowania otrzymamy
E=1.341 V, zaś dla 120%: E=1.359 V.
E E
Ce
Ce
Ce
0
4
3
0 059
140 0 059
100
100
.
log
[
]
[
]
.
.
log
%
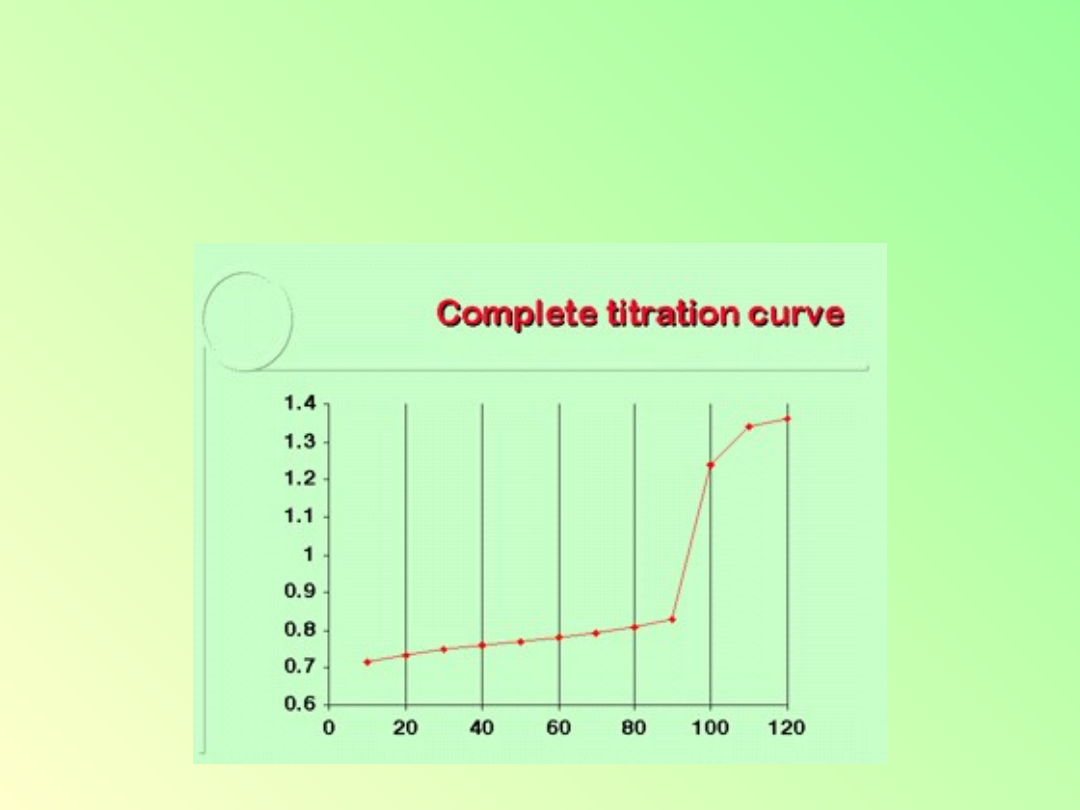
15
Krzywe miareczkowania red-ox
Otrzymana krzywa miareczkowania:

16
Wskaźniki red-ox
Dzielimy je na:
klasyczne wskaźniki redox
(zmieniają barwę w zależności od
potencjału układu)
wskaźniki specyficzne
(reagują ze
składnikami reakcji redox)

17
Wskaźniki red-ox
Klasyczne wskaźniki redox
Ich formy utleniona i zredukowana
różnią się barwą.
Ind
ox
+ ne
-
Ind
red
E E
n
Ind
Ind
Ind
ox
red
0
0 059
.
log
[
]
[
]

18
Wskaźniki red-ox
Klasyczne wskaźniki redox
Przyjęto, że aby zauważyć zmianę
barwy musi nastąpić 10% konwersja
jednej formy w drugą.
Zatem zakres zmiany barwy to
E=+0.059/n
[
]
[
]
Ind
Ind
ox
red
1
10
lub 10
19
Wskaźniki red-ox
Klasyczne wskaźniki redox
1,10-fenantrolina (sól żelazowa)
Zmiana barwy z
bladoniebieskiej
do
czerwonej
20
Wskaźniki red-ox
Klasyczne wskaźniki redox
Kwas dwufenyloaminosulfonowy
21
Wskaźniki red-ox
Specyficzne wskaźniki redox
Nadmanganian:
Jest silnym utleniaczem. Jego własna barwa
(
fioletowa
) jest wystarczająca, a więc sam
titrant jest wskaźnikiem.
Oranż metylowy:
W miareczkowaniach bromianometrycznych, po
punkcie równoważnikowym, zaczyna wydzielać
się brom (w reakcji bromków z bromianami).
Brom nieodwracalnie odbarwia wskaźnik, co
jest sygnałem końca miareczkowania.

22
Wskaźniki red-ox
Specyficzne wskaźniki redox
Skrobia:
skrobia + =
ciemnoniebieski kompleks
Jest to wskaźnik szybki, tani i łatwy w
detekcji. Dlatego też jod jest chętnie
używanym titrantem, choć jest raczej
słabym utleniaczem.
Niekiedy stosuje się też indykator w postaci
kompleksu jodu ze skrobią (w miareczkowaniach
pośrednich). Robimy tak, gdy titrant jest
utleniaczem.
I
3

23
Przygotowanie próbek w
oznaczeniach red-ox
Próbka zawiera zwykle składnik oznaczany na
różnych stopniach utlenienia, a więc trzeba
go najpierw przeprowadzić w jeden z nich.
Przykład: żelazo w próbce występuje jako Fe
2+
i Fe
3+
.
Redukujemy je do Fe
2+
za pomocą kolumny
redukcyjnej (reduktorem jest np. amalgamat
Zn:Hg - reduktor Jonesa lub metaliczne
srebro w środowisku HCl - reduktor
Waldena), albo chlorkiem cynawym SnCl
2
. W
tym ostatnim wypadku nadmiar cyny(II)
usuwamy utleniając chlorkiem rtęci(II).

24
Przygotowanie próbek w
oznaczeniach red-ox
Jeżeli jednak należałoby próbkę utlenić,
nie można zastosować kolumny (nie
ma
materiału
do
wypełnienia).
Utlenianie w roztworze wiąże się z
problemem
usunięcia
nadmiaru
utleniacza.
Przygotowanie próbki do
miareczkowania jest niekiedy bardziej
skomplikowane niż samo oznaczenie.

25
Przygotowanie próbek w
oznaczeniach red-ox
Utleniacze:
bizmutan sodowy NaBiO
3
: bardzo silny, może utlenić
nawet Mn
2+
do MnO
4-
. Jest dość słabo rozpuszczalny
w wodzie, więc jego nadmiar można odsączyć. Zwykle
sporządza się zawiesinę bizmutanu z próbką, gotuje ją
i odsącza.
Nadsiarczan amonu (NH
4
)
2
S
2
O
8
: w środowisku kwaśnym
utlenia Cr
3+
do Cr
2
O
72-
; Mn
2+
do MnO
4-
; Ce
3+
do Ce
4+
.
Nadmiar usuwamy dodając Ag
+
i gotując:
2S
2
O
82-
+ 2H
2
O 4SO
42-
+ O
2
+ 4H
+
Nadtlenek wodoru H
2
O
2
: nie jest tak silnym utleniaczem
jak poprzednie. Stosujemy go w środowisku kwaśnym:
H
2
O
2
+ 2H
+
+ 2e
-
2H
2
O
Nadmiar usuwamy przez gotowanie.

26
Najpopularniejsze titranty red-ox
UTLENIAJĄCE:
Dwuchromian Cr
2
O
72-
: sól potasowa jest
substancją podstawową. Wymaga wskaźnika
red-ox, np. kwasu dwufenylosulfonowego.
Roztwór bardzo trwały. E
o
=+1.44 V
Nadmanganian MnO
4-
: roztwory muszą być
mianowane (zwykle na Na
2
C
2
O
4
). Powoli
redukuje się do MnO
2
, który należy
odsączać. Nie wymaga wskaźnika.
Inne
: jod I
2
(w KI), cer Ce
4+
, bromian BrO
3-
i
inne.

27
Najpopularniejsze titranty red-ox
REDUKUJĄCE:
Fe
2+
: stosowany w postaci Fe(NH
4
)
2
(SO
4
)
2.
6H2O
w 1.0 N H
2
SO
4
. Roztwór jest nietrwały i trzeba go
mianować codziennie.
Jodki I
-
: w metodach pośrednich. Dodaje się
nadmiaru
jodku
i
skrobi
jako
wskaźnika.
Wydzielony jod:
2I
-
I
2
+ 2e
-
oznaczamy mianowanym roztworem tiosiarczanu
S
2
O
32-
Tiosiarczanu najczęściej nie można użyć wprost jako
redukującego titranta, bowiem tylko w reakcji z
jodem utlenia się do dwutionianu S
4
O
62-
ilościowo.

28
Oznaczenie Fishera
Specjalnym przypadkiem miareczkowania red-ox jest
metoda oznaczania wody
Karla Fishera
. Tzw. odczynnik
Karla Fishera to mieszanina jodu, dwutlenku siarki,
pirydyny i metanolu.
C
5
H
5
N
.
I
2
+C
5
H
5
N
.
SO
2
+C
5
H
5
N
.
HI+H
2
O
2C
5
H
5
N
.
HI+C
5
H
5
N
.
SO
3
Metanol usuwa powstający kompleks C
5
H
5
N
.
SO
3
:
C
5
H
5
N
.
SO
3
+ CH
3
OH C
5
H
5
N(H)SO
4
CH
3
Jest to konieczne, bo kompleks C
5
H
5
N
.
SO
3
chętnie reaguje z
wodą i innymi substancjami.
Odczynnik Fishera jest trwały. Metodę stosuje się zwykle w
specjalnych automatycznych analizatorach. Koniec
miareczkowania: intensywna barwa kompleksu jodu.

29
Źródła:
podręczniki,
http://odin.chemistry.uakron.edu/analytical/redox/
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
W19 kompleksonometria, wska«niki i krzywe miareczkowania kompleks i
w13 alkacymetria, krzywe miareczkowania alkac
W19 kompleksonometria, wska«niki i krzywe miareczkowania kompleks i
w14 redox, Nernst
MIARECZKOWANIE 4 id 298319 Nieznany
ANALIZA MIARECZKOWA
Instrukcja 7b Krzywe funkcyjne
sprawozdanie z miareczkowania, UP Wrocław, IŚ I SEM, Chemia
Krzywe zwierciadło
Analiza Instrumentalna Miareczkowanie spektrofotometryczne Sprawozdanie 3 x
1ćw współ filtracji na podst krzywej uziarnienia (materiały)
Krzywe Mandelbrota
3 Redox instr
5 Krzywe 2 ego stopnia
KrzyweBeziera
1. Edukacja polonistyczna w przedszkolu w17.01.2010r[1], III rok
miareczkownie, NAUKA, chemia, lab
więcej podobnych podstron