
Układy wieloskładnikowe jedno i
wielofazowe
Roztwory gazowe (gaz w gazie):
ciśnienie cząstkowe,
wyrażanie składu,
prawo Daltona
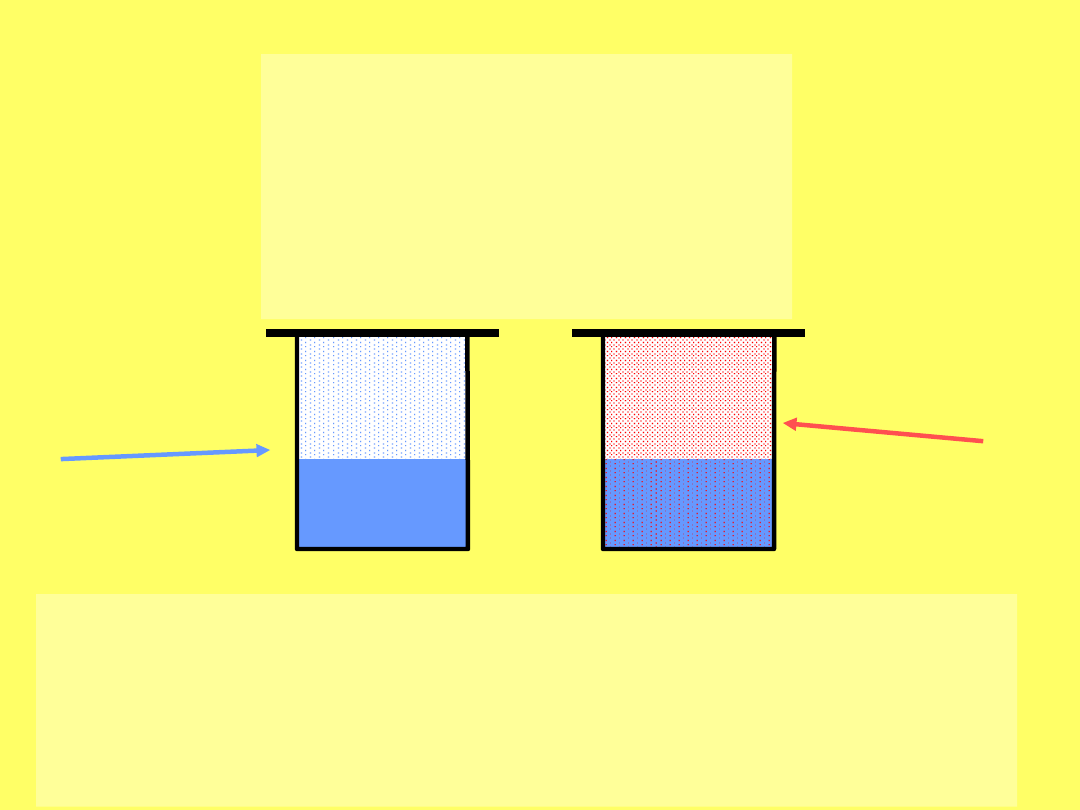
Roztwory gazów w
cieczach
Prawo Henry’ego:
m = k * p
W stałej temperaturze masa (m) gazu
rozpuszczonego w danej objętości cieczy jest
wprost proporcjonalna do jego ciśnienia p
nad roztworem.
Układ
jednoskła
d-nikowy
Układ
dwuskład
ni-kowy

Dla roztworów rozcieńczonych:
X = k’ * p
H – stała Henry’ego
H
p
X
i
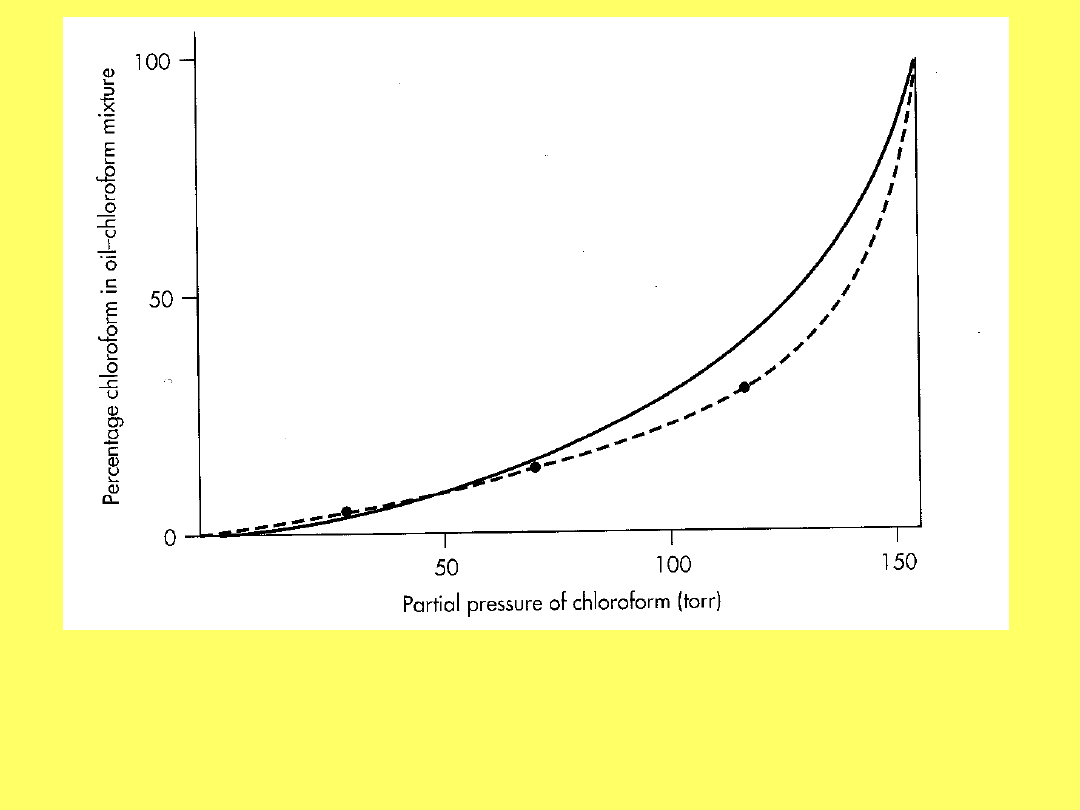
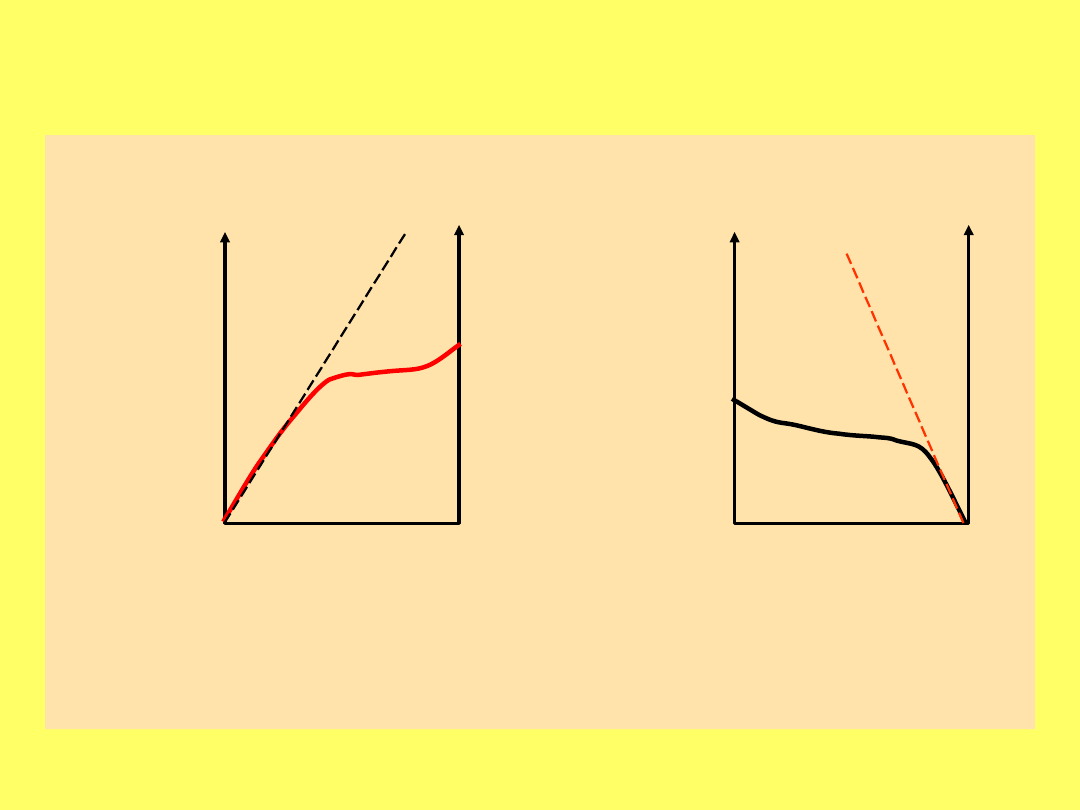
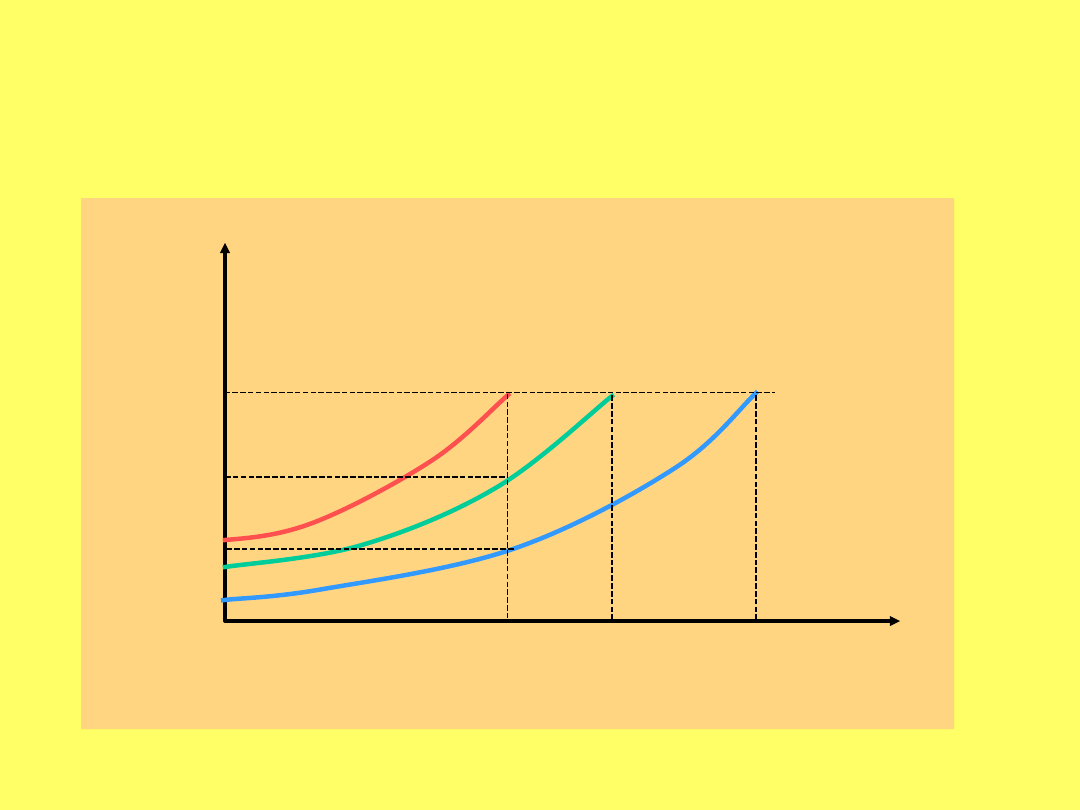
Krzywa kreskowana prezentuje doświadczalnie
wyznaczoną zależność stężenia procentowego
chloroformu w oleju
w zależności od ciśnienia cząstkowego
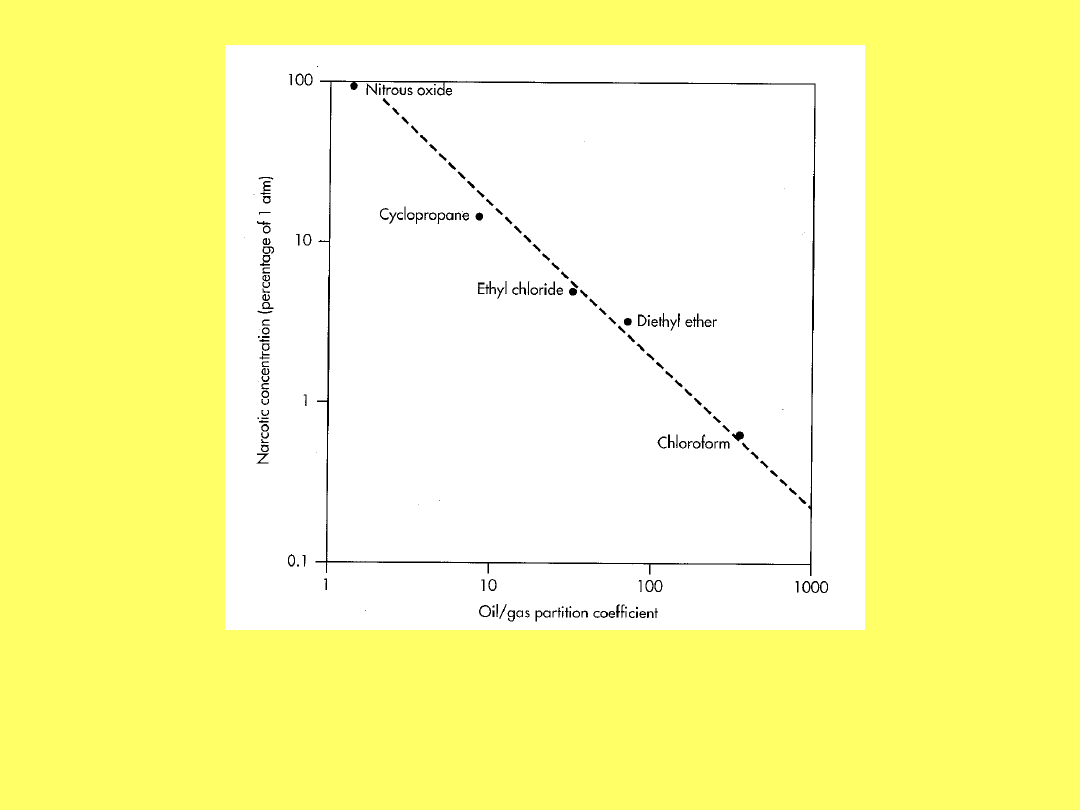
Zależność wartości narkotycznego stężenia
anestetyku od jego rozpuszczalności w alkoholu
olejowym (wyrażonej jako współczynnik podziału
olej/gaz)
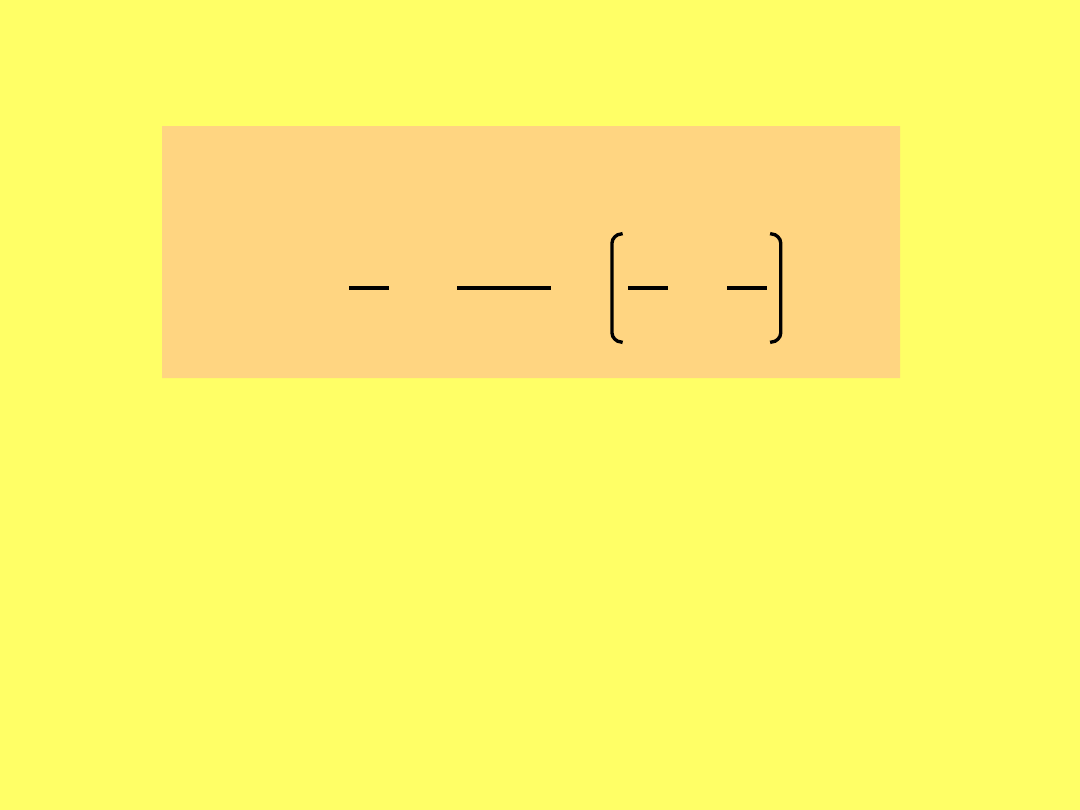
ln =
-
X
1
- H
o
rozp
1
1
X
2
R
T
1
T
2
Wpływ
temperatury:
X
CS2
0
1,0 X
ACETON
1
0
p
X
CS2
0
1,0 X
Aceton
1
0
T =
const
Roztwory idealne rozcieńczone
p
T =
const
Roztwory cieczy w cieczach
Roztwory cieczy mieszających się
nieograniczenie
Układ złożony z roztworu dwóch cieczy i pary
znajdującej się w równowadze nad tym
roztworem ma dwa stopnie swobody:
s = 2 – 2 + 2
= 2
Prężność pary nad układem dwóch cieczy
mieszających się nieograniczenie:
p
= p
A
+ p
B
Układ
dwuskład
ni-kowy
A
+B

A
p
o
A
p
o
B
B
Układ
jednoskła
dni-kowy
(A)
Układ
jednoskła
dni-kowy
(B)
Układ
dwuskład
ni-kowy
A
+ B
p
A
= p
o
A
*
X
A
p
B
= p
o
B
*
X
B
Prawo
Raoulta:

RAOULT Francois-Marie
Ur. 10.05.1830.
Zmarł 01.04.1901
X
BENZEN
0 0,5
1,0
X
TOLUEN
1 0,5
0
p T = const
p
o
BENZEN
Prężność pary nad roztworem
dwuskładnikowym (benzen + toluen)
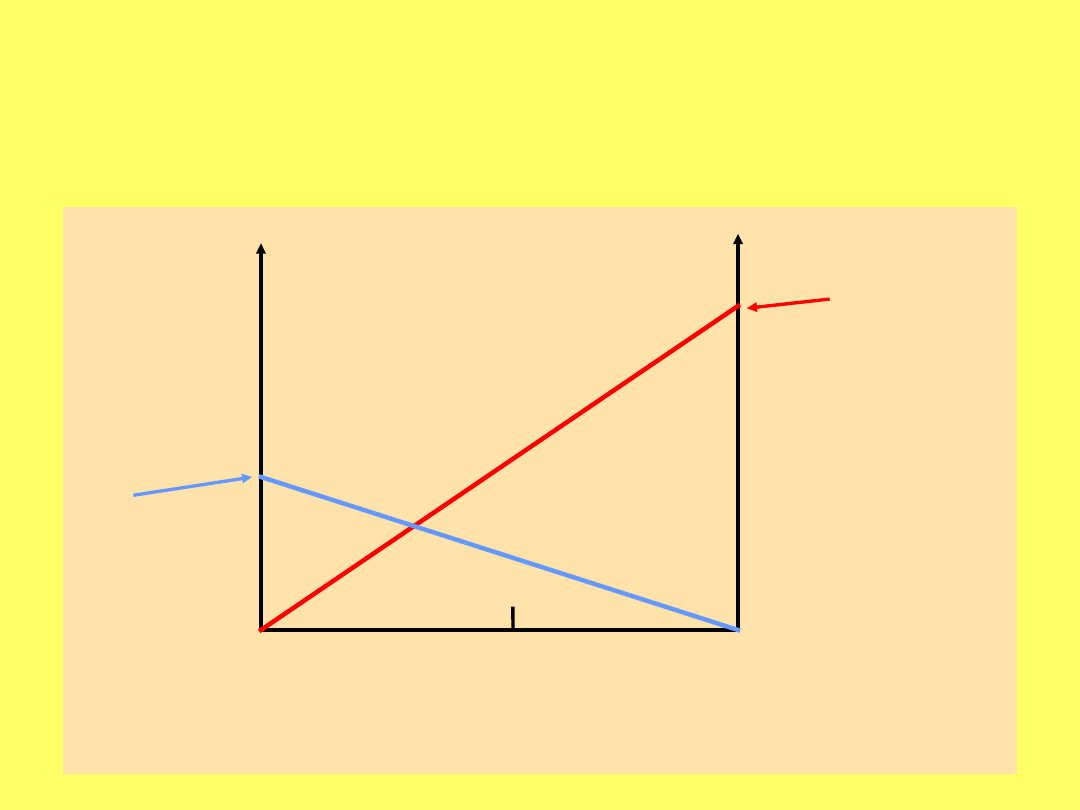
X
BENZEN
0 0,5
1,0
X
TOLUEN
1 0,5
0
p T = const
p
o
BENZEN
Prężność pary nad roztworem
dwuskładnikowym (benzen + toluen)
p
o
TOLUEN
X
BENZEN
0 0,5
1,0
X
TOLUEN
1 0,5
0
p T = const
p
o
BENZEN
Prężność pary nad roztworem
dwuskładnikowym (benzen + toluen)
p
o
TOLUEN
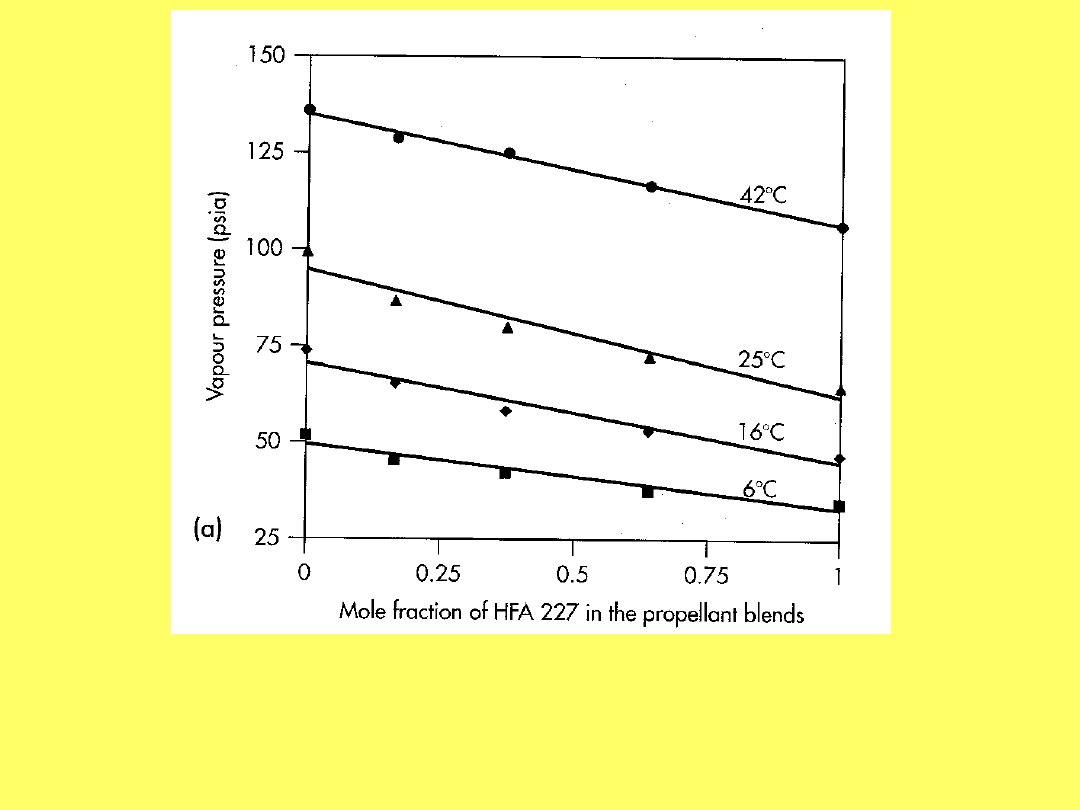
Zależność ciśnienia mieszaniny HFA 134a i HFA 227
od ułamka molowego jednego ze składników w
roztworze w różnych temperaturach
X
A
0
1,0 X
B
1
0
p T =
const
X
A
0
1,0 X
B
1
0
p T =
const
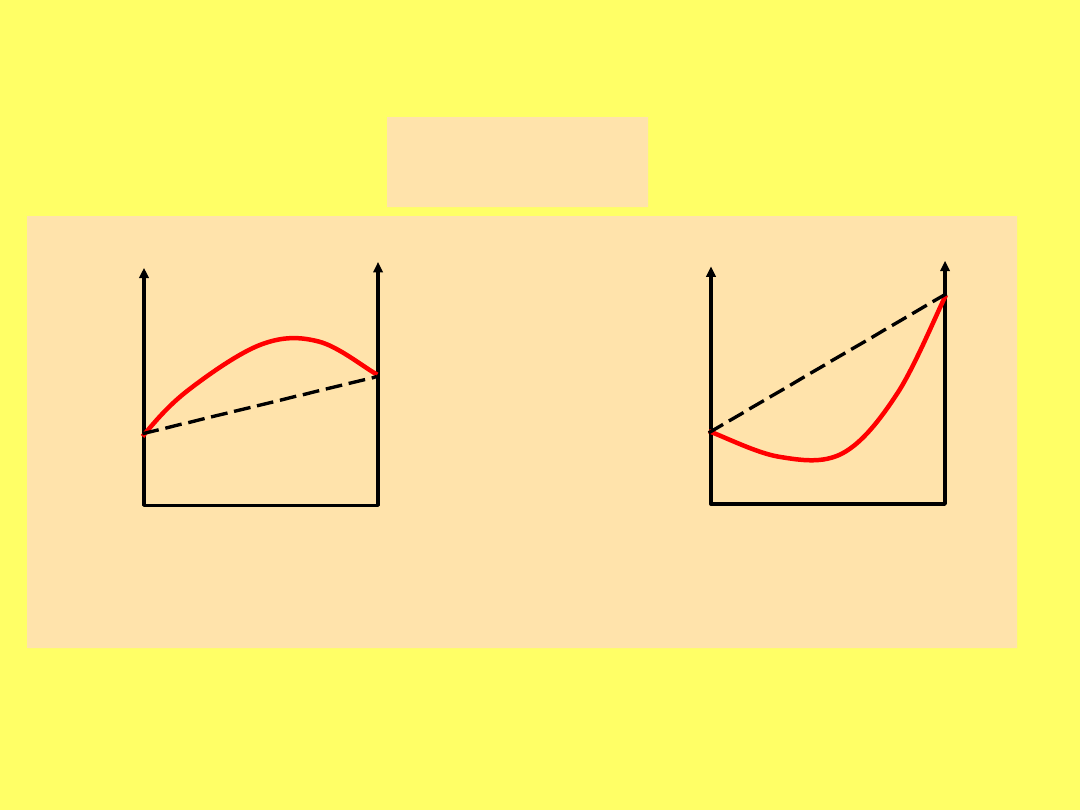
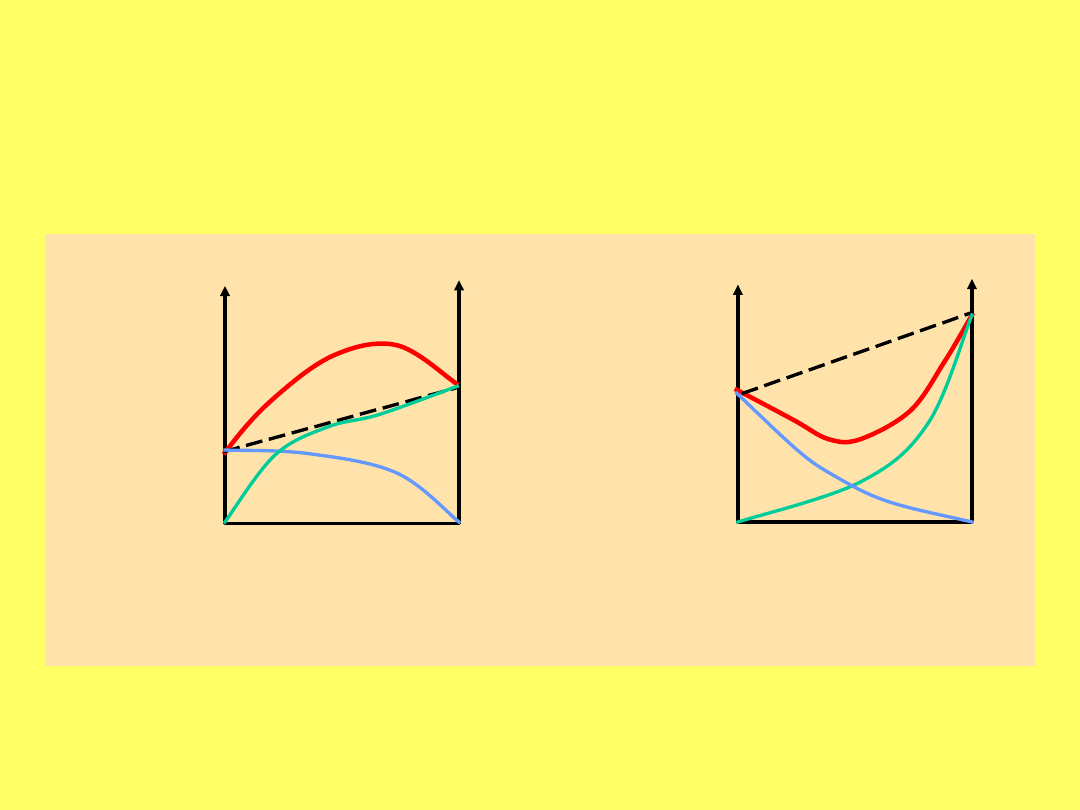
Roztwory wykazujące odchylenia od
prawa Raoulta:
ZEOTROP
Y
X
A
0
1,0 X
B
1
0
p T =
const
X
A
0
1,0 X
B
1
0
p T =
const
Roztwory wykazujące odchylenia od
prawa Raoulta:
AZEOTROPY
X
CS2
0
1,0 X
ACETON
1
0
p T =
const
X
ACETON
0
1,0 X
CHLOROFORM
1
0
p T =
const
Przykłady układów wykazujących
odchylenia od prawa Raoulta:
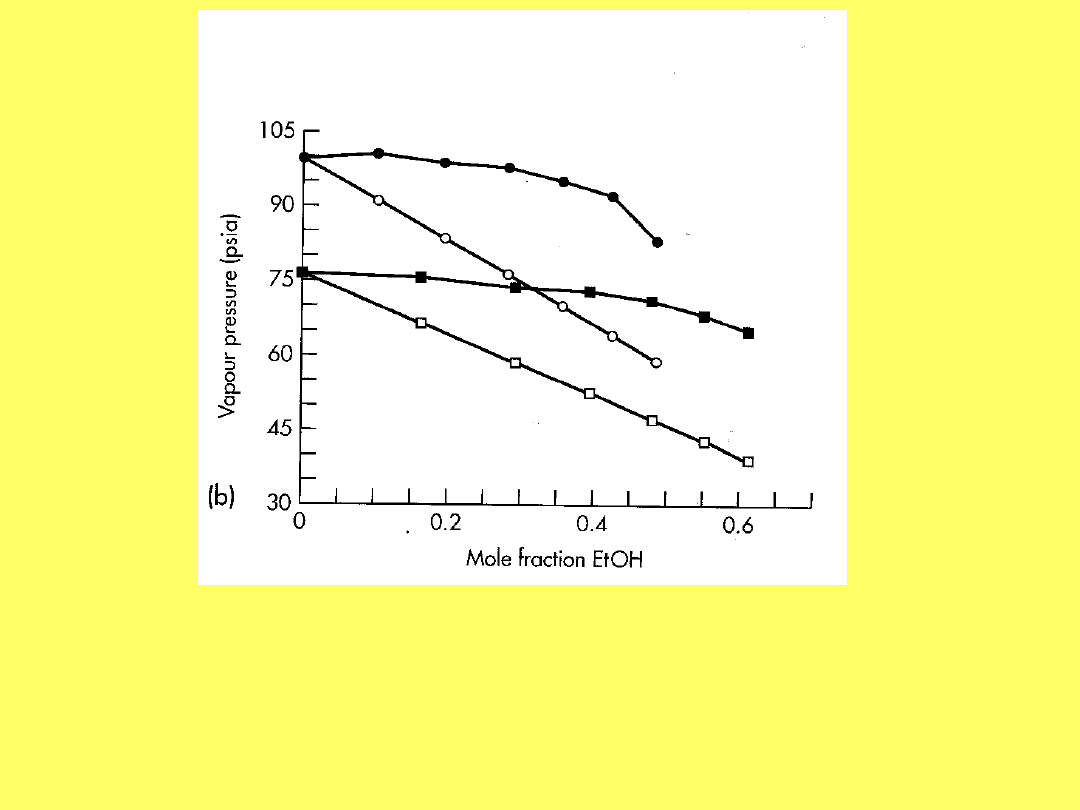
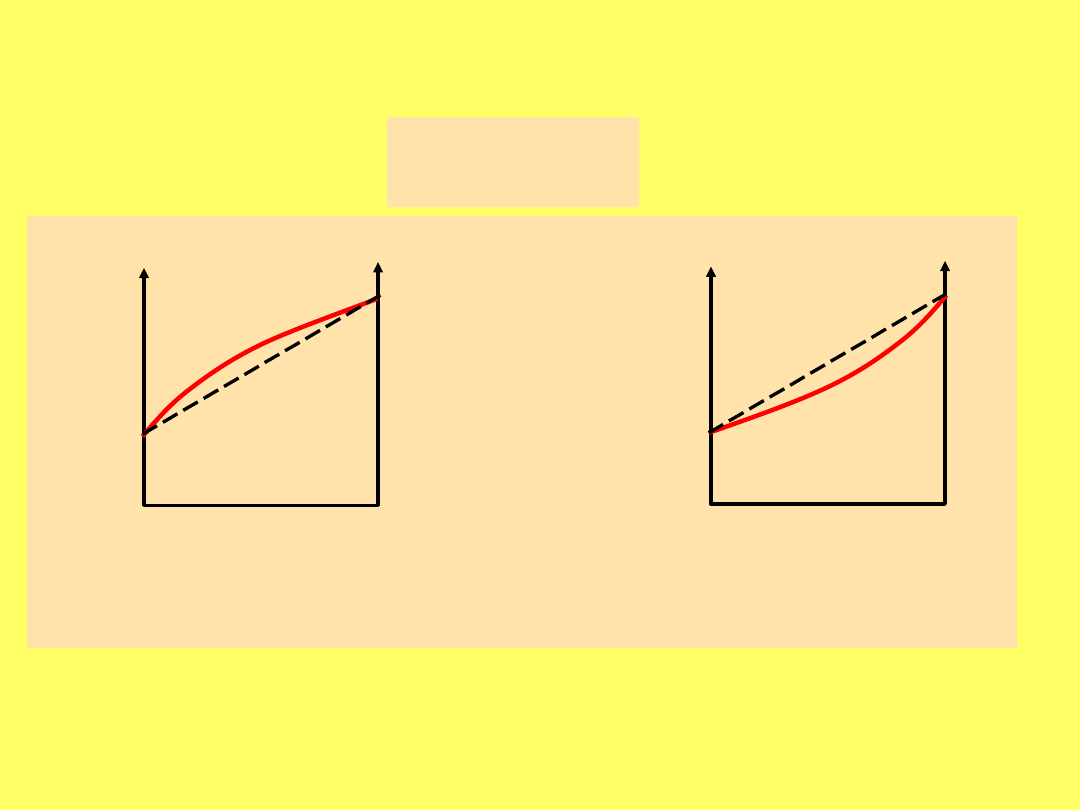
Zależność ciśnienia pary HFA 134a (koła) i HFA 227
(kwadraty) w funkcji ułamka molowego etanolu, temp.
21,5
o
C. Nie wypełnione punkty reprezentują układy
idealne
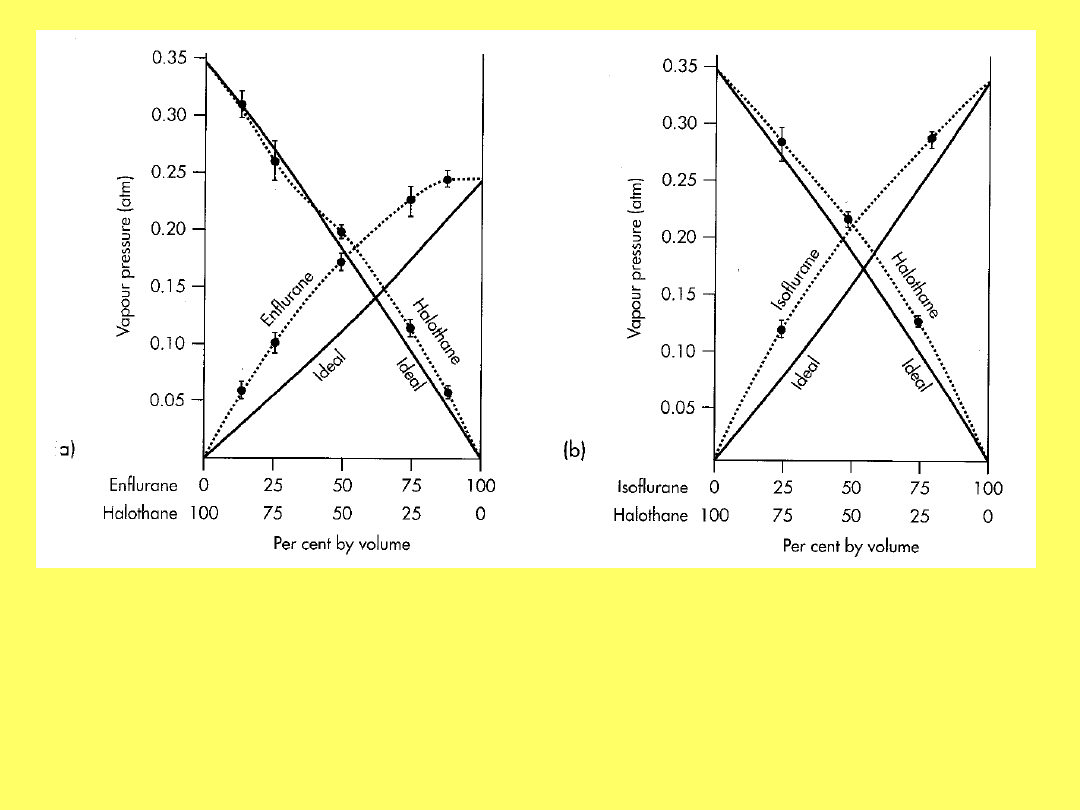
Eksperymentalne (linia kropkowana) i obliczone na
podst. pr. Raoulta (linia ciągła) zależności prężności
pary wybranych anestetyków od ich stężenia
procentowego (v/v).

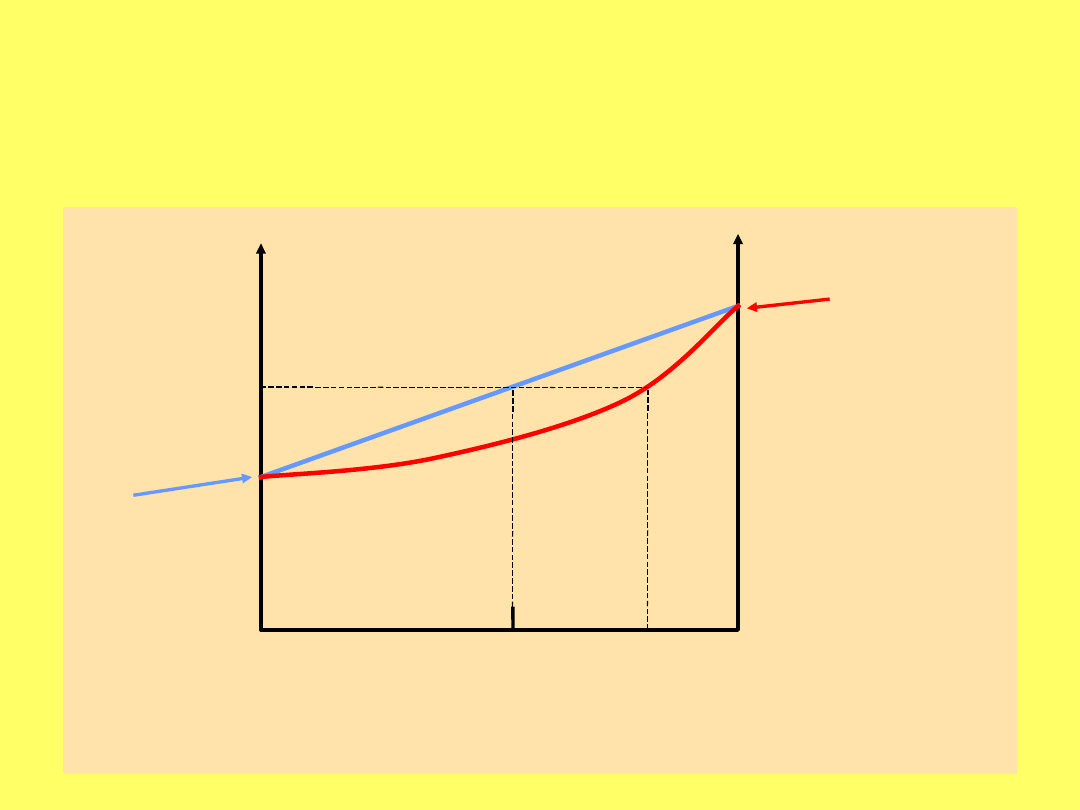
Skład pary nad roztworem dwóch cieczy
mieszających się nieograniczenie
p
A
= X’
A
* p, X’
A
-
ułamek molowy składnika A w
fazie pary
p
B
= X’
B
* p, X’
B
-
ułamek molowy składnika B w
fazie pary
X’
A
* p = X
A
* p
o
A
X’
B
* p = X
B
* p
o
B
Po podzieleniu stronami:
X’
A
/ X’
B
= X
A
* p
o
A
/ X
B
*
p
o
B
lub (
X’
A
* X
B
)
/ (X’
B
*
X
A
) = * p
o
A
/
* p
o
B
To oznacza, że zawartość składnika bardziej
lotnego jest większa w fazie pary niż w fazie
cieczy
X
BENZEN
0 0,5
1,0
X
TOLUEN
1 0,5
0
p T = const
p
o
BENZEN
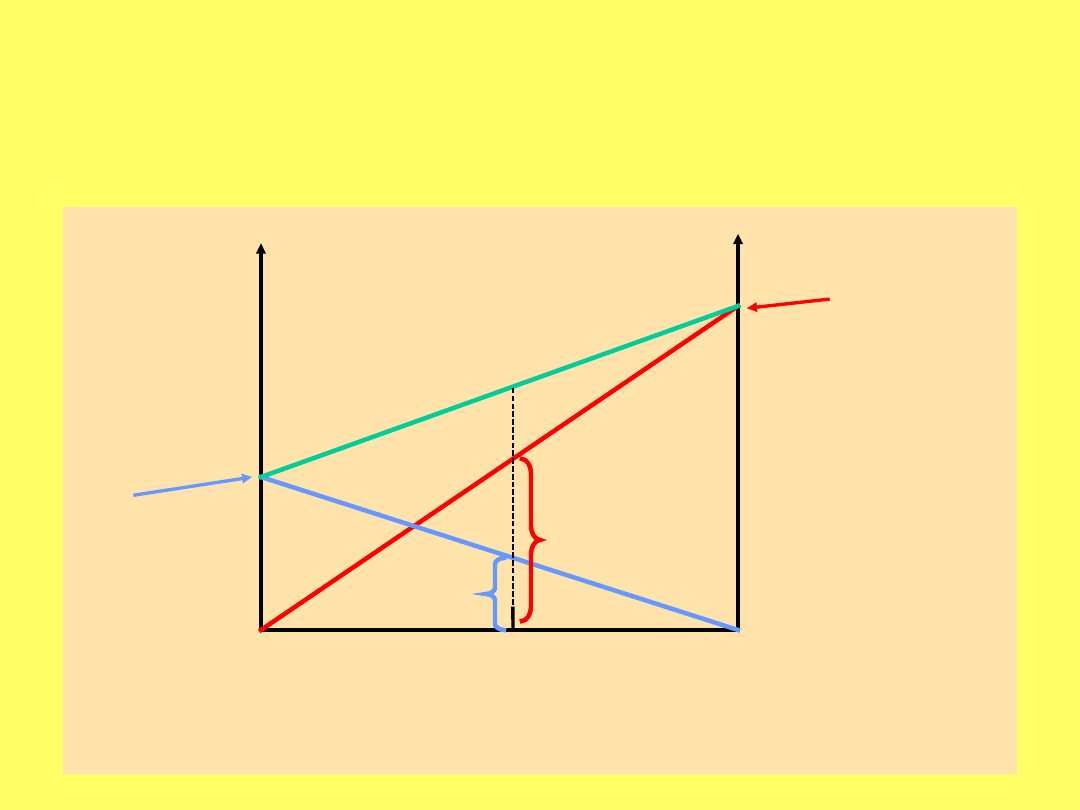
Zależność prężności pary od składu cieczy
(
ciecz
) i od składu pary (
para
)
p
o
TOLUEN
par
a
ciec
z
X
BENZEN
0 0,5
1,0
X
TOLUEN
1 0,5
0
T p =
const
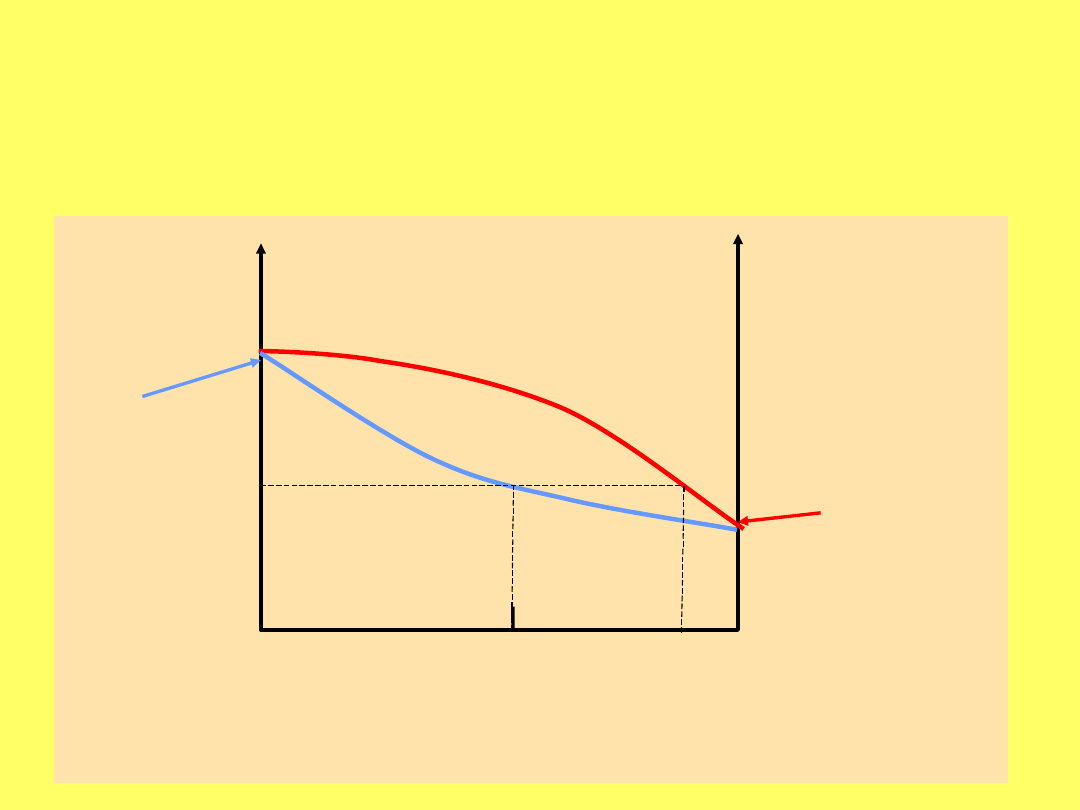
Zależność temperatury wrzenia od składu
cieczy (
ciecz
) i od składu pary (
para
)
T
TOLUEN
para
ciecz
T
BENZE
N
X
CS2
0
1,0 X
ACETON
1
AZ
0
p
X
CS2
0
1,0 X
Aceton
1
AZ
0
T =
const
p
T =
const
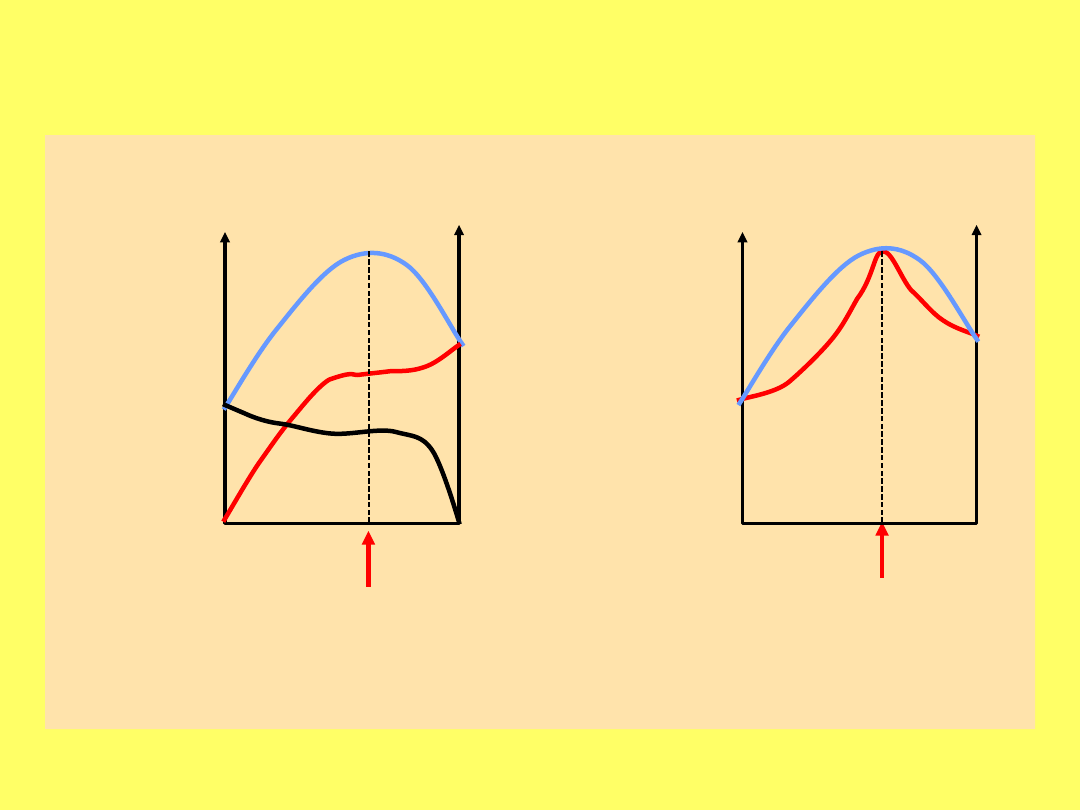
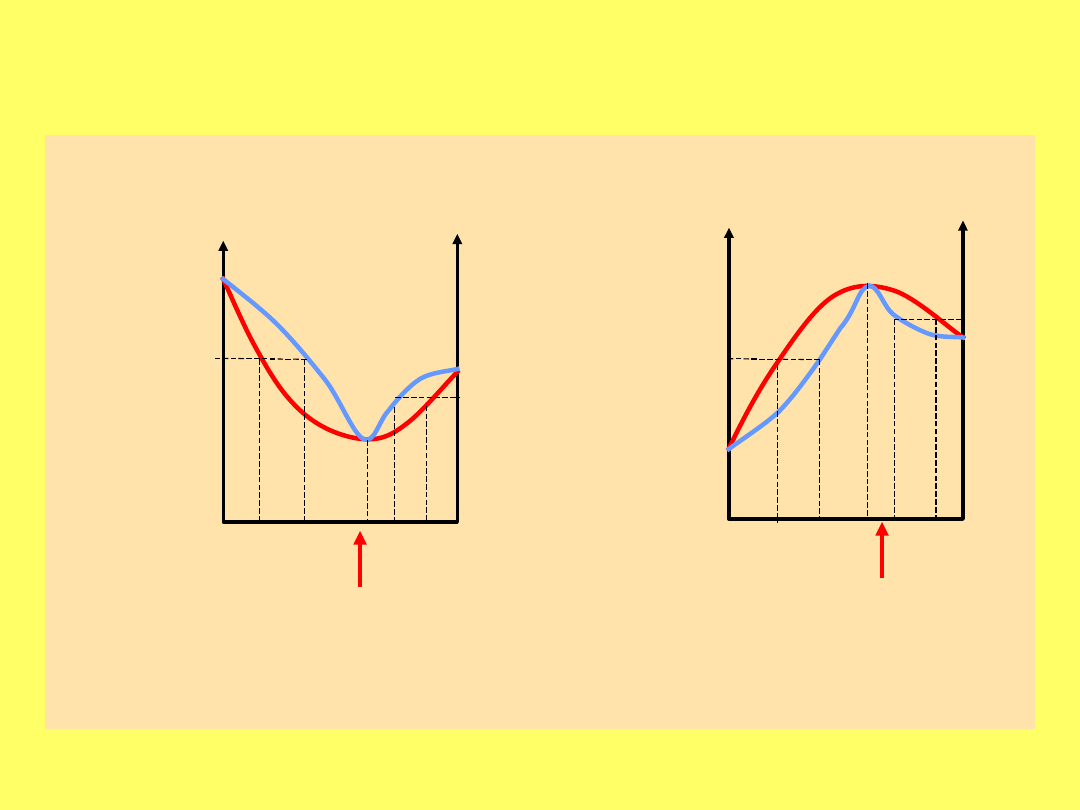
Krzywe równowagi ciecz – para dla układów
azeotropowych
X
CS2
0
1,0 X
ACETON
1
AZ
0
p
X
CS2
0
1,0 X
Aceton
1
AZ
0
T
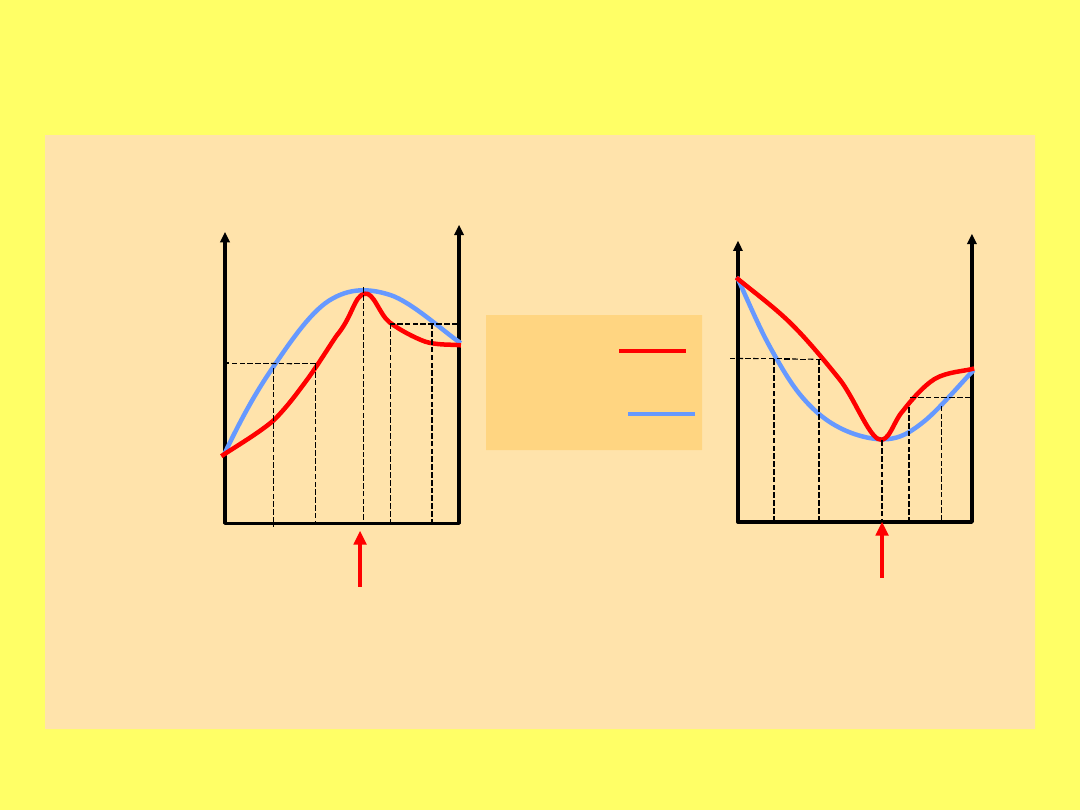
Krzywe równowagi ciecz – para dla układów
azeotropowych
T =
const
p =
const
Para =
Ciecz=
X
CHCl3
0
1,0 X
ACETON
1
AZ
0
p
X
CHCl3
0
1,0 X
ACETON
1
AZ
0
T
T =
const
p =
const
Krzywe równowagi ciecz – para dla układów
azeotropowych
X
CS2
0
1,0 X
ACETON
1
0
p
X
CS2
0
1,0 X
Aceton
1
0
T =
const
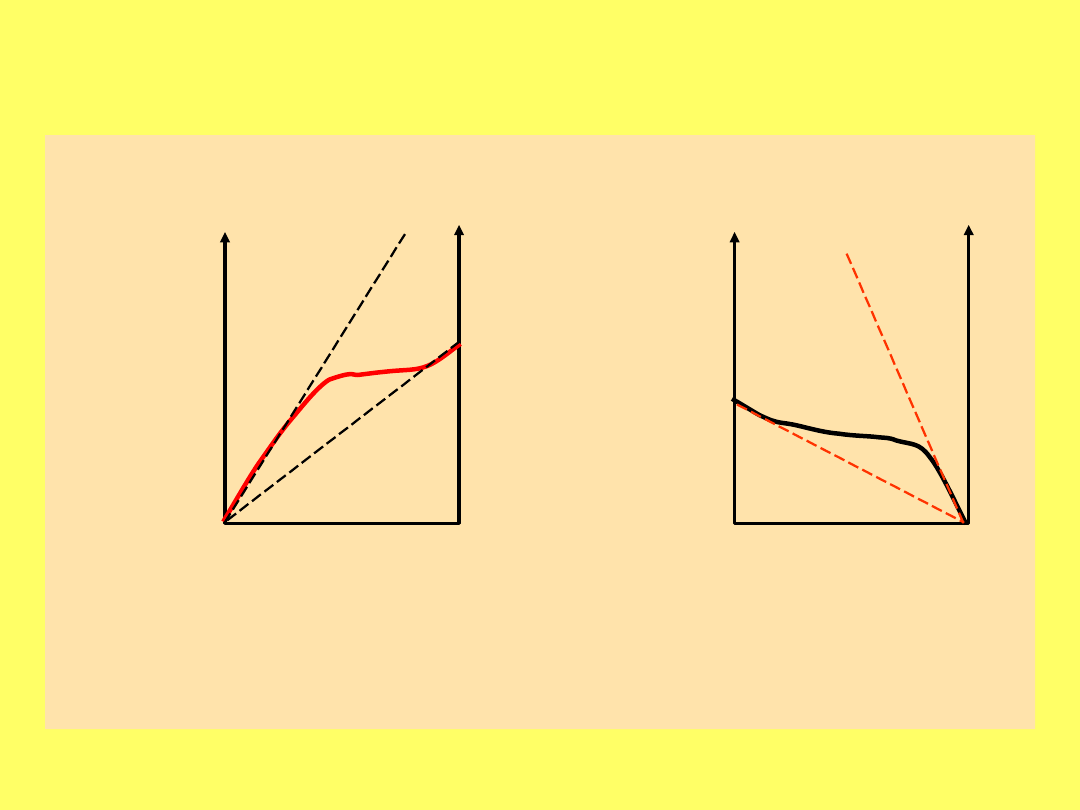
Stosowalność roztworów do praw: Raoulta i
Henry’ego:
p
T =
const
A
B
Układ
dwuskład-
nikowy
(A +
B)
Ograniczona rozpuszczalność wzajemna
dwóch cieczy
T
A
0
100% B
100% 0
T
A
0
100% B
100%
0
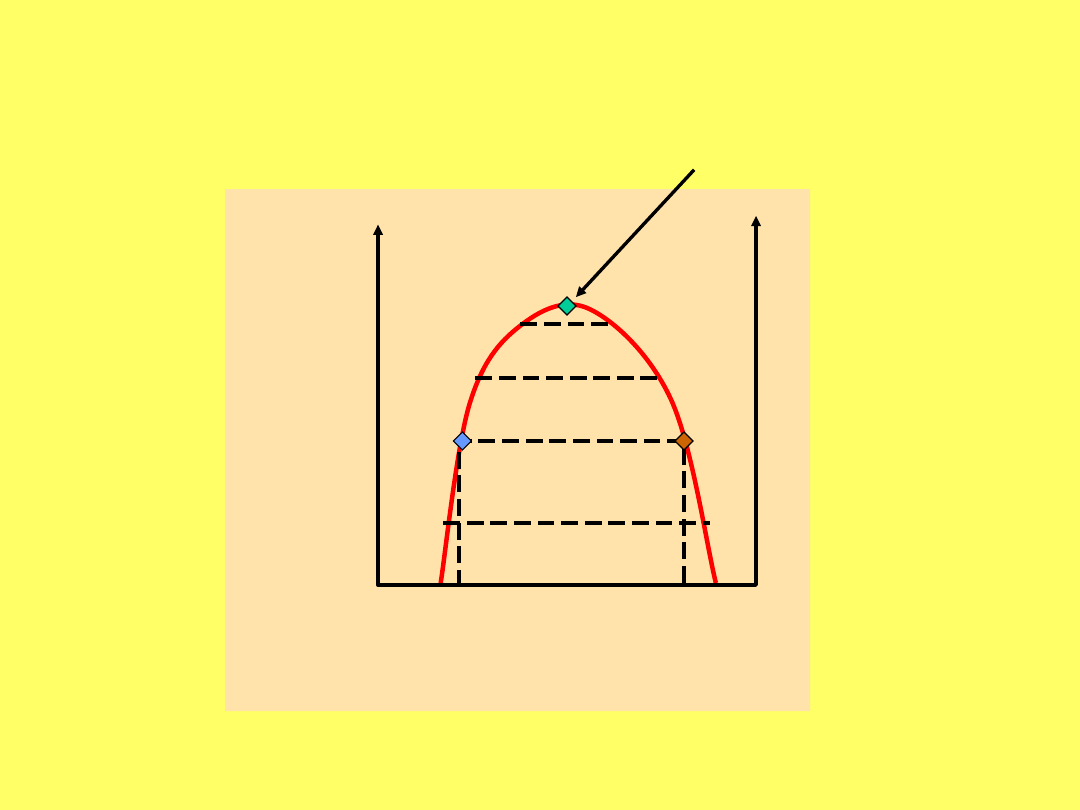
Układ dwóch cieczy o ograniczonej wzajemnej
rozpuszczalności
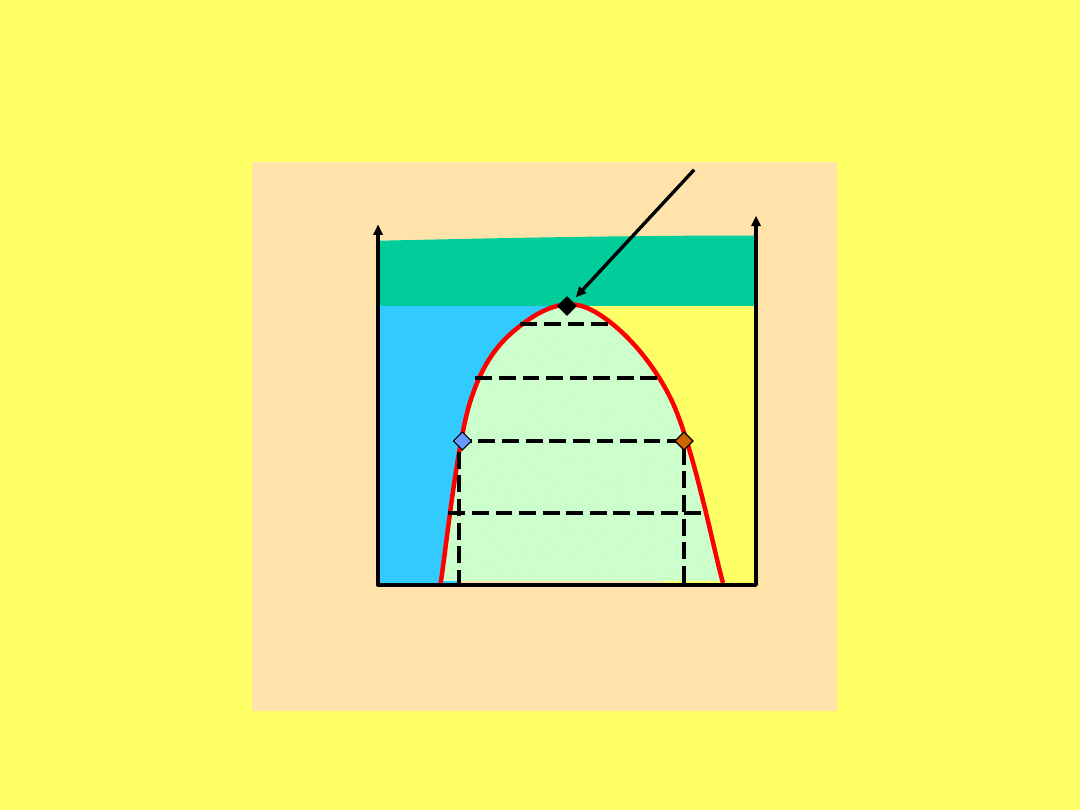
punkt
krytyczny
Krzywa równowagi faz ciekłych w układzie
fenol - woda
T
A
0
100% B
100%
0
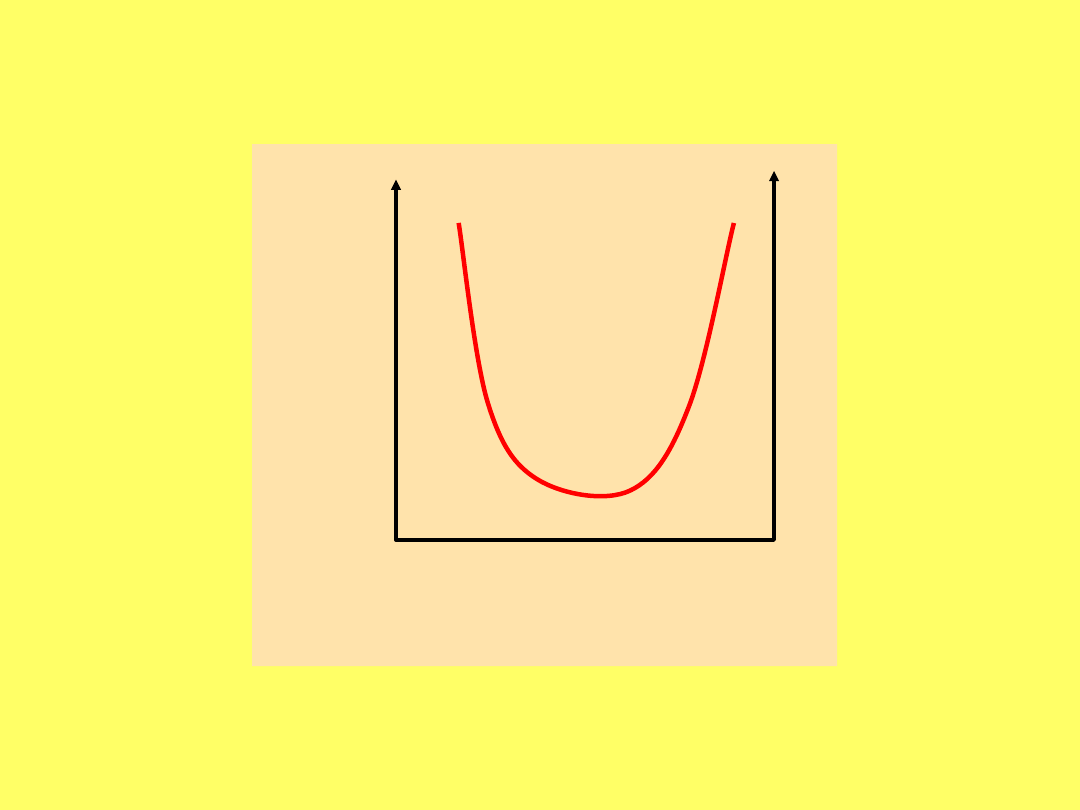
Układ dwóch cieczy o ograniczonej wzajemnej
rozpuszczalności
punkt
krytyczny
Krzywa równowagi faz ciekłych w układzie
fenol - woda
I
II
III
IV
T
A
0
100% B
100 %
0
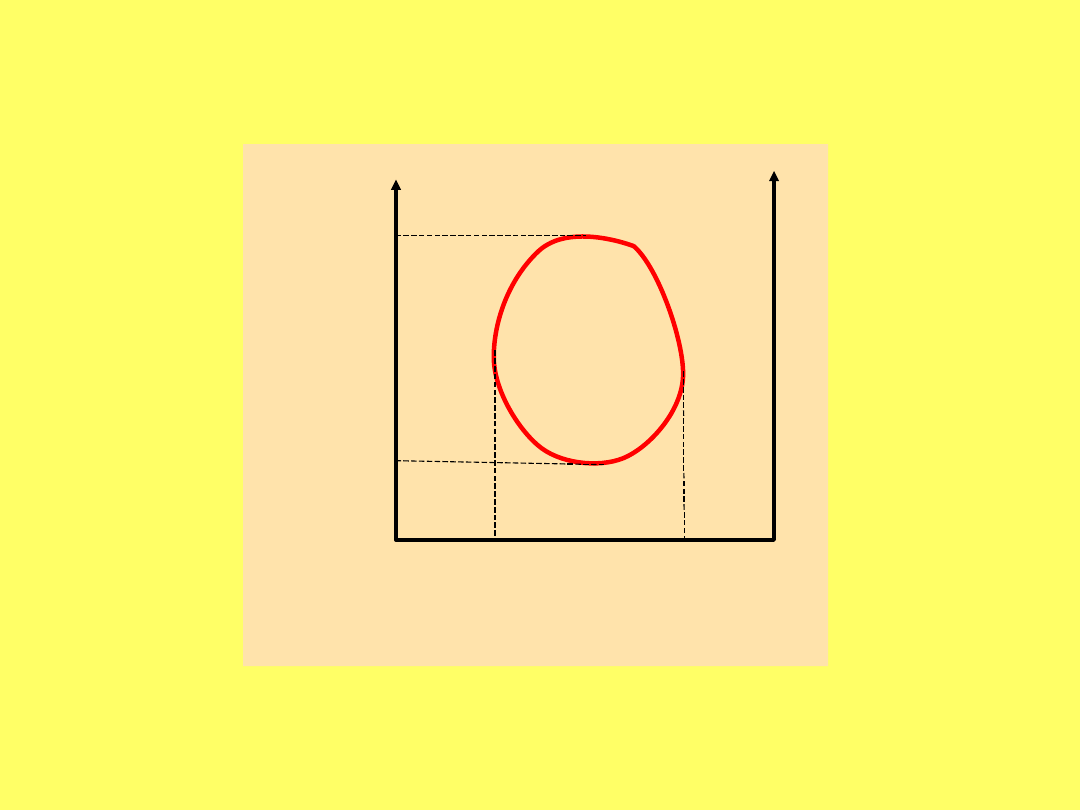
Krzywa wzajemnej rozpuszczalności
trójetyloaminy i wody
T
A
0
100% B
100%
0
Krzywa równowagi faz ciekłych w układzie nikotyna
- woda
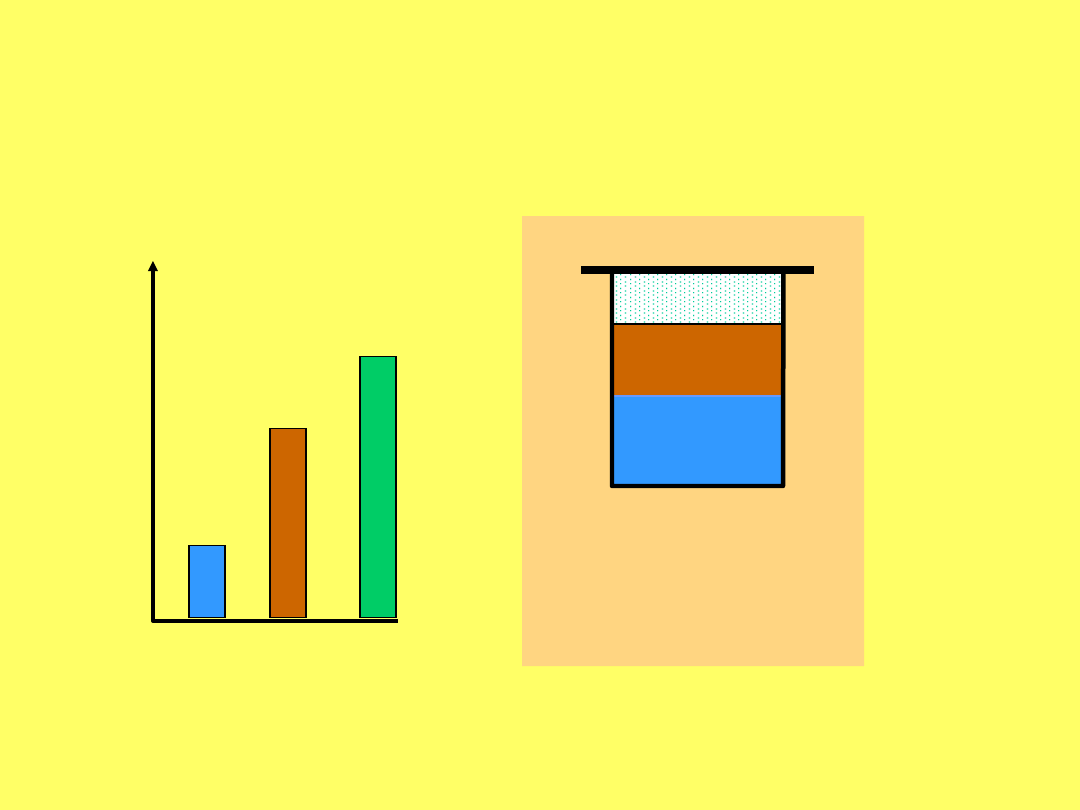
Prężność pary nad układem cieczy nie
mieszających się
W
B
Układ
dwuskład-
nikowy
(A + B)
np.: benzen +
woda
p
p = p
o
B
+
p
o
W
p
W
p
B
p
Destylacja z parą
wodną
p
Z
p
B
p
W
p
T
1
T
2
T
3
T

Przykład:
Prężności pary benzenu i wody w temperaturze
wrzenia ich mieszaniny wynoszą kolejno 71,31 * 10
3
i
29,99 * 10
3
N/m
2
. Obliczyć liczbę moli benzenu i wody
w parze.
p
o
B
: p
o
W
= n
B
: n
W
n
B
: n
W
= (71,31 * 10
3
) : (29,99 * 10
3
) = 2,37 : 1

Przykład:
Naftalen destylowano z parą wodną w temperaturze
327 K pod ciśnieniem 1 * 10
5
N/m
2
. Prężność pary
wodnej w tej temperaturze wynosi 0,98 * 10
5
N/m
2
.
Obliczyć ile kilogramów wody należy zużyć do
przedestylowania dwóch kilogramów naftalenu.
n
W
: n
N
=
p
o
W
: p
o
N
n = m / M
n
W
= n
N
*
p
o
W
/ p
o
N
m
W
= (M
W
* m
N
* p
o
W
) / (M
N
* p
o
N
)
m
W
= (18 * 2 * 0,96 * 10
5
) / (128 * 0,02 * 10
5
) =
13,76 kg
Równowagi fazowe w układach
trójskładnikowych
Jak przedstawić graficznie skład roztworu
trójskładnikowego?
A 0 20 40 60
80 100 B 100
80 60 40 20 0
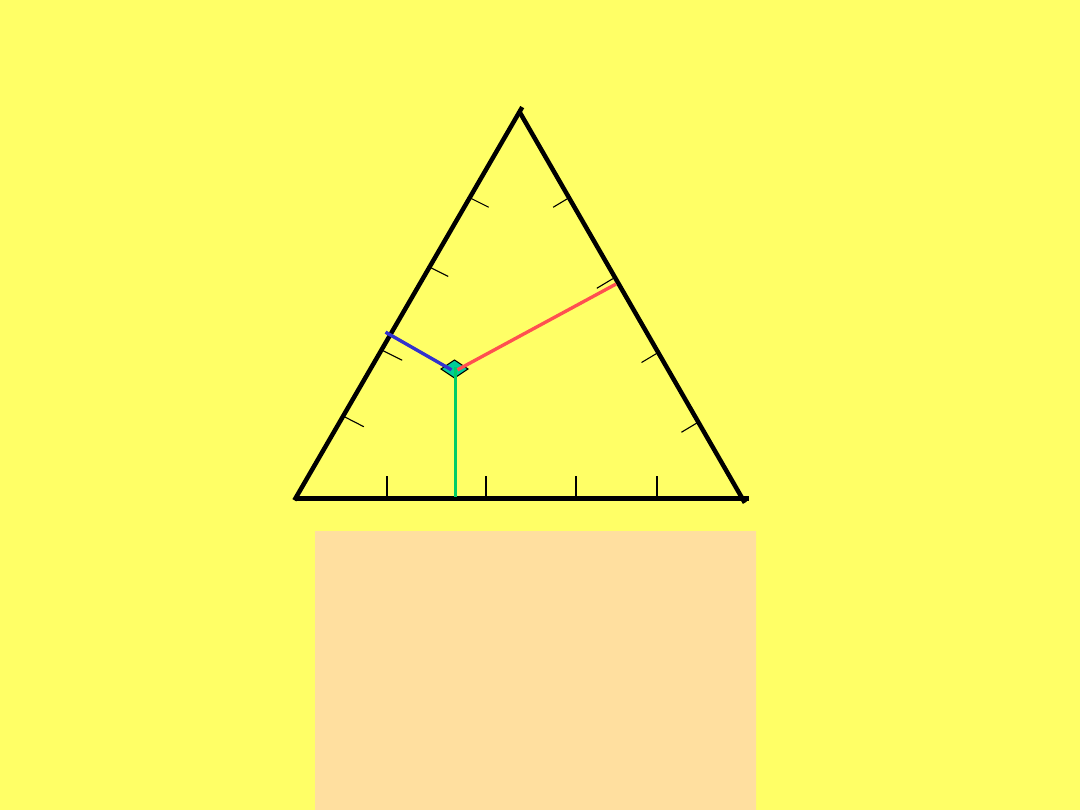
A
C
B
c
b
a
a + b + c = AB = AC
+ BC
%A = 100* a / AB
%B = 100 * b / AB
%C = 100 * c / AB
A
C
B
B
C
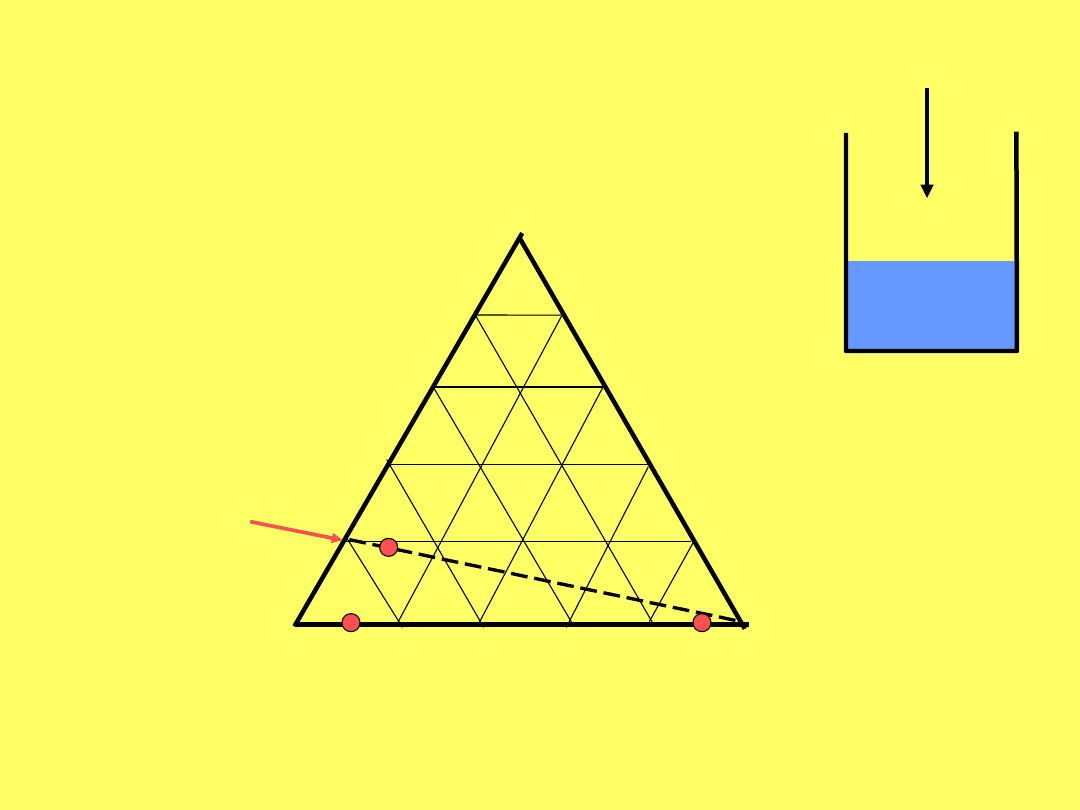
A
C
B
20% A w
B
A +
B
C
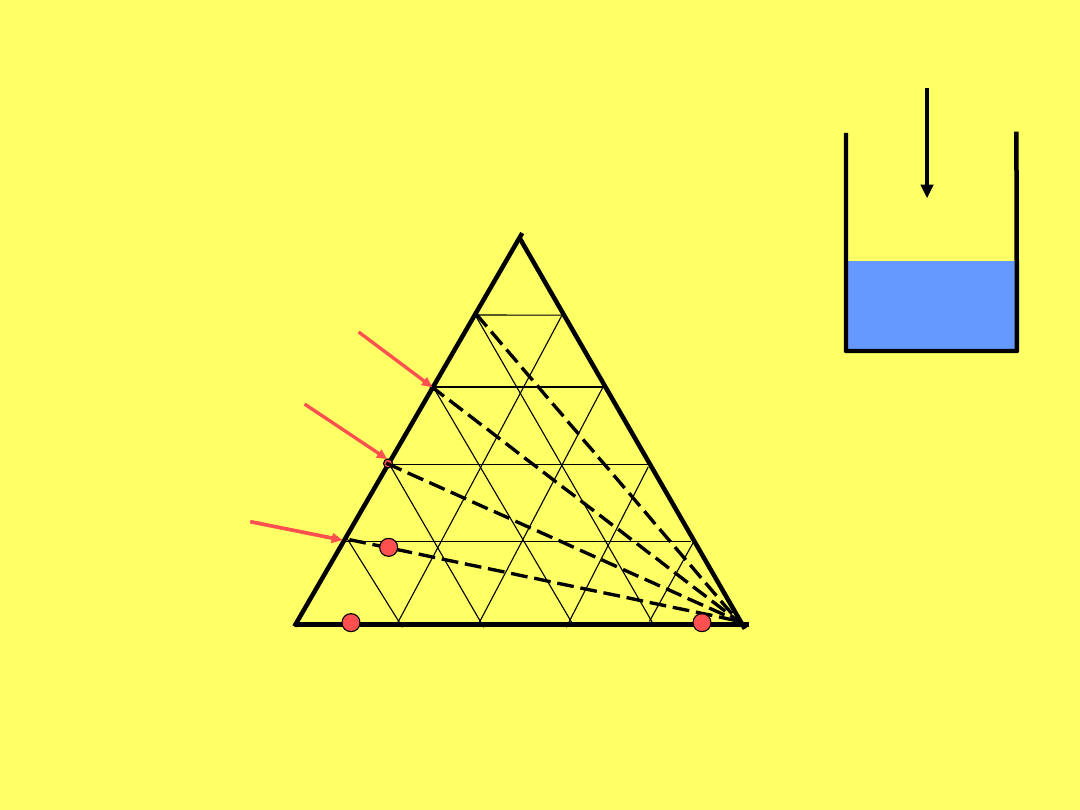
A
C
B
20% A w
B
40% A w
B
60% A w
B
A +
B
C
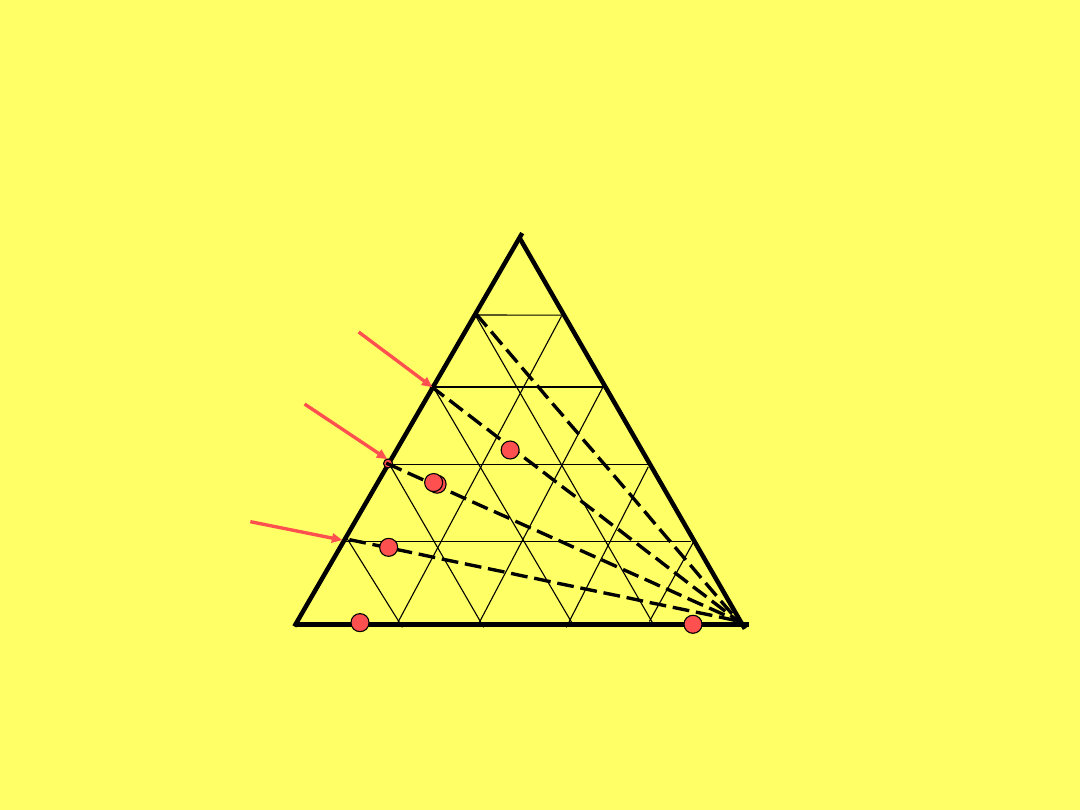
A
C
B
20% A w
B
40% A w
B
60% A w
B
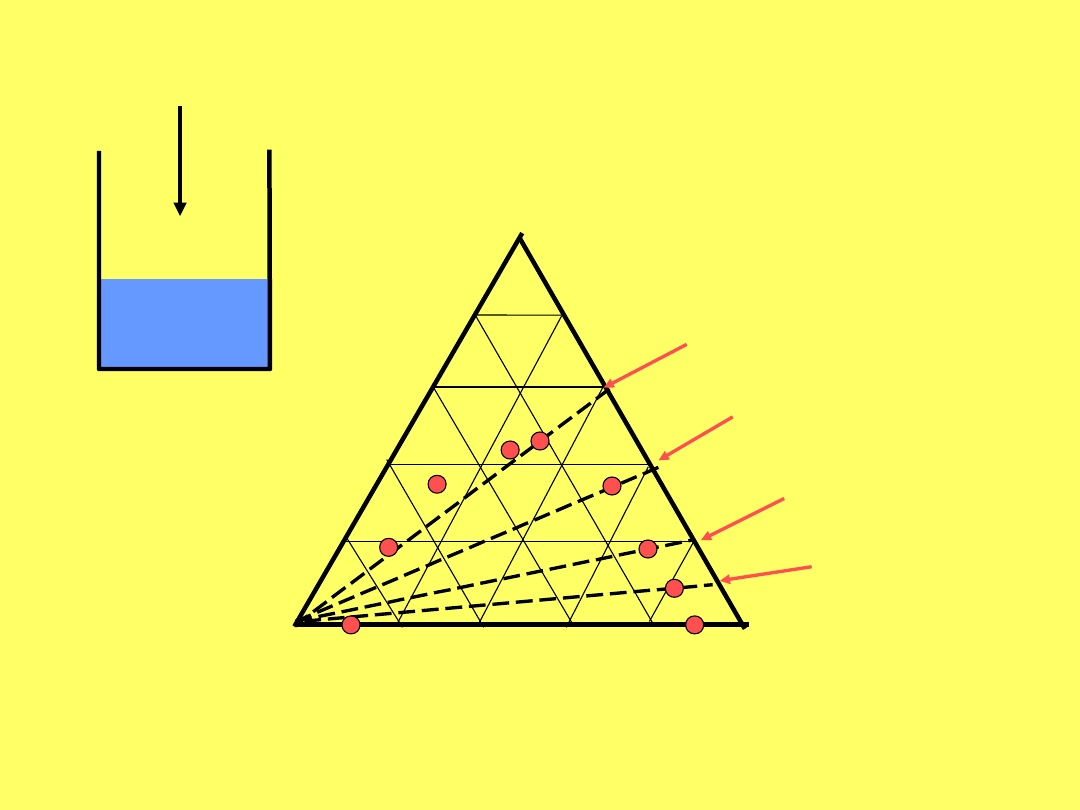
A
C
B
20% A w
C
40% A w
C
60% A w
C
10% A w
C
A +
C
B
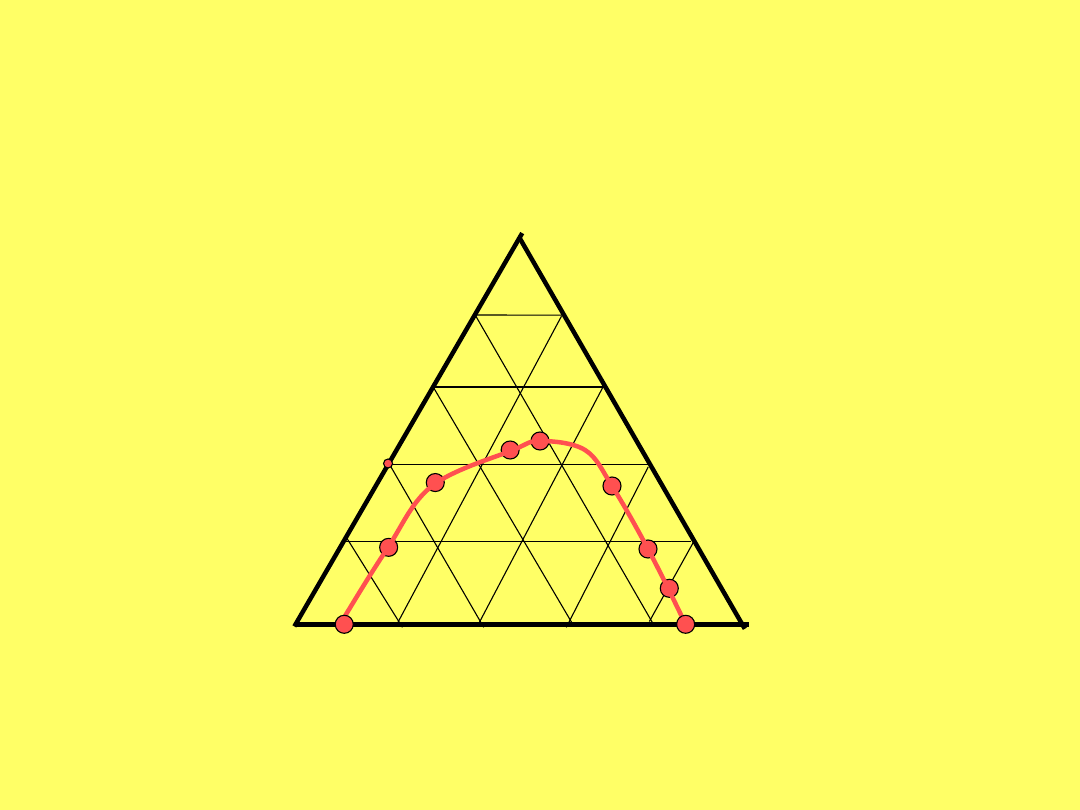
A
C
B
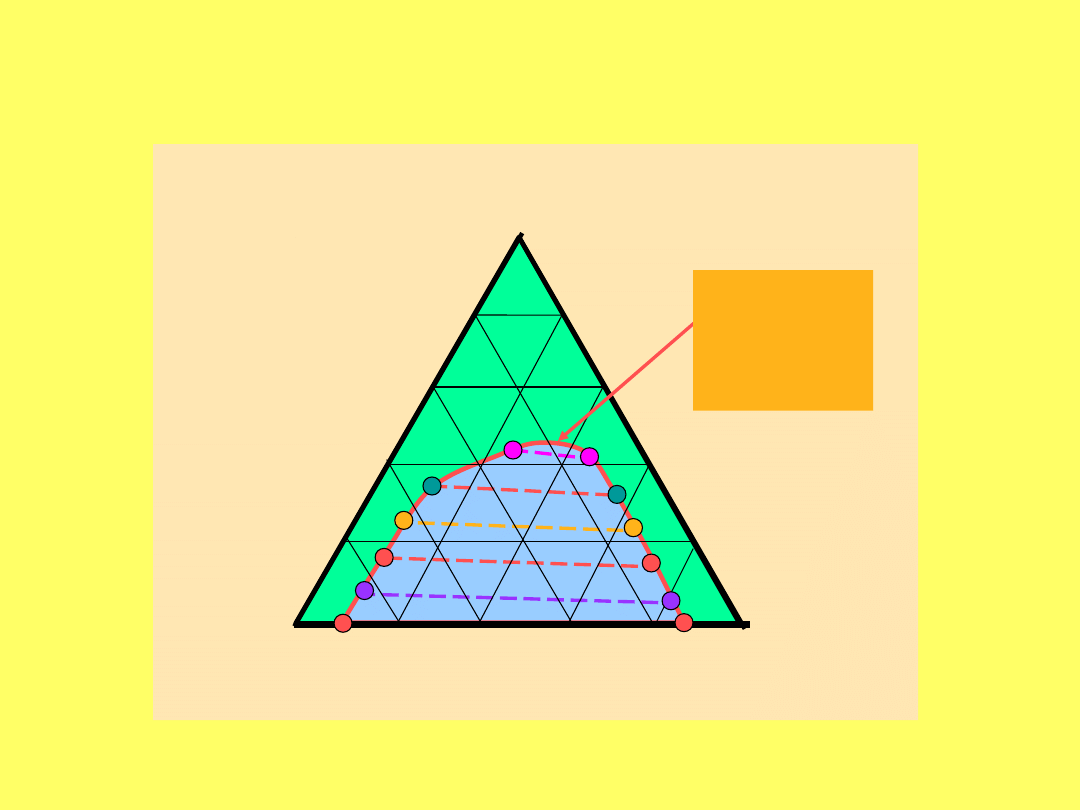
A
C
B
Punkt
krytyczn
y
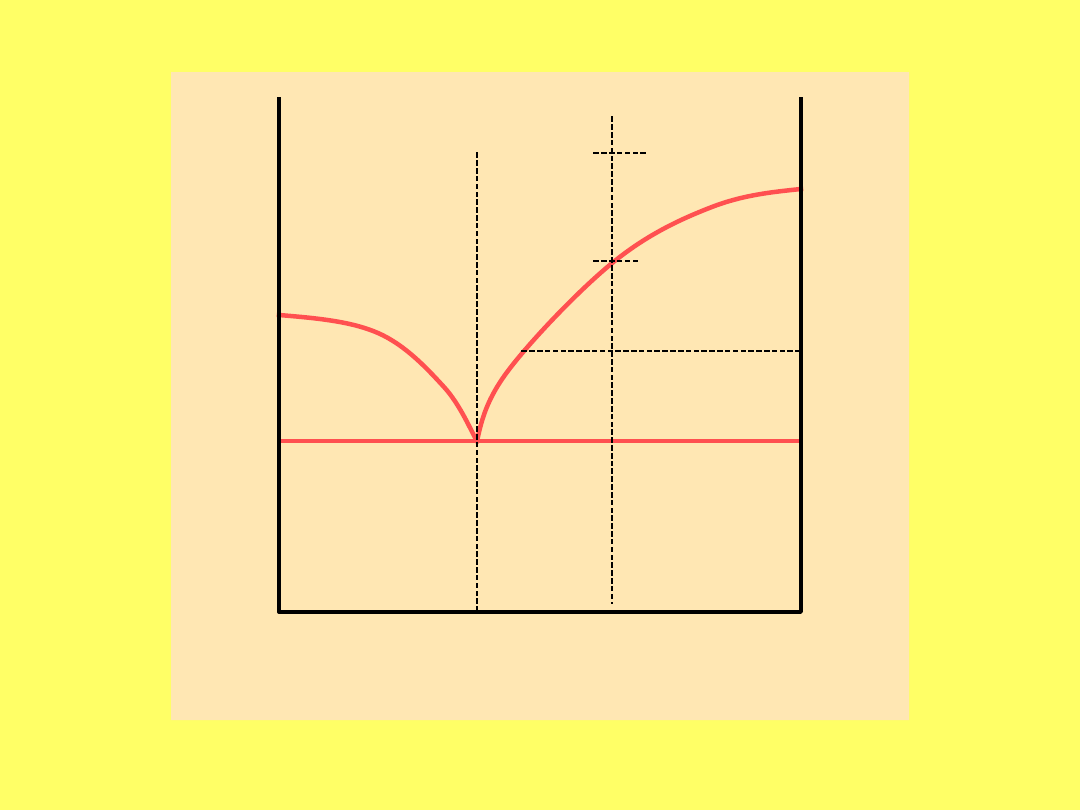
Ciecz
Ciecz
+
stały A
Ciało stałe A + B
Ciecz
+
stały
B
0% skład
100% A 100%
0% B
a
b
c
c1
d
e
Eutekty
ki
Przykład wykresu fazowego dwóch metali (np.
antymon + bizmut)
T

Ciecz
Ciecz
+
stały A
Ciało stałe A + B
Ciecz
+
stały
B
0% skład
100% A 100%
0% B
Eutekty
ki
T

Rozpuszczalność ciał stałych w
cieczach
Reguła Gibbsa dla układów ciecz – ciało stałe
f + s = n + 1
Rozpuszczalność ciał stałych jest procesem
samorzutny.
Można go podzielić na trzy etapy:
•niszczenie sieci krystalicznej,
•solwatacja oderwanych elementów sieci,
•dyfuzja rozpuszczonej substancji w głąb fazy
ciekłej, rozpuszczalnika w kierunku fazy stałej.

Rodzaje roztworów z uwagi na stopień rozpuszczenia
substancji stałej:
nienasycone, nasycone, przesycone.
Wpływ rozpuszczalnika na rozpuszczalność
„podobne rozpuszcza podobne”
Właściwości rozpuszczalników, które decydują o
rozpuszczalności:
stała dielektryczna
zdolność do solwatacji
charakter amfiprotyczny
zdolność do oddziaływań van der Waalsa
Wpływ temperatury na rozpuszczalność
nie ma prostych zasad opisujących wpływ
temperatury na rozpuszczalność ciał stałych
KCl
Na
2
SO
4
NaCl
Li
2
CO
3
Roz
pus
zcz
aln
ość
Temperatura
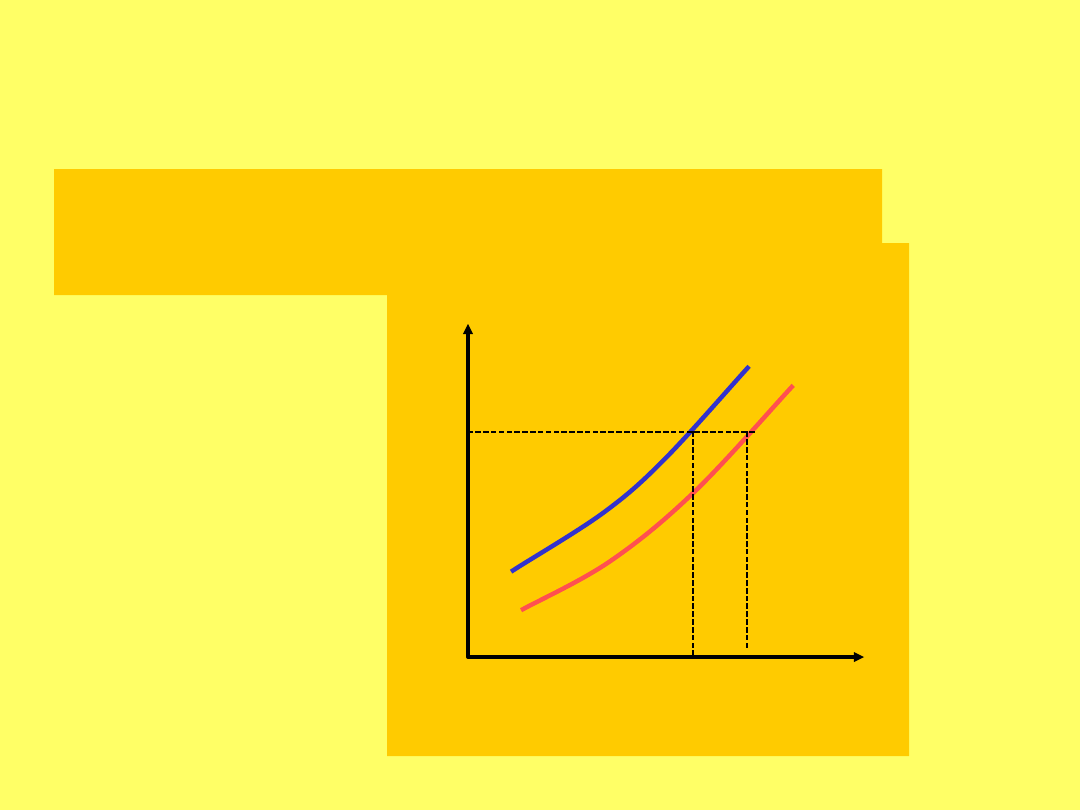
Zmiana rozpuszczalności w zależności od temperatury
jest związana z efektem cieplnym rozpuszczania (reguła
Le Chateliera)
Równanie Clausiusa – Clapeyrona można zastosować
do opisu rozpuszczalności w zależności od
temperatury:
ln =
-
S
1
- H
o
rozp
1
1
S
2
R
T
1
T
2
S
1
S
2
- rozpuszczalności substancji odpowiednio w
temperaturach T
1
i T
2

WŁAŚCIWOŚCI KOLIGATYWNE
(SPOKREWNIONE):
ciśnienie osmotyczne,
obniżenie temperatury
krzepnięcia,
podwyższenie temperatury
wrzenia.
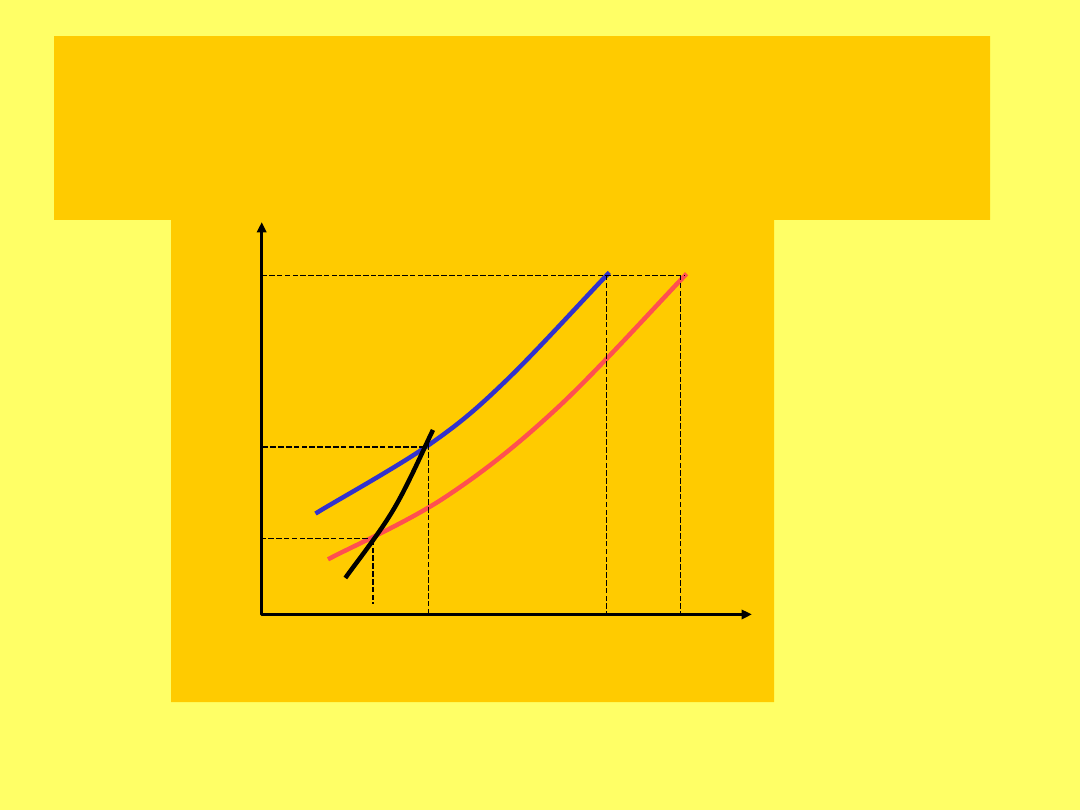
Prężność par nad
roztworem
ciał
stałych:
Zgodnie z prawem Raoulta: p
A
=
p
o
A
* X
A
p
T
o
A
T
A
T
p
A
p
o
A

Obniżenie prężności pary jest równe:
p = p
o
A
- p
o
A
* X
A
p = p
o
A
* X
B
Obniżenie prężności pary jest wprost
proporcjonalne do ułamka molowego
substancji rozpuszczonej

Przykład:
Prężność pary nad czystą wodą w temp. 293 K
wynosi 2320 Pa. Jaka będzie prężność pary nad
roztworem, jeżeli w 1000 g wody rozpuścimy 2 mole
nielotnej substancji?
p = p
o
* X
A
p = 2320 * (1000 / 18) : [(1000 / 18) + 2)]
p = 2239 Pa
a także: p : p
o
= n : (n + N)
p = 2320 * 2 : [(1000 / 18) + 2] = 80,60 Pa
P = 2320 – 80,60 = 2239,4 Pa

Jeżeli roztwór nie zachowuje się w sposób idealny,
wówczas X
B
należy pomnożyć przez pewien czynnik
i
, nazywany współczynnikiem izotonicznym van’t
Hoffa
i = 1 –
+
*
Gdzie
jest liczbą jonów, na jakie rozpada się
cząsteczka elektrolitu.
W ścisłym związku z obniżeniem prężności pary
nad roztworem pozostaje zjawisko podwyższenia
temperatury wrzenia cieczy i obniżenia jej
temperatury krzepnięcia
Krzywe prężności pary nad roztworem (
II
),
rozpuszczlnikiem (
I
) i nad fazą stałą (III)
p
T
TR
T
T
T
W
T
WR
T
II
I
III
T
TR
< T
T
T
WR
> T
W
p
Z

Podwyższenie temperatury wrzenia roztworu
jest
wprost proporcjonalne do stężenia molalnego
substancji rozpuszczonej
T
W
= E * C
T
W
- podwyższenie temperatury wrzenia roztworu,
C – stężenie molalne roztworu,
E – współczynnik proporcjonalności (stała
ebulioskopowa)
m * 1000
T
W
= E
M * m
o

Obniżenie temperatury krzepnięcia roztworu
jest
wprost proporcjonalne do stężenia molalnego
substancji rozpuszczonej
T
K
= K * C
T
K
- obniżenie temperatury krzepnięcia roztworu,
C – stężenie molalne roztworu,
K – współczynnik proporcjonalności (stała
krioskopowa)
m * 1000
T
K
= K
M * m
o

Dla roztworów nieidealnych należy wprowadzić
współczynnik izotoniczny „i”:
T
W
= E * i * C
T
K
= K * i * C
Pomiary ebuliometryczne i kriometryczne
wykorzystuje się do wyznaczania masy molowej, do
oznaczania składu roztworu, do oznaczania stopnia
dysocjacji.

Przykład:
W 100g wody rozpuszczono 3,74888 g substancji.
Temperatura wrzenia tego roztworu była wyższa o
0,2107 K od temperatury wrzenia rozpuszczalnika.
Oblicz masę cząsteczkową substancji rozpuszczonej.
Wiedząc, że był to siarczan sodowy oblicz współczynnik
izotoniczny „i”. Stała ebulioskopowa dla wody wynosi 0,
512 kg * K / mol.
m * 1000
M = E
T
W
* m
o
M = 0,512 * 3,7488 : (0,2107 * 0,1) [(kg K / mol) * g /
(K * kg)
M = 91,1 g / mol
i = M
TEOR
/ M
DOSW
i = 142 / 91,9 = 1,545
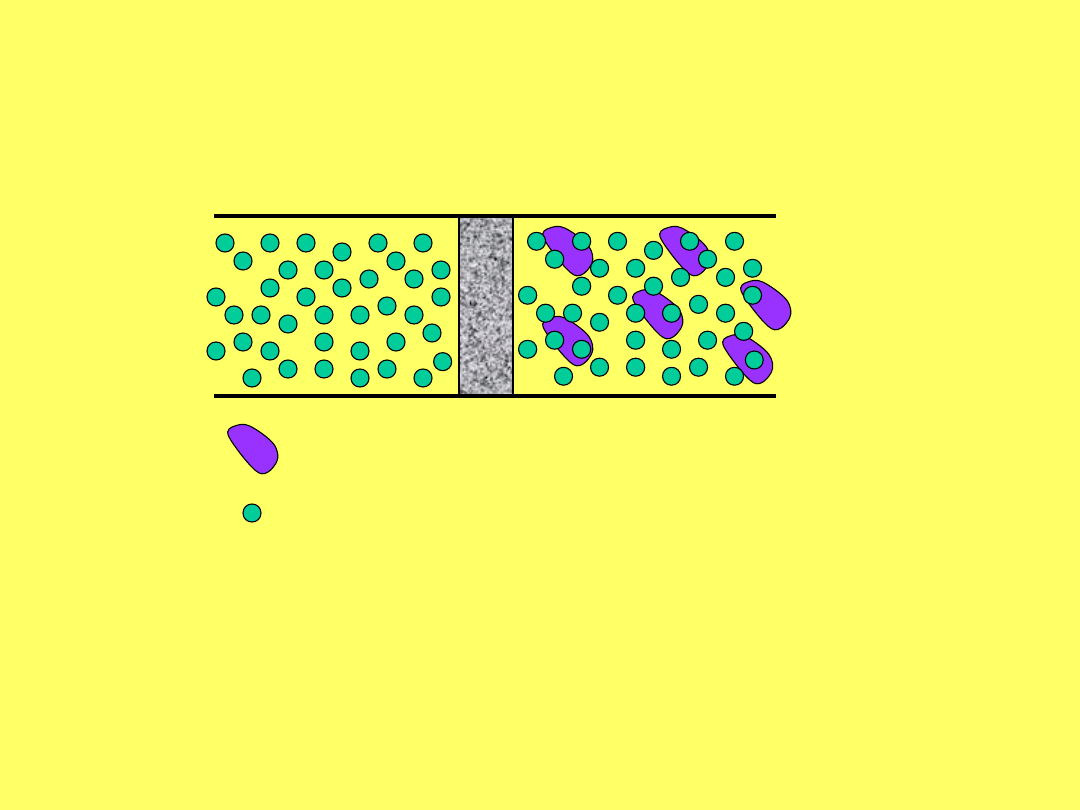
OSMOZA I CIŚNIENIE
OSMOTYCZNE
Cząsteczka substancji
rozpuszczonej
Cząsteczka wody
Jednostronną dyfuzję rozpuszczalnika przez błonę
półprzepuszczalną nazywamy osmozą
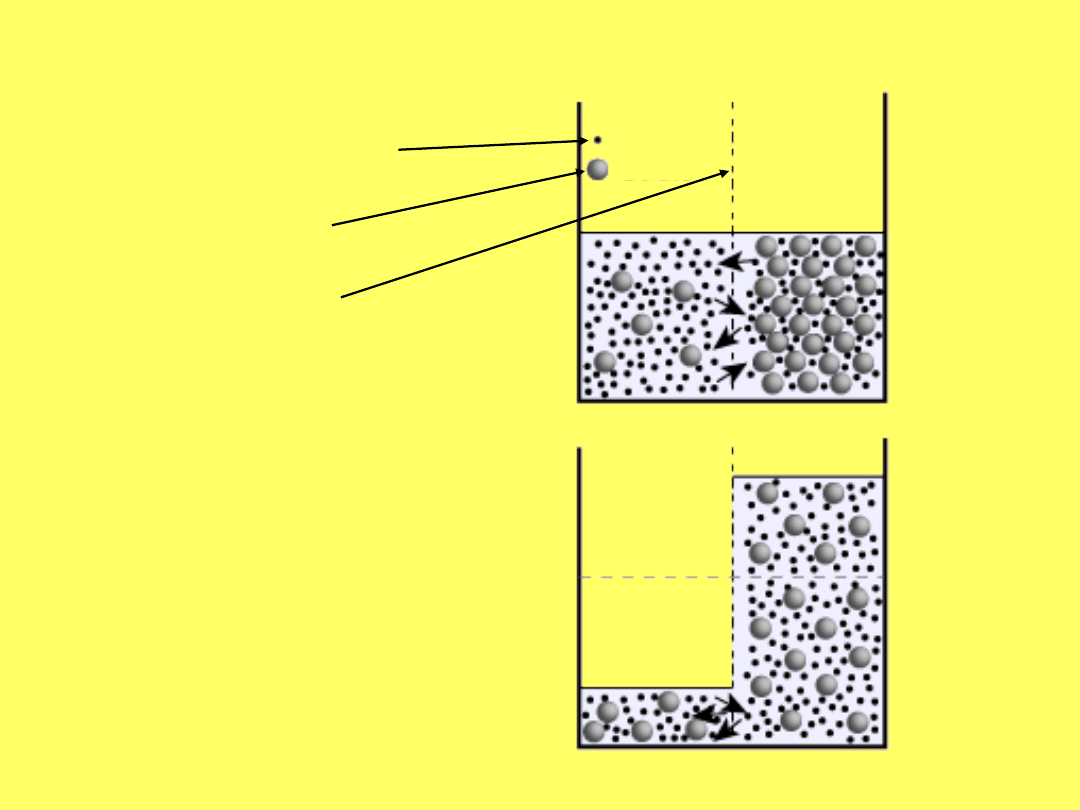
rozpuszczalnik
substancja
membrana
półprzepuszcza
lna
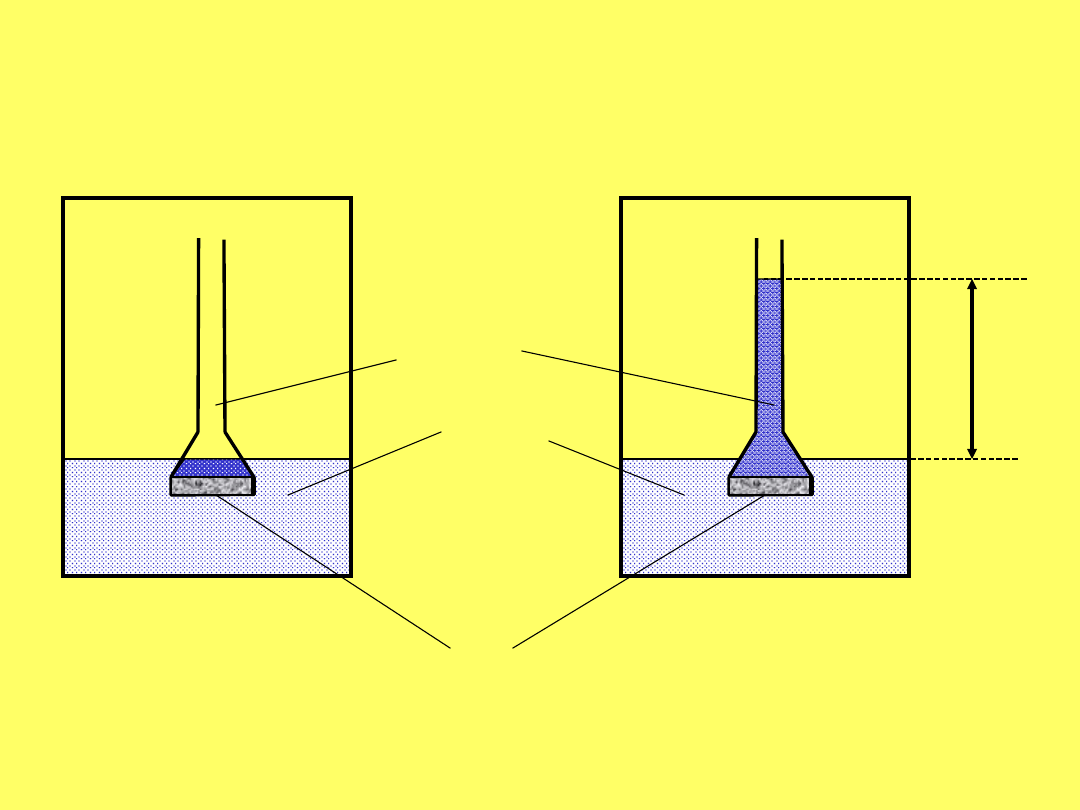
Ciśnienie osmotyczne
– ciśnienie wywierane przez
substancję rozpuszczoną na błonę
półprzepuszczalną
`
h
Roztwór
Rozpuszczalnik
Błona
półprzepuszczalna
`

Wzór empiryczny van’t Hoffa na ciśnienie
osmotyczne
:
* V = n
i
*R * T
V – objętość roztworu
n
i
– liczba moli substancji
Ciśnienie osmotyczne substancji rozpuszczonej w
danej objętości roztworu, w określonej
temperaturze, jest równe ciśnieniu, jakie
wykazywałaby ta substancja, gdyby tworzyła gaz,
który zajmowałby taką samą objętość i posiadał
taką samą temperaturę jak roztwór.
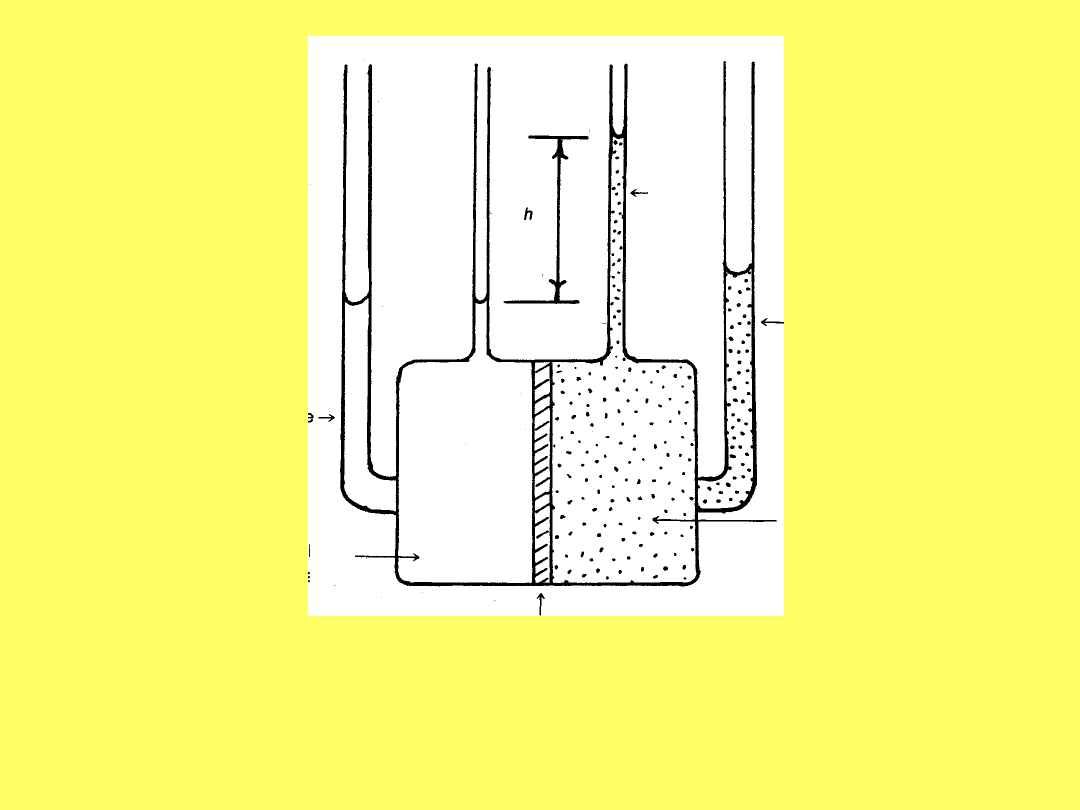
Schemat urządzenia do pomiaru ciśnienia
osmotycznego
π = wysokość, h * gęstość roztworu, ρ *
przyśpieszenie ziemskie, g
Rurka
napełniając
a
Wod
-ny
rozt-
wór
Rurka
napełniając
a
Roztwór:
substancja
+ woda
Woda

* V = n
i
*R * T
Ponieważ: c
i
= n
i
/ V
Można napisać:
= c
i
*R
* T
Wzory na ciśnienie osmotyczne są ważne dla
roztworów rozcieńczonych.
Jeżeli rozpuszczona substancja jest elektrolitem i
dysocjuje na jony, to wzory na ciśnienie
osmotyczne nie są spełnione. Należy wtedy
wprowadzić poprawkę „i” (współczynnik
izotoniczny).
= i * c
i
*R * T
Np. dla KCl i = 2, dla CaCl
2
i = 3.

W przypadku roztworów bardziej
stężonych należy uwzględnić
współczynnik aktywnosci
= i * f * c
i
* R * T

= i * c
* R * T
W praktyce zamiast stężenia molowego stosuje się
stężenie molalne:
= i * c
m
* R * T

= i * c
m
* R * T
' = ν * c
m
* R * T
g
i
,
i jest współczynnikiem izotonicznym
ν jest liczbą jonów na jakie dysocjuje
cząsteczka
g jest współczynnikiem osmotycznym
ξ
m
jest osmolalnością,
= ν * g * c
m
* R * T
ξ
m
= ν * c
m
* g
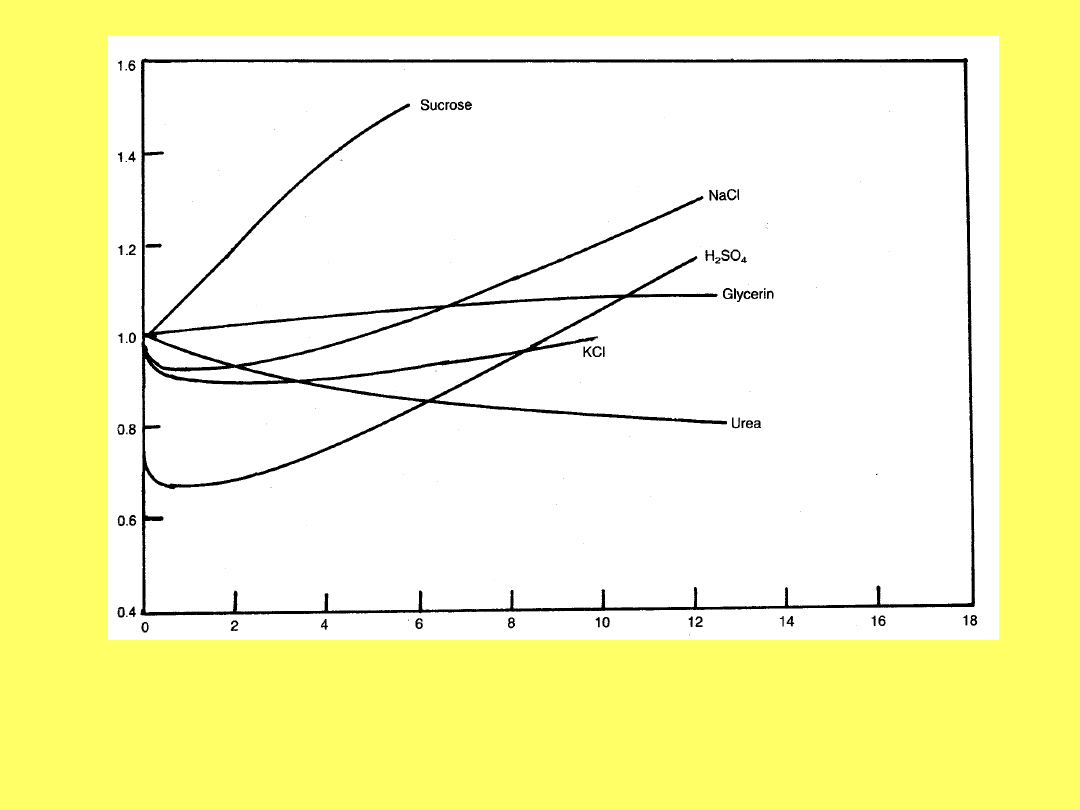
W
sp
ó
łc
zy
n
n
ik
o
sm
o
ty
cz
n
y,
g
Stężenie jonów, ν
* c
m
Zależność współczynnika osmotycznego, g, od stężenia
wybranych związków w roztworach wodnych.

Osmolalność i osmolarność
Praktyczną miarą aktywności osmotycznej jest
osmolalność, ξ
m
(ksi).
Jednostką osmolalności jest osmol * kg
-1
Roztwór zawierający 1 mol nie
dysocjującej substancji w 1 kg wody jest
roztworem o osmolalności równej
1 osmol * kg
-1

Jednostką osmolarności jest osmol * dm
-3
Roztwór zawierajacy 1 mol nie
dysocjującej substancji
w 1 litrze roztworu wodnego jest
roztworem o osmolarności równej 1
osmol * dm
-3

Przykład: obliczanie osmolalności
Roztwór chlorku sodu (M = 58,5 g/mol) o stężeniu
0,90% w/w wykazuje współczynnik osmotyczny g =
0,928. Oblicz osmolalność roztworu.
Osmolalność ξ
m
można obliczyć korzystając z
wyrażenia:
ξ
m
= ν * c
m
* g
1
-
1
-
kg
mosmol
286
kg
osmol
286
,
0
928
,
0
5
,
58
0
,
9
2
m

Ciśnienie osmotyczne odgrywa bardzo
ważną rolę w procesach biologicznych.
Tkanki i błony organizmów żywych są
przegrodami półprzepuszczalnymi.
Roztwory izotoniczne, hipotoniczne i
hipertoniczne.

Osmoza i równowaga osmotyczna -
znaczenie i zastosowanie
...
•Transport wody przez błony komórkowe roślin
i zwierząt, sztywność liści roślin oraz
elastyczność tkanek zwierząt.
•Ciśnienie osmotyczne osocza krwi ludzkiej
wynosi ok. 0,6 MPa (ok. 0.9 % wag. NaCl);
wprowadzenie do krwi wody destylowanej
powoduje hemolizę tzn. pękanie czerwonych
ciałek krwi, które "pęcznieją" wskutek migracji
do ich wnętrza wody - płyny iniekcyjne muszą
być izotoniczne z osoczem krwi

Osmoza i równowaga osmotyczna -
znaczenie i zastosowanie
...
•”Mięknięcie" liści sałaty, kapusty lub
pokrojonych ogórków po ich posoleniu, wynika
z utraty przez ich komórki wody wskutek
osmozy.
• Pomiar ciśnienia osmotycznego
rozcieńczonego roztworu nieelektrolitu
umożliwia wyznaczenie jego stężenia molowego
(masy molowej) - jest to jedna z metod
wyznaczania średnich mas molowych
polimerów.
• Jeżeli roztworowi zamkniętemu przegrodą
półprzepu- szczalną narzuci się ciśnienie
większe od jego ciśnienia osmotycznego, to
zawarty w nim rozpuszczalnik będzie migrował
z roztworu do czystego rozpuszczalnika - jest to
jedna z metod odsalania wody morskiej.

Przykład:
Obliczyć ciśnienie osmotyczne roztworu glukozy w
wodzie o stężeniu równym 0,1 mol / dm
3
w temp. 295
K.
= 0,1 * 8,314 * 295 [mol dm
3
J mol
-1
K
-1
]
= 245,26 [J dm
-3
]
= 245260 Pa
Przykład:
Obliczyć ciśnienie osmotyczne w temp. 273 i 293 K
roztworu, który w objętości 50cm
3
zawiera 2 g
sacharozy.
M
C12H22O11
= 342 g mol
-1
N = 2 / 342 = 0,0058
50 cm
3
= 5* 10
-5
m
3
5* 10
-5
m
3
- 0,0058 mol
1 m
3
- x
x = 1 * 0,0058 : 5 * 10
-5
= 116 mol m
-3
273
= c * R * T = 116 * 8,313 * 273 = 263256 Pa
273
= c * R * T = 116 * 8,313 * 293 = 282542 Pa

Zadanie:
Obliczyć ciśnienie osmotyczne roztworu
NaCl o stężeniu 0,03 mol/l w temp 25
o
C.
Zadanie:
Osocze krwi w temp. 36,6
o
C wywołuje
ciśnienie osmotyczne względem wody
równe 7,6 atm. Jakie jest stężenie
procentowe roztworu NaCl, który
zrównoważy ciśnienie osmotyczne osocza
krwi? Przyjąć współczynnik aktywności f =
0,9 i gęstość d = 1 g/cm
3
.
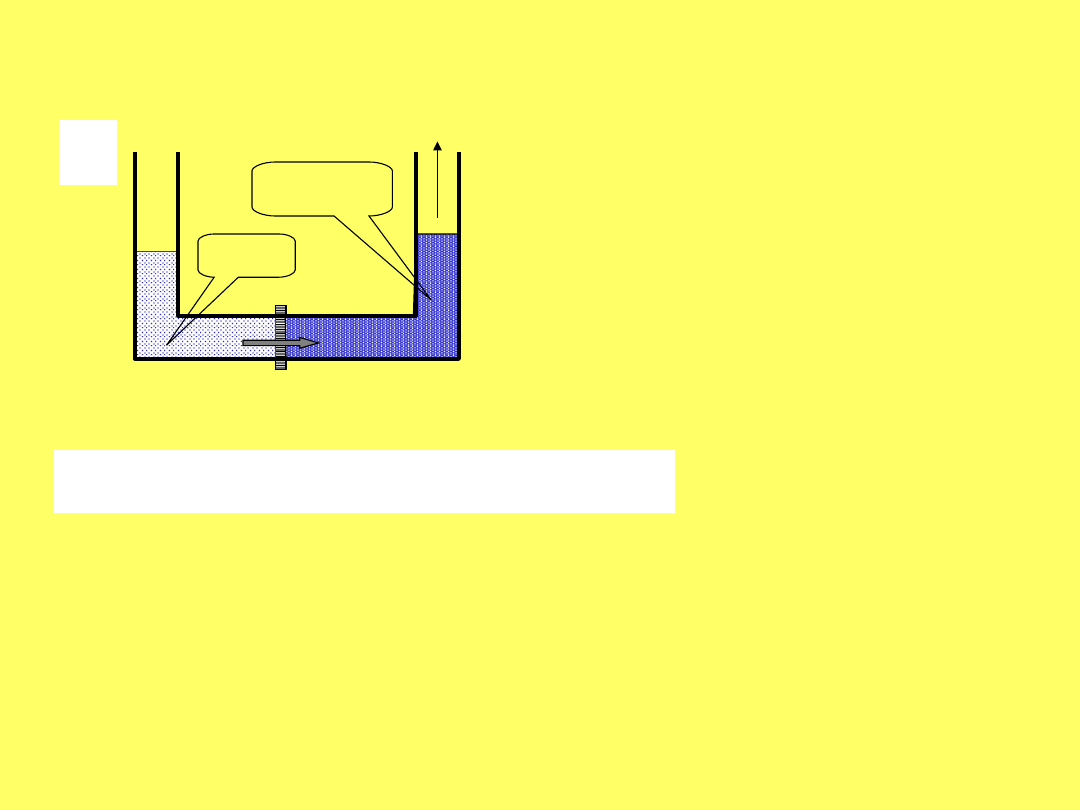
OSMOZA ODWRÓCONA
ROZTWÓ
R
a)
p <
WOD
A
a) osmoza, p – ciśnienie
hydrostatyczne
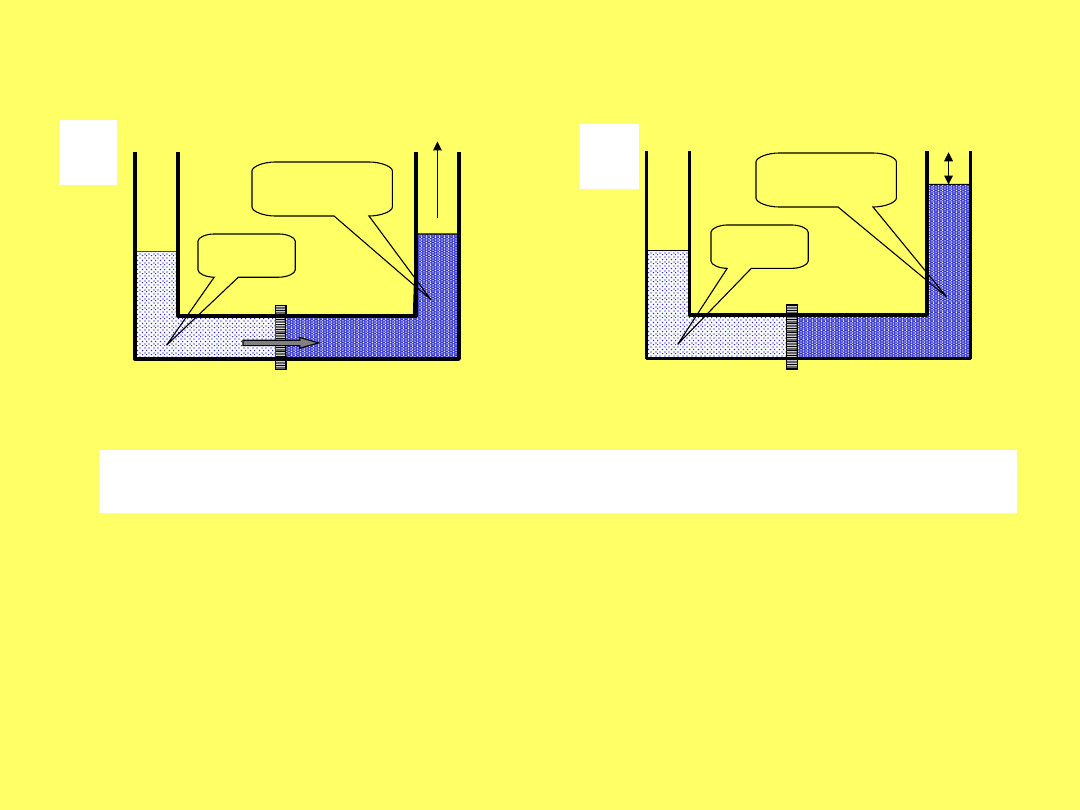
OSMOZA ODWRÓCONA
ROZTWÓ
R
a)
p <
WOD
A
ROZTWÓ
R
p =
b)
WOD
A
a) osmoza, b) równowaga
osmotyczna,
p – ciśnienie
hydrostatyczne
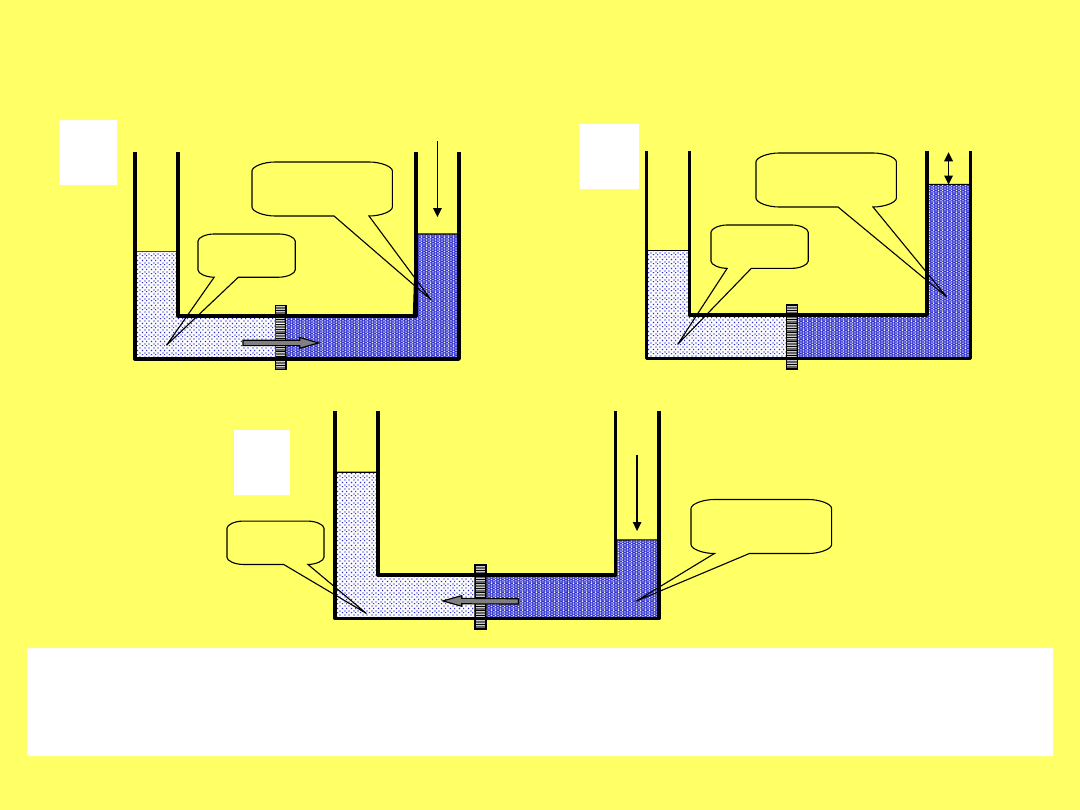
OSMOZA ODWRÓCONA
ROZTWÓ
R
a)
p <
WOD
A
ROZTWÓ
R
p =
b)
WOD
A
c)
WOD
A
ROZTWÓ
R
p >
a) osmoza, b) równowaga osmotyczna, c) odwrócona
osmoza;
- ciśnienie osmotyczne, p – ciśnienie
hydrostatyczne

Wyrównywanie się stężeń w fazach ciekłych
1. Roztwór jest oddzielony od czystego
rozpuszczalnika porowatą przegrodą
przepuszczalną – wyrównywanie się stężeń w
obu fazach ciekłych będzie zachodzić w wyniku
dyfuzji substancji rozpuszczonej do
rozpuszczalnika.
2. Gdy roztwór i rozpuszczalnik są oddzielone
przegrodą półprzepuszczalną - zachodzi
zjawisko osmozy.
3. Gdy między roztworem i rozpuszczalnikiem
znajduje się przegroda nie przepuszczająca
składników układu – zachodzi zjawisko
destylacji, która przenosi rozpuszczalnik do
roztworu.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
Wyszukiwarka
Podobne podstrony:
4 Stany materii uklady jednoskladnikowe wielofazowe
Stany materii
Struktura materiałów, układy równowagi fazowej, przemiany fazowe (Tatiana Kosińska)
wzm operacyjny - wyzysk, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, Układy
stany nieustalone w RC, Elektrotechnika-materiały do szkoły, Elektrotechnika
wzm oper 05, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, Układy Elektronicz
wzm różnicowy 01 - bbb, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, Układy
1 laborka -Układy liniowo sprężyste, Wytrzymałość materiałów(1)
15 Język Instruction List Układy sekwencyjne Działania na liczbach materiały wykładowe
generatory rc 04, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, Układy Elektr
zast wzm do lin przekszt sygn - bk, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechn
1 Stany skupienia materii Zdefiniować pojęcie płynu
generatory rc 02, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, Układy Elektr
Układy Bezpieczeństwa Biernego W Samochodach Osobowych, STUDIA - Kierunek Transport, STOPIEŃ I, MATE
wzm oper 09, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, Układy Elektronicz
ciagle uklady regulacji, Akademia Morska -materiały mechaniczne, szkoła, Mega Szkoła, szkola, AUTOMA
więcej podobnych podstron