
Jądro atomowe
Jądro atomowe charakteryzuje się dodatnim ładunkiem
elektrycznym. Wartość liczbowa tego ładunku Z stanowi
wielokrotność bezwzględnej wartości ładunku elektronu
Q = Ze; wiel kość Z, zwana liczbą atomową (liczbą
ładunku),
równa
się
numerowi
porządkowemu
pierwiastka w układzie okresowym Mendelejewa.
Inną cechę charakterystyczną jądra atomowego stanowi
jego masa m
j
. Jest ona związana z masą atomową
pierwiastka. W rzeczywistości większość pierwiastków
ma po kilka izotopów, tj. po kilka rodzajów atomów o
różnych masach przy tej samej liczbie atomowej Z.
Większość pierwiastków chemicznych występuje w
postaci dwu lub większej liczbie typów atomów,
różniących się między sobą liczbą atomów w jądrze.

Wyróżniamy np. trzy typy atomów wodoru (H), pięć
typów atomów węgla (C) oraz 16 typów ołowiu (Pb) .
Te różne typy atomów jednego i tego samego pierwiastka
nazywane są IZOTOPAMI (isos = równy, topos =
miejsce), ponieważ zajmują one to samo miejsce w
układzie okresowym pierwiastków
.
Wszystkie izotopy danego pierwiastka mają taką samą
liczbę protonów, lecz różnią się liczbą neutronów w
jądrze.
Aczkolwiek izotopy danego pierwiastka mają takie same
właściwości chemiczne, można je rozróżnić stosując
właściwości fizyczne.
Niektóre są radioaktywne, wobec tego można je
wykrywać
i
określić
ilościowo
na
podstawie
intensywności promieniowania.
Inne
izotopy
można
rozróżniać
na
podstawie
nieznacznych różnic w masie atomowej spowodowanych
obecności dodatkowego neutronu w jądrze.

Przez masę atomową M jakiegoś czystego izotopu danego
pierwiastka będziemy rozumieć stosunek masy m
M
jego
atomu do 1/16 m
0
, gdzie m
0
oznacza masę najbardziej
rozpowszechnionego (a zarazem najlżejszego) izotopu
tlenu.
Masę atomową tego izotopu tlenu przyjmuje się w ten
sposób za równą 16,00000. Określone w ten sposób masy
atomowe czystych izotopów wyznacza się przy pomocy
pomiarów na spektrografie masowym.
Wartość bezwzględna (w gramach) masy izotopu tlenu o
masie ato mowej M = 16 można wyznaczyć, znając jego
masę cząsteczkową (równą 16) i liczbę Avogadra,
m
0
= /N = 16.00/6.023 x 10
23
= 26.576 x 10
-27
[kg]
Jednostce masy atomowej odpowiada masa:
26.576 x 10
-24
/ 16 = 1.662 x 10
-27
[kg]
jest to tzw. jednostka masy atomowej.

Stad wartość bezwlędna masy m
M
atomu danego izotopu
wyznacza się ze wzoru:
m
M
= 1.662 x 10
-27
M [kg]
Ponieważ masa elektronu jest prawie dwa tysiące razy
mniejsza od masy jądra, więc masa jądra m
j
dowolnego
izotopu niewiele różni się od masy całego atomu m
M
.
m
e
= 9.31 x 10
-31
kg
Ponieważ E = mc
2
i biorąc pod uwagę zależności
powyższe możemy określić zależność, że jednostka masy
równoważna jest 931 MeV energii; znajomość tej
wielkości pozwala nam przeliczać bilanse masy na
bilanse energii i odwrotnie

PROMIENIOWANIE
JONIZUJĄCE
POWSTAWANIE PROMIENIOWANIA
RENTGENOWSKIEGO
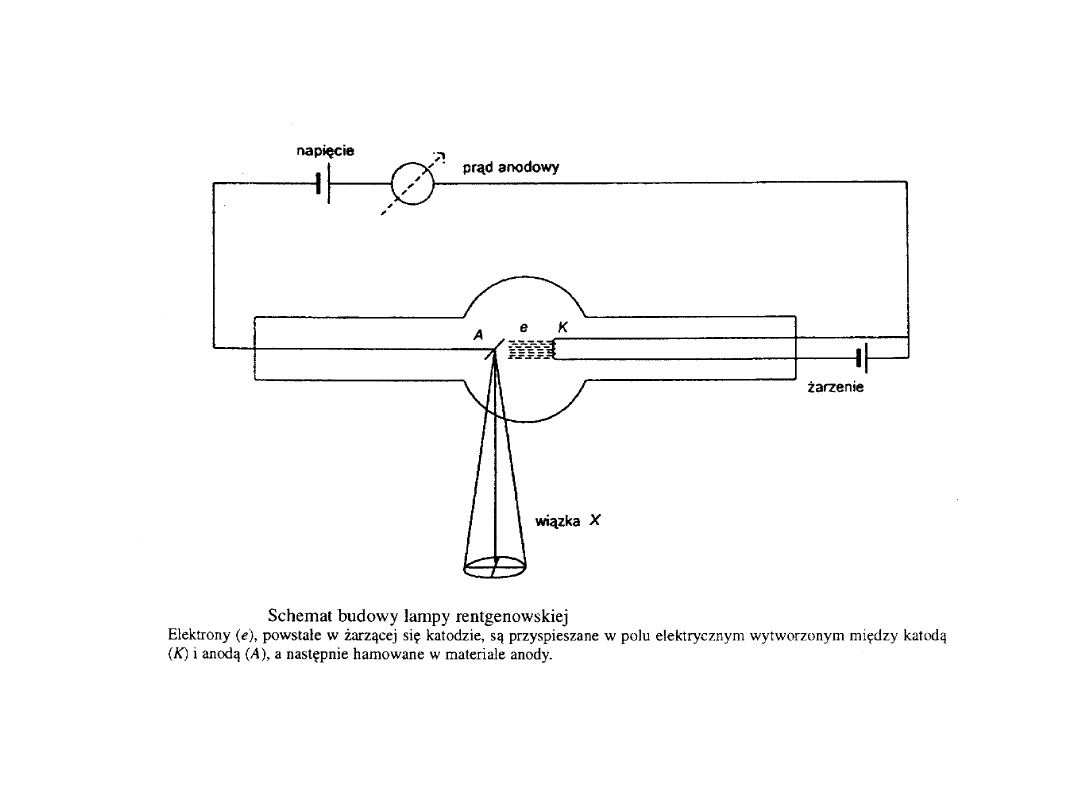

E = eU
min
max
c
h
h
eU
eU
hc
min
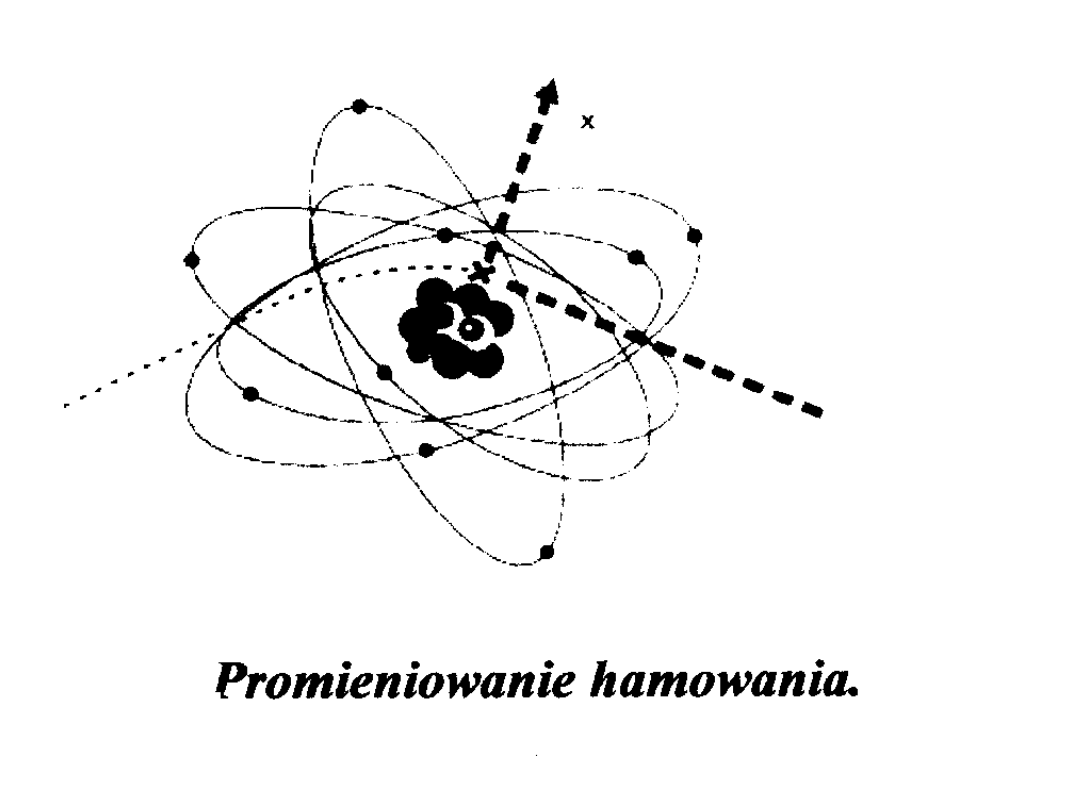
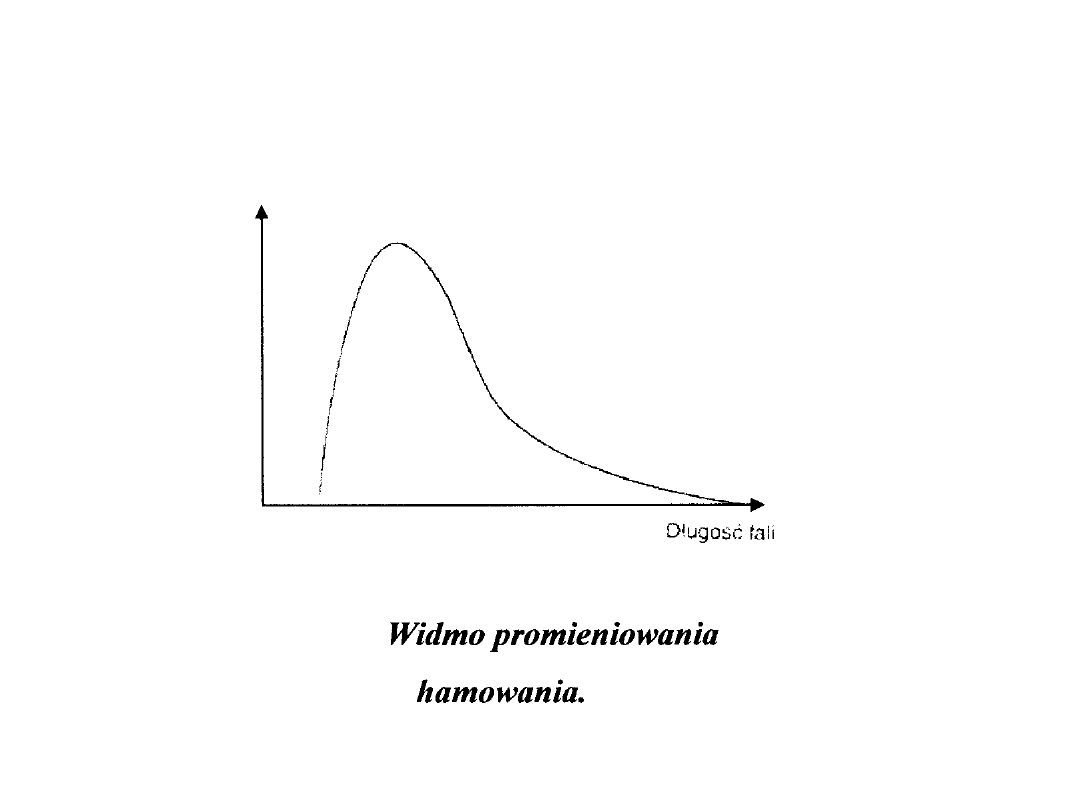
WIDMO PROMIENIOWANIA X
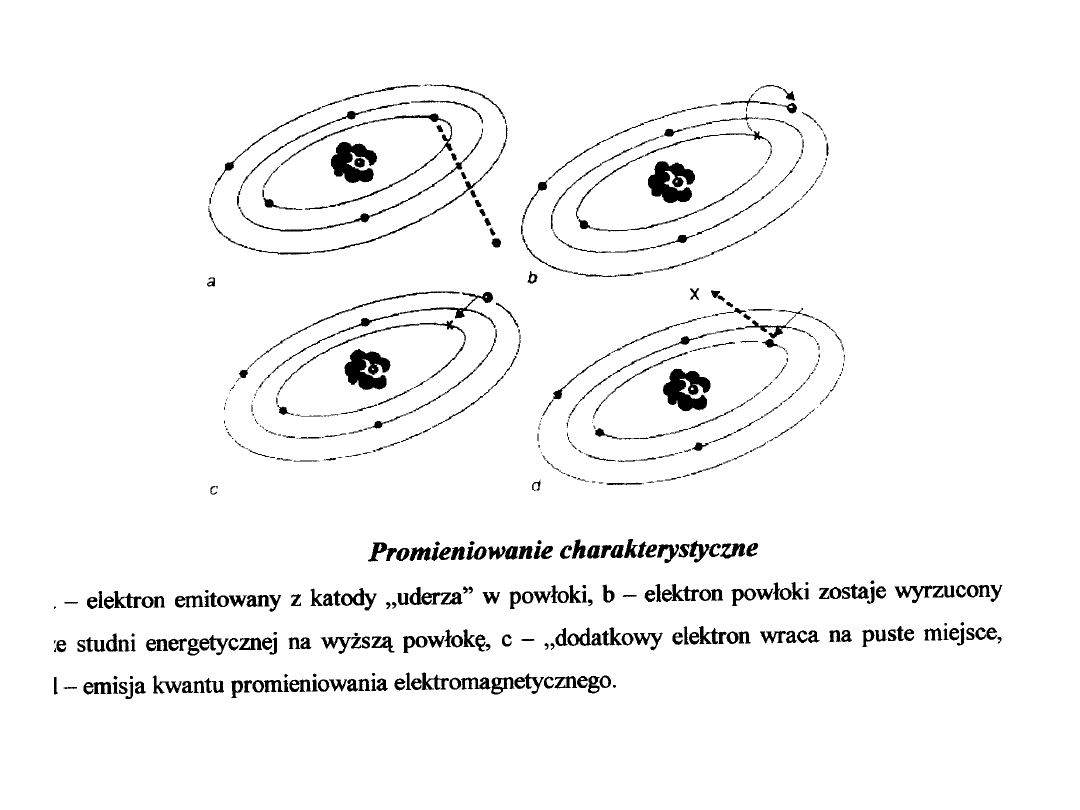
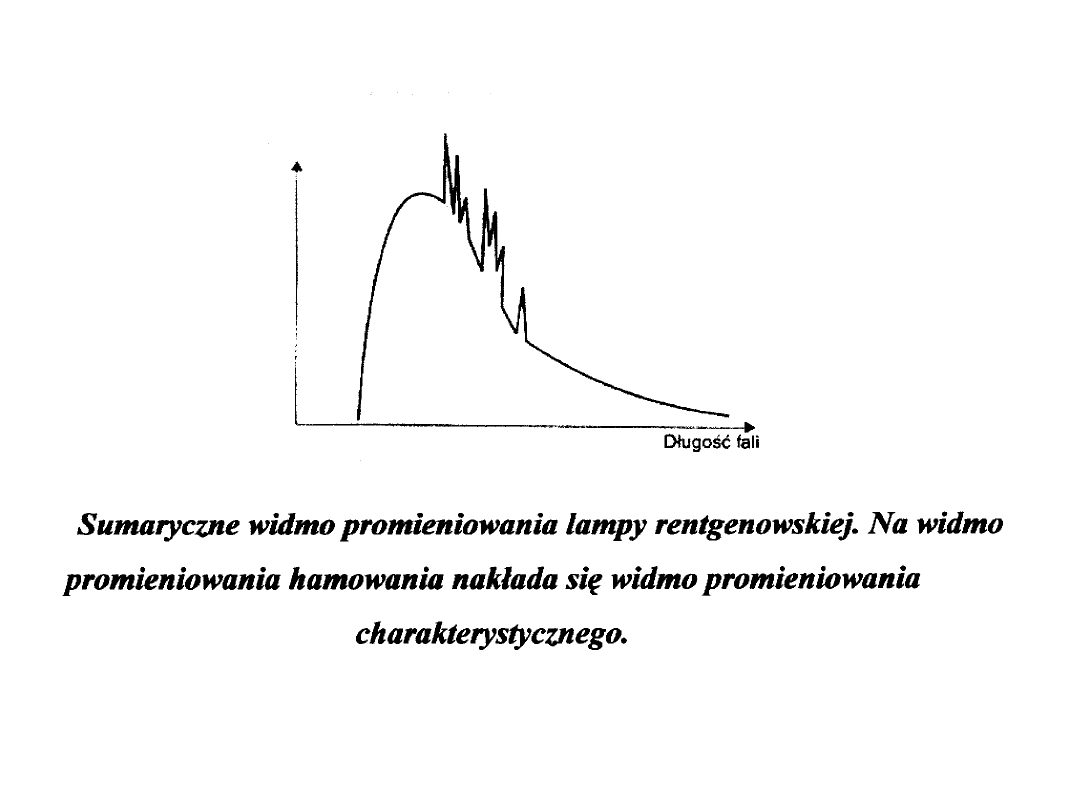

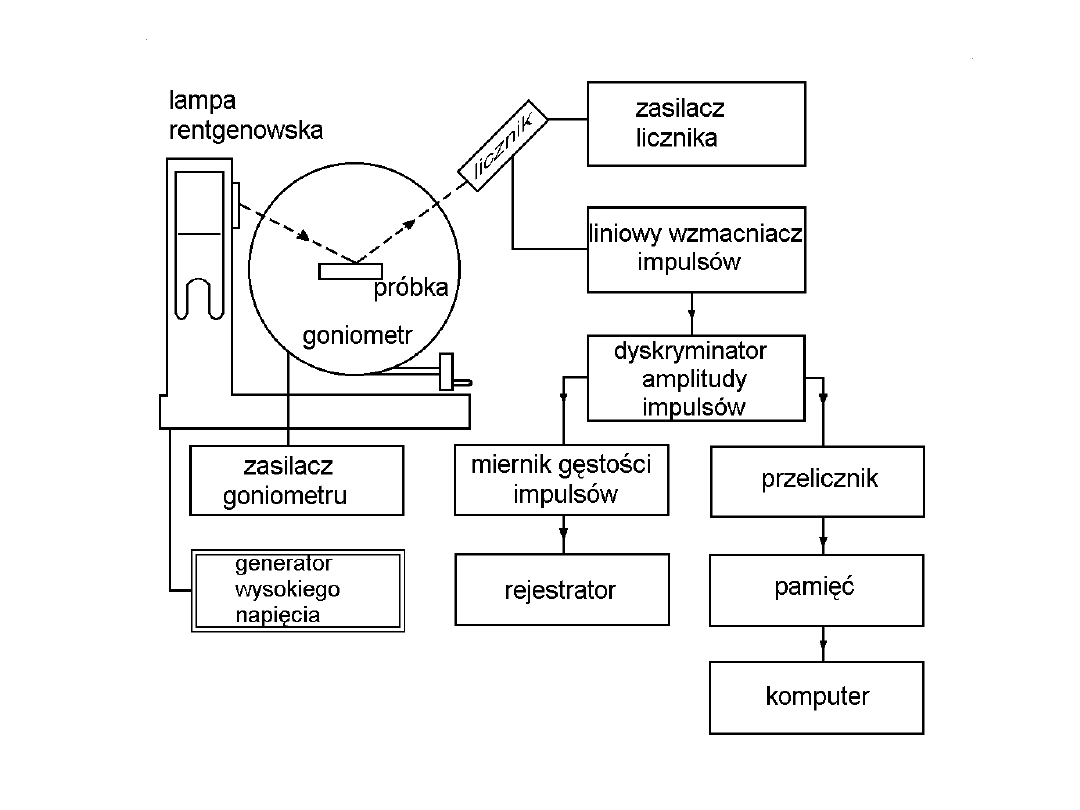
WŁASNOŚCI PROMIENIOWANIA X
d
-
0
e
I
I
I
x
= A Z I
a
U
2
a
I
x
– strumień fotonów prom. X;
A – stała zależna od konstrukcji lampy;
Z - liczba atomowa materiału tarczy;
I
a
- natężenie prądu anodowego;
U
a
- napięcie na lampie rentgenowskiej.
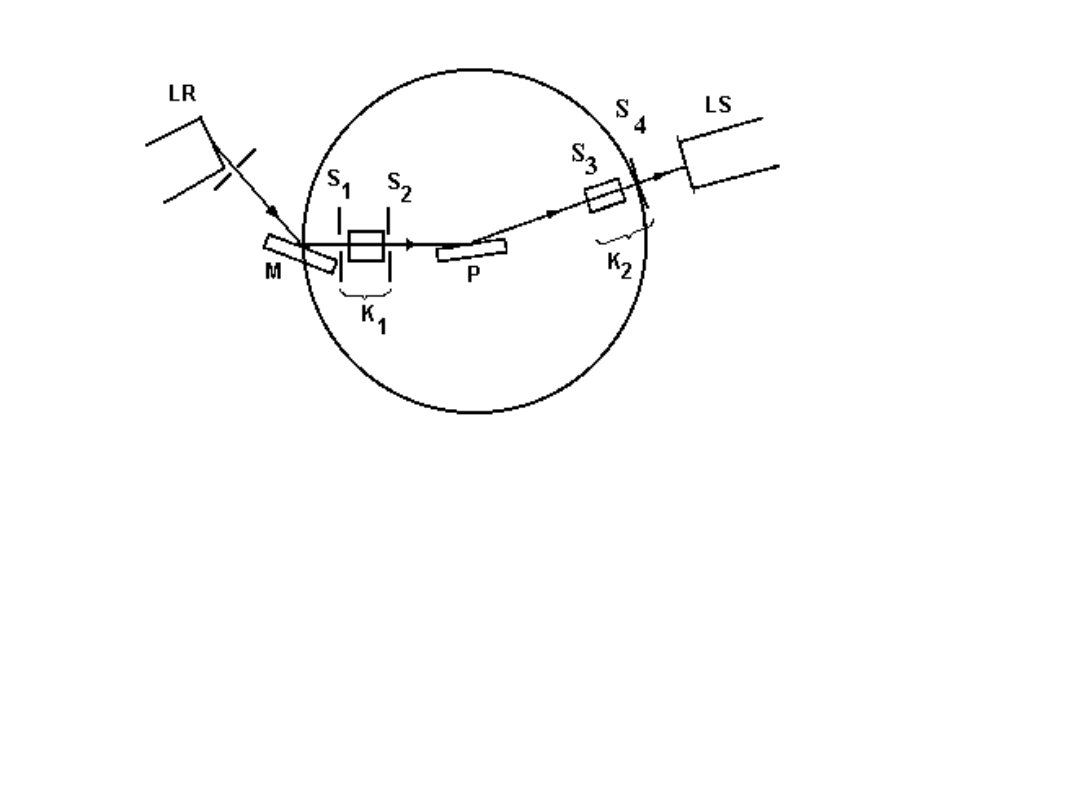
LR
- lampa rentgenowska,
K
1
- kolimator wiązki pierwotnej,
K
2
- kolimator wiązki wtórnej,
M
- monochromator grafitowy,
LS
- licznik scyntylacyjny,
P
- badana próbka,
S
1
, S
2
, S
3
, S
4
- szczeliny.

PROMIENIOTWÓRCZOŚĆ
NATURALNA
W roku 1896 francuski fizyk, A. Becquerel, badając sole
uranu stwierdził, że emitują one niewidzialne promienie,
wywołujące zaczernienie kliszy fotograficznej. Badanie
promieni uranu w polu magnetyczym wykazało, że
występują w nich trzy składowe.
Jedna odchyla się w polu magnetycznym tak, jak
powinien odchylić się strumień cząstek naładowanych
dodatnio. Składową tę nazwano promieniami a.
Druga składowa odchyla się jak strumień cząstek
naładowanych ujemnie, a trzecia — w ogóle nie doznaje
odchylenia w polu magnetycznym. Te składowe nazwano
odpowiednio promieniami i .

Dwa lata później Pierre Curie i Maria Curie-Skłodowska
odkryli; dwa nowe pierwiastki rad i polon wysyłające
promieniowanie analogiczne do promieniowania uranu,
ale o większym natężeniu. Odkryli oni ponadto, że
własności promieniotwórcze wykazuje znany dawniej
pierwiastek tor.
Dalsze badania wykazały, że odkryte promieniowanie:
a) może
wywoływać
działanie
biologiczne
i
chemiczne, w szczególności zaczernienie kliszy
fotograficznej,
b) jonizuje gazy,
c) wzbudza luminescencję licznych ciał stałych i
ciekłych,
d) jest bardzo przenikliwe
.

Najbardziej przenikliwe są promienie , przenikają one
przez grube warstwy ciał stałych, zatrzymywane są
dopiero przez ciężkie metale takie jak ołów.
Najmniej przenikliwe są promienie , ale i one mogą
przenikać przez cienkie warstwy ciał stałych, całkowicie
są pochłaniane przez 2-3 milimetrową warstwę papieru.
Promieniowanie , jest praktycznie monoenergetyczną
wiązką
elektronów,
jest
średnio
przenikliwym
promieniowaniem, które praktycznie może być całkowicie
zaabsorbowane przez kilku milimetrową warstwę
lekkiego metalu np. aluminium.

PRAWO ROZPADU
PROMIENIOTWÓRCZEGO
Jeśli
m
0
oznacza
masę
pierwotną
pierwiastka
promieniotwórczego, to empirycznie prawo zaniku tej
ilości z czasem ma postać:
m = m
0
e
t
gdzie jest stałą rozpadu promieniotwórczego.
Prawo to łatwo można objaśnić, jeśli przyjąć, że liczba
atomów —dN, rozpadających się w czasie dt jest
proporcjonalna do liczby wszystkich atomów:
dN = N dt
Biorąc pod uwagę liczbę atomów pierwiastka
promieniotwórczego:
N = N
0
e
-t

Całkowanie prowadzi do wzoru:
lnN = t + C
gdzie C jest stałą całkowania.
To ostatnie równanie możemy zapisać w postaci:
dN/N = dt
Dla (t = 0) mamy lnN
0
= C,
gdzie N
0
jest pierwotną liczbą atomów
.
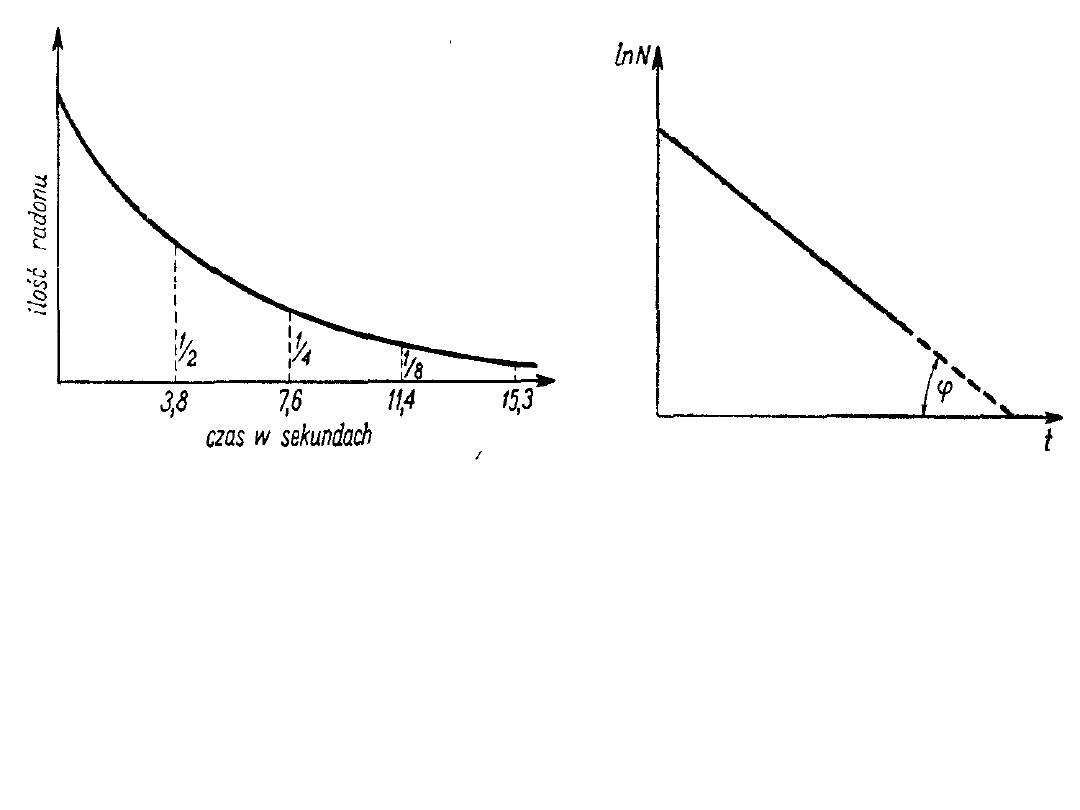
Krzywa rozpadu radonu Krzywa
zależności ln N od czasu

Korzystając z otrzymanej wartości C (lnN
0
= C), możemy
napisać, że:
lnN/N
0
= t lub N = N
0
e
t
Prawo rozpadu jest słuszne dla wszystkich
pierwiastków promieniotwórczych.
Stałą rozpadu łatwo możemy powiązać z czasem
połowicznego zaniku T
1/2
.
Zgodnie z definicją dla t = T
1/2
mamy N = ½ N
0
, a stąd
po uwzględnieniu:
N = N
0
e
t
otrzymamy:
½
=
e
t

Logarytmując to wyrażenie uzyskamy:
T
1/2
= ln2
a więc
T
1/2
= ln2/ = 0.693/
Drugą
ważną
wielkością
charakteryzującą izotop
promieniotwórczy jest aktywność izotopu A.
A = dN/dt
Jednostką aktywności w układzie SI jest
1Bq = 1 rozpad/s.
Ponadto używa się także jednostki Kiur [Ci]:
1 Ci = 3.7 x 10
10
rozpadów/s

RAZPADY PROMIENIOTWÓRCZE.
REGUŁA PRZESUNIĘĆ
Rozpad promieniotwórczy, odbywa się zgodnie z prawem
zachowania
ładunków
elektrycznych
i
prawem
zachowania energii całkowitej.
W myśl pierwszego z tych praw - suma ładunków
powstających cząstek równa się ładunkowi jądra
wyjściowego.
Drugie prawo można zapisać w następujący sposób:
jeśli m
j
oznacza masę jądra wyjściowego, a m
i
masę
powstających cząstek:
2
i
j
c
E
m
m
gdzie E jest ilością energii, która wydzieliła się podczas
rozpadu,
c zaś — prędkością światła w próżni.

Ponieważ w zjawisku promieniotwórczości naturalnej E
odpowiada masie
(E = mc
2)
,
wyrażającej się niewielkim
ułamkiem jednostki masy atomowej, więc z równania
wynika, że
suma liczb masowych powstających cząstek równa się
liczbie masowej jądra wyjściowego.
Wykazano, że przemiany promieniotwórcze radu polegają
na wyrzucaniu cząstek ; taki proces nazywa się
rozpadem
.
Następny typ rozpadu wiąże się z emisją promieni .
Doświadczenia
nad
odchylaniem
promieni
ciał
promieniotwórczych w polu magnetycznym wykazały, że
promienie stanowią strumień bardzo szybkich
elektronów.
Okazuje się więc, że rozpad polega na wyrzucaniu
elektronu z jądra pierwotnego.

Trzeci rodzaj promieniowania — promienie są
promieniowaniem elektromagnetycznym; natura ich jest
identyczna z naturą krótkofalowego promieniowania
rentgenowskiego.
Promieniowanie
towarzyszy rozpadowi
lub
.
Prawo zachowania ładunków i prawo stałości sum liczb
masowych prowadzą do tak zwanych reguł przesunięć,
które pozwalają określić| jaki nowy pierwiastek powstaje
w wyniku danego rozpadu lub rozpadu
+
i
oraz
.
Podczas rozpadu z jądra wyjściowego zostaje
wyrzucone jądro atomu helu
2
He
4
, tj. cząstka o liczbie
atomowej 2 i liczbie masowej 4.
Dlatego też powstający pierwiastek powinien mieć liczbę
atomową (numer porządkowy w tablicy Mendelejewa) o
dwie jednostki mniejszą i liczbę masową o cztery
jednostki mniejszą niż jądro wyjściowe.

Oznaczając jądro wyjściowe symbolem X,
a jądro powstające — symbolem Y,
zapiszemy rozpad w postaci następującego schematu
Q
He
X
4
2
4
-
A
2
-
Z
A
Z
Y
Ponieważ liczba atomowa wyznacza miejsce pierwiastka
w tablicy okresowej Mendelejewa, więc ze schematu
wynika, że:
wskutek rozpadu powstaje nowy pierwiastek,
stojący w układzie okresowym Mendelejewa o dwa
miejsca przed pierwiastkiem wyjściowym.

Podczas rozpadu
z jądra pierwiastka wyjściowego
zostaje wyrzucony elektron.
Masa elektronu jest prawie dwa tysiące razy mniejsza od
masy atomu wodoru; można więc w przybliżeniu przyjąć
liczbę masową elektronu za zero.
Ładunek elektronu równy jest co do wartości
bezwzględnej ładunkowi protonu, jednak ma znak
ujemny, więc należy przyjąć Z = l.
W związku z tym będziemy oznaczać elektron symbolem
e
0
1
i schemat rozpadu
-
przybierze postać:
Q
e
Y
X
0
1
A
1
Z
A
Z

Liczba masowa nowego jądra równa się liczbie masowej
jądra wyjściowego, a jego liczba atomowa jest o jedność
większa.
Wskutek rozpadu
--
powstaje nowy pierwiastek,
stojący w układzie okresowym Mendelejewa o jedno
miejsce za pierwiastkiem wyjściowym.
Podczas rozpadu
+
z jądra pierwiastka wyjściowego
zostaje wyrzucony pozyton.
Masa pozytonu jest taka sama jak masa elektronu.
Ładunek pozytonu jest także równy co do wartości
bezwzględnej ładunkowi elektronu.
m
e
+
= m
e
-
q
e
-
= q
e
+
W związku z tym będziemy oznaczać pozyton symbolem:
e
0
1

schemat rozpadu
+
przybierze postać:
Q
e
Y
X
0
1
A
1
Z
A
Z
Liczba masowa nowego jądra równa się liczbie masowej
jądra wyjściowego, a jego liczba atomowa jest o jedność
mniejsza.
Wskutek rozpadu
-+
powstaje nowy pierwiastek, stojący
w układzie okresowym Mendelejewa o jedno miejsce
przed pierwiastkiem wyjściowym.

Przytoczone dwie reguły przesunięć pozwalają całkowicie
zorientować się we wszystkich kolejnych przemianach,
występujących
w
procesie
promieniotwórczości
naturalnej pierwiastków ciężkich, spotykanych w
skorupie ziemskiej.
Okazuje się, że istnieją trzy szeregi albo trzy rodziny
pierwiastków promieniotwórczych,
które biorą swój początek odpowiednio od uranu
92
U
288
,
toru
90
Th
232
i izotopu uranu
92
U
235
zwanego także aktyno-
uranem (AcU).
Ostatni szereg nazywa się szeregiem aktynowym.
Wszystkie trzy szeregi zaczynają się od pierwiastków o
bardzo dużym okresie połowicznego zaniku:

92
U
288
ma okres połowicznego zaniku
= 4.4 •10
9
lat
dla toru
90
Th
232
= 1.8 •10
10
lat
Dla aktyno-uranu (AcU)
92
U
235
= 4,4 •10
8
lat.
Te długie okresy tłumaczą fakt występowania w skorupie
ziemskiej pierwiastków promieniotwórczych. W odległych
epokach
powstawały
zapewne
te
pierwiastki
z
pierwiastków lżejszych. Znalazłszy się w skorupie
ziemskiej
pierwiastki
te
zapoczątkowały
szeregi
wszystkich
naturalnych
pierwiastków
promieniotwórczych.
W czasie, który upłynął od ich powstania, nie zdążyły się
one rozpaść całkowicie.
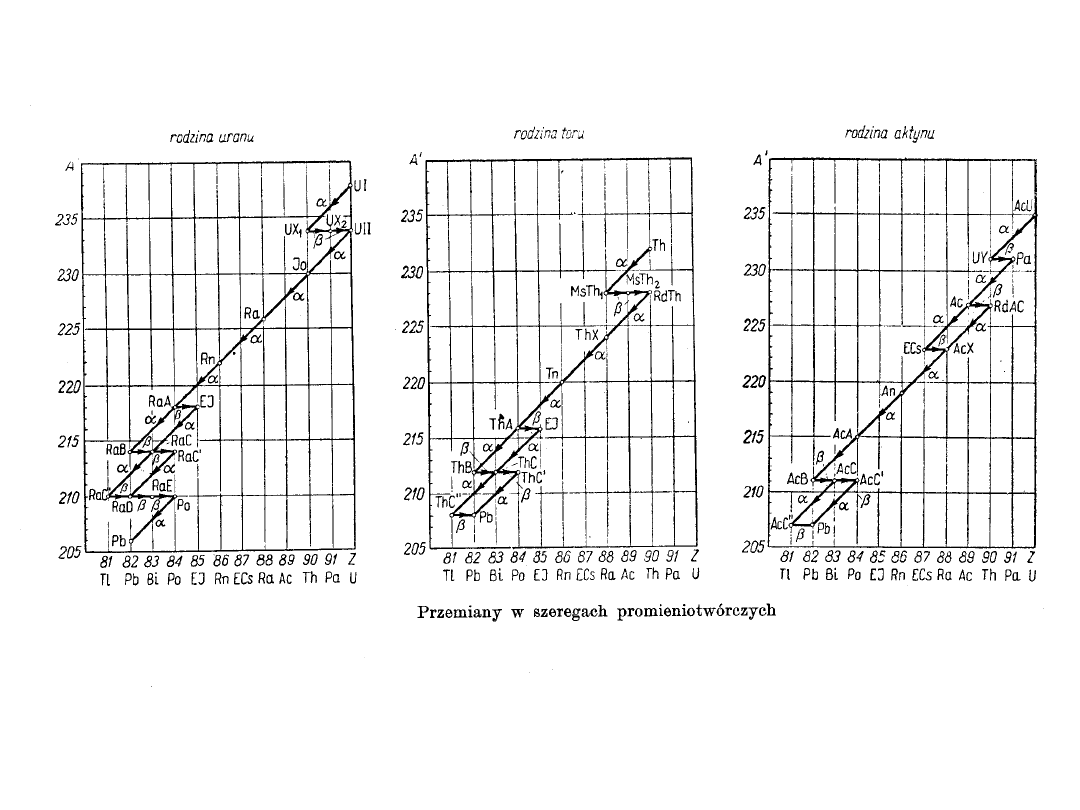

Naturalnym złożom pierwiastków promieniotwórczych
towarzyszy zawsze ołów, który jest końcowym produktem
ich rozpadu.
szereg uranowy kończy się izotopem Pb
206
,
torowy — izotopem Pb
208
aktynowy — izotopem Pb
207
.
w rudach uranowych (zawierających U
238
i U
235
)
występuje ołów, stanowiący mieszaninę dwóch izotopów
Pb
208
i Pb
207
zaś w rudach torowych — ołów, będący czystym izotopem
Pb
208
.
Jest to jedyny przypadek, gdy trwałe izotopy występują w
skorupie ziemskiej rozdzielone.

Prócz wymienionych pierwiastków promieniotwórczych
słabą promieniotwórczość wykazuje jeszcze:
potas
(
= 1.3 • 10
9
lat),
rubid
(
== 6.5 • 10
10
lat)
samar
(
= 6,7 • 10
11
lat).
Wiemy obecnie, że istnieje również dużo izotopów
promieniotwórczych innych pierwiastków, które nie
występują jednak w postaci naturalnej w skorupie
ziemskiej i mogą być otrzymane jedynie w drodze
sztucznych przemian.
Tłumaczy się to w ten sposób, że dla wszystkich tych
izotopów okres połowicznego zaniku jest stosunkowo
krótki, i dlatego jeśli one nawet występowały
kiedykolwiek w skorupie ziemskiej, to zdążyły już rozpaść
się całkowicie.

Rozpad promieniowania :
h
X
X
*
A
Z
*
A
Z
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
Wyszukiwarka
Podobne podstrony:
Promieniowanie wstęp
Wyznaczanie widma promieniowania g wstep, Sprawozdania - Fizyka
Wstęp Promieniowanie gamma
SI wstep
Zajęcie1 Wstęp
Wstęp do psychopatologii zaburzenia osobowosci materiały
3B Promieniowanie jonizujące
układ naczyniowy wstep
ZMPST Wstep
Dekalog 0 wstęp
1 WSTEP kineza i fizykot (2)
sem 2 promieniowanie rtg
Promieniowanie ultrafioletowe
01 AiPP Wstep
wstęp neg
więcej podobnych podstron