
Nomenklatura związków
organicznych
International Union of Pure and Applied Chemistry (I
UPAC) międzynarodowa organizacja powstała w 1918 r
zajmująca się standaryzacją symboliki, nazewnictwa i
wzorców wielkości fizycznych stosowanych przez
chemików na całym świecie wydawca tzw. Kolorowych
Ksiąg, w tym
Księgi Niebieskiej
-Nomenklatura w chemii
organicznej
Członkiem IUPAC jest Polskie Towarzystwo Chemiczne,
wydawca polskie wersji zeszytów Nomenklatury
Związków Organicznych 1978 (ostatnie wydanie
Warszawa, 1992)

Węglowodor
y
Związki zbudowane
wyłącznie z atomów
węgla i wodoru
Chemia organiczna
- nauka zajmująca
się połączeniami chemiczymi tworzonymi
przez węgiel z innymi pierwsiastkami
(zwłaszcza wodorem tlenem i azotem)
Unikalna zdolność do tworzenia łańcuchowych lub
pierścieniowych połączeń zawierających wiele
pojedyńczych lub wielokrotnych wiązań
C-C

Węglowodory
acykliczne
Liczba
Rdzeń
Liczb
a
Rdzeń grecki
grecki
łaciński
1/2
hemi-
semi-
24
tetrakoza-
1
mono-
uni-
25
pentakoza-
1 1/2
sesqui-
26
heksakoza-
2
di-
bi-
27
heptakoza-
3
tri-
tri-, ter-
28
oktakoza- '
4
tetra-
quater-
29
nonakoza-
5
penta
quinciq
e-
30
triakpnta-
6
heksa-
sexi-
31
hentriakonta-
7
hepta-
septi-
32
dotriakonta-
8
okta
octo-
.33
tritriakonta-
9
ennea
nona-
34
tetratriakonta
-
10
deka-
35
pentatriakont
a-
11
hendeka- undeka-
40
tetrakonta-
12
dodeka-
50
pentakonta-
13
trideka-
60
heksakonta-
14
tetradeka
-
70
heptakonta-
15
pentadek
a-
80
oktakonta-
16
heksadek
a-
90
nonakonta-
17
heptadek
a-
100
hekta-
18
oktadeka-
101
henhekta-
19
nonadeka
-
102
dohekta-
20
ejkoza-
110
dekahekta-
21
henejkoza
-
120
ejkozahekta-
22
dokoza-
132
dotriakontahe
kta-
23
trikoza-
200
dikta-
Reguła A—1. Związki nasycone o
łańcuchu nierozgałęzionym i
grupy jednowartościowe
1. 1 — Pierwsze cztery nasycone
nierozgałęzione węglowodory
acykliczne nazywają się metan,
etan, propan i butan. Nazwy
wyższych członów szeregu
homologicznego tworzy się ze
słownego rdzenia liczebnikowego
(pochodzenia greckiego) i
przyrostka „-an", opuszczając
końcowe „ a " z nazwy liczebnika.
Liczebniki greckie i przykłady
nazw węglowodorów umieszczone
są w tablicy obok.
2.1 - Nazwy rozgałęzionych
acyklicznych węglowodorów
nasyconych tworzy się przez
umieszczenie przedrostka
określającego nazwę łańcucha
bocznego przed nazwą
najdłuższego łańcucha węglowego
występującego w cząsteczce.

2.2 — Atomy węgla w
najdłuższym łańcuchu węglowym
numeruje się cyframi arabskimi
począwszy od atomu
krańcowego; kierunek numeracji
dobiera się w ten sposób, aby
położenie łańcuchów bocznych
określić przy pomocy możliwie
najmniejszych wskaźników
liczbowych (lokantów). W
przypadku obecności szeregu
identycznych podstawników
numerację prowadzi się w ten
sposób, aby pierwsza liczba
oznaczająca położenie
podstawnika (lokant) była
najmniejsza.
W przypadku takich samych
pierwszych lokantów, uwzględnia
się wielkość drugiego i wybiera
się mniejszy.
2,3,5-trimetyloheksan nie:
2,4,5-trimetyloheksan)

2.25 — Nazwy
jednowartościowych
rozgałęzionych grup
alkilowych pochodzących od
alkanów tworzy się
umieszczając w przedrostku
nazwy nierozgałęzionej grupy
alkilowej, zawierającej
najdłuższy łańcuch węglowy,
nazwę łańcucha bocznego.
Atom węgla z wolną
wartościowością oznacza się
numerem 1.
1-
metylopentyl
2-
metylopentyl
5-
metyloheksyl
2.3 — W przypadku
obecności dwóch lub
większej liczby łańcuchów
bocznych, wymienia się je
w porządku alfabetycznym
etyl wymienia się przed metylem,
a więc: 4-etylo-3,3-dimetyloheptan
3.1 — Nazwy nienasyconych
nierozgałęzionych węglowodorów
acyklicznych, zawierających jedno
wiązanie podwójne tworzy się przez
zamianę przyrostka „-an’na przyrostek „-
en". W przypadkach dwu lub więcej
wiązań podwójnych stosuje się
przyrostek ,,-adien", ,,-atrien
1,4-
heksadien
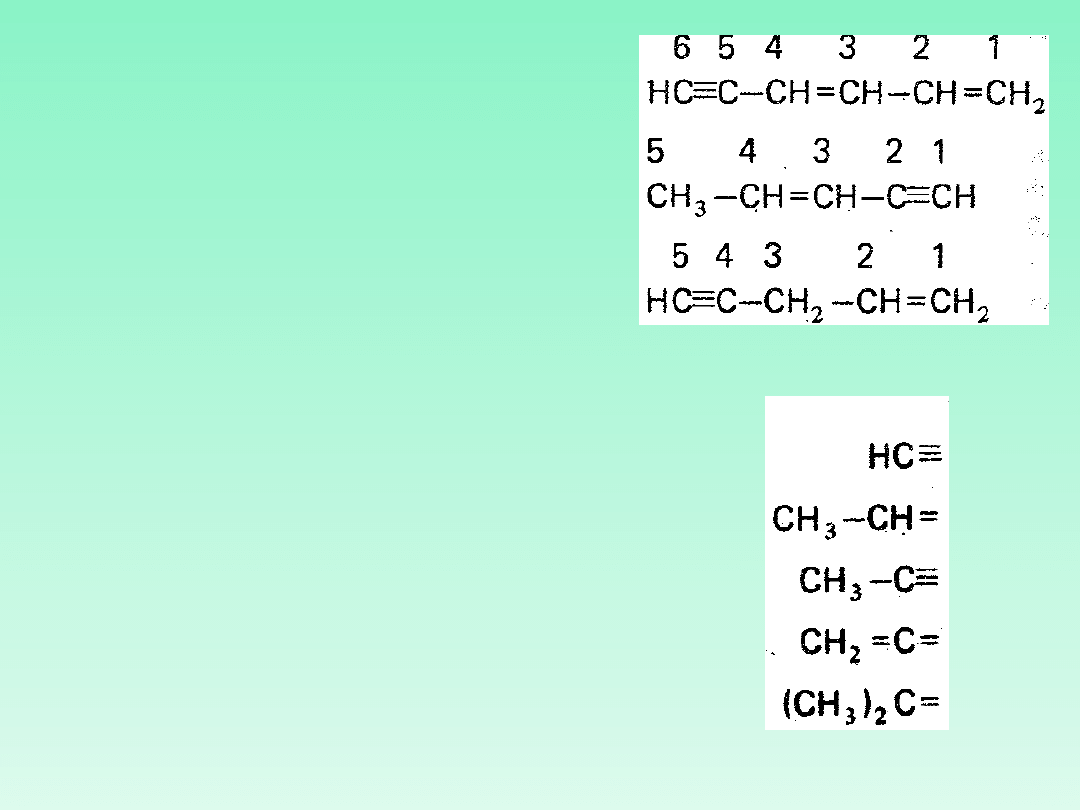
3.2 — Nazwy
nienasyconych
acyklicznych
węglowodorów
nierozgałęzionych
zawierających jedno
wiązanie potrójne tworzy
się przez zamianę
przyrostka „-an" na
przyrostek ,,-yn" lub ,,-in".
W przypadku większej
liczby wiązań potrójnych
stosuje się przyrostki „-
adiyn", „-atriyn" itd.
Ogólną nazwą tych
węglowodorów
(rozgałęzionych i
nierozgałęzionych) jest
„alkin", „alkadiyn",
„alkatriyn" itd.
1,3-heksadien-
5-yn
3-penten-1-yn
1-penten-4-yn
4.1— Grupy dwu- i trójwartościowe
powstałe z węglowodorów
acyklicznych, których nazwy kończą
się na „yl" i utworzone przez
odjęcie jednego lub-dwóch atomów
wodoru od atomu węgla z jedną
wolną wartościowością —
nazywamy przez dodanie przyrostka
„iden" lub „-idyn". Atom węgla z
wolnymi wartościowościami
oznacza się lokantem 1.
metylidyn
etyliden
etylidyn
winyliden
izopropylid
en

4.2 - Grupy dwuwartościowe utworzone z
nierozgałęzionych alkanów przez usunięcia
atomów wodoru z obu końcowych atomów
węgla łańcucha nazywają się: etylen,
trimetylen, tetrametylen
A utworzonych z nierozgałęzionych
alkenów, alkadie-nów itp. przez usunięcie
atomów wodoru z obu końcowych atomów
węgla łańcucha tworzy się przez zamianę
przyrostków na przyrostki „-enylen„
„-dienylen", „-ynylen" lub „inylen" itd.
4-propylo-2-
pentenylen
11.1 — Nazwy nasyconych
węglowodorów monocyklicznych
(bez łańcuchów bocznych) tworzy
się przez dodanie przedrostka
„cyklo" do nazwy odpowiedniego
acyklicznego alkanu
12.2 - Monocykliczne
podstawione węglowodory
aromatyczne nazywane są jako
pochodne benzenu. Natomiast jeśli
podstawnik wprowadzony do
takiego związku jest identyczny z
jednym już obecnym, to
podstawiony związek nazywa się
tak jak pochodną benzenu
12.3 — Położenia podstawników w
zwiazkach aromatycznych określa
się numerami, z wyjątkiem
dwupodstawionych pochodnych
benzenu, dla których można
stosować odpowiednio określenia
o- {orto), m- {meta) i p- {para}
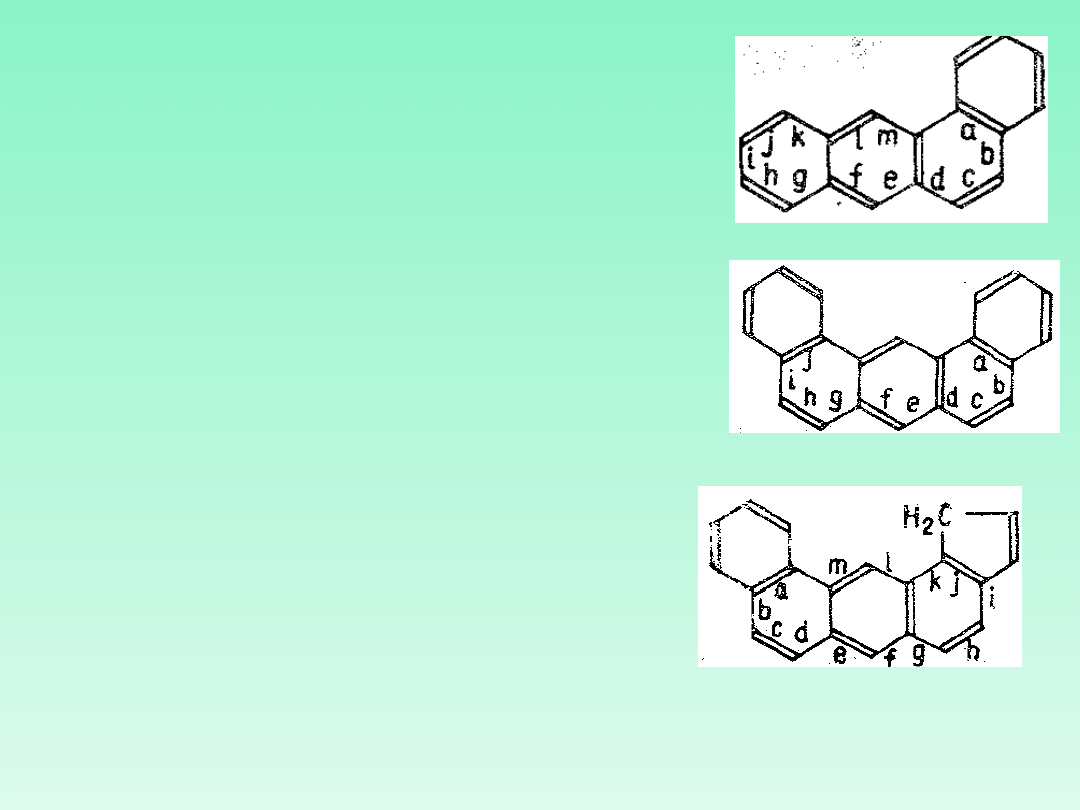
21.5 — Izomery
skondensowanych
węglowodorów
policyklicznych oznacza się
za pomocą literowania
krawędzi znajdujących się na
obwodzie układu składnika
podstawowego: a, b, c,
itd.począwszy od litery „a"
dla krawędzi „1,2"; ,b" dla
„2,3" (lub w niektórych
przypadkach „2,2a") itd.
dookoła układu
pierścieniowego. Do litery
możliwie bliskiej początku
alfabetu, oznaczającej
krawędź skondensowania,
dodaje się (jeśli to konieczne
w celu uniknięcia
dwuznaczności) cyfry
określające miejsce
skondensowania w drugim
składniku. Cyfry dobiera się
w ten sposób, aby były one
najniższe i zgodne z
numeracją składnika;
kolejność tych cyfr powinna
być zgodna z kierunkiem
literowania składnika
podstawowego
Benz[a]antrac
en
dibenz[a,j]antracen
(nie nafto[2,1-
b]fenantren)
1H-
benzo[a]cyklopent[j]antrac
en
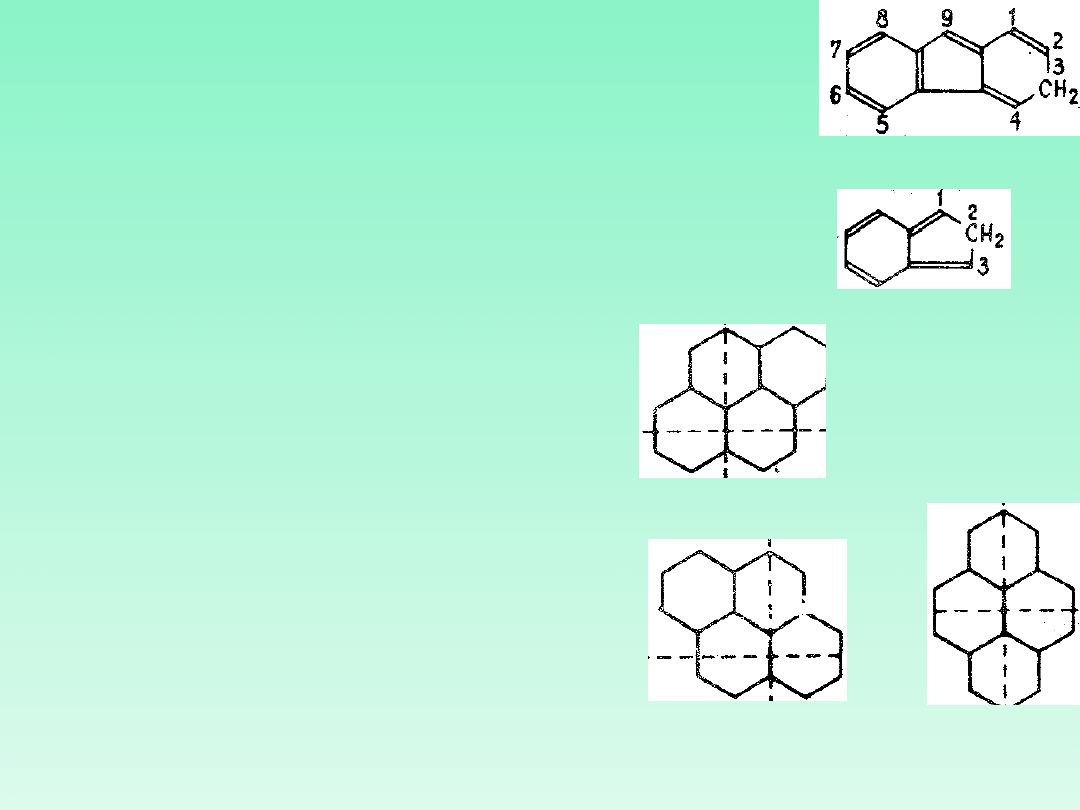
21.6 — W przypadkach gdy tę samą nazwę stosuje się do
dwu lub więcej izomerycznych skondensowanych
układów pierścieniowych z maksymalną liczbą
nieskumulowanych wiązań podwójnych, określoną nazwę
tworzy się przez wskazanie położenia jednego lub
większej liczby atomów wodoru w strukturze związku.
Dokonuje się tego przez dodanie dla każdego atomu
wodoru dużej litery H pisanej kursywą i poprzedzonej
lokantem. Symbol ten zazwyczaj poprzedza nazwę
związku. Taki atom lub atomy nazywa się „wskazanym,
atomem wodoru".
3H-fluoren
2H-inden
A22 — Numeracja. W celu prawidłowej
numeracji orientację rysunku układu
policyklicznego ustala się w ten sposób, aby
(a) największa liczba pierścieni leżała w
szeregu poziomym i (b) największa liczba
pierścieni leżała w górnej części rysunku po
prawej stronie szeregu poziomego (górny
prawy kwadrant). W przypadku gdy
wymaganiom tym odpowiadają dwie lub
więcej orientacji, to wybrać należy tę, która
ma najmniejszą liczbę pierścieni w dolnym
lewym kwadrancie. układ numeruje się w
kierunku zgodnym z ruchem wskazówek
zegara zaczynając od atomu węgla nie
znajdującego się na złączu pierścieni,
znajdującego się w najdalszym położeniu w
kierunku niezgodnym z ruchem wskazówek
zegara w górnym prawym pierścieniu. W
numeracji pomija się atomy węgla wspólne
dla dwu lub więcej pierścieni.
prawidłow
o
nieprawidło
wo
nieprawidłowo
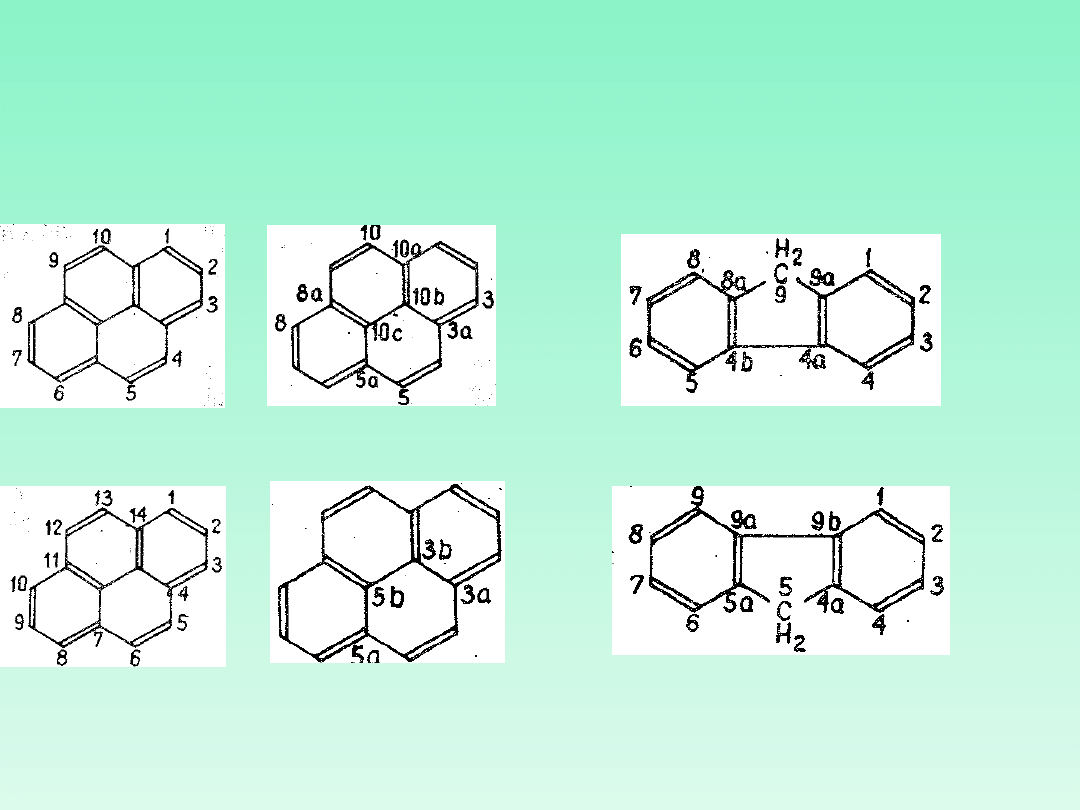
22.2 — Atomy na złączach, wspólne dla dwóch lub większej liczby pierścieni
oznacza się przez dodanie liter „a", ,b", „c" itd. bezpośrednio po numerach
określających położenia sąsiedniego atomu węgla w kierunku numeracji.
Atomy mieszczące się wewnątrz układu pierścieniowego oznacza się
najwyższymi numerami, w kolejności zgodnej z ruchem wskazówek zegara.
22.3 — W przypadkach gdy istnieje możliwość wyboru, atomy węgla leżące
na złączach dwóch lub większej liczby pierścieni oznacza się możliwie
najniższymi numerami.
prawidło
wo
prawidło
wo
prawidło
wo
nieprawidło
wo
nieprawidło
wo
nieprawidło
wo
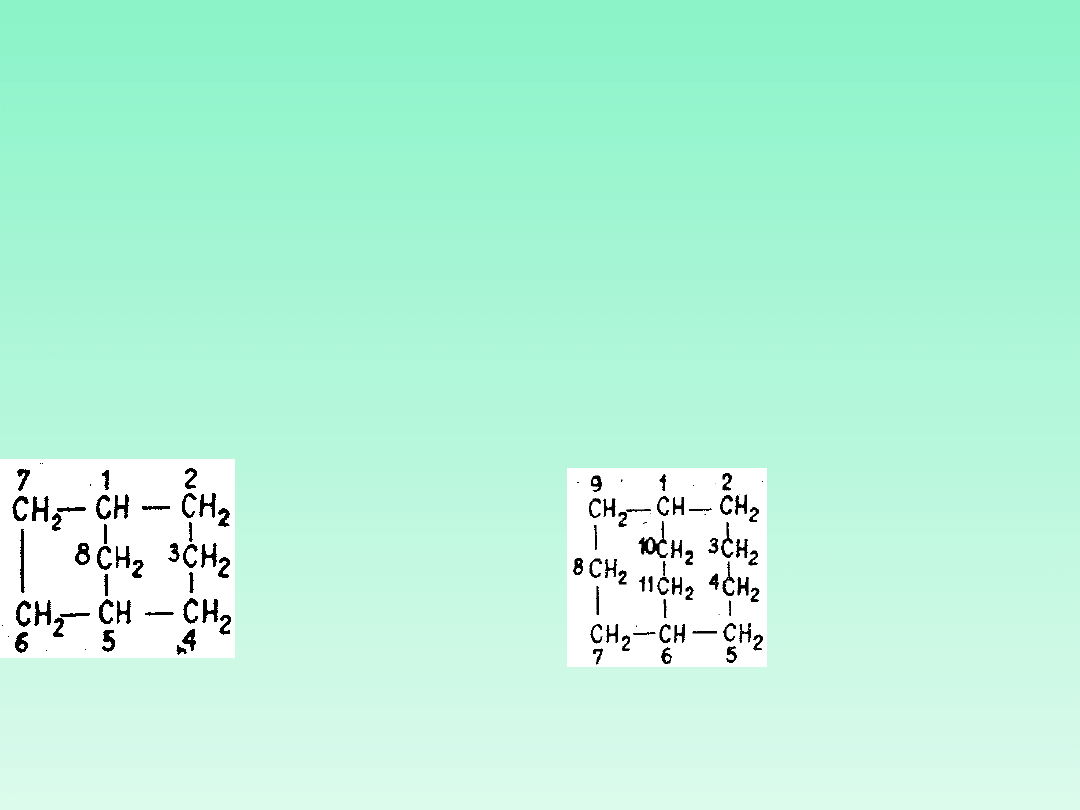
Węglowodory
mostkowe
31.1 — Nazwy nasyconych układów węglowodorów alicyklicznych
zawierających dwa pierścienie i dwa lub większą liczbę wspólnych atomów,
tworzy się z nazw odpowiednich węglowodorów łańcuchowych przez
dodanie przedrostka „bicyklo-". Liczby atomów węgla w każdym z trzech
mostków* związanych z dwoma trzeciorzędowymi atomami węgla umieszcza
się w nawiasach kwadratowych w szeregu liczb malejących.
*Mostkiem nazywa się wiązanie kowalencyjne , atom, albo też nierozgałęziony łańcuch atomów
wiążących dwie różne części cząsteczki. Trzeciorzędowe atomy węgla powiązane mostkiem
nazywają się atomami ,,przyczółkowymi”
31. 2 - Numerację układu rozpoczyna się od jednego spośród atomów
przyczółkowych (węzłowych) i prowadzi możliwie najdłuższą drogą ku
drugiemu atomowi przyczółkowemu (węzłowemu); numerację prowadzi się
dalej od tego ostatniego atomu dłuższą drogą do pierwszego atomu
przyczółkowego (węzłowego) i na końcu numeruje się najkrótszą drogę.
najdłuższa droga: 1, 2, 3, 4,
5
następna dłuższa droga: 5,
6, 7, 1
najkrótsza droga: 1, 8, 5
bicyklo[3.2.1]okt
an
bicyklo[4.3.2]und
ekan

32.11 — Nazwy układów węglowodorów pierścieniowych zawierających trzy
lub większą liczbę pierścieni tworzy się zgodnie z zasadami podanymi w
regule 31. Przedrostek „bicyklo-" zastępuje się odpowiednim przedrostkiem
„tricyklo-", „tetracyklo-" itd.
32.12 —
Liczba pierścieni w układzie policyklicznym jest równa liczbie cięć
niezbędnych do zamiany układu cyklicznego w układ acykliczny!!!!!!.
32.13 — Po słowie „cyklo" umieszcza się w nawiasie w kolejności malejącej
numery określające liczby atomów węgla w: obu gałęziach głównego
pierścienia, głównym mostku, dodatkowym mostku.
tricyklo [2.2.1.0]
heptan
tricyklo [5.3.1.1 ]
dodekan
(głównym,
największym
pierścieniem jest
układ
sześcioczłonowy 1-
6; głównym
mostkiem jest
mostek najdłuższy
od C-1 do C-4;
dodatkowym
mostkiem jest
najkrótszy od C-2
do C-6 i nie
zawierający
atomów węgla).
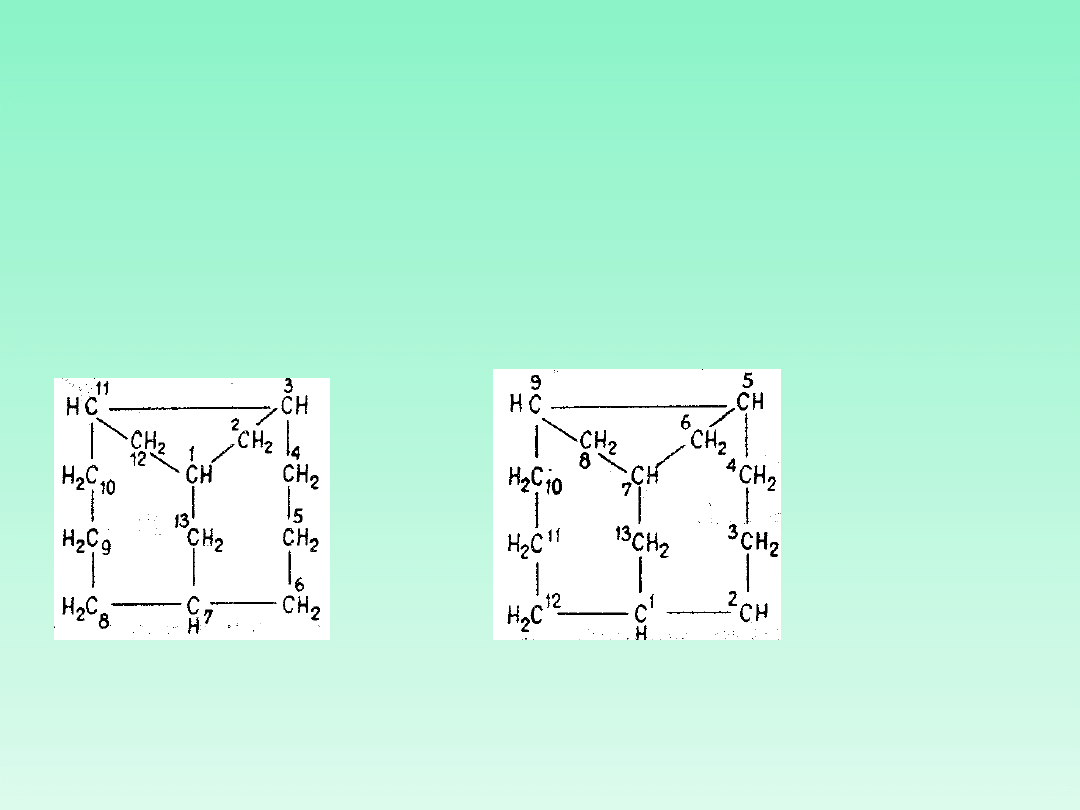
32.21 — Główny pierścień i główny mostek tworzą układ bicykliczny,
który numeruje się zgodnie z zasadami reguły 31.
32.22 — W celu ulokowania dodatkowych mostków nad liczbą
określającą ilość atomów węgla w dodatkowym mostku umieszcza się
górne wskaźniki pozycji
32.23 — Dodatkowe mostki numeruje się w porządku malejącym.
Numerację każdego łańcucha mostkowego rozpoczyna się od części
już numerowanej zaczynając od atomu przyczółkowego o najwyższym
numerze. W przypadku obecności mostków o jednakowej długości
numerację rozpoczyna się od atomu przyczółkowego o najwyższym
numerze.
Główny pierścień powinien zawierać możliwie jak największą liczbę
atomów węgla
Główny mostek powinien być najdłuższy z możliwych
Górne wskaźniki lokujące-dodatkowe mostki powinny być możliwie
najmniejsze
tricyklo[5.5.1.0
3
'
11
]tri
dekan
prawidłowa
numeracja
tricyklo[5.5.1.0
5
'
9
]trid
ekan nieprawidłowa
numeracja
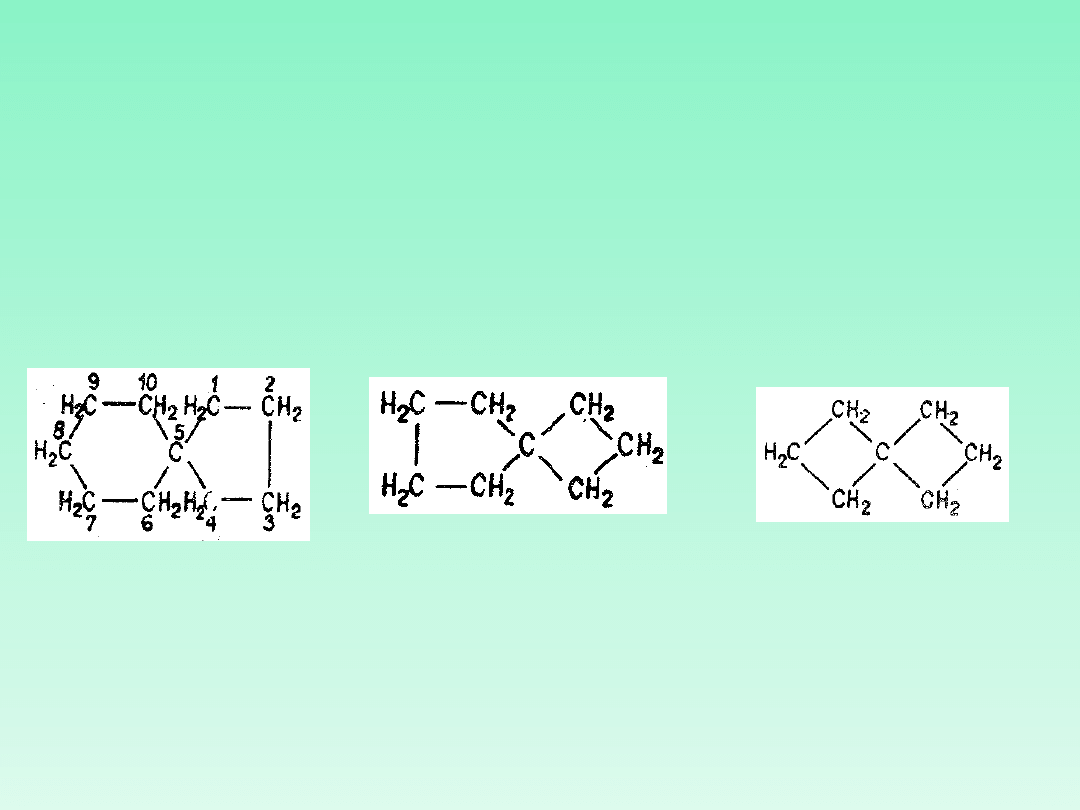
41.1 — Związki monospiranowe są zbudowane jedynie z dwóch pierścieni
alicyklicznych; nazwy tych związków tworzy się umieszczając przedrostek
„spiro" przed nazwą węglowodoru łańcuchowego nierozgałęzionego o tej
samej liczbie atomów węgla. Liczbę atomów węgla związanych z atomem
spiro w każdym pierścieniu podaje się w kolejności wzrastającej, w nawiasie
kwadratowym umieszczonym pomiędzy przedrostkiem spiro- a nazwą
węglowodoru
41.2 - Numerację atomów węgla w węglowodorach monospiranowych
rozpoczyna się od tego atomu pierścienia, który sąsiaduje z atomem spiro i
prowadzi się najpierw poprzez pierścień mniejszy (w przypadku gdy istnieje
w układzie), następnie przez atom spiro i wreszcie dookoła drugiego
pierścienia
Węglowodory
spiranowe
spiro[4.5]dek
an
spiro[3.4]ok
tan
spiro[3.3]hep
tan
PODSTAWOWE UKŁADY HETEROCYKLICZNE
ZAWIERAJĄCE HETEROATOMY
W przypadku odpowiednich heteroatomów wskazujemy ich obecność
używając odpowiednich przedrostków –oksa
O(II)
, tia-
S(II)
, aza-
N(III
), fosfa-
P(III)
(a) Związki o maksymalnej liczbie nieskumulowanych wiązań
podwójnych; heteroatomy mają normalne wartościowości
(b) W przypadku fosforu przedrostek „fosfa-" zostaje zastąpiony przez
„fosfor-"
(c) Nazwę tworzy się przez umieszczenie przedrostka ,,perhydro"
przed nazwą odpowiedniego związku nienasyconego.
(d) Nie dotyczy związków: krzemu, germanu i ołowiu. W tych
przypadkach przedrostek „perhydro-" umieszcza się przed nazwą
odpowiedniego związku nienasyconego.
(e) Pochodzenie sylab określających wielkości pierścieni trój-, cztero-
lub siedmio- do dziesięcioczłonowych jest następujące: „ir" od „tri",
„et" od „tetra", „ep" od „hepta ‘
Liczba
atomó
w
Pierścienie z
azotem
Pierścienie bez azotu
nasyco
ne
nienasycon
e (a)
nasycon
e
nienasycone
(a)
3
-iryna
-irydyna
-iren
-iran (e)
4
-et
-etydyna
-et
etan -
5
-ol
-olidyna
-ol
-olan
6
-yna
(b)
(c)
-yn (b)
-an (d)
7
-epina
(c)
-epin
-epan
8
-ocyna
(c)
-ocyn
-okan
9
-onina
(c)
-onin
-onan
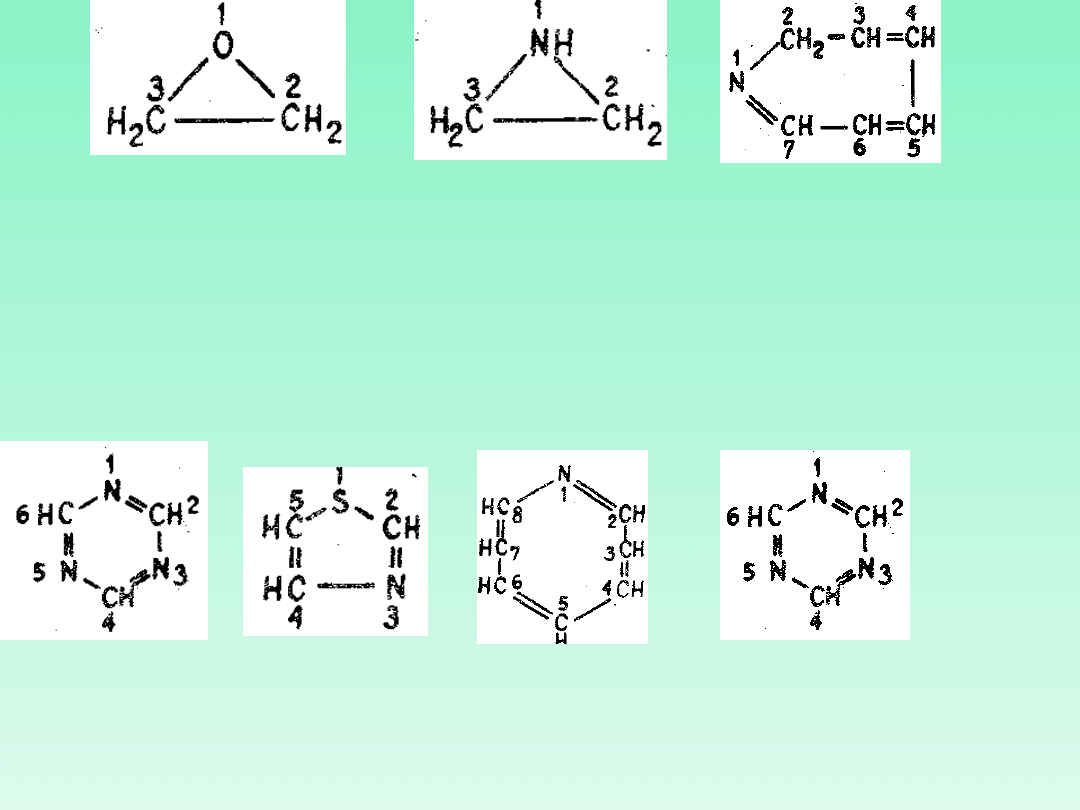
oksira
n
azirydy
na
2H-azepina
Wielokrotność występowania tego samego heteroatomu oznacza się w za
pomocą przedrostków „di-", „tri-" itd., umieszczonych przed odpowiednim
członem „a"**, oznaczającym heteroatom
W przypadku gdy w nazwie związku występują dwa lub więcej człony „a", to
wymienia się je w kolejności wzrastającej liczby atomowej. Numerację
atomów w związkach
monocyklicznych z jednym heteroatomem
rozpoczyna
się od heteroatomu.
1,3,5-
triazyna
1,3-
tiazol
azocyn
a
1,3,5-
triazyna

Skondensowane układy
heterocykliczne
Skondensowane związki pierścieniowe zawierające heteroatomy nazywa
się zgodnie z zasadami opisanymi dla węglowodorów. Składniki układów
nazywa się zgodnie z opisanymi wcześniej regułami. W przypadku gdy
nazwa składnika w nazwie układu skondensowanego zawiera lokanty
(numery lub litery), które nie mają związku z numeracją całego układu
skondensowanego, lokanty te umieszcza się w nawiasach kwadratowych
(dotyczy to lokantów wskazujących położenia skondensowania, zgodnie z
regułą A—21.5). Składnikiem podstawowym powinien być układ
heterocykliczny. Gdy istnieje możliwość wyboru składnik podstawowy
wyznacza się według zasad branych pod uwagę w następującej
kolejności:
(a) składnik zawierający atom lub atomy azotu
(b) składnik zawierający heteroatom (inny niż azot) w kolejności tlen-
siarka-fosfor
(c) związek zawierający największą liczbę pierścieni;
(d) składnik zawierający największy pierścień pojedynczy;
(e) składnik zawierający największą liczbę dowolnych heteroatomów;
(f) składnik zawierający największą różnorodność heteroatomów;
(g) gdy istnieje możliwość wyboru pomiędzy składnikami o tej samej
wielkości zawierającymi tę samą liczbę i rodzaj heteroatomów, za
składnik podstawowy przyjmuje się układ, w którym heteroatomy mają
przed kondensacją niższe lokanty;
W przypadku gdy heteroatom znajduje się na złączu pierścieni, ich nazwy
w układzie skondensowanym dobiera się w ten sposób, aby oba
pierścienie zawierały ten heteroatom.
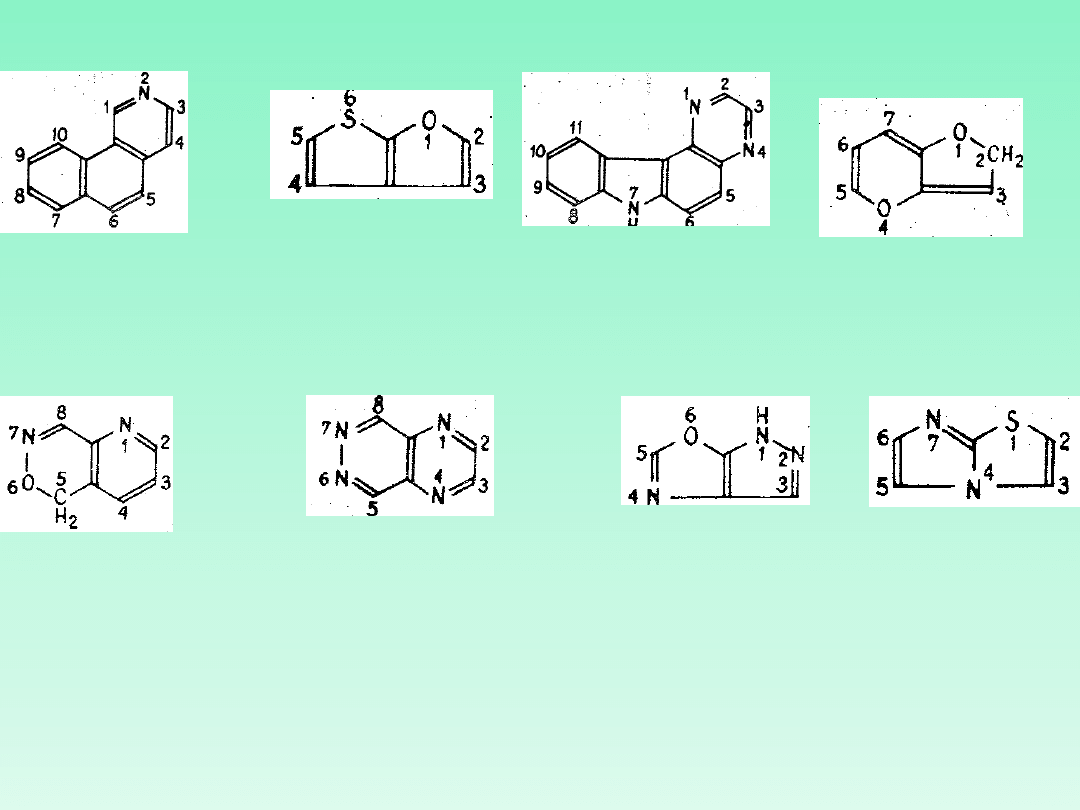
PRZYKŁADY
imidazo[2,1-
b]tiazol
(2x używamy N)
1H-pirazolo[4,3-
d]
oksazol, nie:
oksazolo[5,4-
c]pirazol
(bo
różnorodność)
pirazyno[2,3-c]
pirydazyna
(bo niższe
lokanty)
5H-pirydo[2,3-d]
-1,2-oksazyna ,
nie:
1,2-
oksazyno[4,5-d]
pirydyna
(bo więcej
heteroatomów)
2H-furo[3,2-
b]piran nie:
2H-pirano[3,2-
b]furan
(bo większy
pierścień)
7H-pirazyno[2,3-
c]karbazol
nie:7H-indolo[3,2-f]
chinoksalina
(ilość pierścieni)
tieno[2,3-
b]furan
nie:
furo[2,3-
b]tiofen
(bo O przed
S)
benzo[h]izochin
olina
nie:pirydo[3,4-a]
naftalen
(bo atom N)
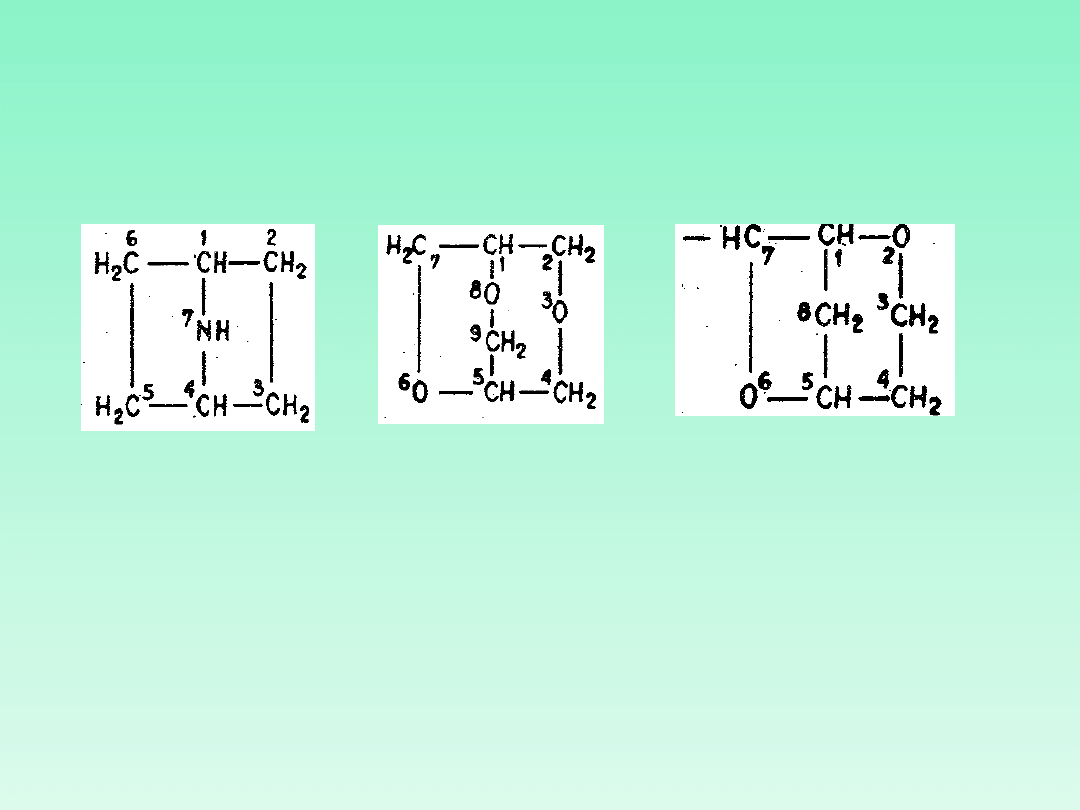
Mostkowe układy
heterocykliczne
Mostkowe układy heterocykliczne nazywa się zgodnie z zasadami
dla węglowodorów wskazując heteroatomy. Podobnie nazywa się
odpowiednie rodniki
7-
azabicyklo[2.2.1]hep
tan
3,6,8-
trioksabicyklo
[3.2.2]nonan
2,6-
dioksabicyklo
[3.2.1]okt-7-yl
Afiksy
uwielokratniajace
di-, tri-, tetra-, penta- itd. stosuje się dla wskazania zestawów identycznych
niepodstawionych grup lub związków macierzystych, np. 1,2-etano
di
ol
HO-CH
2
-CH
2
-OH
formy: bis-, tris-, tetrakis-, pentakis- itd. stosuje się dla wskazania
identycznych grup podstawionych w ten sam sposób, np.
bis
(2-
chloroetylo)amina HN(CH
2
-CH
2
-Cl)
2

Ważniejsze zasady nomenklatury
podstawnikowej
Następujące grupy charakterystyczne określa się zawsze w postaci
przedrostków: bromo-, chloro-fluoro-, diazo-, azydo-, nitrozo-, nitro-, aci-
nitro, R-oksy, R-tio. W miarę potrzeby dodaje się afiksy uwielokrotniające i
lokanty. Jeśli w cząsteczce obecne są grupy charakterystyczne różne od
wymienionych powyżej wówczas jeden i tylko jeden rodzaj grupy musi być
określony przy pomocy przyrostka; Grupa określona w ten sposób nazywa
się
GRUPĄ GŁÓWNĄ
. Gdy związek zawiera więcej niż jeden rodzaj grup
niewymienionychpowyżej, wówczas grupą główną jest grupa
charakteryzująca klasę związku umieszczonego najwyżej w hierarchii
podanej poniżej. Wszystkie pozostałe grupy charakterystyczne określa się
przy pomocy przedrostków.
-Kationy -oniowe i podobne
-Kwasy w kolejności: karboksylowe, nadtlenokwasy, ich S pochodne,
sulfonowe itd.
-Pochodne kwasów w kolejności: bezwodniki, estry, halogenki acyli, amidy,
hydrazydy, imidy,
-Nitryle (cyjanki), a następnie izocyjanki
-Aldehydy, a następnie ich S analogi, pochodne aldehydów
-Ketony, a następnie ich analogi i pochodne w tej samej kolejności co
aldehydy .
-Alkohole a następnie fenole, potem S analogi alkoholi, estry alkoholi z
kwasami nieorganicznymi, i dalej podobne pochodne fenoli w tej samej
kolejności
-Wodoronadtlenki
-Aminy, a następnie iminy, hydrazyny itd.
-Etery, a następnie ich S analogi
-Nadtlenki
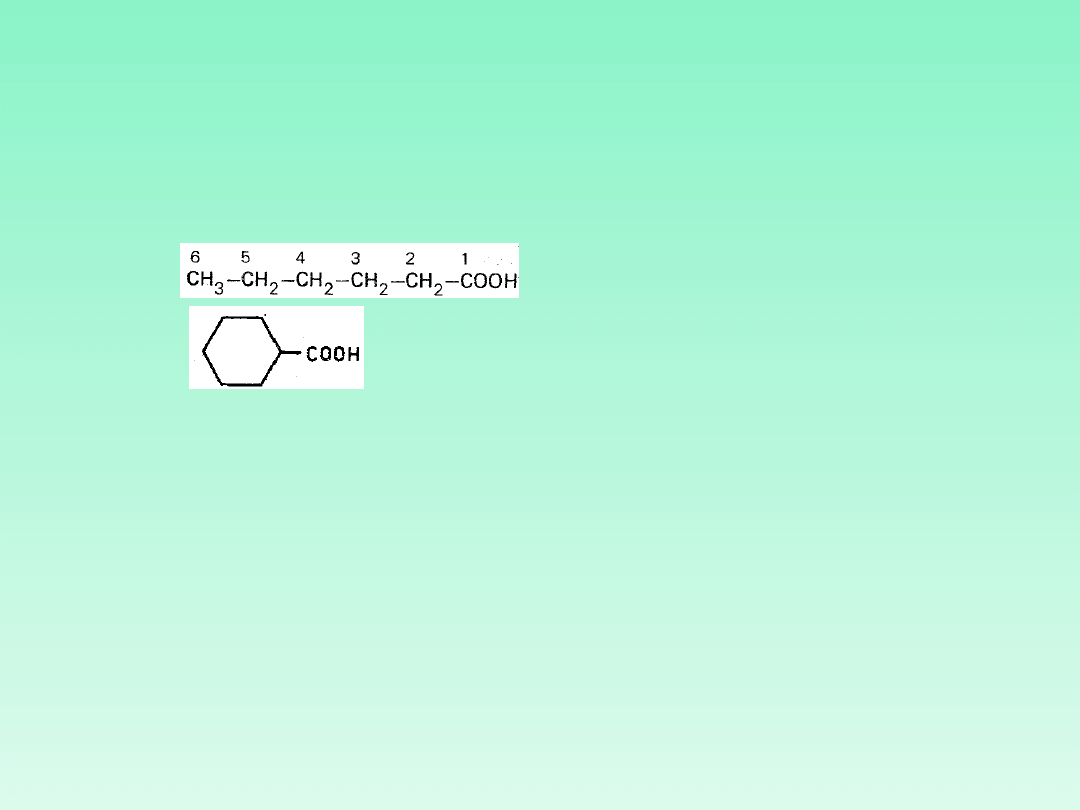
Obie metody opisane w regule stosuje się w zasadzie również do
ALDEHYDÓW alifatycznych i ich pochodnych oraz NITRYLI. Należy dokonać
wyboru pomiędzy następującymi końcówkami: odpowiednio al- lub
-karbaldehyd dla -CHO oraz –nitryl lub –karbonitryl dla –CN
Dla prostych AMIN R
1
R
2
R
3
N nazwy grup alkilowych poprzedzają słowo
„amina”
KWASY KARBOKSYLOWE
Atom = O i grupa —OH znajdujące się przy tym samym atomie węgla określa
się łącznie przyrostkiem „-owy" dodanym do nazwy macierzystego łańcucha
alifatycznego poprzedzonej słowem „kwas". Tak więc przekształcenie
końcówki „-an" w „-anowy" (wraz z dodatkiem słowa „kwas" na początku
nazwy) oznacza zamianę –CH
3
w –COOH
Określenie „kwas ... -karboksylowy" traktuje grupę -COOH jako samodzielny
podstawnik. Atom węgla grupy karboksylowej jest fragmentem tego
podstawnika.
kwas
heksanowy
kwas
cykloheksanokarboksylowy
Obie metody stosuje się do tworzenia nazw pochodnych kwasów
alifatycznych i grup acylowych. Do wyboru pozostają więc dwa rodzaje
końcówek, takie jak: -amid lub -karbonamid dla
-CO-NH
2
, -hydrazyd lub -karbohydrazyd dla -CO-NH-NH
2
, chlorek ... -oilu
(-ylu) lub chlorek ... -karbonylu dla -CO-Cl, -an (ian) lub -karboksylan dla
-COOR (estry) itd., a dla grup R— CO-
-oil (-yl) lub -karbonyl.
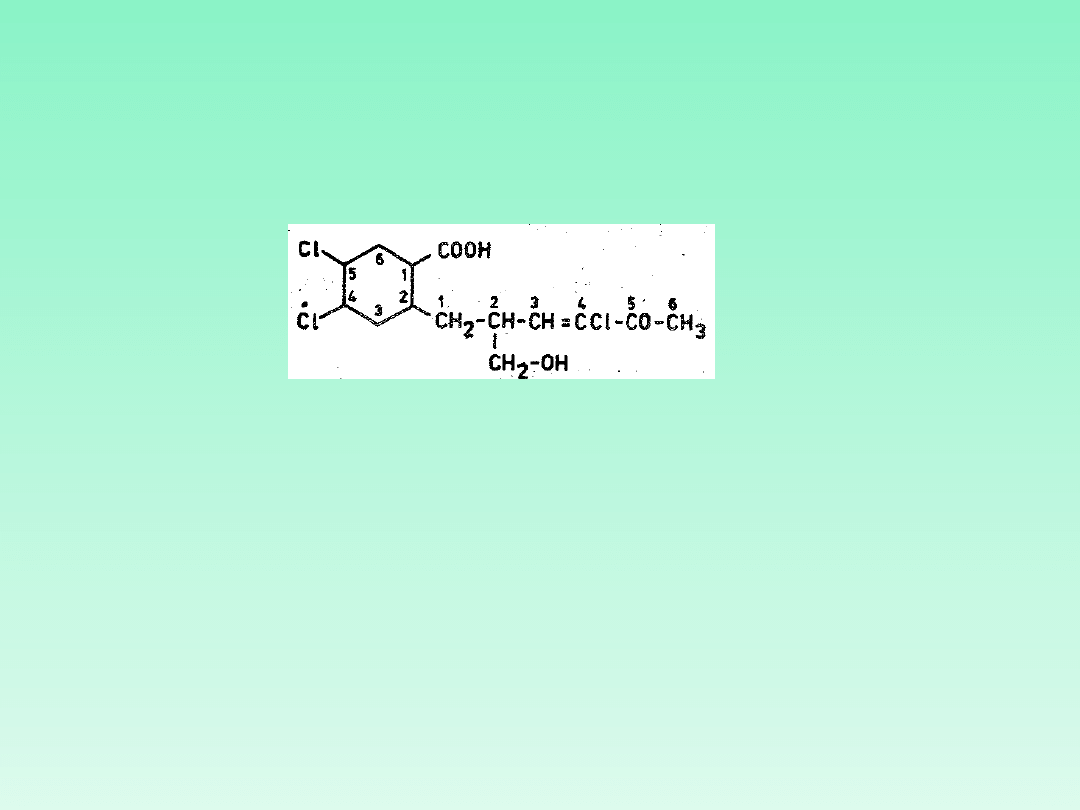
Po wytypowaniu i nazwaniu: związku macierzystego (główny łańcuch, układ
cykliczny), grupy głównej i innych podstawników, dokonuje się właściwej
numeracji atomów w związku. Numeracja ta zależy w pierwszym rzędzie od
sposobu numerowania głównego łańcucha i układów cyklicznych. Po
wytypowaniu, nazwaniu i ponumerowaniu poszczególnych komponentów,
dokonaniu należytych modyfikacji addytywnych i substraktywnych i
uszeregowaniu przedrostków, zespala się wszystkie wymienione elementy
tworząc pełną nazwę związku.
główna grupa: kwas ...-karboksylowy
składnik macierzysty: cykloheksan
przedrostki podstawników głównych: 4,5-
dichloro-, 2-heksyl-
-modyfikacji substraktywnej: heksyl- na 3-
heksenyl-
-podstawników : 4-chloro-, 5-okso-, 2-
(hydroksymetyl)
zespolona nazwa: kwas 4,5-dichloro-2[4-chloro-2-
(hydroksymetylo)-5-okso-3-heksenylo]-
-cykloheksanokarboksylowy
.

PIERWSZEŃSTWO (STARSZEŃSTWO) ŁAŃCUCHÓW (ŁAŃCUCH
GŁÓWNY)
W przypadku związków acyklicznych łańcuch, który służy za podstawę
nazwy i numeracji zwany jest „łańcuchem głównym". Gdy należy dokonać
wyboru łańcucha głównego stosuje się następujące kryteria w kolejności ich
wyszczególniania, aż do osiągnięcia jednoznacznej decyzji.
Największa liczba podstawników odpowiadająca głównej grupie.
(b) Największa liczba, branych wspólnie pod uwagę, podwójnych i
potrójnych wiązań
(c) Największa długość łańcucha
(d) Największa ilość podwójnych wiązań.
(e) Najniższe lokanty dla głównych grup (to jest dla przyrostka)
(f) Najniższe lokanty dla wiązań wielokrotnych
(g) Najniższe lokanty dla podwójnego wiązania
(h) Największa ilość podstawników określonych przy pomocy przedrostków
STARSZEŃSTWO UKŁADÓW CY KLICZNYCH
Starszeństwo układów cyklicznych określa się według następujących
kryteriów, stosowanych w kolejności ich wyszczególnienia, aż do
osiągnięcia jednoznacznej decyzji:
(a) Pierścienie heterocykliczne mają pierwszeństwo przed pierścieniami
karbocyklicznymi
(b) Hierarchia pierścieni heterocyklicznych wynika z rodzaju i pozycji
heteroatomów
(c) Większa ilość pierścieni
(d) Największy pojedynczy pierścień przy wystąpieniu pierwszej różnicy
wynikłej z porównania kolejnych co do wielkości pierścieni
(e) Większa liczba atomów wspólnych dla kilku pierścieni
STEREOCHEM
IA
Stereoizomerami
są takie izomery, które mają identyczną konstytucję, a
różnie się jedynie przestrzennym rozmieszczeniem atomów.
Konfiguracja
cząsteczki jest to rozmieszczenie w przestrzeni jej
atomów, bez uwzględnienia różnych położeń atomów wynikających z
rotacji wewnętrznej wokół jednego lub kilku wiązań pojedynczych.
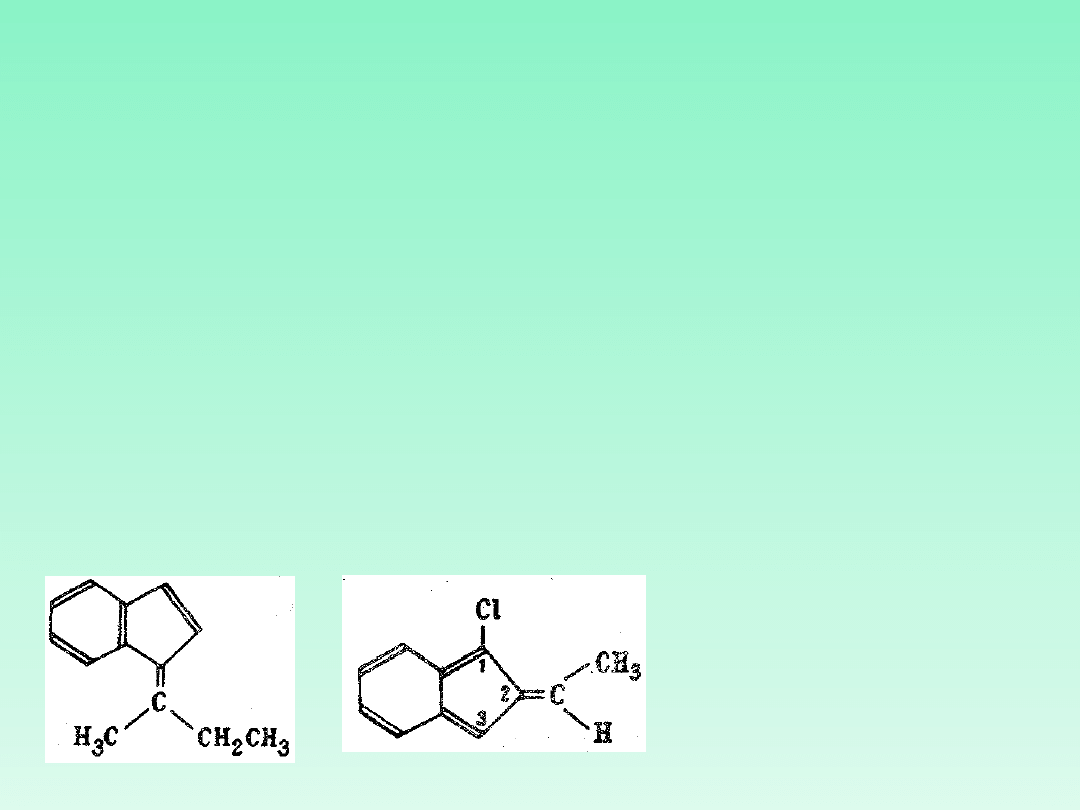
Steryczne relacje grup wokół wiązania podwójnego określa się w nazwie
związku przedrostkiem. Z lub E. Przedrostek ustala się następująco: dla
każdego z dwóch atomów tworzących wiązanie podwójne wybieramy na
podstawie reguły pierwszeństwa podstawnik preferowany i określamy
względne położenie podstawników preferowanych; jeżeli ta wybrana para
podstawników znajduje się po tej samej stronie płaszczyzny odniesienia
stosuje się jako przedrostek dużą literę Z (pisaną kursywą); jeśli wybrane
grupy znajdują się po stronach przeciwnych — stosuje się (pisaną kursywą)
dużą literę E. Przedrostki umieszczone w nawiasach i zaopatrzone w łącznik
poprzedzają nazwę. Jeżeli cząsteczka zawiera kilka wiązań podwójnych,
wówczas przedrostki poprzedzają bezpośrednio właściwe lokanty.
(E)-1 -sec-
butylidenoinden
(Z)-1-chloro-2-etylideno-2H-
inden

Chiralność
-
właściwość przedmiotu polegająca na tym, że jest on
nieidentyczny ze swym odbiciem lustrzanym.
Asymetria
-brak
elementów symetrii. Obiekt (np. cząsteczka) o określonej konfiguracji lub
konformacji jest asymetryczny, jeżeli nie ma elementów symetrii.
Każda cząsteczka asymetryczna jest chiralna, a substancja składająca się z
takich cząsteczek jest optycznie czynna; jednak nie wszystkie cząsteczki
chiralne są asymetryczne, gdyż niektóre z nich mają osie symetrii.
Cząsteczki stanowiące nawzajem odbicia lustrzane zwane są
enancjomerami
.
Reguła pierwszeństwa operuje symbolami R i S umożliwia jednoznaczny opis
przestrzennego rozmieszczenia grup w cząsteczkach chiralnych.
Podstawową czynnością postępowania jest uporządkowanie wybranych
atomów lub grup według przyznanego pierwszeństwa, na przykład
uszeregowanie 4 podstawników związanych z asymetrycznym atomem
węgla: a > b > c > d, gdzie symbol ,, > " czytać należy „posiada
pierwszeństwo w stosunku do”. Zasady ustalania szeregu pierwszeństwa są
następujące:
Podstawniki szereguje się w kolejności malejących liczb atomowych
.atomów
związanych z asymetryczymatomem C. Jeśli dwa podstawniki różnią się
jedynie masą atomową, to cięższy ma pierwszeństwo, na przykład dla
izotopów wodoru: D > H. Jeżeli z centrum chiralności związane są dwa, trzy
lub cztery identyczne atomy (najczęściej C), porównujemy kolejne dalsze
atomy związane z atomami C podstawników. W celu przypisania symboli
konfiguracyjnych każdemu z dwóch enancjomerów związku obserwujemy ich
cząsteczki
od strony przeciwnej
do podstawnika, zaszeregowanego
jako
ostatni
.Następnie śledzimy kierunek w jakim zmieniają się pierwszeństwa
pozostałych podstawników i jeżeli jest to kierunek zgodny z ruchem
wskazówek zegara, to oznaczamy konfigurację związku przez R
(rectus w
jęz. łac. oznacza prawy); dla drugiego enancjomeru otrzymujemy kierunek
zmiany pierwszeństwa podstawników przeciwny do ruchu wskazówek zegara
i przyporządkowujemy mu symbol S (sinister — lewy)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
WYKŁAD VII
Wykład 1, WPŁYW ŻYWIENIA NA ZDROWIE W RÓŻNYCH ETAPACH ŻYCIA CZŁOWIEKA
Zaburzenia nerwicowe wyklad
Szkol Wykład do Or
Strategie marketingowe prezentacje wykład
Wykład 6 2009 Użytkowanie obiektu
wyklad2
wykład 3
wyklad1 4
więcej podobnych podstron