
APOPTOZA

Fizjologiczna śmierć komórki
(śmierć zaprogramowana) synonim
apoptoza
(apoptosis, od greckiego
słowa – opadanie liści, płatków
kwiatu- Kerr w 1972 r)
Jest konsekwencją samobójczego
programu genetycznego,
uruchomianego w odpowiedzi na
złożone oddziaływanie z innymi
komórkami

Najczęściej następuje naruszenie
integralności
1 z 4 systemów
wewnątrzkomórkowych
• oddychania tlenowego
• funkcjonowania błon
komórkowych
• enzymów i białek strukturalnych
• naprawy aparatu genetycznego

Nagroda Nobla
Rok 2002
Sydney
Brenner
Sir John
Sulston
Robert H.
Horvitz
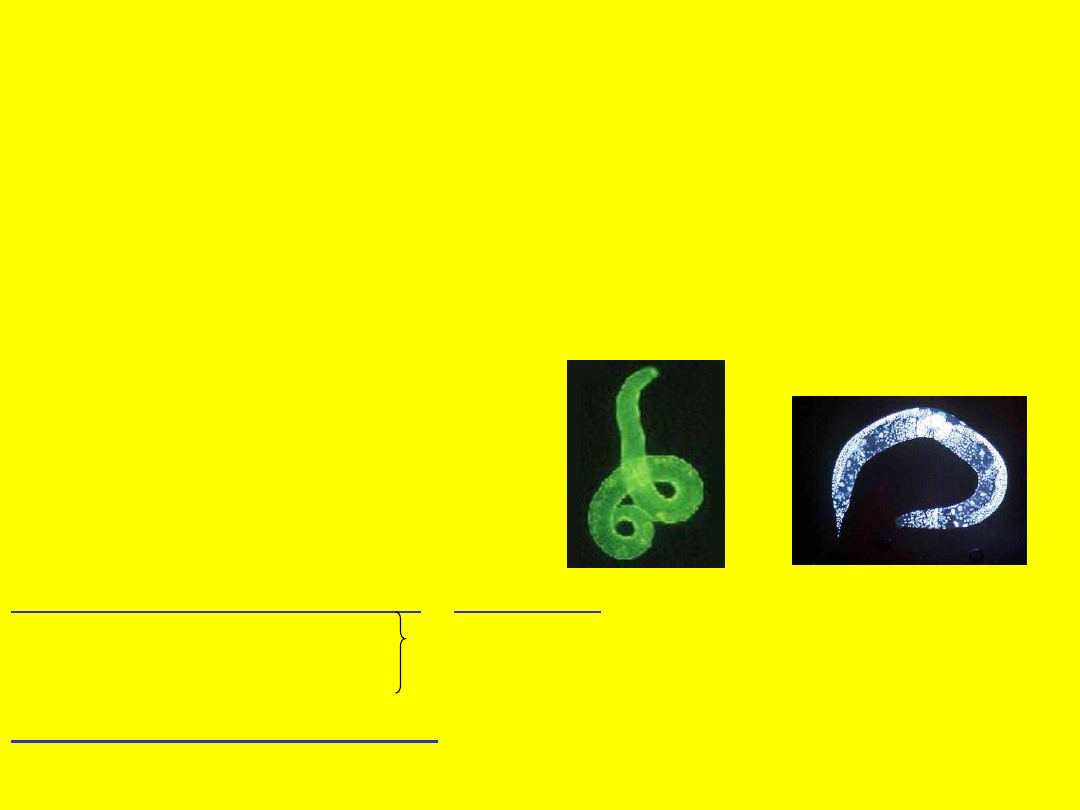
Apoptoza Caenorhabditis elegans
Dorosły osobnik jest hermafrodytą i
składa się z 959 komórek somatycznych
Liczba komórek powstających – 1090
W wyniku apoptozy ginie 131
- 113 umiera podczas embriogenezy
- 18 podczas dorosłego życia
Geny proapoptotyczne Fenotyp
ced-3 (ICE)
apoptoza 131 komórek
ced-4 (Apaf-1)
Geny antyapoptotyczne
ced-9 (bcl-2) brak apoptozy

Genetyczna kontrola apoptozy
• „ced” (cell death) geny śmierci są
dobrze zachowane w procesie ewolucji
• ekspresja genów ced-3 i ced-4
odpowiada za molekularne procesy
apoptozy
• ced-9 (u ludzi bcl-2) – ekspresja w
komórkach stymulowanych do proliferacji
(m. in. limfocyty prawidłowe, kom.
nowotworowe)
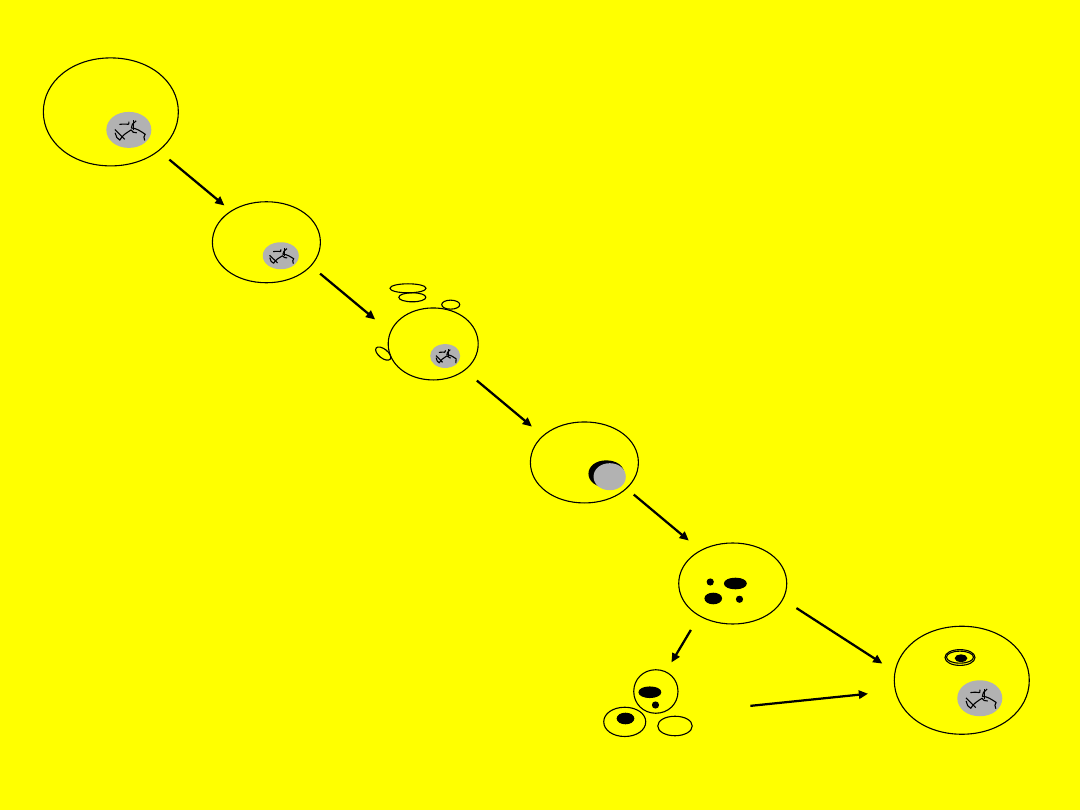
Zdrowa komórka
Komórka obkurcza się i
oddziela od komórek
sąsiednich
Powstawanie pęcherzyków
(uwypuklenie) kondensacja
chromatyny i cytoplazmy
Marginacja
skondensowanej
chromatyny
Fragmentacja
jądra i
komórki
Ciałka apoptotyczne
Fagocytoz
a

Różnice morfologiczne pomiędzy apoptozą
a martwicą
Apoptoza
Martwica
1. Dotyczy zwykle
pojedynczych komórek
2. Zmniejszenie objętości
komórki i pofałdowanie błony
komórkowej
3. Kondensacja chromatyny,
fragmentacja jądra
4. Zamknięcie organelli w
ciałkach apoptotycznych
5. Ciągłość błony kom.
zachowana aż do momentu
sfagocytowania ciałek
apoptotycznych
6. Brak zapalenia, hamowanie
reakcji zapalnej
7. Fagocytoza przez sąsiednie
komórki i makrofagi
1. Najczęściej dotyczy grup
komórek
2. Zwiększenie objętości i
pęcznienie komórki
3. Brak kondensacji
chromatyny, liza jądra
4. Pęcznienie i rozpad
organelli
5. Perforacja błony,
zawartość komórek
wydostaje się do
przestrzeni
pozakomórkowej
6. Odczyn zapalny ze strony
otoczenia
7. Fagocytoza przez fagocyty

Zmiany biochemiczne
Materiał
genetyczny
Apoptoza
Martwica
aktywacja
specyficznych
endonukleaz,
fragmentacja,
utworzenie
odcinków o
długości 200-300
kb, 20-50 kb, 200-
300 bp
aktywacja
niespecyficznych
nukleaz,
fragmentacja na
odcinki o
przypadkowej
długości
Rozdział
elektroforetyczn
y DNA
obraz drabinki
DNA
Obraz smugi
(smear)
Aktywacja
enzymów
kinaz białkowych
(np. kinazy MAP) i
fosfataz, nukleaz,
kaspaz, kalpain
niespecyficzna
degradacja
Białka
regulacyjne
Apoptoza
Martwica
białka rodziny Bcl-
2 (pro- i anty-
apoptotyczne),
inhibitory
apoptozy
(białka IAP),
inhibitory kaspaz
w niektórych
przypadkach
ekspresja Bcl-2
Wymagania
energetyczne
proces aktywny,
zależny od ATP
Proces bierny,
niezależny od ATP
Substraty
białka
enzymatyczne i
strukturalne
przypadkowe
białka
Inne
synteza poli(ADP-
rybozy), synteza
de novo mRNA i
białek
brak syntezy
białek

Czynniki wywołujące
apoptozę
Hormony i cytokiny
Deficyt czynników wzrostowych
i troficznych
Czynniki cytotoksyczne
Czynniki fizyczne

Szlaki sygnałowe apoptozy
W zależności od rodzaju komórki i
czynnika indukującego proces apoptozy
może przebiegać różnymi ścieżkami
Do najlepiej poznanych należą:
- szlak związany z błoną komórkową tzw.
zewnętrzny
- szlak wewnętrzny zwany
mitochondrialnym
- szlak angażujący perforyny i granzym B,
czyli pseudoreceptorowy
Apoptoza może również odbywać się z
udziałem szlaku sfingomielinowo-
ceramidowego oraz indukowanego
stresem

Szlak zewnętrzny
- pobudzenie receptorów śmierci
należących do nadrodziny receptorów
TNF np. Fas/CD95/Apo1, TRAIL-R1 i
R2/Apo2
- receptory śmierci posiadają
wewnątrzkomórkową domenę śmierci DD
- po związaniu się odpowiedniego liganda
z receptorem błonowym (TNF-α, FasL,
TRAIL/Apo2L) dochodzi do oligomeryzacji
receptora, a następnie powstaje
kompleks DISC (death inducing
signaling complex)

- kompleks ten powstaje poprzez
połączenie domen śmierci z
białkiem adaptorowym FADD oraz
z prokaspazą 8
- następuje aktywacja prokaspazy
8, która jest bezpośrednim
aktywatorem kaspazy 3
(kaspazy wykonawczej)

Szlak wewnętrzny
inicjowany jest poprzez:
• zmiany potencjału mitochondrialnego
• mutacje DNA
• inne zaburzenia metabolizmu
komórkowego
Szlak ten może łączyć się ze ścieżką
receptorową zewnętrzną poprzez białko
Bid, które ulega proteolizie - powstaje tBid
(truncated Bid) – postać ta wpływa na
uwalnianie cytochromu c - aktywacja sz.
mitochondrialnego

Szlak wewnętrzny
- istotnym etapem jest uwolnienie cytochromu c
z przestrzeni międzybłonowej poprzez specjalne
kanały
- kanały te tworzone są poprzez białka z rodziny
Bcl-2 (bax, bak) z białkiem VDAC (Voltage
Dependent Anion Channel)
- przez kanały z mitochondrium do cytoplazmy
dostaje się cytochrom c
- wypływ cytochromu c jest sygnałem do
tworzenia kompleksu zwanego apoptosomem

- apoptosom składa się z cytochromu
c, prokaspazy 9, białka Apaf-1
(ATP)
- kompleks ten potrzebny jest do
autoproteolizy kaspazy 9, która
następnie aktywuje kaspazę 3
- podczas apoptozy z mitochondrium
uwalniane są także białka
Smac/Diablo i Omi/HTR A2 są one
antagonistami inhibitorów apoptozy
(IAP)
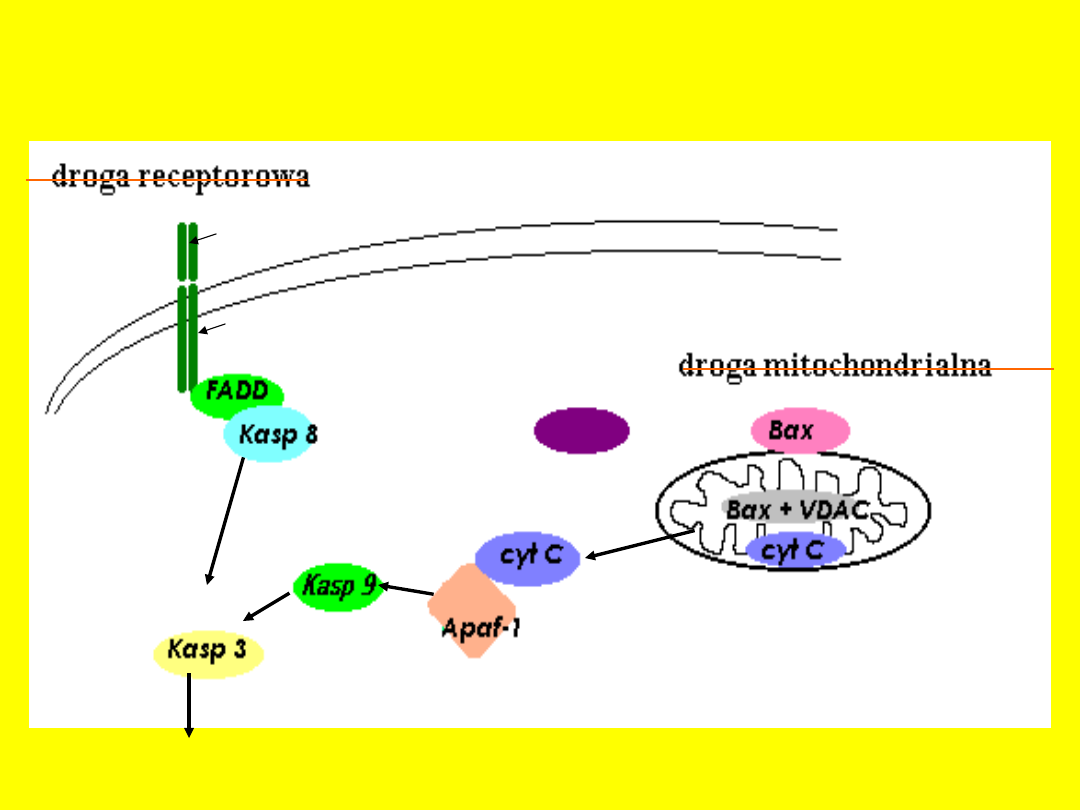
Dwa zasadnicze szlaki indukcji
apoptozy
Ligand
śmierci
receptor
DD (domena
śmierci)
(swoiste białko śmierci)
APOPTOZA
Bi
d

Szlak pseudoreceptorowy – indukowany
przez cytotoksyczne limfocyty T oraz
komórki NK
Limfocyt w kontakcie z komórką
docelową uwalnia perforyny
Cząsteczki perforyny tworzą w błonie
komórki docelowej kanały
Przez kanały wnikają granzymy B do
komórki docelowej aktywujące szlak
kaspaz
Wraz z granzymami uwalniają się jony
Ca 2+ wpływające stymulująco na
proces apoptozy

Właściwości kaspaz
Proteazy cysteinowe, substraty
ich zawierają kwas
asparaginowy w pozycji P1
(proteoliza w miejscu reszty
Asp)
Syntetyzowane są jako
nieaktywne zymogeny

Dotychczas zidentyfikowano 14
kaspaz
• Kaspazy inicjatorowe -8, -9; również -2, -10
• Kaspazy wykonawcze -3, -6, -7
Kaspazy inicjatorowe posiadają
„ domeny śmierci” CARD i DED
Kaspazy wykonawcze aktywują
enzymy prowadzące do destrukcji
komórek

Białka trawione przez kaspazy
Większość tych białek
uczestniczy w procesach
molekularnych związanych z
cyklem komórkowym
i apoptozą
Do proteolizy białek dochodzi
tylko przy udziale kaspaz -3, -6
i -7

Trawione są między innymi
białka
•
Białko PARP- bierze udział w
rozpoznaniu i naprawie DNA
• Białko ICAD- (inhibitor of Caspase-
Activated DNA)
• Białko Rb- kontroluje przechodzenie
komórki przez kolejne fazy cyklu
komórkowego
• Białko MDM2- wiąże się z białkiem
p53 i je stabilizuje
• Niektóre białka szkieletu komórki
np.. Laminy, aktyna, fodryna
• Inne cząsteczki kaspaz

Śmierć komórki niezależna od
Kaspaz
Proteaza aktywowana wapniem
kalpaina, prawdopodobnie pełni
autonomiczną rolę w apoptozie
• Ostatnie doniesienia wskazują na jej
rolę w procesie aktywacji i
unieczynnienia kaspazy -3, -7, -9 i
ostatnio -12

Proteazy serynowe: jedna z nich
AP24 zaangażowana jest we
fragmentację DNA
Katepsyna D, proteaza lizosomalna,
zaangażowana w zewnątrzpochodną
drogę aktywacji apoptozy
Także inne katepsyny mogą
uczestniczyć w regulacji apoptozy

Białka pro-apoptotyczne np.Bax,
Bad, Bak, Bik, Bid, Bcl-xs zmuszają
komórkę do apoptozy
Białka anty-apoptotyczne np. Bcl-2,
Bcl-Xl, Mcl-1 zwiększają
prawdopodobieństwo przeżycia
komórki
Rodzina białek Bcl-2

Rodzina białek Bcl-2
Pełnią funkcję regulatorów apoptozy
przez oddziaływanie na wiele istotnych
procesów komórkowych, jak:
• Kontrola komórkowego poziomu jonów
(Ca
2+
,H
+
,K
+
,Cl
-
) – tworzą kanały
wbudowywane między innymi w błony
mitochondrialne
• Nadzór nad stanem redoks
• Regulacja wypływu z mitochondriów
cytochromu C i AIF (apoptotic inducing
factor)
• Aktywacja enzymów kaspaz i DN-az

Tworzą homo- i heterodimery
• Stosunek homodimerów
antyapoptotycznych do
proapoptotycznych decyduje o śmierci
bądź przeżyciu komórki
• Połączenie się białek w heterodimery o
przeciwstawnym charakterze powoduje
inhibicję biologicznej ich aktywności
Rodzina białek Bcl-2

Fizjologiczne znaczenie
apoptozy
Apoptoza jest procesem
przeciwstawnym do mitozy i
wspólnie z nią decyduje o
liczbie komórek w każdej
populacji
Ma ogromne znaczenie w
embriogenezie, wzroście i
rozwoju

Przykłady apoptozy w rozwoju
kręgowców
• Śmierć komórek ogona kijanki w procesie
metamorfozy
• Śmierć blisko połowy neuronów
powstających w trakcie embriogenezy w
rozwoju układu nerwowego
• Śmierć komórek soczewki oka w czasie jej
kształtowania
• Zanik błony pławnej między palcami u
zarodka ludzkiego
• W życiu postnatalnym: apoptoza
keratynocytów skóry, krypt jelitowych,
komórek endometrium macicy itd.

Apoptoza w stanach
patologicznych
Ograniczenie apoptozy prowadzi do
powstania:
• Nowotworów
• Autoagresji komórek układu
odpornościowego
Wzrost apoptozy jest
charakterystyczny dla chorób
zwyrodnieniowych: choroby
Alzheimera, Parkinsona, AIDS,
zawału serca czy udaru mózgu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
Wyszukiwarka
Podobne podstrony:
Apoptoza2
Apoptoza CMUJ
OAEB Staining to Detect Apoptosis
Apoptoza, Materiały, Biologia komorki materialy
Introduction to Apoptosis
biologia komorki zwierzecej apoptoza
Bcl 2 family regulator of apoptosis
apoptoza, nekroza
ewolucja apoptozy
Antioxidant, anticancer, and apoptosis inducing effects in HELA cells
Apoptoza 6
APOPTOZA 5
apoptoza
Metabolizm białka proteoliza, apoptoza1
Porˇwnianie procesu apoptozy i nekrozy
pyt 1 apoptoza, Fizjoterapia
więcej podobnych podstron