
Apoptoza, nekroza
Kamila Podkrólewicz
Analityka Medyczna, III
rok
gr. e
APOPTOZA

Apoptoza (gr. apoptosis)
Apoptoza nazywana programową śmiercią
komórki jest procesem fizjologicznym
warunkującym prawidłowe funkcjonowanie
organizmu za równo na etapie
embrionalnym jak i w późniejszym okresie.
Apoptoza przebiega zarówno w warunkach
fizjologicznych jak i patologicznych.
Śmierć komórek jest niezbędna do
utrzymania homeostazy organizmu.
Apoptoza jest wynikiem ekspresji
odpowiednich genów i zachodzi w wyniku
określonych reakcji biochemicznych

Apoptoza cd.
• zjawisko apoptozy dotyczy pojedynczych
komórek, które uzyskały tzw. kompetencje,
ale liczba komórek jakie w danej chwili
uległy apoptozie, może być duża
• apoptoza zachodzi poprzez aktywowanie
wewnątrzkomórkowego programu
samobójstwa komórek
• informacja odpowiedzialna za apoptozę jest
umieszczona wewnątrz komórek (czynniki
wewnątrz komórkowe), ale aktywacja
programu śmierci jest również regulowana
przez wiele sygnałów pochodzących ze
środowiska zewnętrznego (czynniki
zewnątrzkomórkowe)

Apoptoza cd
Programowana śmierć komórki może być
podzielona na następujące fazy
I.
Faza indukcji albo wzbudzenia
(decyzja o śmierci komórki)
II. Faza wykonawcza (śmierć komórki)
III. Faza zniszczenia (degradacja) i
fagocytoza (pochłonięcie komórki
przez fagocyty lub komórki
sąsiadujące)


Apoptoza cd
• pobudzenie odpowiednich układów
receptorowych jest przekazywane w komórce
przez szereg cząsteczek pośredniczących
m.in. przez cząsteczki aktywujące kaspazy
takie jak:
– FADD (Fas Associating Protein With Death Domain)
– TRAD ( TNFR-1 Associated Death Domain Protein)
• sygnał do apoptozy może być też przekazany
innymi drogami, np. przekaźnikiem mogą być
ceramidy syntetyzowane de novo lub
uzyskiwane przez komórkę sfingomieliny.

Sygnał apoptozy
• przekazywany komórce wieloma drogami
• najlepiej poznana droga – układ receptor-
ligand CD95/CD95L
• apoptozę wzbudza także uwolnienie do
cytoplazmy cytochromu C, znajdującego się
w mitochondriach
(regulacja uwalniania cytochromu C do cytoplazmy
zachodzi przy udziale białek BAX, BAD, BMI i BAK
(czynniki promujące apoptozę) oraz białek BCL-2,
BCL-X, A-1 i MEL-1 (czynniki hamujące apoptozę)

Proces apoptozy przebiega zawsze według
określonego schematu. Pierwszym morfologicznym
objawem świadczącym o rozpoczęciu procesu
samobójczej śmierci komórki są zmiany na poziomie
jądra.
Chromatyna ulega kondensacji i umiejscowieniu tuż
pod błoną komórkową, następnie dochodzi do
obkurczenia całego jądra oraz jego fragmentacji.
Kolejny etap „umierania” to kondensacja cytoplazmy
oraz tworzenie charakterystycznych pęcherzyków na
powierzchni komórki.
Z uwypukleń błony komórkowej tworzą się ciałka
apoptotyczne, które są strukturami zawierającymi
chromatynę, cytoplazmę oraz organelle komórkowe.
Ostatecznym etapem jest fagocytoza powstałych
ciałek.

Jak już wcześniej wspomniano, programowana śmierć
komórki jest procesem czynnym, wymagającym
aktywacji wielu genów oraz nakładu energii.
Dwie najlepiej poznane ścieżki to szlak zewnętrzny
(receptorowy), związany z błoną komórkową oraz
wewnętrzny przebiegający z udziałem
mitochondrium.
Wśród innych dróg sygnałowych apoptozy, wymienia
się również zaobserwowany w cytotoksycznych
limfocytach T oraz komorkach NK – szlak
pseudoreceptorowy angażujący perforyny i granzym
B, szlak sfingomielinowo-ceramidowy oraz opisany
w 2000 r. – związany z reticulum endoplazmatycznym
szlak indukowany stresem.
Niezależnie od rodzaju przebiegu apoptozy,
elementem łączącym wszystkie te szlaki są kaspazy
(proteazy cysteinowe), ktore w zależności od etapu
apoptozy, w którym biorą udział, dzielimy na
inicjatorowe (indukujące) oraz wykonawcze
(efektorowe)

Szlaki apoptozy
• zewnętrzny (receptorowy)
• wewnętrzny (z udziałem
mitochondrium)
• pseudoreceptorowy
• sfingomielinowo-ceramidowy
• szlak indukowany stresem

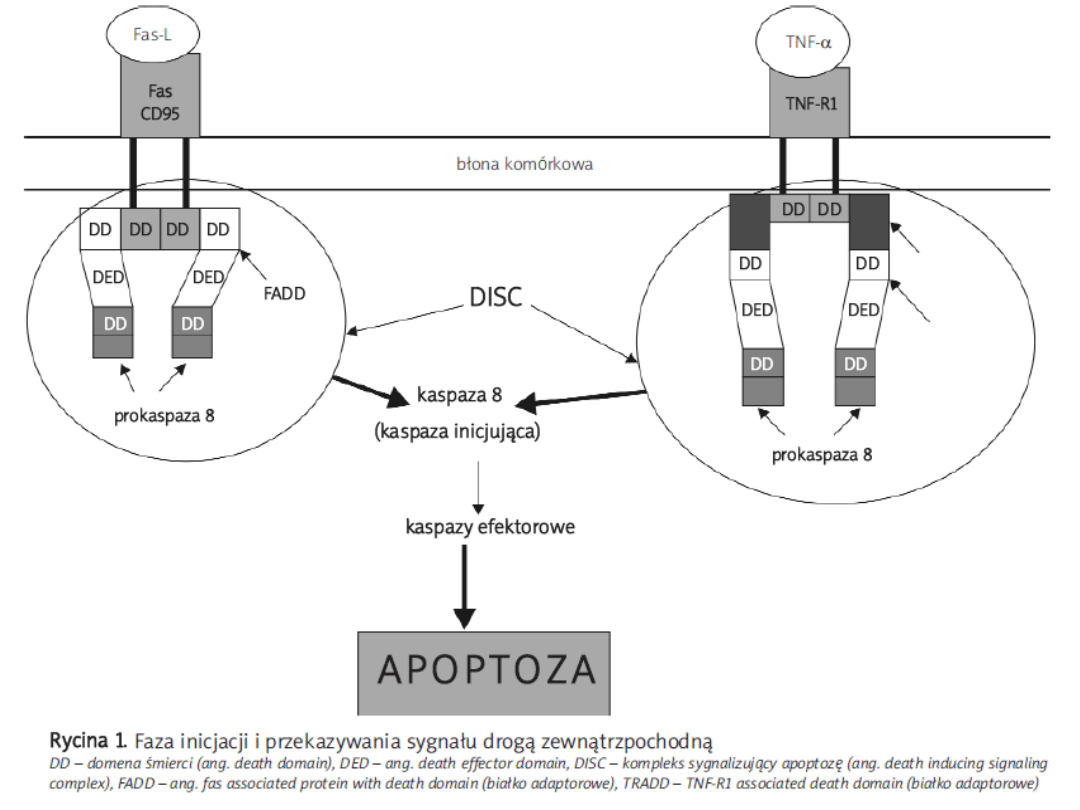
Zewnętrzny szlak apoptozy
• opiera się głownie na receptorach błonowych i ligandach
• do receptorów śmierci zaliczamy białka narodziny TNF
( TNFR1, TNFR2, Fas/CD95/Apo1 lub też TRAIL/Apo2)
• ligand wiąże się z odpowiednim receptorem błonowym
• sygnał śmierci jest przekazywany do białka adaptorowego
FADD
• aktywowane kaspazy zapoczątkowują działanie kaskady
kaspaz wykonawczych prowadzących do śmierci komórki
• szlak receptorowy może się łączyć z opisywanym poniżej
szlakiem wewnętrznym poprzez białko Bid, które ulega
proteolizie z powstaniem postaci tBid (truncated Bid).

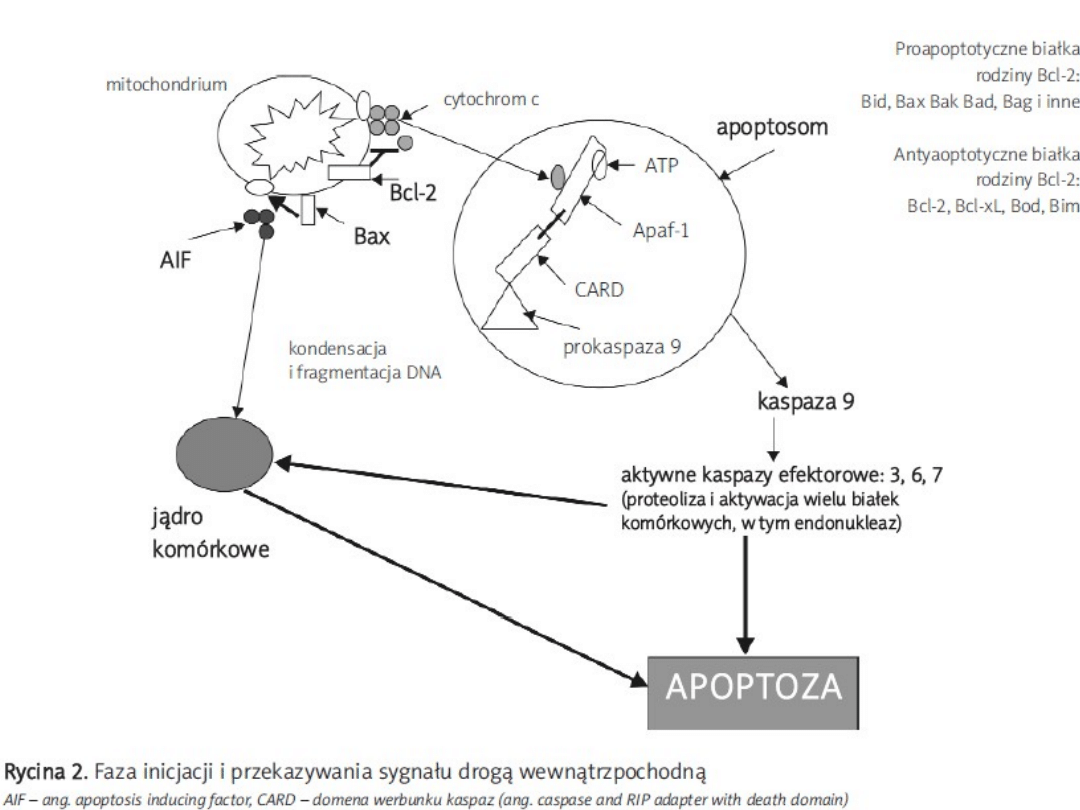
Wewnętrzny szlak apoptozy
• szlak mitochondrialny jest aktywowany w
wyniku wzrostu stężenia reaktywnych form
tlenu (ROS-reactive oxygen species), stresu
oksydacyjnego, uszkodzeń DNA, zaburzeń
transportu elektrolitów oraz wzrostu
stężenia jonów wapnia w cytoplazmie
• najważniejszym elementem tego szlaku są
oczywiście mitochondria, a dokładniej
megakanały (PTP – permeability transition
pore) tych organelli, które są
umiejscowione na styku dwóch błon

• Kolejna z hipotez przedstawia model oparty wyłącznie na
działaniu ANT błony wewnętrznej z pęczniejącym matriks,
co w konsekwencji powoduje przerwanie błony
zewnętrznej
• wpływ na powstawanie porów mitochondrialnych mają
również czynniki oddziałujące bezpośrednio z ANT, m.in.
białka Bax, Bak oraz Bcl-2
• następny model opiera się na selektywnej permeabilizacji
zewnętrznej błony mitochondrium, powiązanej z
wzajemnym oddziaływaniem VDAC i białka Bax
• jeszcze jedna teoria przedstawia działanie samego
oligomeryczne-go białka Bax, które niezależnie od VDAC
tworzy autonomiczny kanał, który prawdopodobnie może
być regulowany jedynie przez białko Bid oraz jego krótszą
formę tBid

• jak wszystkie szlaki apoptozy, także i
wewnętrzny jest regulowany przez wiele
czynników
• oprócz cytochromu C z mitochondrium
wypływa około 40 innych białek, a niektóre z
nich mają wpływ na dalsze etapy tego procesu
• najliczniejszymi i najbardziej poznanymi
regulatorami apoptozy są białka z rodziny Bcl-
2
• czynnikami antyapoptotycznymi wpływającymi
hamująco na działanie kaspaz 3, 7 i 9 są białka
IAP
• natomiast białko p53 wykazuje właściwości
proapoptyczne

Szlak sfingomielinowo -
ceramidowy
• opisywany szlak apoptozy wiąże się ze wzrostem
stężenia ceramidów w komórce, co jest wynikiem
połączenia odpowiedniego liganda z receptorem
rodziny TNF, m.in. FAS, IL-1, a następnie aktywacji
kwaśniej lub obojętnej sfingomielinazy
• enzym ten tnie jeden z lipidów błonowych –
sfingomielinę na ceramid i fosfocholinę
• pierwszy ze składników hydrolizy sfingomieliny, pod
wpływem działania czynników apoptotycznych,
syntetyzowany jest także de novo.
• ceramid pełni rolę lipidowego, wtórnego przekaźnika
śmierci, który może aktywować kinazy CAPK (ceramide-
activated protein kinases), MAPK (mitogen-activated
protein kinases), kaskady kinaz SAPK/JNK (stress
associated protein kinase/Jun N-terminal kinase) oraz
fosfatazy CAPP (ceramide-activated protein
phosphatase) i fosfolipazę A2
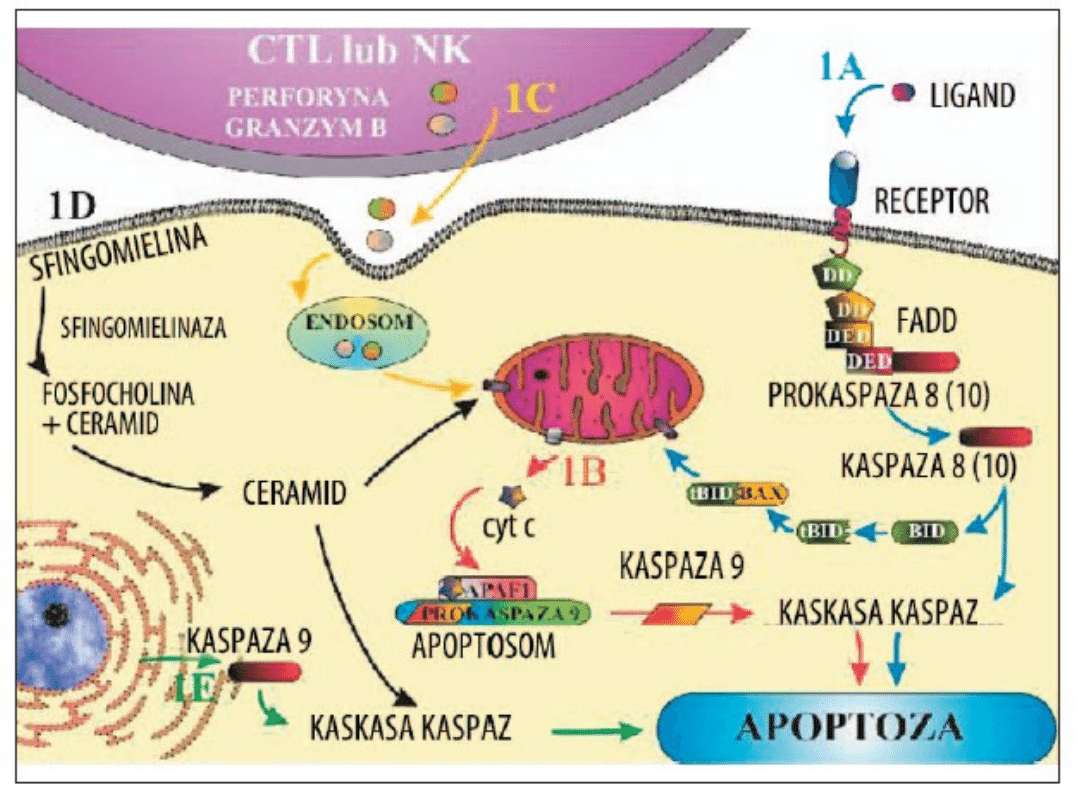
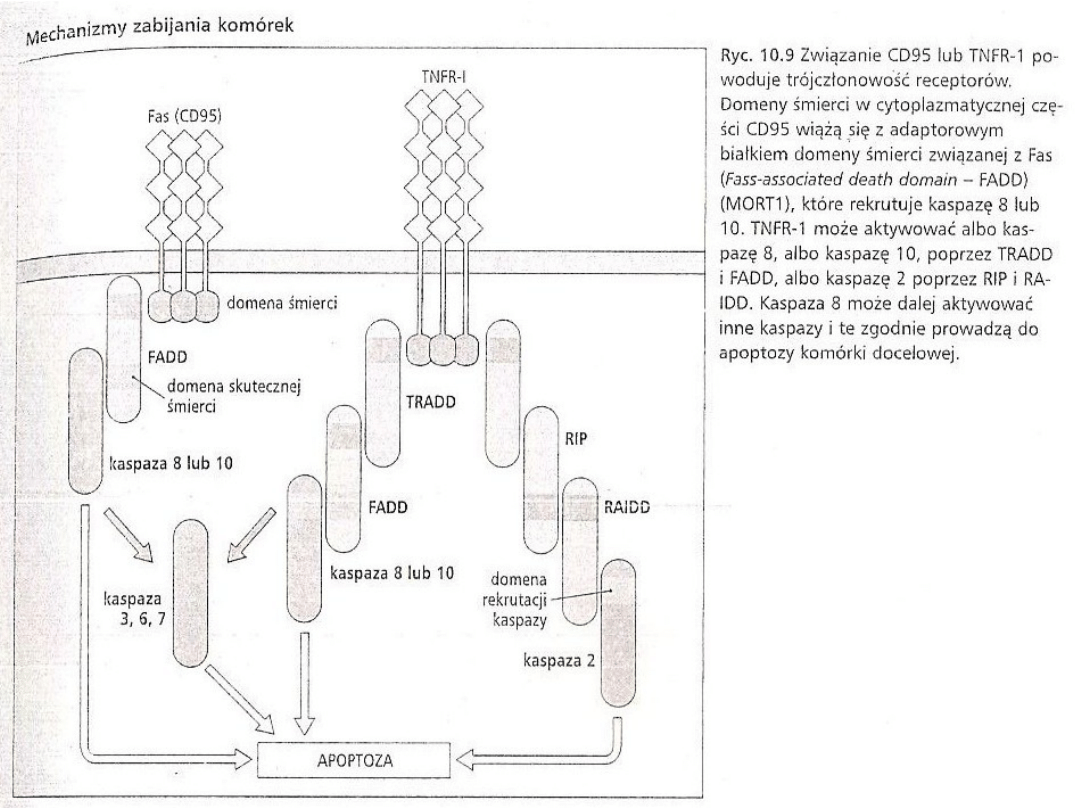
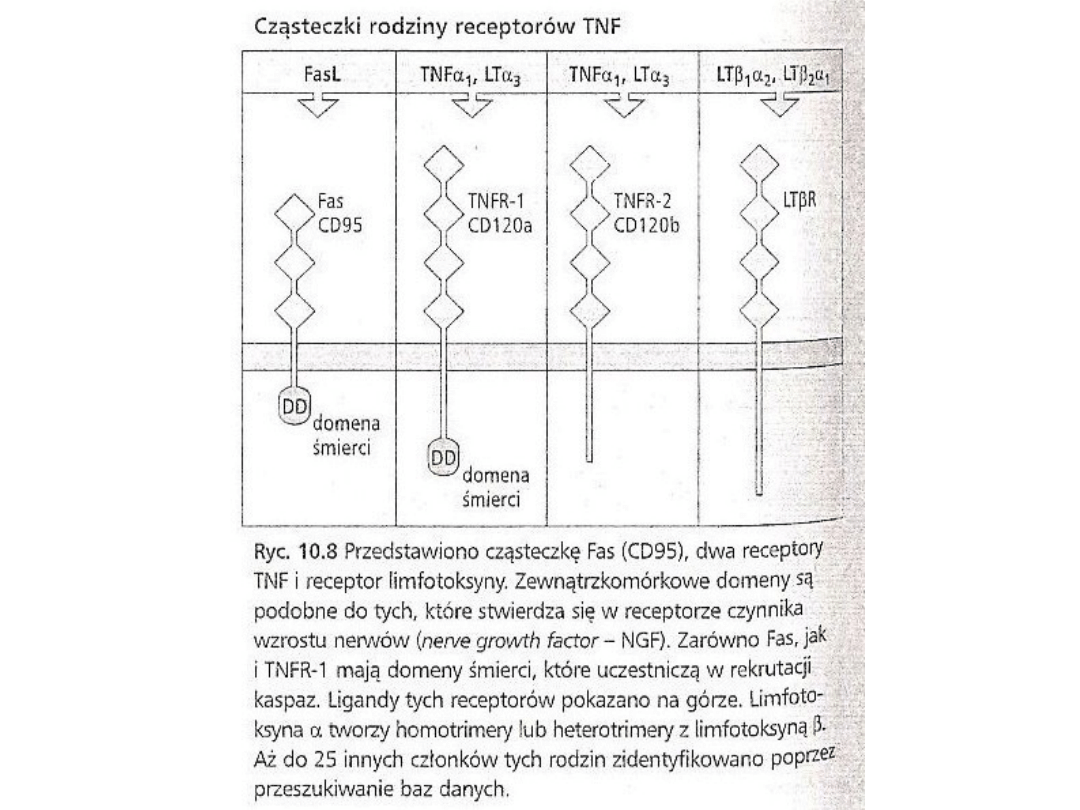

• Obie komórki T – CD-4 i CD-8 – mogą zapoczątkowywać
śmierć komórki poprzez ekspresję ligandu Fas, członka
rodziny TNF.
• Ligand Fas rozpoznaje białko FAS, szeroko
rozprzestrzenione na powierzchni komórek. Krzyżowe
zespolenie prowadzi do trójczłonowości Fas i rekrutacji
FADD do domeny śmierci (Fass-associated Heath domain –
FADD) w cytoplazmatycznym fragmencie Fas. FADD
rekrutuje kaspazy 8 lub 10, prowadząc do Ca2+-zależnej
od apoptozy.
• Aktywowana kazpaza 8 może, oprócz własnego
bezpośredniego działania na szlaku apoptozy, rozszczepiać
i aktywować inne kaspazy.
• Inni członkowie rodziny receptorów dla TNF z domenami
śmierci w ich cytoplazmatycznych fragmentach, np. TNF-
R1, mogą również wywoływać śmierci komórki zależnej od
kaspazy po nawiązaniu kontaktu ze swoim ligandem
według podobnego mechanizmu.
• Zdolność do wywoływania śmierci komórki zależnej od
obecności domeny śmierci w cytoplazmatyczny
fragmencie.
• Członkowie receptorów dla TNF z brakiem domeny śmierci
nie pośredniczą w śmierci komórki zależnej od kaspaz.

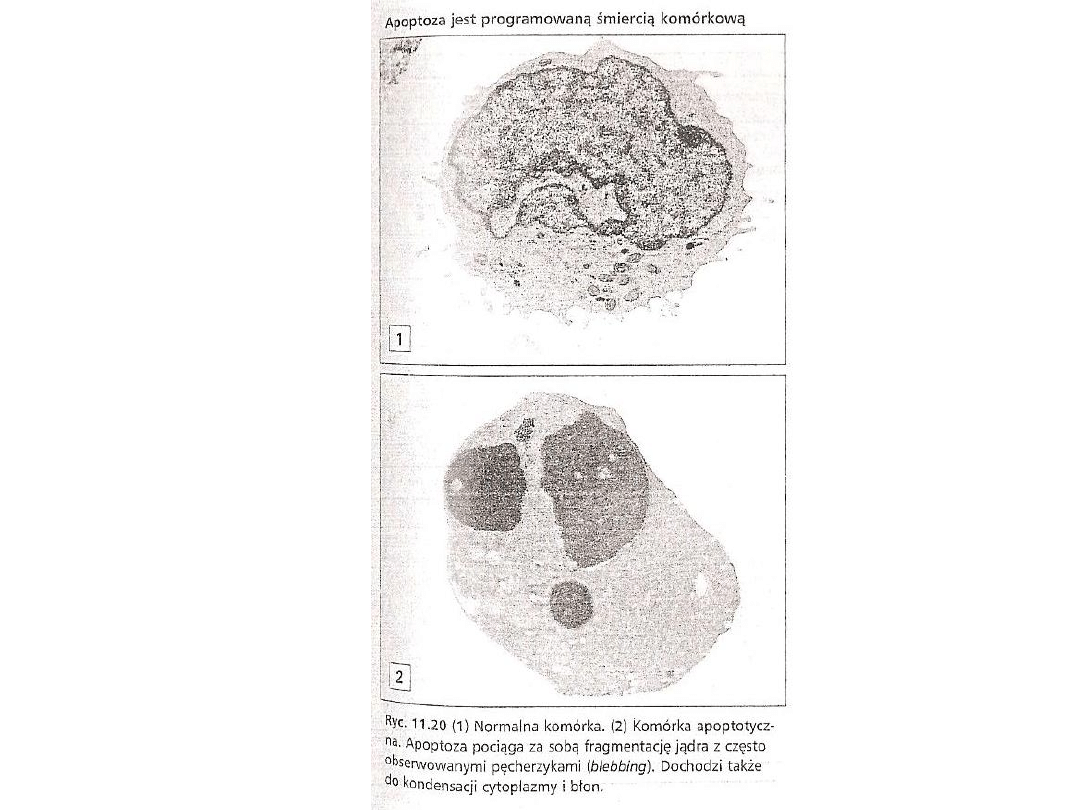
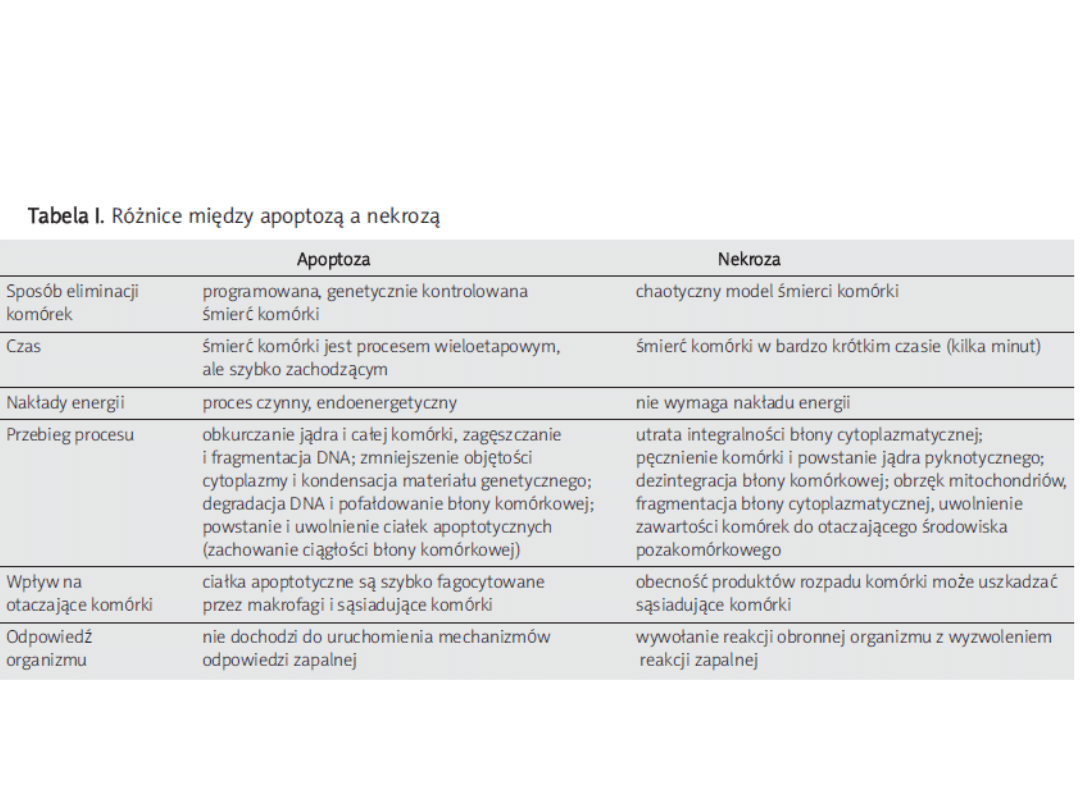
Morfologia komórki
apoptotycznej
• komórki umierające w wyniku apoptozy wykazują szereg
charakterystycznych, morfologicznych zmian
• komórka apoptotyczna z reguły oddziela się od pozostałych
• na skutek utraty wewnątrzkomórkowej wody i elektrolitów dochodzi
do jej obkurczenia, zmiany kształtu, wielkości oraz zagęszczenia
cytoplazmy
•
• powierzchnia takiej komórki ulega charakterystycznemu pofałdowaniu
• jednocześnie dochodzi do zmian w chromatynie jądrowej. Ulega ona
zagęszczeniu i początkowo gromadzi się w pobliżu błony jądrowej
• następnie wypełnia ona całe jądro, które staje się pyknotyczne
• organella są gęsto upakowane w cytoplazmie i nie wykazują
znaczących zmian morfologicznych

Morfologia komórek apoptotycznych cd.
• cechą charakterystyczną dla apoptozy jest również
fragmentacja jądra komórkowego oraz powstawanie tzw. ciałek
apoptotycznych w późniejszych stadiach tego procesu
• w przypadku apoptozy zawartość komórki nie wydostaje się na
zewnątrz i nie dochodzi do powstania odczynów zapalnych
(dzieje się tak dzięki tworzeniu się nierozpuszczalnej osłony
stabilizującej integralność całej komórki apoptotycznej, a w
późniejszym etapie również ciałek apoptotycznych)
• jest to efekt tworzenia się dodatkowych wiązań pomiędzy
białkami błonowymi
• w warunkach fizjologicznych, komórki podlegające apoptozie są
fagocytowane przez makrofagi lub sąsiadujące komórki.
• w hodowli zaś, wobec braku komórek fagocytujących, komórki
apoptotyczne ulegają wtórnej martwicy
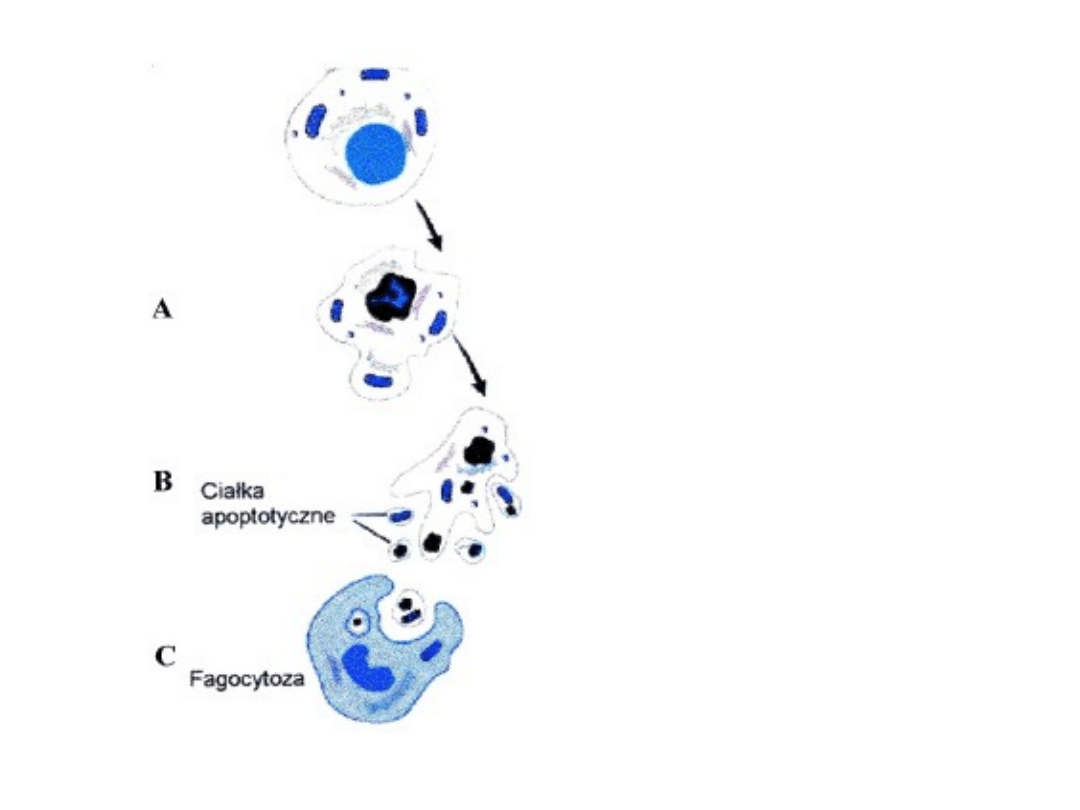
Rys. 1. Zmiany
morfologiczne
zachodzące w
komórce
apoptotycznej. A -
kondensacja
chromatyny,
której towarzyszy
obkurczenie komórki i
zagęszczenie
cytoplazmy; B -
fragmentacja jądra
komórkowego; C –
fagocytoza [na
podstawie
www.mol.uj.edu.pl -
zmienione].

Zmiany biochemiczne
zachodzące w komórce
umierającej na drodze
apoptozy

Zmiany zachodzące w błonie plazmatycznej komórki
podczas procesu apoptozy
• cechą charakterystyczną procesu apoptozy są zmiany
zachodzące w budowie błony komórkowej
(dochodzi wówczas do zaburzenia asymetrii w
rozmieszczeniu fosfolipidów błonowych; w normalnej
komórce na powierzchni błony przeważają fosfolipidy
obojętne, do których zalicza się: sfingomielinę i
fosfatydylocholinę; w warstwie wewnętrznej zaś dominują
fosfolipidy anionowe, takie jak fosfatydyloseryna)
• w komórkach apoptotycznych fosfatydyloseryna jest
eksponowana w zewnętrznej warstwie błony komórkowej.
(zjawisko to wykorzystuje się do znakowania komórek
apoptotycznych za pośrednictwem aneksyny V, która ma
zdolność do preferencyjnego wiązania się z ujemnie
naładowanymi fosfolipidami, takimi jak
fosfatydyloseryna)
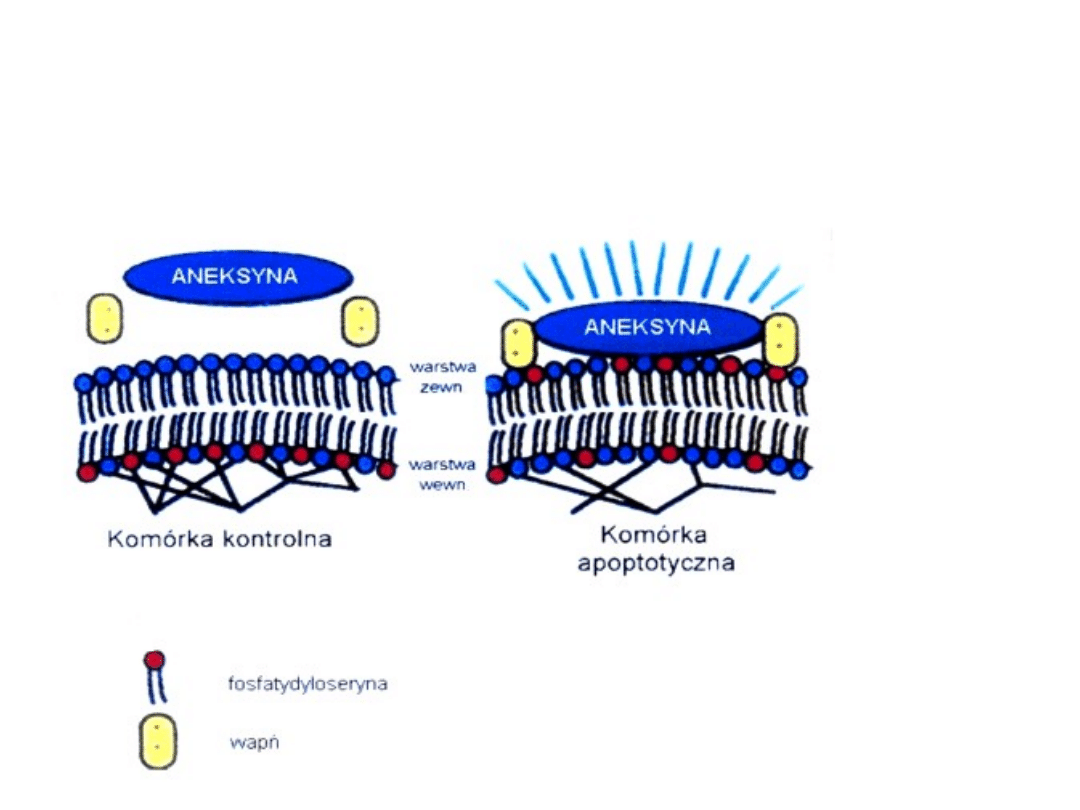
Zmiany zachodzące w budowie błony komórkowej
we wczesnych fazach apoptozy

Zmiany w funkcjonowaniu mitochondriów
• apoptoza jest ściśle kontrolowana na poziomie mitochondriów
• jednym z kluczowych parametrów, określających zaburzenie
funkcji tych organelli podczas apoptozy, jest spadek potencjału
elektrochemicznego (Ψm) na wewnętrznej błonie
mitochondrialnej
• następuje on przed pojawieniem się fragmentacji DNA i
charakterystycznych dla apoptozy zmian w morfologii komórki
• spadek potencjału Ψm poniżej krytycznej wartości tzw.
potencjału bramkującego, sprzyja otwieraniu tzw. megakanałów
itochondrialnych, co nieodwracalnie prowadzi do apoptozy
• w wyniku otwarcia tychże megakanałów dochodzi do
uwolnienia z przestrzeni międzybłonowej mitochondriów do
cytoplazmy szeregu białek apoptogennych, takich jak
cytochrom c, czynnik indukujący apoptozę (AIF) oraz
prokaspazy 2, 3 i 9

Fragmentacja DNA
• kolejnym, charakterystycznym znacznikiem procesu apoptozy
jest degradacja DNA, przebiegająca w kilku następujących po
sobie etapach
• w pierwszym z nich powstają duże fragmenty DNA (HMW, ang.
high molecular DNA), osiągające wielkość od 300 do 50 tysięcy
par zasad
• w kolejnym etapie, DNA może ulec fragmentacji do krótkich
odcinków, będących wielokrotnością około 200 par zasad
• stosując technikę elektroforezy w żelu agarozowym można
rozdzielić DNA podegradowane na mono- i oligonukleosomy
• fragmenty te układają się na elektroforegramie w
charakterystyczną „drabinkę”; do fragmentacji DNA dochodzi w
wyniku aktywacji specyficznych endonukleaz, takich jak
DFF40/CAD oraz endonukleaza G, czy lizosomalna DNaza II

Aktywacja specyficznych enzymów
proteolitycznych - kaspaz
• kaspazy to specyficzna klasa enzymów będących protezami
cysteinowymi, które przecinają łańcuch polipeptydowy na
reszcie argininy w określonej sekwencji aminokwasowej
• enzymy te syntetyzowane są w postaci nieaktywnego
zymogenu, a ich funkcje fizjologiczne w normalnej komórce
nie są znane
• zostały one podzielone na dwie grupy: kaspazy inicjatorowe i
kaspazy egzekutorowe
• w początkowej fazie apoptozy aktywowane są kaspazy
inicjatorowe, a dopiero później kaspazy egzekutorowe,
których substratami są różne białka komórkowe (np. PARP,
kinaza DNA – PK, topoizomeraza II, aktyna, gelsolina, lamina
B)


Podsumowanie
• apoptoza jest procesem genetycznie zaprogramowanym
podobnie jak podziały komórkowe
• program genetyczny apoptozy zachował duże
podobieństwo w rozwoju ewolucyjnym organizmów
• u kręgowców i bezkręgowców zaprogramowana śmierć
komórki zachodzi według podobnych schematów i przy
udziale homologicznych białek
• w utrzymniu homeostazy apoptoza ma równoważną rolę z
podziałami komókowymi
• w wielu chorobach znaczenie mają zaburzenia w przebiegu
apoptozy, dlatego poznanie i możliwość regulacji tego
procesu będą miały w przyszłości duży wpływ na leczenie
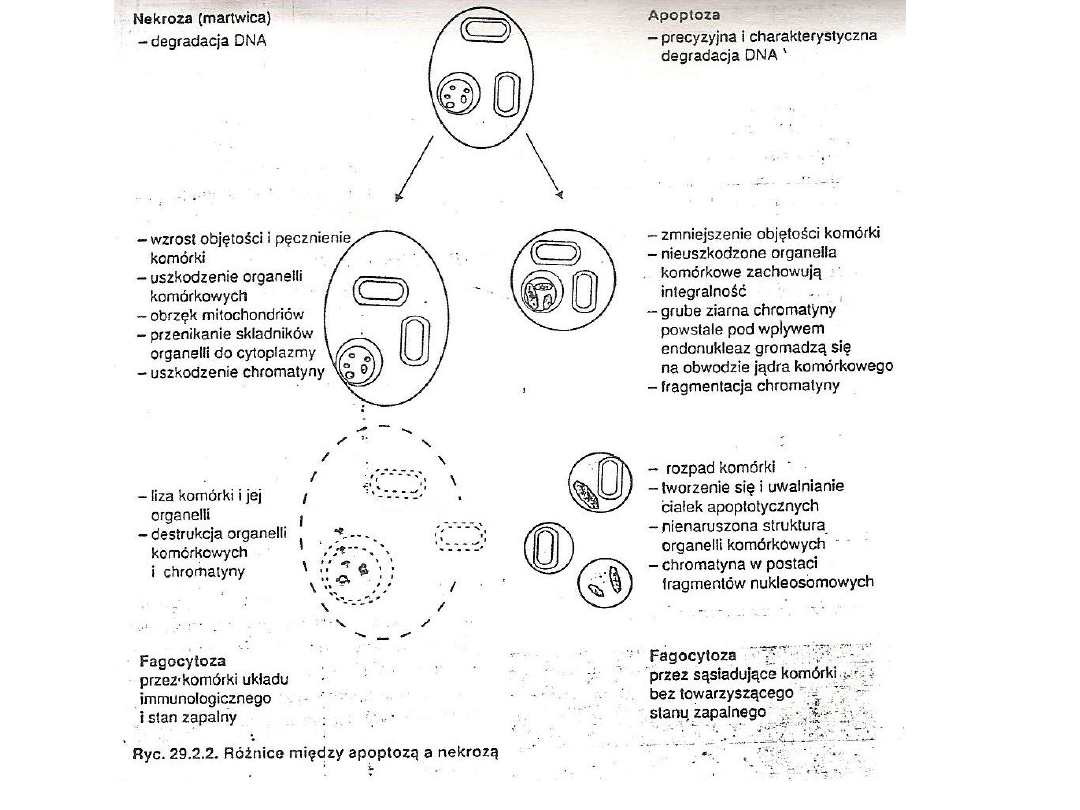
NEKROZA

W odróżnieniu od programowanej
genetycznie śmierci komórki,
występuje również zjawisko nekrozy,
a więc śmierć komórki pod wpływem
masywnych czynników
uszkadzających, co powoduje utratę
równowagi osmotycznej w komórce.

• ten rodzaj śmierci zachodzi pod wpływem zarówno czynników
fizycznych, chemicznych jak i biologicznych, m.in.
wywoływany jest przez niską i wysoką temperaturę,
promieniowanie UV i γ, a także toksyny bakteryjne
• aby doszło do tego typu śmierci czas działania oraz natężenie
szkodliwych czynników musi przekroczyć próg odporności tych
komórek
• nekroza dotyczy grupy komórek, które pęcznieją i tracą
ciągłość błony komórkowej; w komórkach, które mają ulec
śmierci nekrotycznej drastycznie spada poziom ATP, który jest
niezbędny do prawidłowego przebiegu wielu procesów
• deficyt ATP następuje w wyniku depolaryzacji błony
mitochondrium, czego konsekwencją są zaburzenia w
transporcie elektronów
• nie tylko funkcja i budowa mitochondriom ulegają zmianom;
destrukcja dotyczy także innych organelli, m.in. reticulum
endoplazmatycznego, polisomów, jądra komórkowego oraz
lizosomów

• w wyniku zaburzeń w strukturze błony komórkowej dochodzi do
biernego napływu wody i jonów (głównie wapnia i sodu) do
wnętrza komórki.
• pojawienie się dużej ilości jonów CA2+ w cytozolu (napływ z
zewnątrz oraz wypływ z ER), jest uważane za typowy objaw
nekrozy
• wzrost stężenia ww. jonów wpływa na aktywację nukleaz, które
tną DNA, a jądro komórkowe ulega dezintegracji
• zaburzeniu ulegają również inne struktury komórki, ponieważ
zostają uwolnione enzymy hydrolityczne z pękających lizosomów
• napęczniała coraz bardziej komórka i jej organella ulegają
rozpadowi, a cała zawartość jest uwalniana do przestrzeni
międzykomórkowej
• rozlane składniki komórkowe wywołują odczyn zapalny, którego
brak w przypadku apoptozy
Ryc. „Znaczenie apoptozy w patogenezie
miażdżycy”; Zapolska-Downar D., Sygitowicz
G., Jarosz M.; Instytut Żywności i Żywienia;
Warszawa
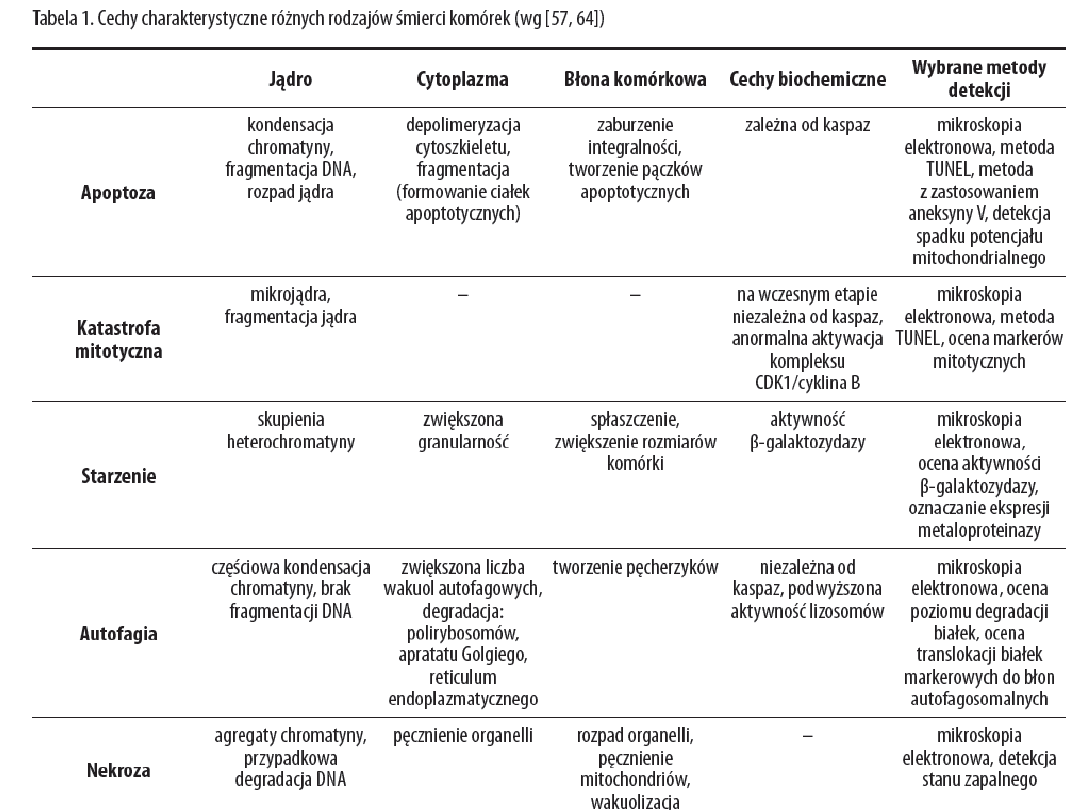
Ryc. „Rodzaje śmierci komórki”; Aleksandra Stępień, Magdalena
Izdebska, Alina Grzanka; Katedra i Zakład Histologii i
Embriologii Collegium Medicum im. L. Rydygiera w
Bydgoszczy UMK w Toruniu

KONIEC
Bibliografia:
1)
„Immunologia”, red. nauk. Gołąb J., Jakóbisiak M., Lasek W.,
Stokłosa T., wyd. PWN
2)
„Immunologia”, Male D., Roth D.B., Roitt I., Brostoff J., wyd. I
polskie pod red. Żeromskiego J., wyd. Urban & Partner
3)
„Immunologia kliniczna”, pod red. Kowalskiego M.R., wyd.
Mediton Oficyna Wydawnicza 2000
4)
„Podstawy genetyki”; pod red. Drewy G. i Ferenca T; wyd. II;
wyd. Medyczne Urban & Partner
5)
Artykuły:
1)
„Rodzaje śmierci komórki”; Aleksandra Stępień, Magdalena
Izdebska, Alina Grzanka; Katedra i Zakład Histologii i Embriologii
Collegium Medicum im. L. Rydygiera w Bydgoszczy UMK w Toruniu
2)
„Znaczenie apoptozy w patogenezie miażdżycy”; Zapolska-Downar
D., Sygitowicz G., Jarosz M.; Instytut Żywności i Żywienia; Warszawa
3)
„Zaprogramowana śmierć komórki”; dr hab. Olga Haus, prof..
nadzw. AM; listopad 2002; abc pacjenta
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
Porˇwnianie procesu apoptozy i nekrozy
6. Porównanie mechanizmu i przebiegu śmierci kom órki na drodze apoptozy i nekrozy, Studia, biologia
Apoptoza i Nekroza
Apoptoza i nekroza
Apoptoza i Nekroza
apoptoza katastora nekroza
Apoptoza2
APOPTOZA
Apoptoza CMUJ
OAEB Staining to Detect Apoptosis
Apoptoza, Materiały, Biologia komorki materialy
Introduction to Apoptosis
biologia komorki zwierzecej apoptoza
Bcl 2 family regulator of apoptosis
ewolucja apoptozy
Antioxidant, anticancer, and apoptosis inducing effects in HELA cells
więcej podobnych podstron