
TRANSPORT DO
KOMÓREK, WYMIANA
BIAŁEK I AMINOKWASÓW
MIĘDZY TKANKAMI.

•
złożony i zróżnicowany ze względu na dużą różnorodność
struktur i właściwości poszczególnych aminokwasów
•
Ogólny mechanizm-związany z udziałem mniej lub bardziej
swoistych układów przenośnikowych
TRANSPORT AMINOKWASÓW PRZEZ BŁONY
KOMÓRKOWE

•
Najpowszechniejsze występowanie, największe
znaczenie we wszystkich tkankach
•
Transportuje większość obojętnych aminokwasów, z
wyjątkiem hydrofobowych
•
Ma cechy układu aktywnego tzn. jest sprzężony z
transportem jonów sodowych i jest uwarunkowany
energetycznie
•
Działa w błonach komórek większości tkanek (nie jest
ograniczony do nabłonków nerki i jelita)
UKŁAD A

•
Ma cechy transportu aktywnego
•
Występuje głównie w nerce i jelicie
(w pozostałych tkankach transport tych aminokwasów jest
znikomy)
•
Aminokwasy te praktycznie nie występują w osoczu, i nie
podlegają wymianie między tkankami
UKŁAD TRANSPORTUJĄCY AMINOKWASY
ANIONOWE GLU, ASP

•
Drugi układ aktywnego transportu aminokwasów obojętnych
•
bardziej wybiórczy, transportuje głównie Ala, Ser, Cys.
Istnieją jeszcze bardziej swoiste układy, aktywnie
transportujące tylko pewne aminokwasy obojetne np.
•
Układ Gly-transportujący Gly,
•
układ N transportujący His, Glu, Asp
UKŁAD ASC

Transportuje aminokwasy hydrofobowe Leu, Ile, Val, Phe
Nie wykazuje związku z transportem jonów sodowych, działa
na zasadzie dyfuzji ułatwionej
Podobne cechy wykazuje układ transportujący aminokwasy
zasadowe-Lys,Arg
UKŁAD L

•
Zależność
od
wewnątrzkomórkowego
stężenia
aminokwasów
(duże
wewcząsteczkowe stężenie hamuje, a małe
pobudza transport do wnętrza komórki)
•
Regulacja hormonalna
REGULACJA TRANSPORTU

Hormony anaboliczne:
•
hormon wzrostu (pobudza wychwyt
aminokwasów do wszystkich tkanek i narządów)
•
insulina (pobudza wychwyt aminokwasów przez
mięśnie szkieletowe, ogranicza podaż
aminokwasów do wątroby).
Hormony adrenergiczne:
•
pobudza wychwyt aminokwasów przez
wątrobę( reakcje anaboliczne), bez wpływu lub
hamują transport do kom, w których wywołują
reakcje kataboliczne-mięśnie, tkanka tłuszczowa)
REGULACJA TRANSPORTU

•
O bezwzględnej wielkości wychwytu lub wyrzuty
aminokwasów decyduje intensywność przemian
białek i aminokwasów w danej tkance i szybkość
przepływu krwi.
•
Największy udział w ogólnoustrojowym bilansie
azotowym mają mięśnie i wątroba.
•
Zmiany stanu fizjologicznego organizmu odbijają się
w największym stopniu na wielkość wychwytu lub
wyrzutu aminokwasów przez te narządy. W cyklu
dobowym zmiany te się równoważą.
MIĘDZYNARZĄDOWA WYMIANA
AMINOKWASÓW

•
Największe znaczenie w krążeniu azotu między
mięśniami i wątrobą mają Ala, Glu i aminokwasy
o rozgałęzionych łańcuchach.
•
Mięśnie szkieletowe stale, nawet w okresie
resorpcyjnym uwalniają Ala i Glu do krwi.
•
Wątroba stale wychwytuje azot i wbudowuje go
w mocznik.
•
Aminokwasy o rozgałęzionym łańcuchu są w
mniejszym stopniu wychwytywane przez wątrobę,
stanowią natomiast główne źródło azotu
wbudowywanego w Ala i Glu w mięśniach
szkieletowych.

Po spożyciu posiłku białkowego w płynach przewodu
pokarmowego odbywa się trawienie białek i
peptydów oraz wchłanianie aminokwasów, w którym
uczestniczą wszystkie układy transportujące.
Aminokwasy przejściowo kumulują się w komórkach
nabłonka jelita, podlegają tam też różnorodnym
przemianom i biorą udział w biosyntezie białek
komórkowych.
Większość aminokwasów przechodzi do płynu
pozakomórkowego i do krwi żyły wrotnej, w której
bardzo zwiększa się stęż wolnych aminokwasów
osiągając szczyt 1,5-2 godz po posiłku.
Część Gln przechodzi w Pro albo też ulega utlenieniu
do ornityny.
TRANSPORT I PRZEMIANY AMINOKWASÓW W
STANIE RESORPCYJNYM

•
Krew wrotna spływająca z jelit do wątroby niesie z
sobą „hydrolizat” białek pokarmowych
pozbawionych jednak całkowicie Glu, Asp, Arg i
większości Gln, a wzbogacona znacznie w Ala, Pro,
amoniak, cytrulinę.
•
Amoniak powstaje w świetle jelita (wskutek
bakteryjnego rozkładu produktów azotowych
głównie mocznika).stężenie amoniaku z żyle wrotnej
w stanie resorpcyjnym przewyższa ok. 10-krotnie
stężenie we krwi tętniczej.
•
Wątroba wychwytuje całkowicie amoniak oraz
prawie 50% puli aminokwasów dopływających z
jelita.

Wątroba buforuje więc znaczne zmiany w stężeniu
aminokwasów we krwi tętniczej w okresie po spożyciu
posiłku. Wzrost ten ogólnie wynosi ok. 20%.Wychwyt
wątrobowy aminokwasów jest wybiórczy.
W największym stopniu wychwytywana jest Ala, a w
najmniejszym aminokwasy o rozgałęzionym łańcuchu.
Wychwyt wątrobowy Ala przewyższa napływ Ala z jelita,
co wskazuje, że wątroba wychwytuje też Ala
dopływającą z krwią tętniczą.
We krwi wątrobowej odpływającej z wątroby, stęż Ala i
Glu jest znacznie mniejsze niż we krwi tętniczej,
natomiast stęż aminokwasów o rozgałęzionym
łańcuchu jest znacznie wyższe. Val o ok. 100%, Leu i Ile
o ok. 200%.
W ciągu pierwszej godziny po posiłku aminokwasy
rozgałęzione stanowią prawie połowę ilości
aminokwasów wypływających z wątroby.

•
Wzrasta wyrzut wątrobowy aminokwasów egzogennych-
zasadowych, aromatycznych, hydroksylowych i Gly.
•
Krew wątrobowa miesza się z żylną spływająca z
pozatrzewnych
tkanek
obwodowych-
głównie
mięśni
szkieletowych, i po przejściu przez płuca już jako krew
tętnicza rozprowadzana jest do trzew i mięśni.
•
Skład aminokwasów we krwi tętniczej jest wypadkową składu
krwi wątrobowej i krwi spływającej z mięśni.1-bogata w
aminokwasy rozgałęzione i w mniejszym stopniu w
egzogenne, 2-zwiększone stęż Ala i Glu, spore ilości
amoniaku.
•
Po spożyciu posiłku mięśnie szkieletowe wychwytują te
aminokwasy, które nie wychwyciła wątroba.

W stanie poresorbcyjnym krew wrotna
spływająca z trzewi nie jest już tak bogata w
aminokwasy, ale stężenie ogólne
aminokwasów jest większe niż we krwi
tętniczej
W przewodzie pokarmowym stale zachodzi
rozpad pewnej ilości białek tworzących tzw.
Nietrwałe białko tkankowe oraz tzw. Białko
endogenne pochodzące głównie ze
złuszczonych komórek nabłonka jelita
TRANSPORT I PRZEMIANY AMINOKWASÓW W
STANIE PORESORBCYJNYM

Glutamina jest rozkładana w enterocytach do
amoniaku i glutaminianu, które wraz z
asparaginianem przemieniają się w alaninę.
W stanie poresobcyjnym wątroba wychwytuje
nadal w znacznym stopniu alaninę, a ponadto
wszystkie inne aminokwasy, zwłaszcza
egzogenne oraz glicynę
Mięśnie nie wychwytują praktycznie żadnych
aminokwasów, stale uwalniając znaczne ilości
alaniny i glutaminy oraz niewielkie ilości
aminokwasów rozgałęzionych

Udział jelit , wątroby i mięśni w
ogólnoustrojowym bilansie przemian azotu
aminokwasów zmienia się nienznacznie po
przejściu w stan poresorbcyjny
Zmiany polegają na stopniowym ograniczaniu
syntezy białek w mięśniach
Mniejsze zużycie aminokwasów uwalnianych
podczas rozpadu białek, do odnowy własnych
białek tkankowych, pozwala przy zachowaniu
stałej wielkości puli aminokwasów w tkance-na
zwiększony wyrzut aminokwasów do krwi

Aminokwasy te są wychwytywane przez wątrobę i
wykorzystywane do syntezy białek wydzielniczych
i własnych białek szybko się odnawiających,
podlegają też przemianom katabolicznym
Widać, że wychwyt i przemiany aminokwasów w
trzewiach uzupełniają się z wychwytem i
przemianami aminokwasów w mięśniach
Podsumowując, mięśnie zamieniają azot aminowy
glutaminy , glutaminianu i asparaginianu w azot
alaniny
Wątroba wychwytuje amoniak, alaninę i inne
aminokwasy i wbudowuje azot amoniak i azot
grup aminowych w mocznik

Alanina jest jednym z 2 głównych przenośników
azotu aminokwasów do wątroby
Źródłem alaniny są głównie jelito i mięśnie
Synteza alaniny obejmuje reakcje transaminacji
różnych aminokwasów w( w tym rozgałęzionych) z
alfa-ketoglutaranem i wytworzenie glutaminianu,
który transaminuje następnie z pirogronianem
powstającym z metabolizowanej w mięśniu glukozy
Alanina jest więc produktem 2 ciągów reakcji:
1)glikolizy-powstaje łańcuch węglowy
2)transaminacji-dostarcza azot grupy aminowej
Około 70% powstającej w mięśniach alaniny zawiera
łańcuch węglowy pochodzący z glukozy
ALANINA -ZNACZENIE W
TRANSPORCIE AMINOKWASÓW
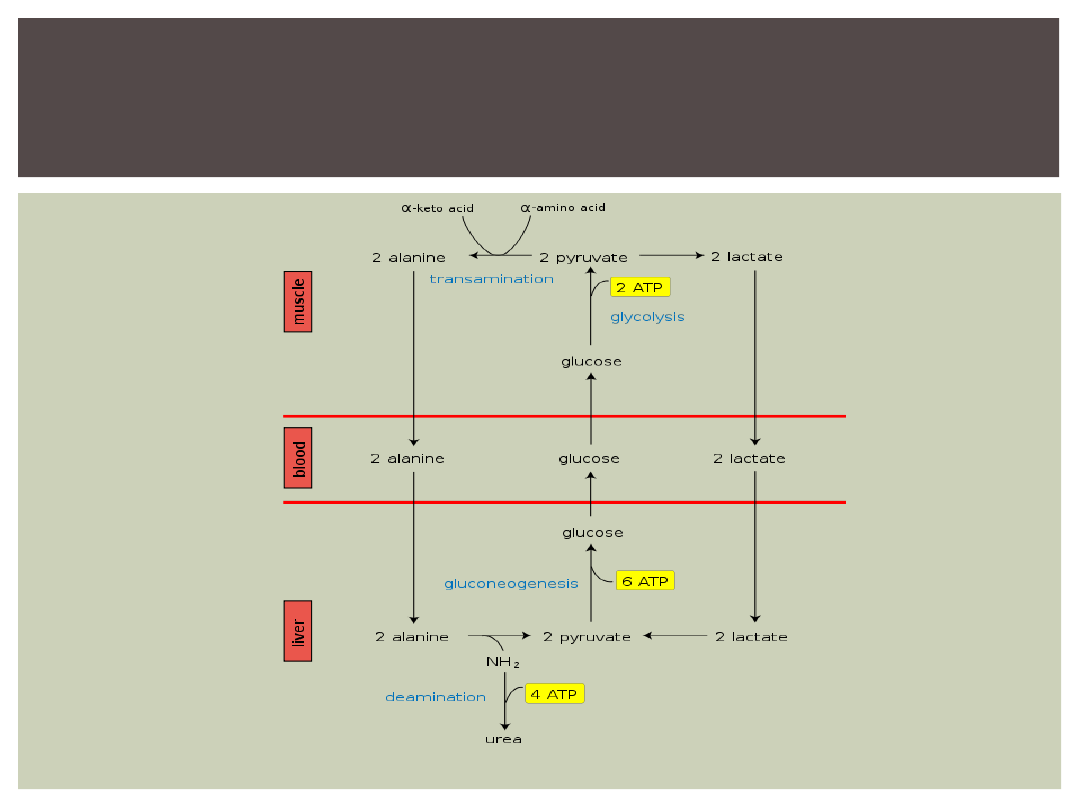
CYKL GLUKOZOWO-ALANINOWY

Drugi ważny przenośnik azotu między tkankami
obwodowymi a wątrobą
W znacznym stopniu rozkładana w komórkach
nabłonka jelita i do wątroby docierają już produkty
przemian glutaminy
Synteza glutaminy jest podstawową reakcją
wiązania amoniaku w tkankach obwodowych
Głównym miejscem syntezy glutaminy są mięśnie
szkieletowe
Glutamina jest donorem azotu w wielu reakcjach
biosyntezy, jest głównym substratem
amoniogenezy nerkowej
GLUTAMINA-PRZENOŚNIK AZOTU

Głównym miejscem katabolizmu glutaminy jest
jelito oraz w pewnej mierze wątroba
Enterocyty rozkładają zarówno glutaminę
wchłoniętą z jelita jak i dopływającą z krwią
tętniczą do trzewi
Wychwyt glutaminy przepływającej jest bardzo
wydajny-w jednym pasażu podlega ekstrakcji 30
% glutaminy osocza
Azot glutaminy odzyskiwany jest w 40% jako
amoniak, 25 % jako alanina, w 25 % jako cytrulina
i 5-10 % jako prolina
w sumie 30 – 40% azotu wbudowanego w
mocznik pochodzi z azotu produktów jelitowej
przemiany glutaminy

Aminokwasy o rozgałęzionym łańcuchu
tworzą odrębną grupę aminokwasów
Służą wyłącznie do biosyntezy białek i nie są
prekursorami żadnych innych aktywnych
biologicznie związków
Utleniane są w większym stopniu przez
tkanki obwodowe
Odgrywają szczególną rolę w transporcie
azotu aminokwasów do mięśni szkieletowych
AMINOKWASY ROZGAŁĘZIONE

W okresie resorbcyjnym wątrobowy wychwyt
aminokwasów rozgałęzionych jest wyraźnie mniejszy niż
ich napływ z krwią wrotną
Występuje znaczne i długo się utrzymujące zwiększone
stężenie aminokwasów we krwi wątrobowej i we krwi
tętniczej
Aminokwasy te są w znacznej mierze wychwytywane
przez mięśnie szkieletowe , gdzie są źródłem azotu do
syntezy alaniny i glutaminy
Aktywność aminotransferaz katalizujących przeniesienie
grupy aminowej aminokwasów rozgałęzionych na alfa-
ketoglutaran jest b. duża w właśnie w mięśniach

Znaczną aktywność tych enzymów wykazuje również
nerki, serce, mózg
Powstające w wyniku transaminacji ketoanalogi
aminokwasów rozgałęzionych są częściowo utleniane,
w dużej mierze przechodzą do krwi
Aktywność enzymów utleniającyh ketoanalogi jest
bardzo mała w mięśniach a duża w wątrobie
Ketoanalogi uwalniane przez mięśnie są
wychwytywane przez wątrobę, nerki i serce i utleniane
lub podlegają reaminacji z powrotem do aminokwasów
rozgałęzionych
Istnieje więc swoiste krążenie łańcuchów węglowych
aminokwasów rozgałęzionych co jest wyrazem
oszczędzania tych łańcuchów egzogennych przez
degradacją
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Projekty interwencji w problem ubóstwa po przez organizowanie pomocy społecznej
METODY I ŚRODKI WYKORZYSTYWANE PRZEZ ORGANIZACJE MIĘDZYNARODOWE DO UTRZYMYWANIA POKOJU I?ZPIECZEŃSTW
stowarzyszenia i organizacje pozarzadowe ppt IOVWIGP5UI6QV5UYLTYWNKODN2KCY37RNER2ODY
Pomiar ciepła wydzielanego przez organizm ludzki Kalorymetryczny pmiar prędkości przepływu krwi
0 Dane organizacyjneid 1756 ppt
Recepcja doktryny nauczania wychowującego Herbarta i doktryny uczenia się przez działanie Dewey’a pp
(4363) konflikt w organizacjiid 1067 ppt
01 Zagadnienia organizacyjneid 2680 ppt
19 STARZENIE SIĘ ORGANIZMUid 18196 ppt
STRATEGIE ORGANIZATORSKIE WYKŁAD ppt
1 ZARZADZANIe ORGANIZACJIbid 10144 ppt
Temat pracy Rola składników odżywczych trawienie i przyswajanie białek, tłuszczów i węglowodanówx
Wręczanie podziękowań dla szanownej komisji przez organizatorów z PP nr 6, dyplomy, zaproszenia, pod
reakcje zwiazkow organicznych wielofunkcyjnych ppt
Procesy i przemiany biochemiczne wywoływane i prowadzone przez organizmy glebowe, Studia - Ochrona Ś
więcej podobnych podstron