Antybiotyki
Definicja
Dawniej uważano, że antybiotyk, to substancja
chemiczna produkowana przez pewne drobnoustroje i
mająca negatywny wpływ na wzrost i rozwój innych
mikroorganizmów.
Obecnie, pojęcie to poszerzane jest także o związki
półsyntetyczne wyprowadzone z naturalnych
produktów, a także o związki syntetyczne wzorowane
na tych produkowanych przez mikroorganizmy.
Najszersza definicja mówi, że antybiotykami są też te
związki syntetyczne, które wywierają negatywny wpływ
na mikroorganizmy, a nie mają swoich pierwowzorów
wśród naturalnie produkowanych substancji.
Historia
W roku 1929 Fleming wykrył penicylinę -
antybiotyk z grupy β-laktamów. Pojęcie
"antybiotyku" zostało wprowadzone dopiero
kilkanaście lat później (1943) przez Waksmana -
odkrywcę streptomycy (antybiotyk
aminoglikozydowy).
W kolejnych latach odkrywano kolejne związki
chemiczne, które hamowały wzrost bakterii. Były
to zarówno związki naturalne jak i syntetyczne.
Często też stosowano modyfikację znanych już
związków w celu polepszenia ich właściwości
antybakteryjnych.
Podział
Antybiotyki możemy podzielić według różnych kluczy. Jednym
z nich jest podział na grupy o podobnej budowie chemicznej
(m.in. antybiotyki β-laktamowe czy tetracykliny). Podział taki
jest mało przydatny dla zwykłego człowieka, gdyż nie niesie
on ze sobą informacji zrozumiałych dla każdego. Dużo
sensowniejszy jest podział ze względu na proces życiowy
bakterii, który zakłócają dane związki. Tym sposobem można
wyróżnić cztery duże grupy antybiotyków:
działające na syntezę ściany komórkowej (np. cefalosporyny)
działające na syntezę białek (np. tetracykliny)
działające na replikację i naprawę DNA (np. lewofloksacyna)
działające na syntezę kwasu foliowego (np. sulfonamidy)
Podział
Nie wszystkie antybiotyki działają bakteriobójczo.
Uwzględniając stopień szkodliwości danych
związków na bakterie możemy wyróżnić trzy
grupy antybiotyków:
antybiotyki bakteriobójcze (np. chinolony)
antybiotyki bakteriobójcze w pewnych
okolicznościach (np. penicylina)
antybiotyki bakteriostatyczne (np. chloramfenikol)
MBC –minimal bacteriocidal
activity
MIC-minimal inhibitory
concentration
MAKROLIDY
MAKROLIDY
SULFONAMIDY
SULFONAMIDY
LINKOZAMIDY
LINKOZAMIDY
TETRACYKLINY
TETRACYKLINY
CHLORAMFENIKOL
CHLORAMFENIKOL
TRIMETOPRIM
TRIMETOPRIM
KETOLIDY
KETOLIDY
BAKTERIOSTATYCZNE
BAKTERIOSTATYCZNE
BAKTERIOBÓJCZE
BAKTERIOBÓJCZE
B-LAKTAMY
B-LAKTAMY
AMINOGLIKOZYDY
AMINOGLIKOZYDY
CHINOLONY
CHINOLONY
KOTIMOKSAZOL
KOTIMOKSAZOL
GLIKOPEPTYDY
GLIKOPEPTYDY
PODZIAŁ ZE WZGLĘDU NA SPOSÓB DZIAŁANIA
PODZIAŁ ZE WZGLĘDU NA SPOSÓB DZIAŁANIA
ANTYBIOTYKU
ANTYBIOTYKU
Antybiotykooporność
Wraz ze stosowaniem antybiotyków coraz większa
liczba bakterii nabiera zdolności obronnych przed
ich szkodliwym działaniem i leki te wychodzą z
użytku. Niektóre gatunki bakterii zawsze były
oporne na pewne antybiotyki, inne zaś zyskały
oporność pobierając z otoczenia plazmid z
odpowiednim genem lub też na skutek mutacji.
Niektóre ze szczepów bakteryjnych posiadają
oporność na bardzo wiele antybiotyków, co
zdecydowanie utrudnia walkę z zakażeniami przez
nie wywoływanymi. Przykładem mogą tu być
szczepy MRSA Staphylococcus aureus (Methicilin
Resistant Staphylococcus Aureus).
Antybiotykooporność mechanizm
działania
Wszystkie poznane dotąd mechanizmy
można podzielić pomiędzy cztery osobne
grupy:
zmniejszenie wewnątrzkomórkowego
stężenia antybiotyku
modyfikacja prowadząca do inaktywacji
antybiotyku
ominięcie procesu blokowanego przez
antybiotyk
modyfikacja "celu", na który normalnie
działa antybiotyk
Oporność bakterii na dany antybiotyk może być
wynikiem współdziałania kilku różnych
mechanizmów
.
Podstawą skutecznego działania antybiotyków jest ich przeniknięcie
do wnętrza komórki lub przynajmniej do wnętrza ściany
komórkowej i działanie tam na odpowiednie procesy. Jeśli na skutek
różnych modyfikacji w budowie ściany komórkowej antybiotyk nie
będzie mógł wniknąć do komórki (lub będzie wnikał w bardzo małej
ilości) to rozwój bakterii nie zostanie powstrzymany lub będzie
powstrzymywany w bardzo małym stopniu. Oporność powstająca
na skutek zwykłego pogrubienia ściany komórkowej nie jest zbyt
silna i zwykle powiększenie stężenia antybiotyku powinno pozwolić
na zabicie bakterii. Jeśli jednak nastąpią mutacje i zmiany w
białkach tworzących pory w błonie komórkowej to oporność może
być dużo silniejsza. Przykładem jest oporność na chinolony
(mutacja porów powoduje też często wzrost oporności na inne
antybiotyki).
Oporność bakterii na dany antybiotyk może być
wynikiem współdziałania kilku różnych
mechanizmów
.
Mechanizm wypompowywania antybiotyku z
komórki bakteryjnej prowadzi zasadniczo do tego
samego - do uniemożliwienia kontaktu
antybiotyku z celem. Za wyprowadzenie
antybiotyku poza komórkę odpowiedzialne są
specjalne pompy. Naukowcy podzielili je na kilka
klas. Jednak najważniejszy jest ogólny podział na
pompy specyficzne względem danego antybiotyku
lub danej klasy antybiotyków (np. pompy
usuwające z komórek tetracykliny) oraz na pompy
działające na szereg różnych związków (np.
rodzina MATE - Multidrug and Toxic compounds
Extrusion).
Oporność bakterii na dany antybiotyk może być
wynikiem współdziałania kilku różnych
mechanizmów
Oporność polegająca na modyfikacji prowadzącej do inaktywacji
antybiotyku jest stosunkowo prostą metodą. Opiera się ona o
enzymatyczne przekształcenie antybiotyku tak, aby przestał on
zagrażać podstawowym procesom komórkowym. Sposób
modyfikowania antybiotyku może być różny. Najbardziej
klasycznym przykładem jest tu przecinanie pierścienia β-
laktamowego (np. penicyliny) poprzez β-laktamazy. Inną
strategię inaktywacji antybiotyku (linkomycyny) stosuje
Streptococcus agalactiae (jeden z paciorkowców). Odpowiedni
enzym (dokładniej jedna z nukleotydylotransferaz) przyłącza do
linkomycyny (a także niektórych innych antybiotyków) resztę
adenylową (z ATP) i powstający kompleks nie wykazuje
aktywności bakteriobójczej. Mechanizm polegający na ominięciu
procesu blokowanego przez antybiotyk jest dosyć oczywisty.
Jeśli stosowany lek blokuje jeden z enzymów potrzebnych przy
syntezie ściany komórkowej to jest możliwe, że komórka będzie
posiadać inny enzym, który będzie pełnił tę samą funkcję, a
jednocześnie będzie niewrażliwy na działanie antybiotyku. Taki
mechanizm występuje np. u MRSA. Dzięki temu te szczepy
gronkowca wykazują oporność na antybiotyki β-laktamowe.
Oporność bakterii na dany antybiotyk może być
wynikiem współdziałania kilku różnych
mechanizmów
Ostatnim z mechanizmów oporności jest
modyfikacja "celu" (ang. target), na który działa
antybiotyk. Doskonałym przykładem jest oporność
niektórych bakterii (np. gronkowców) na
erytromycynę. Normalnie ten antybiotyk przyłącza
się do 23SrRNA w rybosomach. Jednak na skutek
działania enzymu erm (erythromycin ribosome
methylase) z jednej z adenin w tym RNA usuwana
jest grupa metylowa. Powoduje to, że antybiotyk
nie może się przyłączyć do rybosomu, a tym
samym nie blokuje translacji białek.
Antybiotykooporność ocena.
Do bardziej tradycyjnych technik należy wyznaczanie MIC
(Minimal Inhibitory Concentration) - czyli wyznaczanie
minimalnego stężenia antybiotyku wywołującego zahamowanie
wzrostu bakterii oraz antybiogram.
wyznaczenie MIC polega na przygotowaniu seryjnego
rozcieńczenia danego antybiotyku w odpowiedniej pożywce, a
następnie zaszczepieniu takiej pożywki daną ilością bakterii
(ważne jest by do każdego rozcieńczenia antybiotyku dodać
taką samą ilość bakterii). Po inkubacji serii rozcieńczeń w
odpowiednich warunkach możemy zaobserwować przy jakim
stężeniu widać zahamowanie wzrostu, a przy jakim nie. Test ten
jest bardzo prosty do wykonania i nawet niewprawna osoba jest
w stanie odczytać wyniki.
W celu zbadania antybiogramu musimy wysiać bakterie na
szalkę z odpowiednią pożywką. Bakterie należy równomiernie
rozprowadzić. Na tak przygotowaną szalkę wykładamy specjalne
krążki nasączone różnymi antybiotykami. Po odpowiedniej
inkubacji wokół krążków będziemy widzieli strefy zahamowania
wzrostu (jeśli bakterie były wrażliwe na dany antybiotyk).
Oporność krzyżowa
Istotną kwestią, na którą należy zwrócić
uwagę przy omawianiu antybiotykooporności
jest oporność krzyżowa. Jest to zjawisko
polegające na tym, że oporność na pewne
antybiotyki jest ze sobą powiązana. Znane są
liczne przykłady oporności krzyżowej np.
pomiędzy różnymi cefalosporynami (grupa
antybiotyków β-laktamowych). Jeśli wiemy,
że pomiędzy daną parą antybiotyków
zachodzi oporność krzyżowa to wykonując
antybiogram badamy tylko jeden z nich i
wyciągamy wnioski na temat drugiego.
Antybiotyki działające na syntezę ściany
komórkowej
Ściana komórkowa będąca najbardziej zewnętrzną częścią komórki
bakteryjnej jest potencjalnym celem działania antybiotyków.
ściana składa się z wielu warstw peptydoglikanu (dodatkowo w jej
skład wchodzą też inne substancje).
Peptydoglikan zwany też mureiną czy muropeptydem różni się
budową u różnych gatunków bakterii, ale zasadniczo można w nim
wyróżnić zawsze dwa komponenty: cukrowy i peptydowy. Pierwszy
z nich składa się z dwóch cząsteczek cukru (ściślej N-
acetyloglukozaminy i kwasu N-acetylomuraminowego) drugi zaś
stanowi pentapeptyd, który u różnych gatunków ma różny skład.
enzymy zwane transpeptydazami katalizują tworzenie wiązań, a
zatem spajają peptydoglikan w całość. Właśnie transpeptydazy są
celem działania wszystkich antybiotyków β-laktamowych (m.in.
penicyliny, cefalosporyny, monobaktam, karbapenemy).
Antybiotyki te przyłączają się do enzymu, który powoduje
przecięcie ich pierścienia β-laktamowego. W tej sytuacji
połączenie antybiotyk - enzym staje się trwałe i transpeptydazy
nie mogą pełnić swojej funkcji.
Antybiotyki działające na syntezę ściany
komórkowej
Inny mechanizm działania wykazują antybiotyki z grupy
glikopeptydów (wankomycyna, teicoplanina). Nie
inaktywują one transpeptydaz. Zamiast tego łączą się z
ich substratami - podjednostkami mureiny powodując, że
stają się one niedostępne dla transpeptydaz. Antybiotyki
te działają tylko na bakterie gramdodatnie (nie mogą
przenikać przez błonę zewnętrzną bakterii
gramujemnych).
Bakterie oporne na wankomycynę stosują dwie techniki.
Pierwszą techniką jest pogrubienie ściany komórkowej
na tyle, by antybiotyk łączył się z zewnętrznymi
warstwami peptydoglikanu nie docierając do miejsca, w
którym wbudowywane są kolejne jednostki
muropeptydu. Oporność ta nie jest pełna i zwiększenie
stężenia antybiotyku powoduje zabicie bakterii. Drugi
mechanizm oporności jest dużo skuteczniejszy - polega
on na enzymatycznej modyfikacji monomerów mureiny
tak by antybiotyk nie mógł się do nich przyłączyć.
Antybiotyki działające na syntezę białek
Białka są jednym z podstawowych składników komórki. Blokada ich syntezy
jest zawsze szkodliwa i jeśli trwa wystarczająco długo może prowadzić do
śmierci komórki. Z biochemicznego punktu widzenia proces syntezy białek
jest bardzo złożony,
Pierwszym procesem na drodze od materiału genetycznego do białka jest
transkrypcja czyli przepisanie informacji z DNA na RNA.
Cząsteczka mRNA przyłącza się w cytoplaźmie komórki do kompleksu białek
i kwasów nukleinowych zwanego rybosomem.
Na tym etapie zaczyna się translacja czyli przepisywanie informacji z mRNA
na sekwencję aminokwasów.
Odpowiednie cząsteczki tRNA rozpoznają trójki nukleotydów w mRNA i
przyłączają się do nich. Każda cząsteczka tRNA niesie ze sobą konkretny
aminokwas.
W rybosomie mRNA przesuwa się i następuje synteza białka.
Rybosom jest doskonałym celem działania antybiotyków. Związki chemiczne
przyłączające się do niego mogą albo zablokować syntezę białka, albo
spowodować, że rybosom będzie się "mylił" i powstające białka będą
niefunkcjonalne. Znamy antybiotyki przyłączające się do dużej podjednostki
rybosomu (np. makrolidy) jak i do jego małej podjednostki (np. tetracykliny)
Tetracykliny działają poprzez uniemożliwienie wnikania cząsteczek tRNA
niosących aminokwasy do rybosomu. Tym sposobem blokowana jest
synteza białek.
Antybiotyki działające na replikację i naprawę
DNA
W wypadku bakterii rozmanażaniem jest proste
dzielenie się komórek. Jednak by to mogło nastąpić,
materiał genetyczny musi ulec podwojeniu w procesie
zwanym replikacją.
Jednymi z enzymów, które biorą udział w syntezia DNA
są topoizomerazy.
Do antybiotyków działających na topoizomerazy należy
ogromna grupa syntetycznych chinolonów . Poprzez
przyłączenie się do topoizomeraz blokują one replikację
i prowadzą do śmierci komórki.
Antybiotyki działające na metabolizm kwasu
foliowego
Bardzo ważnym związkiem występującym w żywych
organizmach jest kwas tetrahydrofoliowy.
Bakterie posiadają zdolność syntezy tego kwasu. Jego rola w
komórce jest różnoraka. Najogólniej służy on do przenoszenia
reszt jednowęglowych.
Kwas foliowy w komórkach bakteryjnych umożliwia syntezę
tymidyny, wszystkich puryn oraz niektórych aminokwasów.
Brak tej substancji powoduje zarówno zablokowanie replikacji
DNA jak i transkrypcji i translacji.
Sulfonamidy blokują pierwszy etap bakteryjnej syntezy kwasu
foliowego. Leki te wywodzą się od sulfanilamidu, który jest
analogiem strukturalnym kwasu para-aminobenzoesowego
(PABA). Związek ten jest przekształcany w kilku etapach do
kwasu foliowego. Sulfonamidy, jako jego analogi strukturalne
wiążą się konkurencyjnie do enzymu przekształcającego PABA
(syntetazy dihydropterynianowej - DHPS).
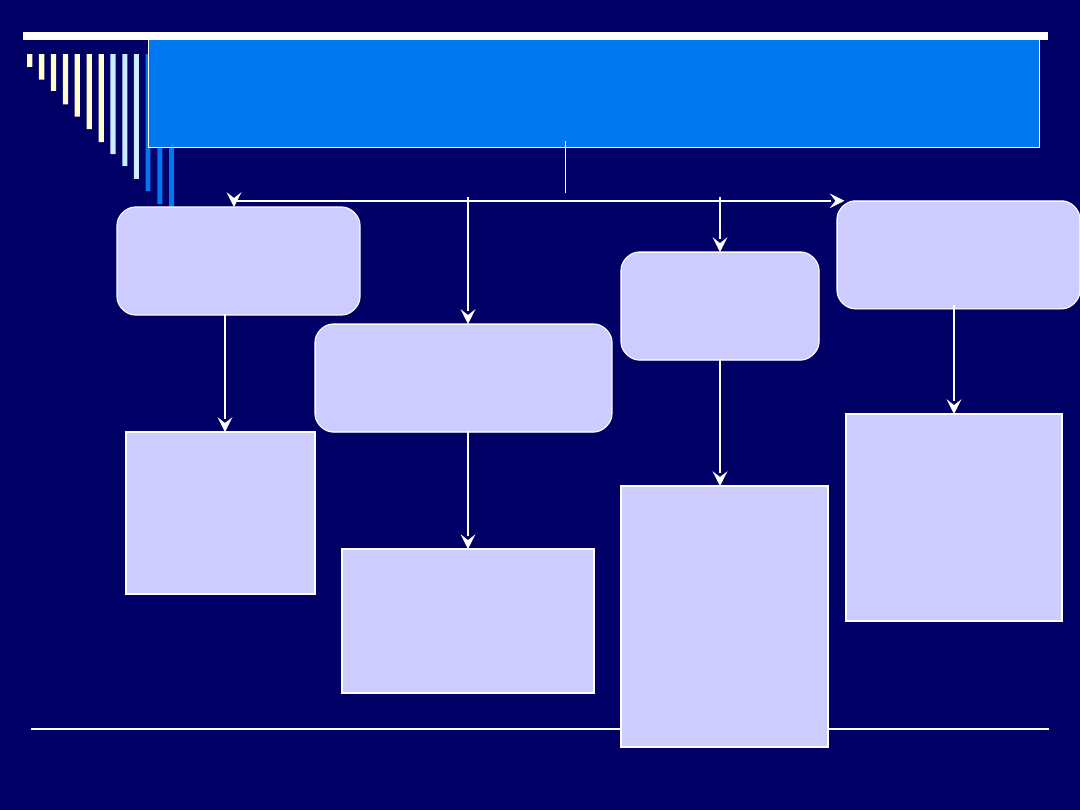
Blokowanie
biosyntezy ściany
komórkowej
Uszkodzenie błony
protoplazmatycznej
Blokowanie
biosyntezy białka
Blokowanie
syntezy DNA
p-laktamy
glikopeptydy
fosfomycyna
bacytracyna
Polimyksyny
oraz leki
przeciw grzybicze
chloramfenikol
aminoglikozydy
tetracykliny
makrolidy
kwas fusydowy
kotrimoksazol
chinolony
nitrofurany
metronidazol
rifamycyny
leki przeciw
-wirusowe
Mechanizm działania antybiotyków i
Mechanizm działania antybiotyków i
chemioterapeutyków na drobnoustroje
chemioterapeutyków na drobnoustroje
Najważniejsze grupy leków przeciwbakteryjnych
Tetracykliny
:
Są to antybiotyki o działaniu bakteriostatycznym,
charakteryzujące się bardzo szerokim spektrum
przeciwbakteryjnym, aktywne wobec bakterii tlenowych,
beztlenowych, atypowych, krętków a także pierwotniaków. Wśród
tlenowych ziarenkowców Gram(+), pałeczek Gram(-) oraz
beztlenowców, w ostatnich latach pojawiły się wysokie odsetki
szczepów opornych.
Tetracykliny są stosowane w terapii empirycznej atypowych
zakażeń dróg oddechowych i układu moczowo-płciowego,
boreliozie (w postaci wczesnej), zakażeniach skóry (zwłaszcza w
trądziku) oraz chorobie wrzodowej (w terapii skojarzonej z innymi
lekami).
Tetracyklin nie należy stosować u dzieci poniżej 8 roku życia oraz
kobiet ciężarnych i karmiących, ze względu na niekorzystny wpływ
na tworzenie zawiązków kostnych i wzrost kości oraz przebarwienie
zębów. Tetracykliny mogą również wywoływać nadwrażliwość na
światło oraz sprzyjać nadkażeniom Candida.
Preparaty:
Doksycyklina
Tetracyklina
Najważniejsze grupy leków przeciwbakteryjnych
Nitroimidazole:Są to związki o aktywności wobec pierwotniaków
oraz bakterii beztlenowych. Ich spektrum aktywności obejmuje
przede wszystkim beztlenowe pałeczki Gram(-) z rodzaju Bacteroides,
Prevotella i Fusobacterium, beztlenowe ziarenkowce oraz laseczki z
rodzaju Clostridium. Wrażliwe na nitroimidazole są również
Gardnerella vaginalis oraz Helicobacter pylori. Wśród tego ostatniego
gatunku w Polsce występują wysokie odsetki szczepów opornych (45-
60%).
Nitroimidazole działają bakteriobójczo, stają się aktywne dopiero po
wniknięciu do komórki bakteryjnej i redukcji pod wpływem enzymów
bakteryjnych. Charakteryzują się znakomitą penetracją do tkanek, w
tym również do płynu mózgowo-rdzeniowego i tkanki mózgu. Mimo
długoletniego stosowania w lecznictwie, wśród beztlenowców, a
zwłaszcza pałeczek Gram(-) z rodzaju Bacteroides, szczepy oporne
występują sporadycznie. Do najczęściej stosowanych leków z tej
grupy należą metronidazol i tynidazol. Tynidazol jest stosowany
głównie w leczeniu rzęsistkowicy, natomiast metronidazol – w
różnorodnych zakażeniach z udziałem beztlenowców. Metronidazol w
połączeniu z antybiotykiem aktywnym wobec bakterii tlenowych jest
również stosowany w profilaktyce zakażeń chirurgicznych, gdzie
spodziewana jest obecność bakterii beztlenowych (jama brzuszna,
drogi rodne, głowa, szyja). Metronidazol jest również uznawany za lek
z wyboru w terapii rzekomobłoniastego zapalenia jelita grubego o
etiologii Clostridium difficile.
Preparaty: Metronidazol , Tynidazol
Najważniejsze grupy leków przeciwbakteryjnych
Chinolony :Są to związki syntetyczne, pochodne chlorochiny. Ich
prototypem był kwas nalidyksowy, wycofany z użycia ze względu na
szybką selekcję szczepów opornych. Chinolony działają bakteriobójczo
poprzez zahamowanie syntezy bakteryjnego DNA. O ich skuteczności
klinicznej decyduje nie tylko stężenie w ognisku zakażenia, ale również
czas utrzymywania się stężenia hamującego wzrost bakterii. Poszczególne
preparaty różnią się aktywnością w stosunku do poszczególnych grup
bakterii. Starsze chinoliny, tj. cyprofloksacyna i ofloksacyna charakteryzują
się znakomitą aktywnością wobec pałeczek Gram(-) oraz bakterii
atypowych. Nie posiadają natomiast dostatecznej aktywności wobec
beztlenowców oraz ziarenkowców Gram(+) z rodzaju Streptococcus tj.,
Streptococcus pneumoniae oraz Enterococcus. Cyprofloksacyna jest nadal
najbardziej aktywnym chinolonem wobec Pseudomonas aeruginosa. Nowe
preparaty, takie jak lewofloksacyna i moksyfloksacyna są równie aktywne
wobec bakterii Gram(-) i jak Gram(+), w tym również wobec szczepów
Streptococcus pneumoniae, także tych opornych na penicylinę.
W czasie leczenia, szybko dochodzi do selekcji szczepów opornych,
zwłaszcza wśród gronkowców i Pseudomonas aeruginosa. Szczepy oporne
obserwowano również wśród pałeczek Salmonella i dwoinek rzeżączki.
Chinolony są na ogół dobrze tolerowane, ale ze względu na stwierdzone u
zwierząt doświadczalnych zaburzenia syntezy chrząstki, są
zarezerwowane do leczenia dorosłych (> 16 roku życia).
Preparaty:
Cyprofloksacyna,
,
,
,
Najważniejsze grupy leków przeciwbakteryjnych
Glikopeptydy:Są to związki wielkocząsteczkowe, źle penetrujące do
tkanek i narządów (dotyczy to także płynu mózgowo-rdzeniowego). Są
wybiórczo aktywne wobec tlenowych ziarenkowców Gram(+) (w tym
także wobec szczepów opornych na inne antybiotyki, takich jak
metycylinooporne gronkowce) oraz niektórych beztlenowców (m.in.
Clostridium difficile). Działanie bakteriobójcze jest wynikiem
zahamowania syntezy ściany komórkowej bakterii. Są stosowane w
leczeniu zakażeń wywoływanych przez ziarenkowce Gram(+) u
pacjentów uczulonych na β-laktamy oraz w sytuacjach, gdy szczep
odpowiedzialny za zakażenie jest oporny na penicyliny i cefalosporyny.
Glikopeptydy są zarezerwowane do leczenia szpitalnego ciężkich
zakażeń (również uogólnionych) wywoływanych przez Enterococcus,
metycylinooporne szczepy gronkowców złocistych (MRSA) lub skórnych,
szczepy Streptococcus pneumoniae wysoce oporne na penicylinę, a
także do terapii ciężkich postaci rzekomobłoniastego zapalenia jelita
grubego o etiologii C. difficile, nie odpowiadających na metronidazol.
Należą do tzw. „antybiotyków ostatniej szansy”, dlatego też muszą być
stosowane bardzo rozważnie. W ostatnich latach pojawiły się na świecie,
a także w Polsce szczepy Enterococcus oporne na glikopeptydy. Szczepy
gronkowców o obniżonej wrażliwości obserwowano w Japonii i USA.
Wśród klinicznych szczepów ziarenkowców Gram(+) dochodzi czasami
do rozwoju tolerancji na glikopeptydy.
Preparaty:Wankomycyna, Teikoplanina
Najważniejsze grupy leków przeciwbakteryjnych
Aminoglikozydy:
Prototypowym antybiotykiem w tej grupie
jest odkryta w 1944 roku streptomycyna. Spośród 11
dostępnych aminoglikozydów, najczęściej stosuje się 4:
gentamycynę, tobramycynę netylmycynę i amikacynę.
Wszystkie aminoglikozydy mają identyczne spektrum
aktywności, obejmujące przede wszystkim tlenowe pałeczki
Gram(-). Niewielka aktywność wobec ziarenkowców Gram(+)
sprawia, że aminoglikozydy muszą być zazwyczaj kojarzone z
innymi antybiotykami, najczęściej β-laktamami.
Aminoglikozydy są związkami niskocząsteczkowymi, o
aktywności bakteriobójczej. Mechanizm działania polega na
zahamowaniu syntezy białka w komórce bakteryjnej.
Aktywność bakteriobójcza tych antybiotyków zależy od ich
stężenia w ognisku zakażenia. Połączenie aminoglikozydu z
β-laktamem daje efekt addycyjny lub synergistyczny.
Skojarzenie to ma na celu: spotęgowanie działania
bakteriobójczego wobec ziarenkowców Gram(+), w tym
Enterococcus, zmniejszenie częstości selekcji szczepów
opornych oraz zwiększenie aktywności przeciwbakteryjnej
wobec bakterii Gram(-), zwłaszcza Pseudomonas aeruginosa.
Aminoglikozydy rzadziej niż inne antybiotyki indukują
oporność wśród bakterii.
Najważniejsze grupy leków przeciwbakteryjnych
Aminoglikozydy cd:
Oporność pałeczek Gram(-) jest
wynikiem enzymatycznej inaktywacji antybiotyku.
Najbardziej oporna na działanie enzymów
bakteryjnych jest amikacyna, dlatego też w
środowisku szpitalnym odsetek szczepów opornych na
ten antybiotyk jest niewielki. Aminoglikozydy
wywierają tzw. efekt poantybiotykowy, co oznacza, że
wzrost bakterii jest zahamowany nawet wtedy, gdy
stężenie leku w ognisku zakażenia spada poniżej
wartości najniższego stężenia hamującego (MIC).
Aminoglikozydy nie mogą być mieszane z β-laktamami
w tym samym roztworze, ponieważ ulegają
inaktywacji, dlatego też terapia skojarzona wymaga
oddzielnego podawania obu leków w odstępie 20-30
minut.
Aminoglikozydy mogą działać oto- i nefrotoksycznie.
Działanie to zależy od całkowitej dawki antybiotyku
podanej pacjentowi. Nie należy powtarzać terapii
aminoglikozydem w krótkim odstępie czasu.
Preparaty: Amikacyna, Gentamycyna, Neomycyna
, Streptomycyna, Tobramycyna
Najważniejsze
grupy leków
przeciwbakteryjnych
Makrolidy :
Są antybiotykami bakteriostatycznymi, ich
mechanizm działania polega na zahamowaniu syntezy białek w
komórce bakteryjnej. Są lekami z wyboru w terapii zakażeń układu
oddechowego o etiologii Mycoplasma pnemoniae i Legionella
pneumophila oraz antybiotykami alternatywnymi do tetracyklin w
leczeniu zakażeń Chlamydia sp. Charakteryzują się doskonałą
penetracją do wnętrza komórek (dotyczy to również makrofagów),
dlatego też są bardzo aktywne wobec patogenów
wewnątrzkomórkowych. W terapii niektórych zakażeń (głównie
dróg oddechowych) są stosowane alternatywnie do antybiotyków
β-laktamowych (penicylin i cefalosporyn). Jeden z nowych
makrolidów – klarytromycyna, jest stosowany w terapii skojarzonej
choroby wrzodowej (eradykacja zakażenia Helicobacter pylori)
Prototypowym antybiotykiem w tej grupie jest erytromycyna, z
której uzyskano wiele pochodnych, takich jak m.in.
roksytromycyna, klarytromycyna i azytromycyna. Są to preparaty
półsyntetyczne, które w porównaniu z erytromycyną wykazują
lepsze właściwości farmakokinetyczne, wymagają rzadszego
dawkowania i wywołują mniej działań niepożądanych. Wszystkie
preparaty mają identyczne spektrum działania, ale różnią się
aktywnością wobec poszczególnych gatunków bakterii: najbardziej
aktywne wobec Haemophilus influenzae są azytromycyna i
klarytromycyna.
Najważniejsze grupy leków przeciwbakteryjnych
Makrolidy cd
: znacznie szybciej niż β-laktamy
selekcjonują oporne szczepy bakterii. Szczególne
właściwości selekcyjne mają preparaty o bardzo
długim okresie biologicznego półtrwania
(azytromycyna). Oporność na makrolidy ma charakter
krzyżowy w obrębie grupy (szczep oporny na
określony preparat makrolidowy jest równocześnie
oporny na wszystkie inne makrolidy).Szczepy oporne
na makrolidy często wykazują również oporność na
antybiotyki z innych grup np. penicyliny,
cefalosporyny, tetracykliny i
trimetoprim/sulfametoksazol.
Makrolidy obok aktywności przeciwbakteryjnej
wykazują również działanie przeciwzapalne. Należą do
grupy najbardziej bezpiecznych antybiotyków.
Najczęstszym objawem niepożądanym jest biegunka,
występująca głównie w czasie leczenia erytromycyną.
Preparaty:
Azytromycyna,
,
Spiramycyna
Najważniejsze grupy leków przeciwbakteryjnych
β-laktamy:
Jest to bardzo szeroka grupa antybiotyków,
do której należą: penicyliny, cefalosporyny,
monobaktamy, karbapenemy i inhibitory β-laktamaz.
Wszystkie działają podobnie, hamując syntezę ściany
komórkowej bakterii i w konsekwencji prowadząc do
śmierci bakterii (działanie bakteriobójcze). Ich
aktywność przeciwbakteryjna oraz skuteczność
terapeutyczna zależą od czasu utrzymywania się
antybiotyku w surowicy w stężeniu przekraczającym
wartość minimalnego stężenia hamującego (MIC) wzrost
bakterii wywołujących zakażenie. Największą wadą β-
laktamów jest wrażliwość na działanie β-laktamaz,
enzymów bakteryjnych, które rozkładają cząsteczkę
antybiotyku i w ten sposób ją inaktywują. Aby temu
zapobiec, niektóre preparaty łączy się z inhibitorami β-
laktamaz (takimi jak np. kwas klawulanowy,
tazobaktam, sulbaktam).
Najważniejsze grupy leków przeciwbakteryjnych
Penicyliny
Poszczególne penicyliny różnią spektrum i aktywnością
przeciwbakteryjną.
Penicyliny o wąskim spektrum:
Penicylina fenoksymetylowa
Penicyliny przeciwgronkowcowe:
Penicyliny szerokowachlarzowe aktywne wobec bakterii
Gram(+), Gram(-) i beztlenowców:
Amoksycylina
Karbenicylina
Tykarcylina
Mezlocylina
Azlocylina
Piperacylina
Penicyliny należą do najbezpieczniejszych i najlepiej
tolerowanych antybiotyków (ale nie są pozbawione
działań niepożądanych).
Najważniejsze grupy leków przeciwbakteryjnych
Cefalosporyny:
dzielą się na cztery generacje, które
różnią się spektrum przeciwbakteryjnym, wrażliwością na
działanie β-laktamaz oraz właściwościami
farmakokinetycznymi / farmakodynamicznymi. Bez
względu na generację, cefalosporyny są nieaktywne
wobec gronkowców opornych na metycylinę, szczepów
Enterococcus, pałeczek Listeria monocytogenes i
beztlenowców (wyjątek: cefoksytyna i cefotetan). Żaden z
preparatów I generacji nie penetruje do płynu mózgowo-
rdzeniowego, w związku z czym nie może być stosowany
w leczeniu zakażeń ośrodkowego układu nerwowego
Ogólnie można przyjąć, że I generacja ma najlepszą
aktywność wobec ziarenkowców Gram(+) i stosunkowo
słabą wobec tlenowych pałeczek Gram(-), w kolejnych
generacjach proporcje te ulegają odwróceniu – rośnie
aktywność wobec pałeczek Gram(-) i spada – wobec
ziarenkowców Gram(+). Cefalosporyny, obok penicylin
należą do najczęściej stosowanych antybiotyków zarówno
w lecznictwie otwartym (zakażenia dróg oddechowych,
układu moczowego i skóry), jak i zamkniętym.
Najważniejsze grupy leków przeciwbakteryjnych
Cefalosporyny:
I generacja:
Cefaleksyna,
,
II generacja:
Cefaklor,
,
,
III generacja:
Cefotaksym,
,
,
,
,
,
,
,
,
.
● IV generacja:
Cefepim,
Najważniejsze grupy leków przeciwbakteryjnych
Karbapenemy:
Są to antybiotyki β-laktamowe o bardzo szerokim
spektrum aktywności obejmującym niemal wszystkie bakterie
tlenowe i beztlenowe z wyjątkiem:
metycylinoopornych gronkowców
Enterococcus faecium
Pseudomonas cepacia
Xantomonas maltophila
Corynebacterium jeikeium
Ze względu na doskonałe spektrum aktywności i dobre
właściwości farmakokinetyczne / farmakodynamiczne
są stosowane w terapii empirycznej ciężkich zakażeń
takich jak: posocznica, zapalenie płuc u pacjentów
sztucznie wentylowanych, gorączka u chorych z
leukopenią, pooperacyjne powikłania septyczne. Mogą
być kojarzone z aminoglikozydami, w celu
zmniejszenia ryzyka selekcji szczepów opornych
(zwłaszcza Pseudomonas aeruginosa).
Preparaty:
Imipenem,
Najważniejsze grupy leków przeciwbakteryjnych
Monobaktamy:
Jedynym dostępnym antybiotykiem z tej grupy
jest
. Jest to preparat β-laktamowy
aktywny wobec tlenowych bakterii Gram(-) (jego
spektrum aktywności przypomina
aminoglikozydy).
Najważniejsze grupy leków przeciwbakteryjnych
Linkozamidy:Są to antybiotyki bakteriostatyczne, ich
mechanizm działania polega na hamowaniu syntezy
białek w komórce bakteryjnej. Pod względem spektrum
aktywności i właściwości farmakokinetycznych /
farmakodynamicznych przypominają makrolidy. Ich
największą zaletą jest dobra aktywność wobec bakterii
beztlenowych. Niestety wśród niektórych gatunków,
zwłaszcza pałeczek z rodzaju Bactetroides pojawiły się
znaczne odsetki szczepów opornych. Linkozamidy nie
penetrują do płynu mózgowo-rdzeniowego, w związku z
czym nie mogą być stosowane w leczeniu zakażeń
ośrodkowego układu nerwowego. Dość silnie zaburzają
florę fizjologiczną przewodu pokarmowego, co może
prowadzić do rzekomobłoniatego zapalenia jelita
grubego, na skutek nadmiernego rozplemu Clistridium
difficile.
Preparaty:
Linkomycyna, Klindamycyna
Najważniejsze grupy leków przeciwbakteryjnych
Sulfonamidy:
Sulfonamidy były pierwszymi skutecznymi chemioterapeutykami
przeciwbakteryjnymi wprowadzonymi do leczenia jeszcze przed
penicyliną.
. Sulfonamidy są strukturalnymi analogami, a przez to konkurencyjnymi
antagonistami kwasu para-aminobenzoesowego (PABA).
Uniemożliwiają one wykorzystanie PABA do syntezy kwasu foliowego.
PABA jest łączony z pterydyną w wyniku czego powstaje kwas
dihydropteroilowy (prekursor kwasu foliowego), a rekcję katalizuje
syntetaza dihydropteroilowa. Ten właśnie enzym blokują sulfonamidy.
Sulfonamidy działają tylko na te drobnoustroje, które syntetyzują kwas
foliowy. Z tego powodu nie mają też metabolicznego działania na
makroorganizm.
Sulfonamidy wykazują synergizm działania z trimetoprimem, który
również zaburza syntezę kwasu foliowego. Trimetoprim jest inhibitorem
reduktazy kwasu dihyrofoliowego, który to enzym bierze udział w
przekształceniu kwasu dihydrofoliowego do kwasu tetrahydrofoliowego
i dopiero ta zredukowana postać kwasu foliowego jest aktywna.
Najważniejsze grupy leków przeciwbakteryjnych
Sulfametoksazol - sulfonamid o krótkim czasie działania, inhibitor
syntetazy dihydropteroilowej;
Sulfametoksazol - sulfonamid o krótkim czasie działania, inhibitor
syntetazy dihydropteroilowej;
Leki te mają działać synergistycznie (choć prawdopodobnie działanie leku
wynika z osiągnięcia przez jeden ze składnik stężenia terapeutycznego w
danej tkance, a nie synergizmu), a ich łączne stosowanie ma zmniejszać
rozwój oporności drobnoustrojów (jak wspomniano spełnienie tych
założeń jest przez niektórych kwestionowane; inne opracowania klasyfikują
ko-trimoksazol jako chemioterapeutyk o bardzo szerokim zakresie działania,
o spektrum porównywalnym do ceftriaksonu, czyli cefalosporyny III
generacji). Optymalne dla uzyskania działania synergistycznego jest
podanie leków w takich dawkach, aby uzyskane stężenia w tkankach
wynosiły 20 części sulfametoksazolu : 1 część trimetoprimu (w
kotrimoksazolu stosunek dawek 5 : 1 zapewnie osiągnięcie w tkankach
zakładanego stosunku stężeń). Sulfametoksazol został wybrany spośród
innych sulfonamidów ze względu na zbliżoną kinetykę do trimetoprimu.
Kotrimoksazol = sulfametoksazol + trimetoprim (nazwy preparatów w
Polsce: preparaty złożone: Apo-Sulfatrim, Bactrim, Bactrim forte, Biseptol,
Groseptol, Septrin, Two-Septol
NITROFURANY
NITROFURANY
-SYNTETYCZNE, HETEROCYKLICZNE
POCHODNE FURANÓW
-BAKTERIOBÓJCZE, HAMUJĄ MIĘDZY INNYMI
BIOSYNTEZY DNA
SPEKTRUM
SPEKTRUM
SZEROKIE – TLENOWE Gram (+) I (-)
BEZTLENOWCE
ZIARENKOWCE Gram(+)
STREPTOCOCCUS (ENTEROCOCCUS)
S.AUREUS
S.EPIDERMIDIS
PAŁECZKI Gram(-)
ENTEROBACTERIACEAE,
CAMPYLOBACTER,
HELICOBACTER
LEKI PRZECIWGRZYBICZNE
LEKI PRZECIWGRZYBICZNE
POLIENY
antybiotyki naturalne
AZOLE
(syntetyczne o 5-
członowym
pierścieniu)
ANTYMETABOLITYECHINOKANDYNY
Amfoterycyn
a B
Nystatyna
natamycyna
*imidazole (zawierające dwa
atomy azotu):
ketokonazol, ekonazol,
mikonazol, tiokonazol,
terkonazol, klotrimazol
*triazole (trzy atomy azotu):
itrakonazol
flukonazol
worikonazol
rawukonazol
posakonazol
najważniejszym antybiotykiem w tej grupie jest amfoterycyna B,
która mimo potencjalnego działania toksycznego należy do
najskuteczniejszych antybiotyków w leczeniu układowych zakażeń
grzybiczych.
kapsifungina
5-fluorocytozyna
5-fluorocytozyna
POLIENY
POLIENY
ANTYBIOTYKI NATURALNE, WYTWARZANE
PRZEZ PROMIENIOWCE:
Streptomyces hodosus (amfoterycyna)
Streptomyces nursei (nystatyna)
Streptomyces natalensis (natamycyna)
PIERŚCIEŃ MAKROLIDOWY, WŁAŚCIWOŚCI HYDROFOBOWE
LUB HYDROFILNE
WIĄŻĄ SIĘ ZE STEROIDAMI BŁON KOMÓRKOWYCH
CO PROWADZI DO
ZWIEKSZENIA
ICH PRZEPUSZCZALNOŚCI DLA JONÓW K+,
ORAZ AMINOCUKRÓW NA ZEWNĄTRZ GRZYBA
EFEKT: ZABURZENIA METABOLIZMU I ŚMIERĆ
AZOLE
AZOLE
POCHODNE IMIDAZOLU, W WIĘKSZOŚCI GRZYBOSTATYCZNE
HAMUJĄ SYNTEZĘ ERGOSTEROLU W BŁONACH KOMÓRKOWYCH
GRZYBÓW, ZABURZAJĄ SYNTEZĘ TRÓJGLICERYDÓW
ZMIENIAJĄ AKTYWNOŚĆ OKSYDAZ I DEHYDROGENAZ, A TYM SAMYM
PROWADZĄ DO NISZCZENIA ORGANELLI WEWNĄTRZ KOMÓRKOWYCH
FLUKONAZOL
– SZEROKIE ZASTOSOWANIE W LECZENIU GRZYBIC
NARZĄDOWYCH I UOGÓLNIONYCH
ANTYMETABOLITY
ANTYMETABOLITY
FLUCYTOZYNA
–
POCHODNA PIRYMIDYNY
PRZENIKA DO CYTOPLAZMY DZIĘKI ENZYMOWI
TRANSPORTUJĄCEMU CYTOZYNĘ I ADENINĘ
ZREDUKOWANA WBUDOWYWUJE SIĘ W RNA
BLOKADA SYNTEZY BIAŁKA
SPEKTRUM
SPEKTRUM
POLIENY
AZOLE
5-FLUOROCYTOZYNA
Cryptococcus
+
+
+
Candida
+
+
1
+
Aspergilius
+
+
2
+?
Epidermophyton
-
+
-
Microsporum
-
+
-
Trychopyton
-
+
-
Histoplasma
+
+
-
Cocddioides
+
+
-
Blastomyces
+
+
-
Mucor
+
-
-
Sporothrix scheneckii
+
+
-
1
z wyjątkiem Candida krusei oraz Candida giabrata;
2
tylko itrakonazol
CHEMIOTERAPEUTYKI PRZECIWWIRUSOWE
CHEMIOTERAPEUTYKI PRZECIWWIRUSOWE
Charakterystyka leku przeciwwirusowego
hamowanie genomu wirusa
bez uszkodzenia
genomu gospodarza
Aktywność zewnątrz-
i wewnątrzkomórkowa
Zdolność penetracji do miejsca
Docelowego działania
Stabilność metaboliczna
1.

2.
Replikacja wirusa
w komórce przebiega w kilku etapach
i polega na:
1. absorpcji na powierzchni komórki
2. penetracji do wnętrza komórki
3. wczesnej transkrypcji i translacji białek regulatorowych
4. replikacji
5. późnej transkrypcji i translacji białek strukturalnych
6. dojrzewaniu wirusów
7. uwalnianiu wirusów z komórki
2 GRUPY LEKÓW:
Inhibitory odwrotnej transkryptazy
Inhibitory proteaz wirusowych
-delawirdyna (DLV)
-newirapina (NVP – Viramune)
-efawirez (EFV)
-
sakwinawir
-ritonawir
-indinawir
-nelfinawir

3.
• acyklowir - herpes zoster-varicella
• gancyklowir - CMV
• zydowudyna - HIV
• lamiwudyna - HIV hepatitis B
• rybawiryna – RSV, wirus Lassa, wspomaganie działania interferonu α w
WZW typu C
• widarabina - herpes zoster
• amantadyna - wirus grypy A
• didanozyna - HIV (przy nietolerancji zydowudyny)
• foskarnet - CMV
• interferon - hepatitis B, hepatitis C (przewlekłe)
• delawirdyna (DLV), efawirenz (EFV), newirapina (NVP)
• zanamiwir - wirus grypy
• sakwinawir, ritonawir (RTY), indinawir (IDV), nelfinawir (NLF) - HIV-1, HIV-2,
SIV
Najczęściej stosowane leki o
aktywności przeciwwirusowej
Dziękuję za uwagę
Andrzej Krawczyk
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
Wyszukiwarka
Podobne podstrony:
Praktyczne zasady antybiotykoterapii
antybiotyki
Antybiotyki strategia leczenia – interakcje, ciąża, podeszły wiek
Antybiotyki
Antybiotyki1[2]
antybiotyki
Metody badania antybiotykoopornoci
Probiotyki antybiotyki id 66316 Nieznany
Mechanizmy działania antybiotyków, materiały farmacja, Materiały 4 rok, farmacja 4 rok part 2, farma
UE szczepienia i racjonalne stosowanie antybiotyków, Zdrowie publiczne, W. Leśnikowska - Ścigalska -
Antybiotyki(1), szkoła, farmakologia
Antybiotyki amino glikozydowe
więcej podobnych podstron