Diagnostyka
parazytologiczna
Katedra i Zakład Biologii
Medycznej
Laboratoryjna diagnostyka pasożytów
opiera się na następujących zasadach:
•
Właściwy wybór materiału do badania
bezpośredniego i pośredniego
•
Właściwy wybór diagnostycznej metody
badania danego materiału
(zagęszczanie, utrwalanie, barwienie)
•
Znajomość stadiów rozwojowych
pasożyta mogących występować w
badanym materiale oraz znajomość
cech gatunkowych pasożyta
Laboratoryjna diagnostyka pasożytów
opiera się na następujących zasadach
•
Wykluczanie określonej inwazji
pasożytniczej dopiero po
kilkakrotnym (co najmniej 3-
krotnym) badaniu materiału.
Materiał diagnostyczny
•
Tkanki
•
Płyny ustrojowe
•
Wydaliny i wydzieliny
Najczęściej bada się:
•
Kał
•
Krew
•
Wydzielinę pochwową
Najczęściej bada się:
•
Treść dwunastnicy
•
Ślinę, plwocinę
•
Zeskrobiny błon śluzowych
•
Płyn mózgowo-rdzeniowy
•
Materiał z punkcji i biopsji
•
Wycinki tkanek pobrane
przyżyciowo lub w czasie sekcji
Metody bezpośrednie
•
Stosuje się je w celu stwierdzenia
obecności pasożyta w badanym
materiale i określenia jego
przynależności gatunkowej.
Obejmują one:
•
Preparaty bezpośrednie – np.
rozmazy kału, krwi, przyżyciowe
lub barwione po utrwaleniu
Metody bezpośrednie
•
Metody zagęszczające pasożyty –
np. sedymentacyjne,
•
Metody hodowlane – polegające na
namnażaniu pasożyta na
podłożach sztucznych lub w ciele
zwierząt laboratoryjnych.
Metody pośrednie
•
Swoiste – celem ich jest wykazanie reakcji
immunologicznej ze strony żywiciela,
będącej odpowiedzią na inwazję
pasożytniczą (np. oznaczanie poziomu
przeciwciał w surowicy krwi).
•
Nieswoiste – obejmują one badania
hematologiczne, histologiczne,
histopatologiczne, radiologiczne lub USG,
których wyniki np. eozynofilia krwi mogą
pośrednio świadczyć o inwazji
pasożytniczej.
Badania koproskopowe.
Przy
pobieraniu kału należy przestrzegać
następujących zasad:
•
Kał pobierać do czystych, suchych naczyń
lub na czysty papier a następnie
(najlepiej całą wydaloną porcję) przenosić
do naczyń odpowiednich do transportu.
•
Po podaniu środków przeczyszczających
pobierać kał w kolejnych porcjach do
ponumerowanych naczyń i bezpośrednio
dostarczyć do laboratorium.
•
Chronić kał przed zamarznięciem.
Przy pobieraniu kału należy
przestrzegać następujących
zasad
•
Normalny kał pobierać do badania
co najmniej 2-3 krotnie, w
odstępach kilkudniowych. Jeżeli
wyniki badań są ujemne, pobrać
kał po podaniu środków
przeczyszczających.
Płyny utrwalające
•
Formalina 5% i 10% - trwale konserwuje
jaja, larwy robaków i cysty pierwotniaków,
nie konserwuje trofozoitów.
•
PVA (utrwalacz poliwinylowy) – konserwuje
jaja, larwy robaków oraz trofozoity i cysty
pierwotniaków. Jest trwały i odpowiedni do
barwienia różnymi metodami. Odczynnikiem
tym utrwalać można nie tylko cały materiał
diagnostyczny, ale również rozmazy, które
barwi się bezpośrednio lub po pewnym
czasie hematoksyliną.
Płyny utrwalające
•
MJF (roztwór mertiolatu, jodu i
formaliny) – konserwuje jaja, larwy
oraz trofozoity. Jest nieodpowiedni
do sporządzania preparatów
trwałych barwionych.
•
PAF (roztwór fenolu, alkoholu i
formaliny) – charakteryzuje się
podobnymi właściwościami jak MJF.
Makroskopowe badanie kału
•
Materiał diagnostyczny umieszcza się w
zlewce lub na płytce Petriego, rozcieńcza
wodą i dekantuje
•
Pasożytów poszukuje się w osadzie za
pomocą lupy i igieł preparacyjnych lub
cedzi się zawiesinę kału przez gazę lub
sitka
•
Wyizolowane z kału robaki bada się
najpierw gołym okiem lub za pomocą lupy
w płynie fizjologicznym
Makroskopowe badanie kału
•
W celu uwidocznienia szczegółów
budowy anatomicznej nicieni dodaje
się do wody barwniki np. czerwień
obojętną, błękit metylenowy
•
Przywry i człony tasiemców z rodziny
Taenidae należy przed badaniem
spłaszczyć, umieszczając je między
dwoma szkiełkami podstawowymi
Makroskopowe badanie kału
•
Preparat można prześwietlić
wprowadzając między szkiełka parę
kropli 5% kwasu octowego lub gliceryny
•
W razie problemów z ustaleniem
przynależności gatunkowej pasożyta
wykonuje się preparaty trwałe
•
Przed utrwaleniem robaki płucze się w
ciepłym roztworze fizjologicznym NaCl
lub przechowuje w chłodni w celu
rozkurczenia wora skórno – mięśniowego.
Makroskopowe badanie kału
•
Barwnik na ogół słabo przenika
przez oskórek nicieni, dlatego
utrwalonych okazów zazwyczaj się
nie barwi, tylko prześwietla, np. w
ksylenie lub olejku cedrowym i
zamyka w balsamie kanadyjskim.
Makroskopowe badanie kału
•
Robaki płaskie utrwala się w płynie
Bouina lub mieszaninie alkoholu i
formaliny, umieszczając je w butelce
z utrwalaczem lub rozciągając między
szkiełkami podstawowymi, między
które wkrapla się utrwalacz pipetą.
•
Czas utrwalania zależnie od grubości
preparatu wynosi 0,5-3h
Makroskopowe badanie kału
•
Utrwalone okazy można przechowywać w
70% alkoholu lub sporządzać z nich
preparaty trwałe barwione
•
Do barwienia robaków płaskich używa
się : karminu ałunowego (małe przywry i
proglotydy tasiemców), karminu
boraksowego (większe przywry i
tasiemce), karminu z kwasem mlekowym
(tasiemce) oraz hematoksyliny ałunowej
lub kwaśnej (mniejsze robaki).
Makroskopowe badanie kału
•
Po zabarwieniu preparaty odwadnia się w
szeregu alkoholi o wzrastających stężeniu
aż do alkoholu absolutnego, prześwietla w
ksylenie, olejku goździkowym lub cedrowym
i zamyka w balsamie kanadyjskim.
•
Robaki obłe utrwala się w płynie Barbagallo,
mieszaninie alkoholu z glicerolem (drobne
nicienie), płynie Zenkera, w ciepłej 5-10%
formalinie z dodatkiem gliceryny (duże
nicienie), w ciepłym 70% alkoholu lub
wodnym roztworze gliceryny.
Mikroskopowe badanie kału
•
Celem tych badań jest wykrycie
trofozoitów i cyst pierwotniaków oraz jaj,
larw i postaci dojrzałych robaków
pasożytniczych. Zwraca się również uwagę
na komórki żywiciela i pewne twory,
których obecność może być związana z
inwazją pasożytniczą np. erytrocyty
świadczące o owrzodzeniach lub zmianach
krwotocznych i naczyniowych, makrofagi
świadczące o infekcji.
Mikroskopowe badanie kału w
kierunku pierwotniaków
•
Rozmaz świeżego kału:
-
preparat mokry niebarwiony
-
preparat mokry podbarwiony (1%
płyn Lugola, odczynnik Quensela)
-
preparat trwały barwiony
Gatunki pierwotniaków, które
mogą występować w kale
•
Lamblia intestinalis – trofozoity i cysty
•
Chilomastix mesnili – trofozoity i cysty
•
Enteromonas hominis – trofozoity i
cysty
•
Retortamonas intestinalis – trofozoity i
cysty
•
Isospora hominis – oocysty
•
Isospora belli - oocysty
Gatunki pierwotniaków, które
mogą występować w kale
•
Entamoeba histolytica – trofozoity i
cysty
•
Entamoeba coli – trofozoity i cysty
•
Entamoeba hartmanni – trofozoity i
cysty
•
Entamoeba polecki – trofozoity i
cysty
•
Endolimax nana – trofozoity i cysty
Gatunki pierwotniaków, które
mogą występować w kale
•
Dientamoeba fragilis – trofozoity
•
Iodomoeba bütschlii – trofozoity i
cysty
•
Balantidium coli – trofozoity i cysty
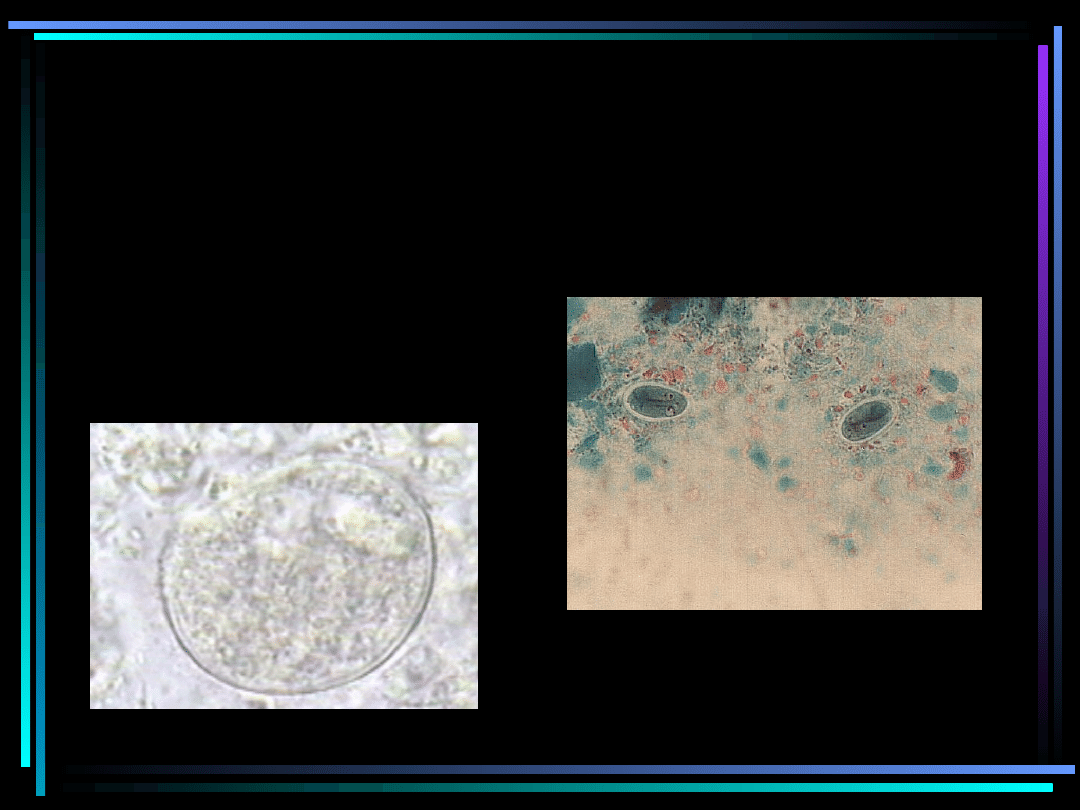
Cysty pierwotniaków
Balantidium coli
Giardia lamblia
Cysty pierwotniaków
Entamoeba histolytica
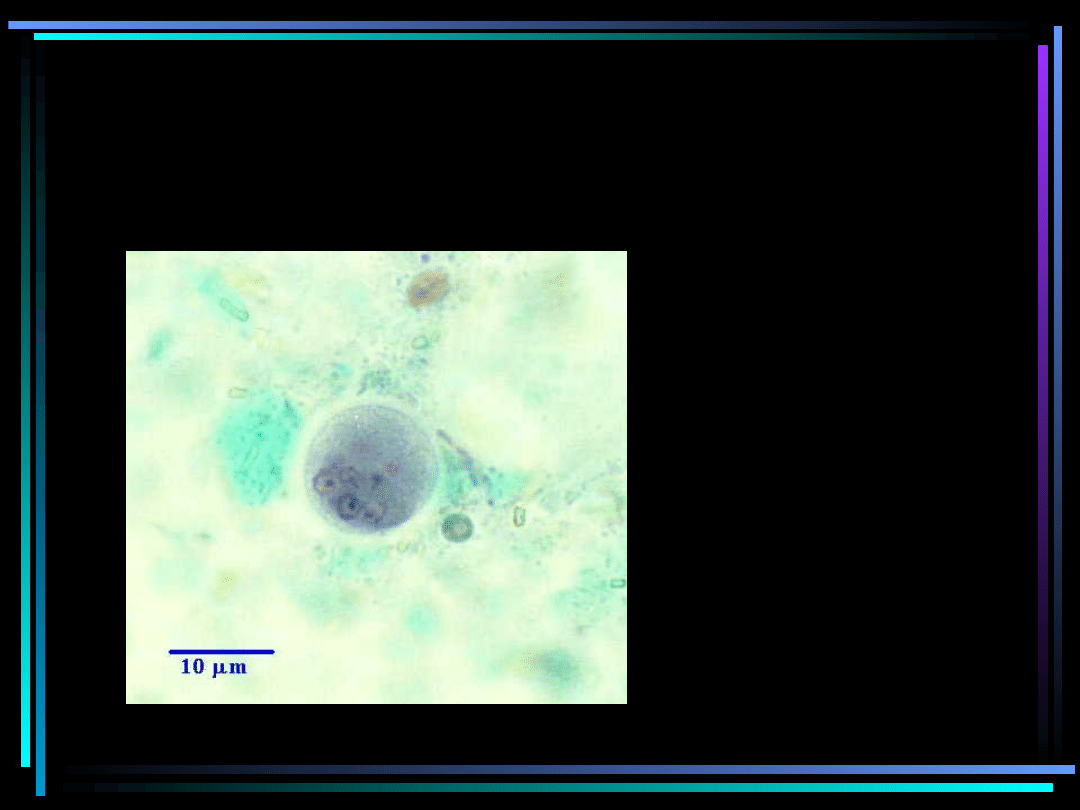
Mikroskopowe badanie kału w
kierunku robaków
pasożytniczych
•
Badać można zarówno kał świeży, jak i utrwalony
w płynach konserwujących
•
W badaniach helmintologicznych stosuje się
najczęściej:
-
rozmaz bezpośredni
-
gruby rozmaz kału
-
metodę Kato i Miura
-
metody zagęszczające
-
wymazy z odbytu i odbytnicy
-
metody hodowli i izolowania larw z kału
-
ilościowe metody koproskopowe
Gruby rozmaz kału
•
Około 50 mg kału miesza się na
szkiełku podstawowym z kroplą
płynu fizjologicznego lub wody,
rozmazuje na powierzchni 2 x 4 cm,
po czym suszy w cieplarce. Preparat
bada się w małym powiększeniu
mikroskopu, w kropli oleju
parafinowego, który rozjaśnia obraz.
Metoda Kato i Miura
•
40-60 mg kału umieszcza się za pomocą igły
preparacyjnej na czystym szkiełku
podstawowym i przykrywa skrawkiem
celofanu, wymoczonego uprzednio w ciągu
24 godzin w roztworze zawierającym wodę,
glicerol i zieleń malachitową. Następnie za
pomocą gumowego korka rozgniata się kał do
odpowiednio grubego rozmazu i po godzinie
w temperaturze pokojowej lub po 20-30
minutach w cieplarce bada się preparat w
słabym powiększeniu mikroskopu.
Metody zagęszczające
•
Sedymentacyjne
Polegają na zanurzeniu badanego materiału w
płynach o mniejszym ciężarze własnym, niż
ciężar jaj, larw robaków i cyst pierwotniaków.
•
Flotacyjne
W metodach tych stosuje się płyny o większym
ciężarze właściwym, niż ciężar cyst, jaj i
larw, które w wyniku tego wypływają i
gromadzą się na powierzchni płynu, skąd
łatwo je pobrać do badania.
Metody zagęszczające
sedymentacyjne
•
Sedymentacja z kwasem i eterem
(Telemanna)
•
Sedymentacja z formaliną i eterem
(Ritchie)
•
Sedymentacja z odczynnikiem MJF
Metody zagęszczające flotacyjne
•
Flotacja z roztworem chlorku sodu
(Fülleborna)
•
Flotacja z roztworem siarczanu
cynku (Fausta)
Wymazy z odbytu i odbytnicy
•
Wymazy należy wykonywać wcześnie rano
lub późnym wieczorem, przed myciem i
wypróżnieniem. Badanie przeprowadza się
bezpośrednio po pobraniu materiału, a w
przypadku jeśli nie jest to możliwe, można
wymazy przez kilka dni, a nawet tygodni
przechowywać w lodówce. Metodą
wymazów wykrywa się jaja Enterobius
vermicularis i Taenia sp.
Wymazy z odbytu i odbytnicy
•
Metoda przylepca celofanowego
(Grahama)
Przezroczysty przylepiec celofanowy o
długości 10 cm i szerokości 2 cm przykłada
się lepką stroną w okolicy odbytu tak, aby
uzyskać wymaz śluzu fałdów odbytniczych.
Następnie taśmę przykleja się do szkiełka
podstawowego i ogląda w małym
powiększeniu mikroskopu.
Wymazy z odbytu i odbytnicy
•
Metoda pałeczki szklanej z celofanem (NIH)
Przygotowuje się pałeczki szklane z
zaokrąglonym końcem, na którym owija się i
przymocowuje gumką kawałek celofanu.
Przeciwległy koniec wkłada się do korka i
umieszcza w probówce. Ruchem obrotowym
pałeczki wymazuje się dokładnie fałdy skóry i
błony śluzowej odbytu. W laboratorium
zdejmuje się pęsetą celofan z pałeczki,
rozprostowuje między dwoma szkiełkami
podstawowymi i ogląda w małym powiększeniu
mikroskopu w kropli glicerolu z wodą.
Formy rozwojowe robaków
pasożytniczych, które można wykryć
badaniem mikroskopowym w kale
•
Fasciola hepatica – jaja
•
Fasciolopsis buski – jaja
•
Dicrocoelium dendriticum – jaja
•
Opisthorchis felineus – jaja
•
Clonorchis sinensis - jaja
•
Paragonimus westermani – jaja
•
Schistosoma haematobium – jaja
•
Schistosoma mansoni – jaja
•
Schistosoma japonicum – jaja
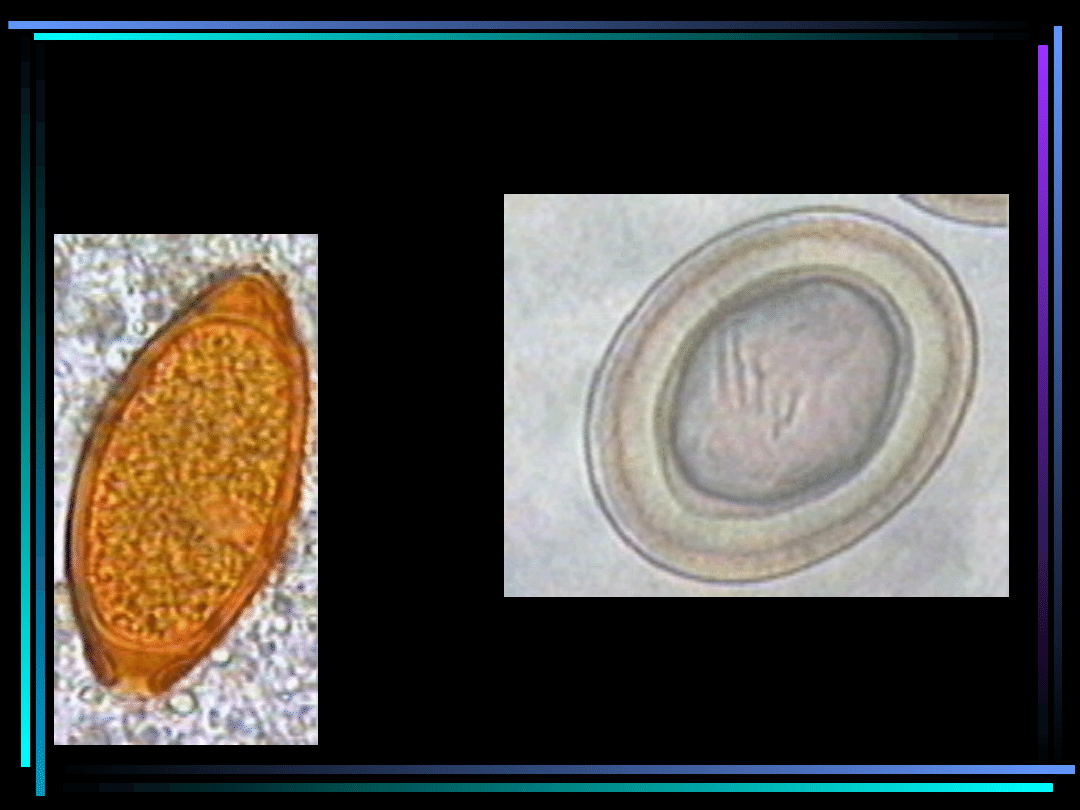
Formy rozwojowe robaków
pasożytniczych, które można wykryć
badaniem mikroskopowym w kale
•
Diphyllobothrium latum – jaja
•
Dipylidium caninum – torebki maciczne
•
Taenia saginata – jaja
•
Taenia solium – jaja
•
Hymenolepis diminuta – jaja
•
Hymenolepis nana – jaja
•
Ascaris lumbricoides – jaja
•
Trichuris trichiura – jaja
•
Enterobius vermicularis - jaja
Formy rozwojowe robaków
pasożytniczych, które można wykryć
badaniem mikroskopowym w kale
•
Strongyloides stercoralis – larwy
•
Ancylostoma duodenale – larwy,
jaja
•
Necator americanus – jaja, larwy
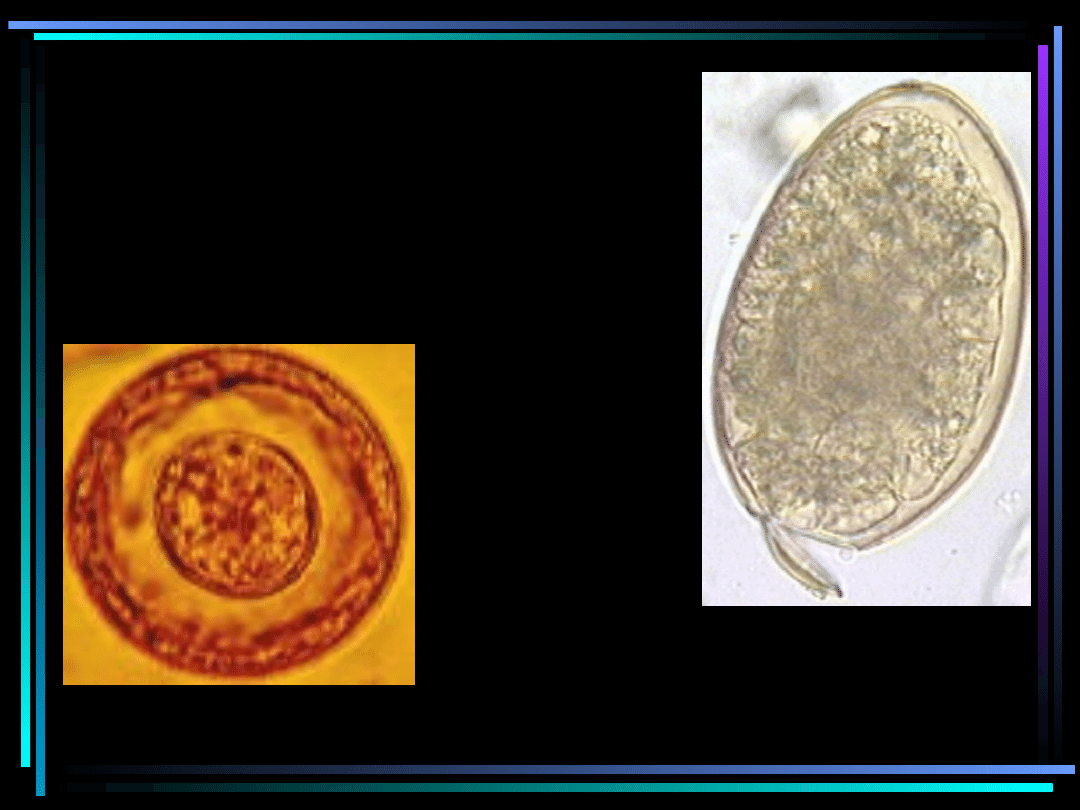
Jaja robaków
Trichiurus trichiura
Taenia solium/saginata
Jaja robaków
Hymenolepis diminuta
Fasciola hepatica
Diagnostyka parazytologiczna
pasożytów krwi
•
Preparat bezpośredni
•
Cienki rozmaz krwi
•
Gruby rozmaz krwi
Preparat bezpośredni
•
Świeżą kroplę krwi przykrywamy
szkiełkiem nakrywkowym i
oglądamy pod mikroskopem,
zaczynając od małego
powiększenia przez średnie i duże.
W preparacie bezpośrednim
poszukuje się świdrowców łatwo
dostrzegalnych dzięki ich ruchowi.
Cienki rozmaz krwi
Kroplę krwi umieścić na brzegu suchego,
odtłuszczonego szkiełka. Drugie szkiełko,
większe od pierwszego o szlifowanej
krawędzi przykłada się pod kątem około
30
o
, tak aby krawędź dotykała kropli,
która po chwili rozpływa się na całej jej
długości. Jednym zdecydowanym ruchem
przesuwa się szkiełko pomocnicze w
kierunku drugiego brzegu szkiełka
podstawowego, uzyskując równomierny
rozmaz krwi.
Gruby rozmaz krwi
•
2-3 krople pobrane na szkiełko
podstawowe łączy się ze sobą i rozmazuje
na powierzchni około 1 cm
2
.
Następnie
miesza się krew przez 30 sekund,
wykonując ruchy obrotowe szkiełkiem,
aby nie dopuścić do wytrącenia się
włóknika. Gruby rozmaz pozwala na 15-
20 –krotne zagęszczenie pasożytów na tej
samej powierzchni w porównaniu z
rozmazem cienkim.
Barwienie rozmazów krwi
•
Metoda Giemsy
•
Metoda Wrighta
•
Metoda barwienia oranżem
akrydyny
•
Metoda barwienia zielenią
metylową i pironiną
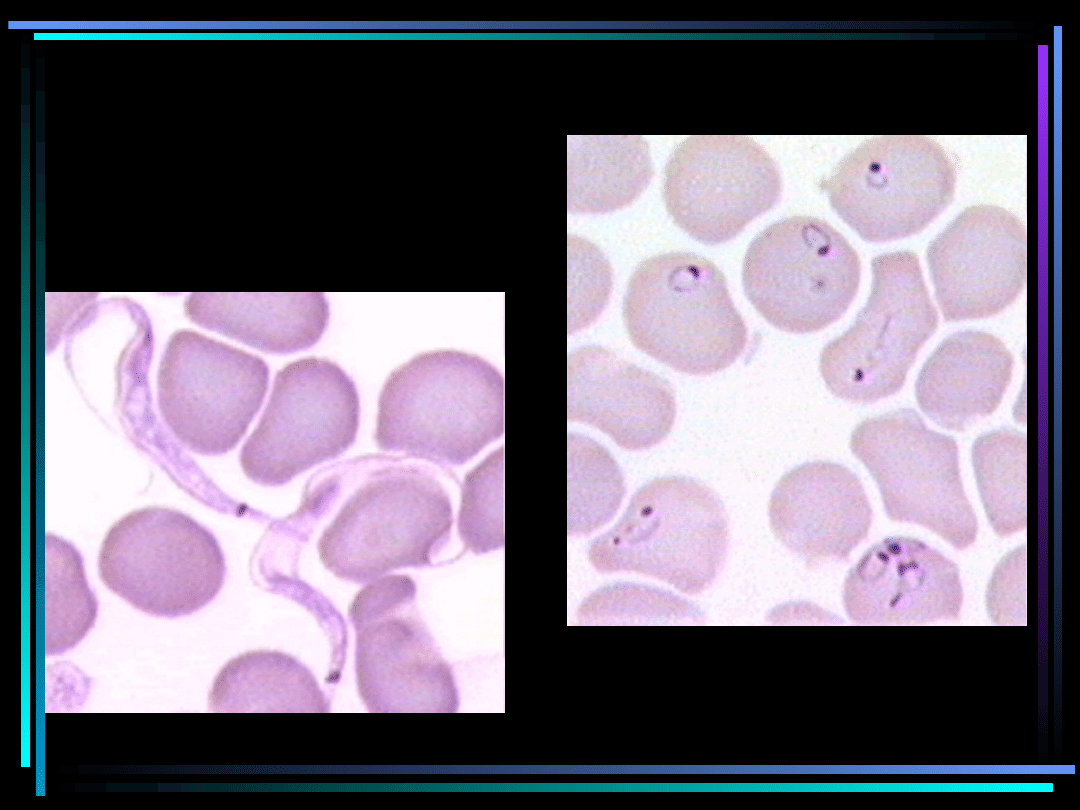
Rozmazy krwi
Trypanosoma gambiense
Plasmodium falciparum
Metody immunologiczne
•
Polegają na wykazaniu reakcji
immunologicznych ze strony
gospodarza jako odpowiedzi na
zarażenie. Pasożyty i ich produkty
metabolizmu działając jako bodźce
antygenowe mogą wyzwalać reakcje
odpornościowe zarówno humoralne,
jak i typu komórkowego.
Metody immunologiczne
•
Odczyny serologiczne polegające na
wykrywaniu swoistych przeciwciał,
prócz wartości diagnostycznej, mają
duże znaczenie w dociekaniach
epidemiologicznych. Szczególną wagę
mają testy serologiczne o wysokim
stopniu swoistości w badaniach
epidemiologicznych na obszarach o
słabym nasileniu endemii
pasożytniczej.
Metody immunologiczne
1. Reakcje serologiczne z udziałem
dopełniacza
- odczyn wiązania dopełniacza (OWD)
- odczyn lityczny (odczyn Sabina-
Feldmana – OSF)
2. Odczyn aglutynacji bezpośredniej
3. Aglutynacja pośrednia lub bierna
Metody immunologiczne
4. Odczyn hemaglutynacji – OH
5. Odczyn immunofluorescencji
pośredniej (OIF)
6. Test ELISA (Enzyme – Linked –
Immunosorbent – Assay)
7. Immunodyfuzja,
immunoelektroforeza
8. Odczyny skórne
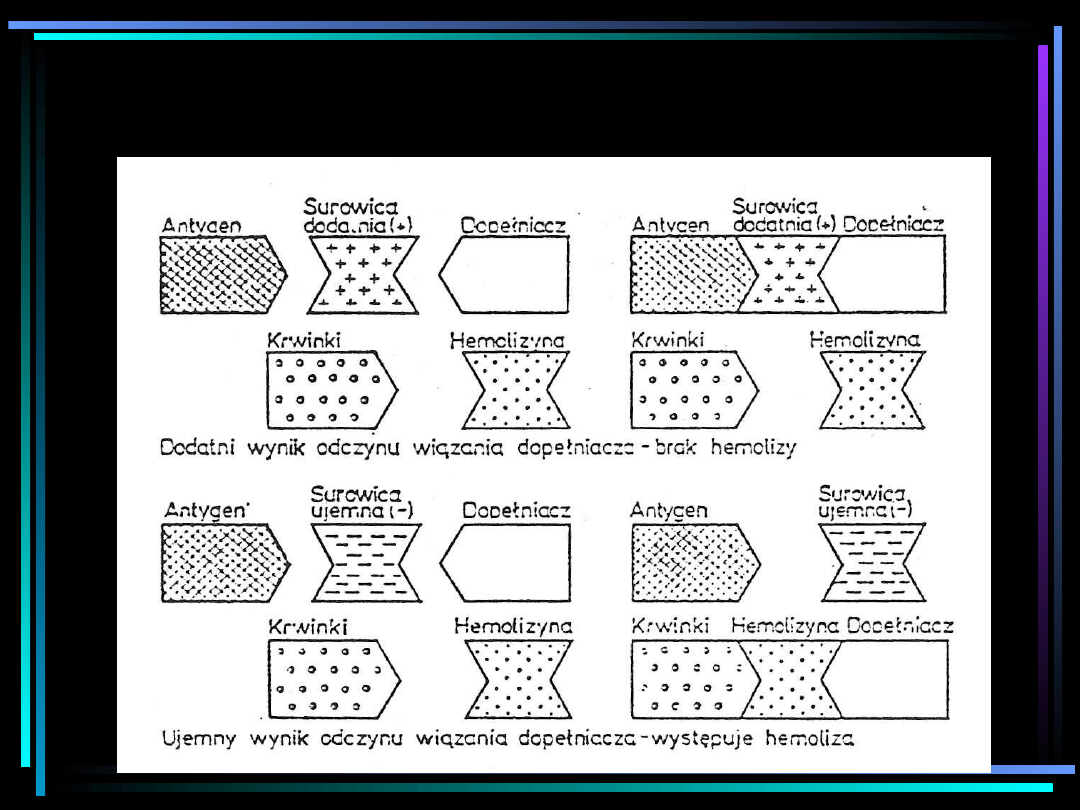
Metoda OWD
OWD
•
Odczyn wiązania dopełniacza stosuje się do
wykrywania swoistych przeciwciał w badanej
surowicy przy użyciu znanego antygenu. Odczyn
ten jest wykonywany w dwóch fazach. W fazie
pierwszej łączy się badaną surowicę ze znanym
antygenem. Jeżeli w surowicy znajdują się swoiste
dla danego antygenu przeciwciała, to powstaje
kompleks antygen-przeciwciało, który wiąże
dodany dopełniacz.
Jeżeli w badanej surowicy brak swoistych
przeciwciał, to kompleks antygen-przeciwciało nie
powstaje i dopełniacz pozostaje w stanie wolnym.
OWD
•
W fazie drugiej do układu antygen-przeciwciało-
dopełniacz dodaje się układ wskaźnikowy
krwinka czerwona-hemolizyna. Jeżeli dopełniacz
został uprzednio związany przez kompleks
antygen-przeciwciało, to hemoliza krwinek nie
wystąpi. Wynik będzie wówczas dodatni.
Jeżeli natomiast w badanej surowicy nie będzie
poszukiwanych przeciwciał, to kompleks
antygen-przeciwciało nie powstanie. Wolny
dopełniacz zwiąże się z układem wskaźnikowym
krwinka czerwona –hemolizyna, co spowoduje
hemolizę. Wynik będzie wówczas ujemny.
OWD
•
Dopełniacz – czyli komplement, jest to
nieswoisty składnik krwi zwierząt
stałocieplnych, bardzo wrażliwy na
temperaturę. Unieczynnia (inaktywuje) się go
przez ogrzewanie 30 min. w temp. 56
o
C.
Powoduje rozpuszczanie bakterii (bakteriolizę)
związanych ze swoistym przeciwciałem, a
także rozpuszczanie czerwonych krwinek
(hemolizę) związanych ze swoistym
przeciwciałem przeciwko tym krwinkom – tzw.
hemolizyną, inaczej amboceptorem.
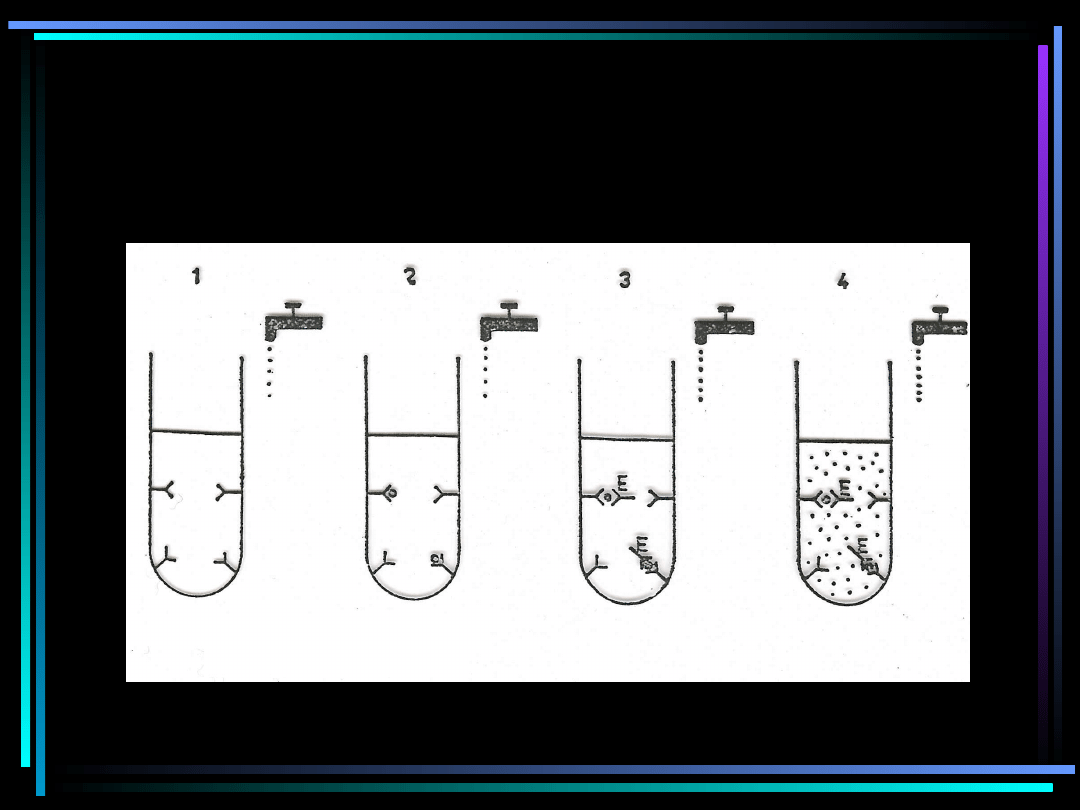
Schemat próby ELISA
Test ELISA
•
Jest to próba wykonywana zwykle w fazie
stałej. Stosowane w niej enzymy powinny być
łatwo rozpuszczalne, stabilne, łatwo łączyć się
z białkiem, nie występować lub występować
jedynie w minimalnych ilościach w płynach
biologicznych, a ich substraty muszą być łatwo
dostępne i dawać wyraźną barwę. Do
najczęściej używanych należą: peroksydaza
chrzanowa i fosfataza zasadowa. Ich
substratami są odpowiednio o-dionizydyna lub
kwas 5-aminosalicylowy i para-
nitrofenylofosforan sodowy.
Test barwny Sabina - Feldmanna
•
Test wykorzystuje zmiany w cytoplazmie żywych
trofozoitów toksoplazm wywołane działaniem
przeciwciał obecnych w surowicy krwi osobnika
chorego, które stają się dobrze widoczne po
wybarwieniu toksoplazm silnym roztworem
błękitu metylowego.
•
Komórki pasożyta namnaża się przez 48 godzin
w wysięku otrzewnowym myszy, miesza ze
wzrastającymi rozcieńczeniami badanej
surowicy oraz aktywatorem i inkubuje w temp.
37
o
C.
Test barwny Sabina - Feldmana
•
Po upływie godziny dodaje się alkalicznego
roztworu błękitu metylowego i ogląda w
wilgotnych preparatach w mikroskopie
świetlnym w dużym powiększeniu lub
stabilizuje reakcję 0,4% roztworem
formaliny, a wynik odczytuje w mikroskopie
kontrastowo-fazowym.
•
Pasożyty nie uszkodzone silnie wybarwiają
się na niebiesko, w przeciwieństwie do
uszkodzonych , które nie ulegają
zabarwieniu
Test barwny Sabina - Feldmana
•
W reakcji dodatniej większość
pasożytów ulega lizie i nie barwi
się. Miano surowicy dodatniej
określa to rozcieńczenie surowicy,
przy którym stosunek organizmów
zabarwionych do bezbarwnych
wynosi 1:1 /dawka śmiertelna dla
50% pasożytów/.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
Wyszukiwarka
Podobne podstrony:
parazyty ostatnie kolo odp, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
Parazytologia test2, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
gielda2, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
parazytologia nr 2, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
TEST 2009caly, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
gr3, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
parazyt, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
odp09, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
parazytologia nr 1, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
parazytologia nr 3, Analityka Medyczna UMB, III, Diagnostyka parazytologiczna, Giełdy-
diagnostyka laboratoryjna, I rok, I rok, gieldy, pen, medycyna, 1 semestr, Biologia medyczna, Parazy
Diagnostyka najczęściej występujących parazytoz u psów i kotów stwierdzanych w praktyce weterynaryjn
diagnostyka
T 3[1] METODY DIAGNOZOWANIA I ROZWIAZYWANIA PROBLEMOW
Przedmiot PRI i jego diagnoza przegląd koncepcji temperamentu
DIAGNOSTYKA FIZJOLOGICZNA I 1
więcej podobnych podstron