
HIV / AIDS
2007
Anita Wnuk
TERAPIA ANTYRETROWIRUSOWA
W CIĄŻY

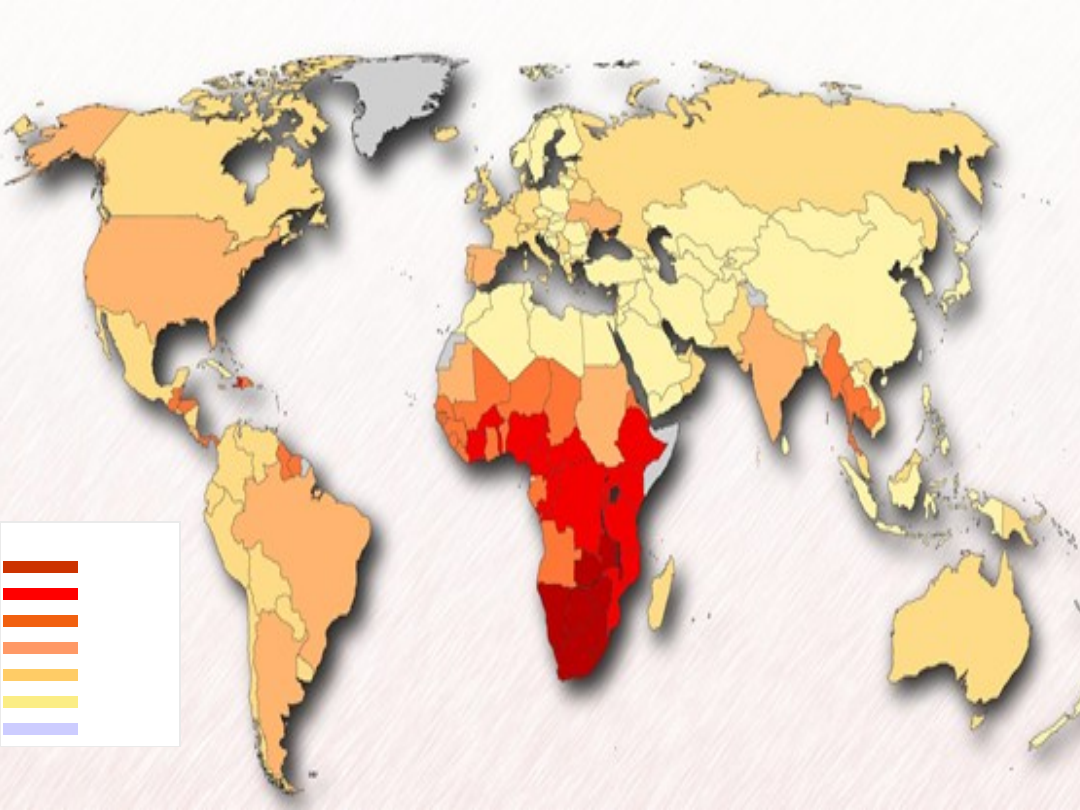
Prevalen
ce
15 – 30
%
5.0 - 15
%
1.0 – 5.0
%
0.5 – 1.0
%
0.1 – 0.5
%
0.0 – 0.1
%
Not
Available
HIV Prevalence
HIV Prevalence
Worldwide
Worldwide
Mężczyźni : Kobiety
US
14 : 1
Europa
8 : 1
Afryka
1 : 1

Testowanie ciężarnych
CDC rekomendacje (od 2002)
Ciąża: rutynowy HIV screening
wszystkich ciężarnych w I trymestrze
ciąży
Poród: rutynowy szybki test dla kobiet
o nieznanym statusie serologicznym
Połóg: rutynowy test dla noworodków
urodzonych z matek o nieznanym
statusie serologicznym

Testowanie w 3 trymestrze
Powtórka przed 36 tygodniem ciąży ( przy
pierwszym wyniku ujemnym ) w grupach
kobiet, które:
Przechorowały STD
Świadczą usługi seksualne
Miały wielu partnerów seksualnych w czasie
ciąży
Stosowały narkotyki w ciąży
Mają partnerów HIV(+) lub z wysokim ryzykiem
zakażenia
Mają objawy sugerujące serokonwersję.
CDC. Revised US Public Health Service recommendations for human immunodeficiency
virus screening of pregnant women. MMWR 2001;50(No. RR-19):59--86.

HIV a ciążą
U wszystkich ciężarnych
(zakażonych lub niezakażonych),
liczba absolutna CD4 obniża się
U HIV (+) ciężarnych odsetek CD4
oraz poziom wiremii nie zmienia się
(ciąża nie powoduje progresji
zakażenia HIV)

Używane skróty
ARV = antyretrowirusowe/y
ART. = leczenie antyretrowirusowe
HAART = high active antiretroviral treatment
=wysoce aktywna terapia antyretrowirusowa
PI`s = protease inhibitors=inhibitory proteazy
NRTI`s = nucleoside reverse transcriptase
inhibitors = nukleozydowe inhibitory odwrotnej
transkryptazy
NNRTI`s = non-nucleoside reverse transcriptase
inhibitors=nienukleozydowe inhibitory RT
MTCT = mother-to-child-transmission

Transmisja wertykalna HIV
Udokumentowana:
In utero
25%–40%
Intrapartum
60%–75%
Postpartum = karmienie piersią
14% ryzyka dla zakażenia stabilnego
29% ryzyka dla OIR

Czynniki ryzyka zakażenia
wertykalnego
Poziom wiremii w
surowicy
Poziom wiremii w
wydzielinie pochwowej
Liczba i odsetek CD4
Stadium kliniczne HIV
Używki: papierosy,
alkohol, narkotyki
Niedobór witaminy A
Ryzykowne
zachowania seksualne
STDs
Leczenie ARV
Poród przedwczesny
Odklejenie łożyska
Inwazyjne badanie płodu
Pęknięcie błon płodowych
Karmienie piersią
Poród siłami natury vs.
Cięcie cesarskie
Anderson J (ed). 2001. A Guide to the Clinical Care of Women with HIV, 2nd
ed. U.S. Department of Health and Human Services, Health Resources and
Services Administration: Rockville, Maryland.

Transmisja wertykalna HIV
In utero
poród
Po porodzie
Leczenie ART
Zmniejszenie ilości urazów
okołoporodowych
Podawanie ART przy porodzie
Elektywne cięcie cesarskie
Karmienie sztuczne lub
alternatywne karmienie naturalne
Profilaktyka u noworodka
W czasie
W czasie
możliwość
możliwość
interwencji
interwencji

Wiremia i ryzyko transmisji
wertykalnej
0
0
16.
16.
6
6
21.
21.
3
3
30.
30.
9
9
40.
40.
6
6
HIV-1 RNA
HIV-1 RNA
Transmis
Transmis
ja
ja
%
%
<1000
<1000
kopii
kopii
/mL
/mL
1000 - 10,000
1000 - 10,000
10,001- 50,000
10,001- 50,000
50,001-100,000
50,001-100,000
>100,000
>100,000
N
N
0/57
0/57
32/193
32/193
39/183
39/183
17/54
17/54
26/64
26/64
Women & Infants Transmission
Study (WITS) Garcia, et al, NEJM
1999

Wskazania do leczenia
ARV
Kategoria kliniczna CD4+liczba HIV RNA
Rekomendacje
Objawowa
Bezobjawo
wa,
AIDS
Bezobjawo
wa
Bezobjawo
wa
Bezobjawo
wa
Każda wartość każda
wartość
CD4+ każda
wartość
<200/mm
3
CD4+
każda
wartość
>200/mm
3
lecz<350 /mm
3
CD4+
>100,000
>350/mm
3
CD4+
<100,000 >350/mm
3
Leczyć
Leczyć
Leczenie powinno
być oferowane
Można odroczyć lub
leczyć
Odroczyć leczenie

Leczenie ARV w ciąży
HAART jest rekomendowany jako
profilaktyka zakażenia wertykalnego u
każdej ciężarnej HIV(+) z VL > 1000
c/mL
Z VL < 1000 c/mL (bez leczenia ARV)
rozważyć AZT w monoterapii

Leczenie HIV a profilaktyka
zakażenia wertykalnego
Kobieta HIV(+) leczona ARV ze
wskazań zachodzi w ciążę – utrzymać
ARV (jeżeli zestaw jest dozwolony) w
ciąży i kontynuować po porodzie
Kobieta HIV(+) nie leczona (brak
wskazań) zachodzi w ciążę –
profilaktyka z.w. w zależności od VL;
odstawić leki po porodzie

Kiedy rozpocząć leczenie ARV
w ciąży?
Rekomendacje PTN AIDS – najpóźniej 12
tygodni przed porodem, HAART (nie
monoterapia AZT), ecc przy niepełnej
supresji
Rekomendacje DHHS 2006 - VL>1000 kopii
HIV-RNA, HAART, monoterapia AZT gdy
VL<1000 kopii, ecc w 38 tygodniu gdy
VL>1000 kopii; gdy VL<1000 kopii w 38 tyg.
– rozwiązanie w zależności od ekonomii

Badania u ciężarnych HIV(+)
przed leczeniem
Obowiązkowe
- CD4
- VL
Rekomendowane
- genotypowanie

Badania u ciężarnych -
kontrola
Wskazane wykonanie co najmniej 3
oznaczeń CD4 i VL – po jednym w każdym
trymestrze
Po rozpoczęciu leczenia ARV – kontrola w
ciągu m-ca
VL ostatnia jak najbliżej terminu porodu

Leki antyretrowirusowe
Nukleozydowe / nukleotydowe analogi
odwrotnej transkryptazy (NRTIs)
ABC
ddI
FTC
3TC
d4T
TDF
ddC
ZDV/
AZT
C
– brak badań. Rozważyć nadwrażliwość
B
– rozważyć kwasicę mleczanową (nie
łączyć zd4T)
B
– brak badań.
C
– dobra tolerancja, szeroko stosowany
C
– rozważyć kwasicę mleczanową (nie
łączyć z ddI)
B
– brak badań.
C
– brak badań. Teratogenny u zwierząt.
C
– dobra tolerancja, najwięcej
stosowany

Leki antyretrowirusowe
Nie-nukleozydowe inhibitory
odwrotnej transkryptazy (NNRTIs)
DLV
EFV
NVP
C
– brak badań.
D
– Teratogenny. Zabroniony w 1
trymestrze
C
– Dobrze tolerowany. Zabroniony, gdy
CD4 >250 cells/mm3.

Leki antyretrowirusowe
Inhibitory proteazy (PIs)
APV
ATV
FPV
IDV
LP/r
NFV
RTV
SQV
TPV
C
– brak badań.
B
– brak badań. rozważyć hyperbilirubinemię
C
– brak badań
C
– Unboosted=zbyt małe stężenie terap.
C
– brak badań
B
– dobrze tolerowany
B
–nie używać bez skojarzenia z innymi
B
– dobrze tolerowany, używać w skojarzeniu
C
– brak badań

Leki i zestawy leków
niewskazane
unikać EFV – teratogenny u
naczelnych
d4T + ddI – wysokie ryzyko kwasicy
mleczanowej
d4T +AZT – antagonizm
farmakologiczny
NVP – p/wskazana, gdy CD4>250/mm³
(wysokie ryzyko hepatotoksyczności)

Zestawy leków niewskazane
–c.d.
ABC+ZDV+3TC/FTC (zbyt mały
potencjał p/wirusowy)
TDF+ddI+każdy (niezgodności
farmakologiczne)
d4T+ddI +każdy (efekty uboczne)

ACTG 076
Badanie III fazy, randomizowane, z placebo
z zastosowaniem zydowudyny (AZT) w
prewencji zakażenia wertykalnego
Schemat podawania AZT
Antepartum
100 mg ZDV po 5x dz., od 14-34 tygodnia ciąży
Intrapartum
przez 1 godz. porodu - 2 mg/kg i.v., potem
1 mg/kg aż do zakończenia porodu
Postpartum/noworodek
2 mg/kg po co 6 godz. przez 6 tygodni, od 8-12
godziny życia dziecka
ACTG 076
Kryteria
włączeni
a
Protokół
ZDV 100 mg 5X dz antepartum
Placebo
2 mg/kg, 1 mg/kg/g intrapartum
2 mg/kg co 6 godz. przez 6 tyg. dla
noworodka
n=180
HIV status znany
n=185
Rezultaty
HIV+ =13
67.5% redukcja
HIV+ = 40
(8.3%)
(25.5%)
Ciężarne HIV+
CD4 >200 kom/mm3
Bez objawów zakażenia
Uprzednio nieleczone ZDV
n= 477
p= 0.000006

ACTG 076 - modyfikacje
VL>1,000 c/mL: HAART w zależności od
liczby CD4
VL<1,000 c/mL i liczba CD4 >350
kom/mm3 = AZT w monoterapii zgodnie
z protokołem ACTG 076
Poród przez ecc
Noworodek otrzymuje w ciągu 12 h co
najmniej dwa leki (AZT+3TC) przez 4 tyg.
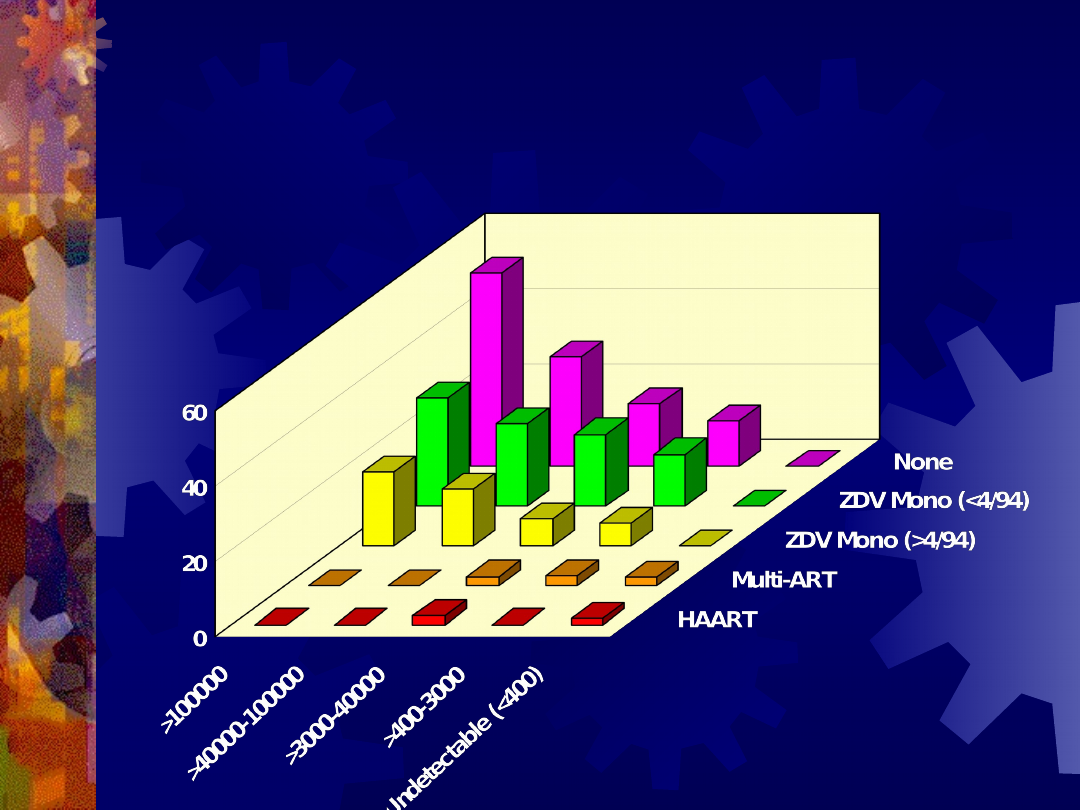
Maternal Delivery HIV RNA Levels and
Antiretroviral Use are Independently
Associated With Perinatal Transmission
Cooper E et al. JAIDS 2002;29:484-94
Transmisja wertykalna zakażenia
HIV
%
M
TC
T

Badania kliniczne z
modyfikacjami profilaktyki
z.w.
Doustnie ZDV u kobiet nie karmiących piersią
(Tailandia) od 36 tyg. ciąży i w czasie porodu
Ryzyko transmisji: 9.4 % ZDV vs 18.9 % placebo
Lancet. 1999 Mar 6;353(9155):773-80
Petra study – intrapartum/postpartum doustnie
ZDV/3TC u kobiet karmiących piersią (Uganda,
S. Africa, Tanzania)
Ryzyko transmisji: 10% ZDV/3TC vs 17% placebo
Lancet. 2002 Apr 6;359(9313):1178-86
HIVNet 012 –
intrapartum/postpartum/noworodek nevirapina
(NVP) vs krótki kurs/noworodek ZDV u kobiet
karmiących piersią (Uganda)
Ryzyko transmisji: 12% NVP vs 21% ZDV
Lancet. 1999 Sep 4;354(9181):795-802
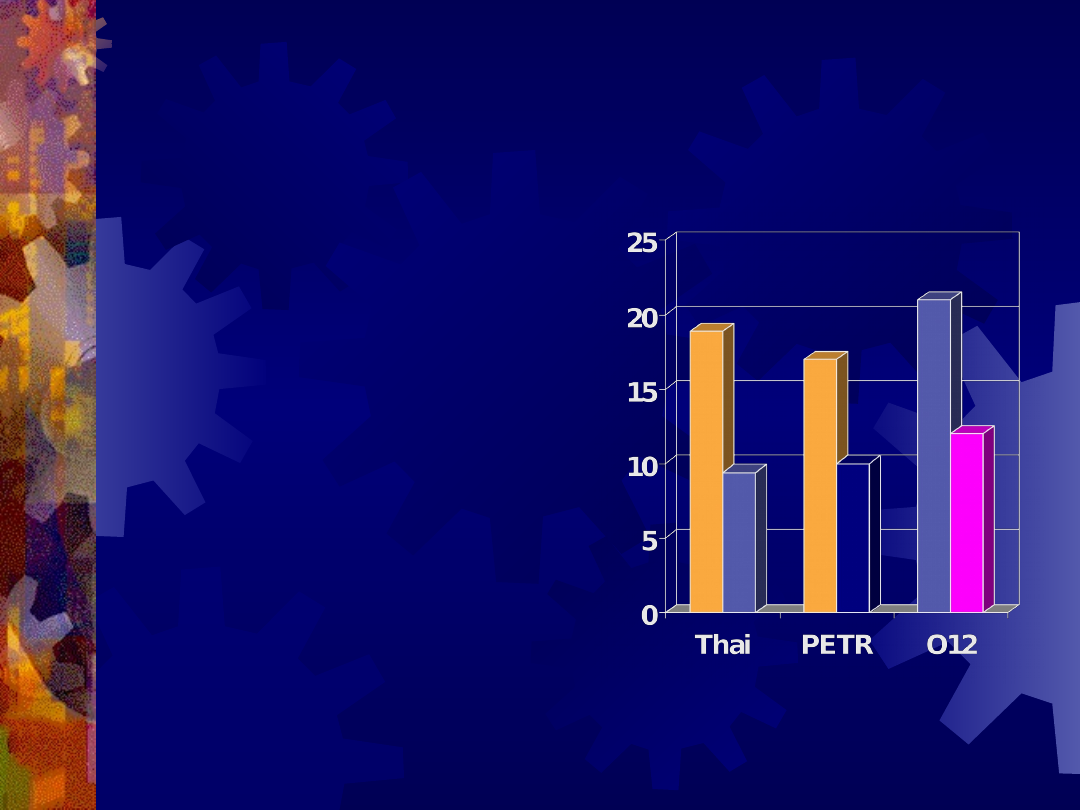
Przegląd badań
klinicznych
Thai
18.9 % placebo
9.4 % ZDV
Petra study
17% placebo
10% ZDV/3TC
HIVNet 012
21% ZDV
12% NVP

Procedury położnicze
Ze względu na zwiększoną
ekspozycję płodu na krew matki lub
wydzielinę pochwową poniższe
procedury zwiększają ryzyko z.w.:
Amniopunkcja
Poród kleszczowy/vacuum
Nacięcie krocza
„wypychanie” płodu

Cięcie cesarskie vs. Poród
naturalny
Ryzyko transmisji wzrasta o 2% z każdą
godziną od pęknięcia błon płodowych do
rozwiązania
Elektywne cięcie cesarskie redukuje ryzyko
transmisji o 50–80% w porównaniu z
porodem naturalny u kobiet bez ARV,
leczonych AZT i VL >1000
Brak korzyści z cięcia cesarskiego ze
wskazań położniczych
Cięcie cesarskie zwiększa ryzyko zakażenia
rany i powikłń z tym związanych
(m.in.sepsy)

HIV a ciążą
Transmisja wertykalna
Ryzyko historyczne: 28%
ACTG 076: 8%
Efektywne ART (VL<50 kopii/mm3) :
<1%
Elektywne cięcie cesarskie: 50%
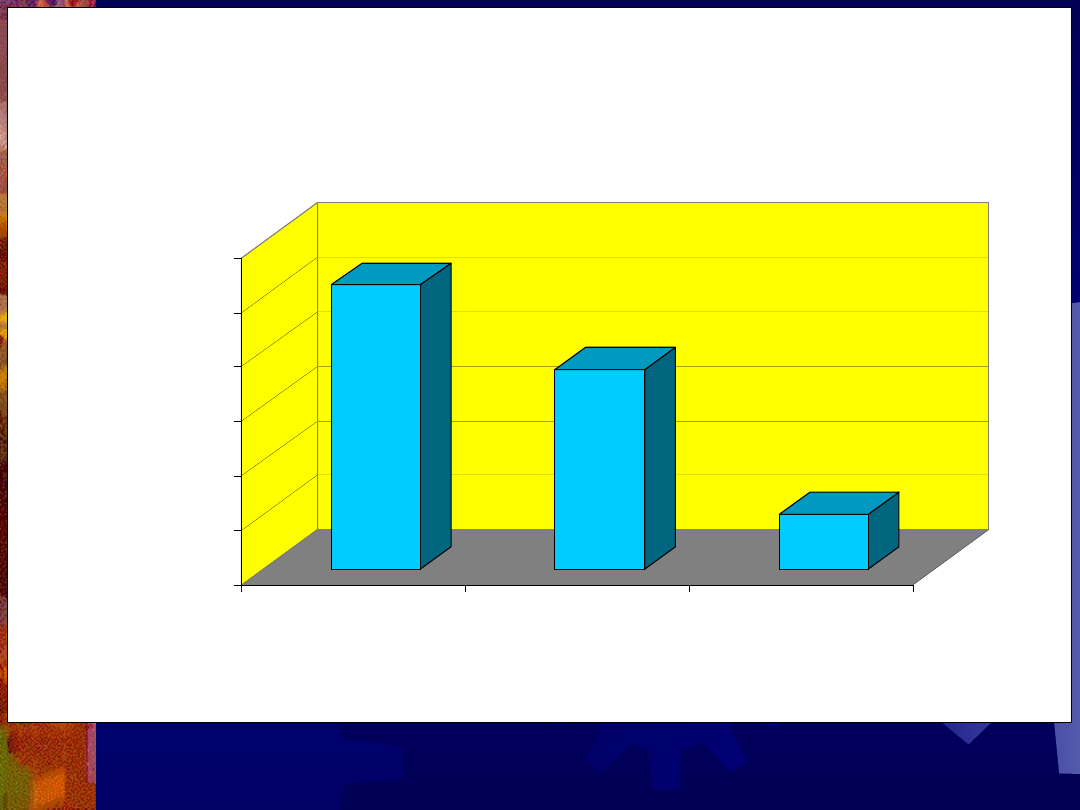
10.40%
7.30%
2.00%
0.00%
2.00%
4.00%
6.00%
8.00%
10.00%
12.00%
E.C.C.
AZT
E.C.C. +
AZT
RYZYKO Z.O. HIV -
MOŻLIWOŚCI INTERWENCJ I
International Perinatal HIV Group, NEJM,
1999, 340, 977

Wykład przygotowany na
podstawie
Rekomendacji DHHS 2006 –
Rekomendacji PTN AIDS – maj 2006
„HIV/AIDS” – podręcznik dla
studentów i lekarzy, pod redakcją
prof. Haloty i prof. Juszczyka, 2006.

Rekomendacje
http://www.aidsinfo.nih.gov/gui
delines
Guidelines for the Use of
Antiretroviral Agents in HIV-Infected
Adults and Adolescents
Updated November 11, 2006
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
Wyszukiwarka
Podobne podstrony:
terapia genowa obawy i nadzieje
Terapia w psychiatrii
Terapia genowa1 (2)
Terapia komórkowa w neurologii
Zaburzenia lękowe Neurobiologia lęku Terapia lęku
Terapia zajeciowa WPROWADZENIE
chroby ukłądu krążenia w ciąży
Fizjoterapia podczas ciąży
Wyklad 7 8 9 Terapia osob z autyzmem
TERAPIA FALĄ ULTRADŹWIĘKOWĄ,
Zapalenie płuc w ciąży
więcej podobnych podstron