
Helowce i ich
Helowce i ich
związki
związki

Odkrycie gazów
Odkrycie gazów
szlachetnych
szlachetnych
Gazy szlachetne zostały odkryte na przełomie XVIII - XIX wieku. Do ich
wynalezienia przyczynił się głównie angielski profesor William Ramsay -
laureat Nagrody Nobla w 1904r. - przy współpracy z innymi odkrywcami.
Odkrycie argonu
Odkrycie argonu
1785 r. – odkrywca wodoru Henry Cavendish zasugerował, że w powietrzu
istnieje nieaktywny gaz.
1894 r. – naukowcy John Rayleigh i William Ramsay wyodrębnili,
zidentyfikowali i zainicjowali istnienie nowego pierwiastka - argonu.
Odkrycie radonu
Odkrycie radonu
1900 r. – niemiecki fizyk Friedrich Dorn podczas badania
promieniotwórczego
rozpadu
radu
wykrył
pojawienie
się
promieniotwórczego gazu: radonu.
Odkrycie helu
Odkrycie helu
1868 r. – francuski astronom Pierre Janssen odkrył nowy pierwiastek na
Słońcu.
W tym samym roku Joseph Norman Lockyer i Edward Frankland
zaproponowali nazwę dla nowego pierwiastka: hel.
1895 r. – William Ramsay odkrył hel w rudach uranu.
3
Odkrycie kryptonu,
Odkrycie kryptonu,
ksenonu
ksenonu
oraz neonu
oraz neonu
1898 r. – William Ramsay wraz ze swoim doktorantem Morrisem
Traversem ponownie przebadali skład powietrza i odkryli w nim trzy kolejne
gazy: krypton, neon i ksenon, przy czym tej ostatni był najtrudniejszy do
wykrycia.
Odkrycie helu
Odkrycie helu
1868 r. – francuski astronom Pierre Janssen odkrył nowy pierwiastek na
Słońcu.
W tym samym roku Joseph Norman Lockyer i Edward Frankland
zaproponowali nazwę dla nowego pierwiastka: hel.
1895 r. – William Ramsay odkrył hel w rudach uranu.
Odkrycie kryptonu,
Odkrycie kryptonu,
ksenonu
ksenonu
oraz neonu
oraz neonu
1898 r. – William Ramsay wraz ze swoim doktorantem Morrisem
Traversem ponownie przebadali skład powietrza i odkryli w nim trzy kolejne
gazy: krypton, neon i ksenon, przy czym tej ostatni był najtrudniejszy do
wykrycia.

Ogólna charakterystyka
Ogólna charakterystyka
helowców
helowców
Do helowców nazywanych także gazami szlachetnymi zalicza się: hel,
neon, krypton, ksenon i radon.
Leżą one w układzie okresowym w grupie nr 18 (VIIIA) i charakteryzują się
najmniejszą aktywnością chemiczną spośród wszystkich znanych pierwiastków.
Konfiguracje helowców są bardzo trwałe:
konfiguracja helowców: n s
2
p
6
wyjątek stanowi hel o konfiguracji: 1s
2
Helowce posiadają wysoką energii jonizacji, co powoduje, że nie tworzą one
trwałych jonów dodatnich, a ich elektroujemność przyjmuje duże wartości.
Helowce wykazują ujemne powinowactwo elektronowe, w wyniku czego nie
tworzą one jonów ujemnych.
Występują we wszystkich stanach skupienia w postaci atomów. Mogą one na
siebie oddziaływać tylko słabymi siłami międzycząsteczkowymi.
4

Występowanie w przyrodzie
Występowanie w przyrodzie
Występowanie helowców we Wszechświecie:
hel jest drugim pierwiastkiem (zaraz po wodorze) pod względem
rozpowszechnienia we Wszechświecie.
neon i argon są bardziej rozpowszechnione niż krzem, w stosunku do
którego określa się zawartość innych pierwiastków w kosmochemii.
Występowanie helowców na Ziemi:
najbardziej rozpowszechnionym pierwiastkiem jest argon, a jego ilości są
podobnego rzędu jak ilości arsenu i boru. Jest on nawet bardziej
rozpowszechniony niż jod, kadm i srebro.
niewielkie ilości argonu i helu powstają ciągle na Ziemi wskutek przemian
promieniotwórczych.
argon to jeden z produktów rozpadu jąder izotopu potasu, które mogą
ulegać dwóm przemianom:
Przypadek
I:
Przypadek
II:
K
40
19
Ca(ok.90%)
40
20
Ar(ok.10%)
40
18
5

Hel tworzy się w skutek przemian α, bardzo częstych w naturalnych
szeregach promieniotwórczych: uranowo-radowym, uranowo-aktynowym
oraz torowym. Radon pojawia się we wszystkich tych szeregach jako jeden
z pierwiastków promieniotwórczych ulegających dalszemu rozpadowi.
Jednak są to izotopy krótkotrwałe i z tego powodu zawartość radonu w
przyrodzie jest mała.
Helowce na Ziemi występują głównie w atmosferze, a ich zawartość w
suchym powietrzu jest niewielka (0,0004 – 0,000008% obj.).
Hel znajduje się także w niektórych źródłach gazu ziemnego.
Występowanie w przyrodzie
Występowanie w przyrodzie
6
Otrzymywanie helowców
Otrzymywanie helowców
Wszystkie helowce (za wyjątkiem radonu) można otrzymać z powietrza. Hel
uzyskuje się jednak głównie z gazu ziemnego bogatego w ten pierwiastek.
Sposoby otrzymywania helowców:
Otrzymywanie w skali laboratoryjnej – wydzielenie mieszaniny
wszystkich helowców z powietrza poprzez:
przepuszczenie powietrza nad ogrzanymi wiórkami miedzi, co powoduje
usunięcie z niego tlenu:
następnie wiąże się azot ogrzewając z metalicznym magnezem lub
wapniem:
pozostałość składa się w 99,8% z argonu oraz z 0,2% z pozostałych gazów
szlachetnych.
2Cu + O
2
2CuO
3Mg + N
2
Mg
3
N
2
7

Otrzymywanie w skali technicznej – polega na przeróbce skroplonego
powietrza w procesie destylacji frakcjonowanej.
Poszczególne gazy zawarte w skroplonym powietrzu różnią się temperaturami
wrzenia i można je ułożyć wg wzrastających temperatur wrzenia w
następujący szereg:
Otrzymywanie helowców
Otrzymywanie helowców
He
Ne
N
2
Ar
O2
Kr
Xe
4,2K
27,1K
77,4K
87,3K
90,2K
119,8K
165,1K
8

Właściwości fizyczne
Właściwości fizyczne
helowców
helowców
Helowce to bezbarwne gazy, bez smaku, bez zapachu.
Ulegają skropleniu dopiero w bardzo niskich temperaturach.
Temperatury wrzenia helowców wzrastają stopniowo wraz ze wzrostem ich
masy atomowej. Hel wykazuje najniższą temperaturę wrzenia oraz skroplenia
pod normalnym ciśnieniem spośród wszystkich znanych substancji.
Ciepła topnienia i parowania helowców są wyjątkowo małe, co jest
spowodowane bardzo słabymi oddziaływaniami między cząsteczkami tych
gazów.
Skroplony hel występuje w dwóch odmianach, oznaczanych jako:
hel I – trwały bezpośrednio poniżej temperatury wrzenia, wykazuje
własności zwykłej cieczy. W temperaturze 2,17 K i pod ciśnieniem 0,05·
10
5
Pa przechodzi on w hel II.
hel II – charakteryzuje się niezwykle małą lepkością, tj. ok. 10
3
razy
mniejszą od lepkości gazowego wodoru; posiada także dobre
przewodnictwo cieplne, które jest ok. 1000 razy większe od przewodnictwa
cieplnego miedzi w temperaturze pokojowej – tzw. stan nadciekły.
9

Zastosowanie helowców
Zastosowanie helowców
Gazy szlachetne znalazły wiele zastosowań praktycznych:
Hel – do wypełniania statków powietrznych lżejszych od powietrza,
czyli aerostatów (balony, sterowce).
Hel – do chłodzenia nadprzewodników.
Hel – jako składnik mieszanki do oddychania w głębokim nurkowaniu
(mieszanina helu z tlenem).
Hel – odgrywa ogromną rolę we wszystkich pracach laboratoryjnych
związanych z otrzymywaniem najniższych temperatur.
W technice oświetleniowej, m.in. w „neonowych” reklamach świetlnych.
Rozrzedzone gazy szlachetne emitują charakterystyczne barwne światło:
neon – czerwone
hel – żółte
mieszanina helu z parami rtęci – niebieskie
Ksenon – w silniku jonowym oraz do wypełniania lamp błyskowych, żarówek
dużej mocy i jarzeniówek.
10

Związki helowców nie tworzą żadnych specjalnych odmiennych typów
wiązań.
Atomy helowców są wiązane dokładnie w ten sam sposób jak od dawna
znane związki międzyhalogenowe, np. IF
7
oraz jak związki tlenowców np. TeF
6
.
Związki gazów szlachetnych można podzielić na trzy typy:
Cząsteczki o krótkim czasie trwania zawierające atom helowca jako: He
2+
,
Ne
2+
, NeAr
+
, NeH
+
, HeNe
+
.
Związki inkluzyjne (klatraty, związki interkalacyjne).
Związki kowalencyjne.
Związki helowców
Związki helowców
11

Związki inkluzyjne – połączenia powstające w wyniku wypełnienia pustych
przestrzeni w sieci krystalicznej lub wnęk w cząsteczkach jednego składnika
jonami, atomami helowca bez tworzenia klasycznych wiązań chemicznych, a
jedynie w wyniku oddziaływań międzycząsteczkowych.
Klatrat – atom zamknięty wewnątrz innych cząsteczek, przy zachowaniu
stałego, określonego składu powstałego połączenia.
Klatraty helowców
Klatraty helowców
12
Przykładowe klatraty
Przykładowe klatraty
Najbardziej znanymi przykładami klatratów tworzących się z udziałem
helowców są klatraty, w których sieć macierzystą tworzy hydrochinon,
C
6
H
4
(OH)
2
. Powstają one podczas krystalizacji hydrochinonu z roztworu
benzenowego lub wodnego nasyconego argonem, kryptonem lub ksenonem
pod zwiększonym ciśnieniem. Klatrat argonu, uzyskany pod ciśnieniem 4MPa
[C
6
H
4
(OH)
2
]
3
· 0,8 Ar:
Klatrat ksenonu, uzyskany pod ciśnieniem 4MPa [C
6
H
4
(OH)
2
]
3
· 0,88 Xe.
Klatraty tworzone są przez wszystkie gazy szlachetne z wyjątkiem helu.
OH
O
H
hydrochinon

Przykładowe klatraty
Przykładowe klatraty
Hydraty helowców – w hydratach o wzorze:
gdzie:
Y – atom helowca cząsteczki wody, krzepnącej w obecności helowca, układają
się w taką strukturę krystaliczną, że komórka elementarna zawiera 46
cząsteczek H
2
O, pomiędzy którymi znajduję się 8 luk zdolnych pomieścić
atomy helowca.
Również i w tym przypadku pomiędzy uwięzionymi atomami helowców a
cząsteczkami wody, tworzącymi sieć przestrzenną kryształu, nie tworzą się
wiązania chemiczne, czynne są tylko słabe siły międzycząsteczkowe.
Y · 5,75 H
2
O
13
Energetycznie uprzywilejowane są struktury, w których gaz szlachetny ma
jak najniższą wartość pierwszej energii jonizacji, natomiast atom ligandowy -
jak najwyższe powinowactwo elektronowe. Nie jest to jednak warunek
wystarczający – XeCl
2
jest mniej trwały od XeF
2
mimo mniejszego
powinowactwa elektronowego fluoru w porównaniu z chlorem.
Helowce tworzą je wyłącznie z silnie elektroujemnymi pierwiastkami, tj. F, Cl,
Br, O.
Ważnym czynnikiem musi być kulombowskie przyciąganie pomiędzy
powstałymi ładunkami o przeciwnym znaku. Stąd preferowane są ligandy o jak
największej gęstości ładunku ujemnego i największej elektroujemności.
Bartlett w 1962 r. zsyntetyzował pierwszy związek chemiczny gazu
szlachetnego:
Pierwotnie heksafluoroplatynianowi(V) ksenonu przypisywano wzór: Xe[PtF
6
].
Związki kowalencyjne
Związki kowalencyjne
O
2
+ PtF
6
[O
2
+
] [PtF
6
-
]
heksafluoroplatynian(V) dioksygenylu
Xe + 2 PtF
6
[XeF
+
] [PtF
6
-
]
+ PtF
5
heksafluoroplatynian(V) ksenonu
14

Ksenon Xe tworzy wraz z fluorem F trzy związki:
XeF
2
XeF
4
(na zdjęciu)
XeF
6
Krypton Kr tworzy z fluorem F jeden stabilny związek:
KrF
2
Argon Ar tworzy wraz z fluorem F jeden związek, którego otrzymywanie nie
jest potwierdzone:
ArF
2
Fluorki helowców
Fluorki helowców
15

Najbardziej trwałymi halogenkami ksenonu są XeF
2
, XeF
4
oraz XeF
6
. Związki
te powstają w wyniku reakcji Xe z F
2
przy różnych warunkach syntezy. Związki
te są rozkładane przez wodę. Wszystkie są silnymi utleniaczami o potencjale
redox malejącym w szeregu:
Otrzymywanie związków fluoru:
Fluorki ksenonu
Fluorki ksenonu
Xe + 2F
2
XeF
4
600°C,
0.6 M Pa
Xe + F
2
XeF
2
400°C,
0.1 M Pa
Xe + 3F
2
XeF
6
300°C, 6 M Pa
Xe : F
2
= 1 :
5
niedobór F
2
Xe : F
2
= 1 :
20
XeF
6
> XeF
4
> XeF
2
16

Fluorki ksenonu
Fluorki ksenonu
Struktura powstających związków ksenonu:
17
Tlenki ksenonu XeO
3
i XeO
4
są substancjami o bardzo silnych właściwościach
utleniających – ich reakcje są wybuchowe.
Odpowiadające im aniony: HXeO
4-
– anion ksenianowy (VI) i XeO
64-
– anion
ksenianowy (VIII) wchodzą w skład stałych soli, trudno rozpuszczalnych w
wodzie jak np. Na
4
XeO
6
·8H
2
O.
Kseniany (VIII) powoli utleniają wodę, ale w środowisku kwaśnym reakcja
przebiega bardzo szybko:
Produktami pośrednimi są tu rodniki hydroksylowe.
Właściwości utleniające ksenianów (VIII) można wykorzystywać też w
reakcjach utleniania Mn
2+
do MnO
4-
, Ce
3+
do Ce
4+
czy HCl do Cl
2
.
Tlenki ksenonu i ich sole
Tlenki ksenonu i ich sole
XeO
3
+ 6H
+
+ 6e
-
Xe + 3H
2
O
E°=+2.10V
H
2
XeO
6
2-
+ H
+
HXeO
4
-
+ H
2
O +
½O
2
18
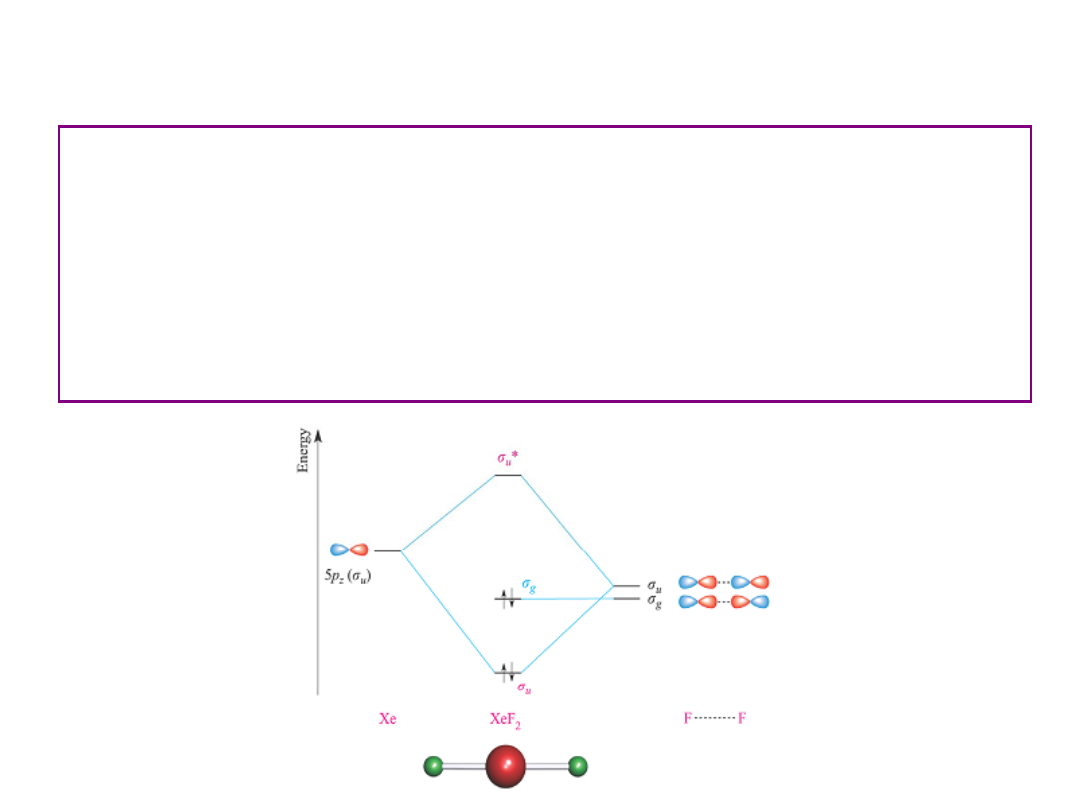
Liniowa cząsteczka XeF
2
, o symetrii D
∞h
jest przykładem molekuły z
wiązaniem 3c-4e. XeF
2
posiada 22 elektrony walencyjne.
20 elektronów, 14e – F oraz 6e – Xe zajmuje 10 orbitali niewiążących. 9
orbitali można traktować jako wolne pary elektronowe.
Pozostałe 2 elektrony zajmują orbital σ
u
wiążący. Stąd XeF
2
posiada rząd
wiązania ½, co odpowiada wiązaniu 3c-4e.
Jeden orbital σ
u*
antywiążący jest pusty.
Teoria orbitali molekularnych –
Teoria orbitali molekularnych –
XeF
XeF
2
2
19
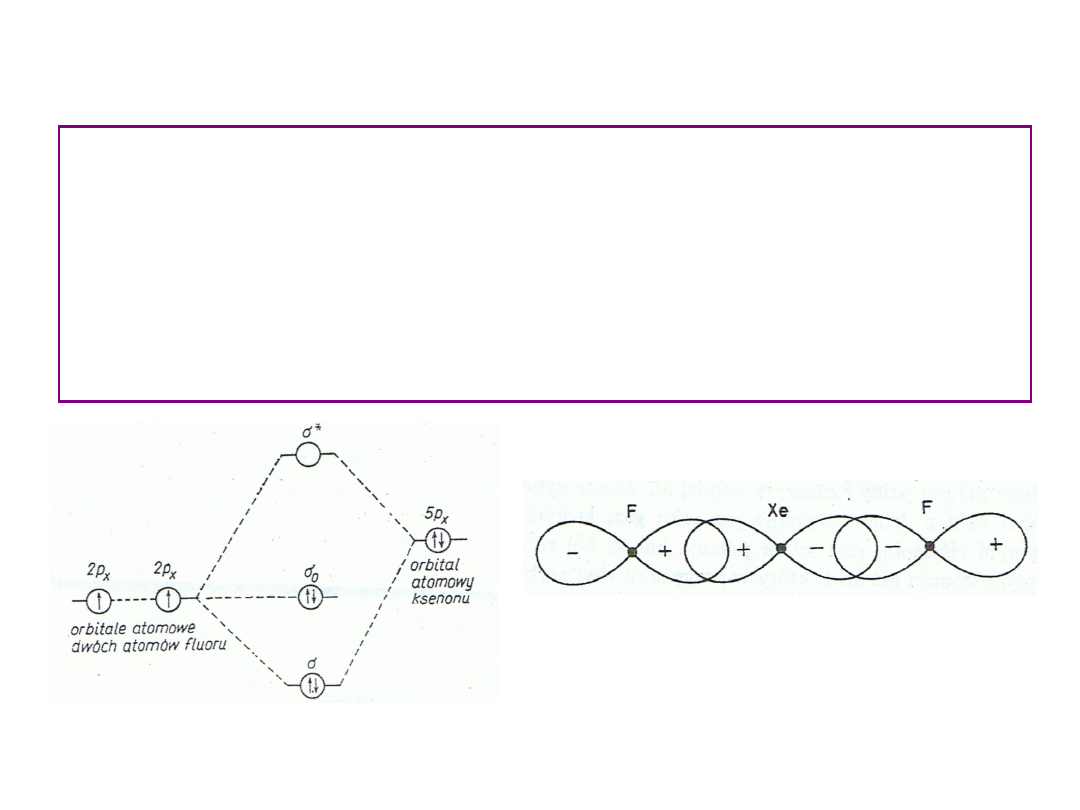
W cząsteczce XeF
2
orbital 5p ksenonu łączy się z orbitalami 2p dwóch
atomów fluoru z utworzeniem dwóch wiązań Xe-F. Prowadzi to do utworzenia
trzech kombinacji liniowych orbitali atomowych, stanowiących trzy
zdelokalizowane orbitale cząsteczkowe: wiążący, niewiążący oraz antywiążący.
Układ trwały uzyskujemy, gdy w tworzeniu wiązania zdelokalizowanego
biorą udział orbitale p obu atomów fluoru zapełnione w połowie (łącznie 2
elektrony). Orbital p ksenonu zapełniony był całkowicie i dostarczył 2
elektronów.
20
Teoria orbitali molekularnych –
Teoria orbitali molekularnych –
XeF
XeF
2
2
20
Rys.1: Schemat poziomów energetycznych
odpowiadających orbitalom cząsteczkowym w
cząsteczce XeF
2
.
Rys.2 Pokrywanie się orbitali atomowych w cząsteczce XeF
2
.

XeF
2
jest cząsteczką liniową podobnie jak KrF
2
.
Oba związki w stanie stałym wykazują znaczące oddziaływania
międzycząsteczkowe (oddziaływania F--F), choć różnią się strukturą.
Struktura cząsteczki XeF
Struktura cząsteczki XeF
2
2
oraz
oraz
KrF
KrF
2
2
21
Struktura cząsteczki XeF
Struktura cząsteczki XeF
6
6
XeF
6
jest dynamiczną strukturą występującą w fazie gazowej jako
zdeformowany oktaedr.
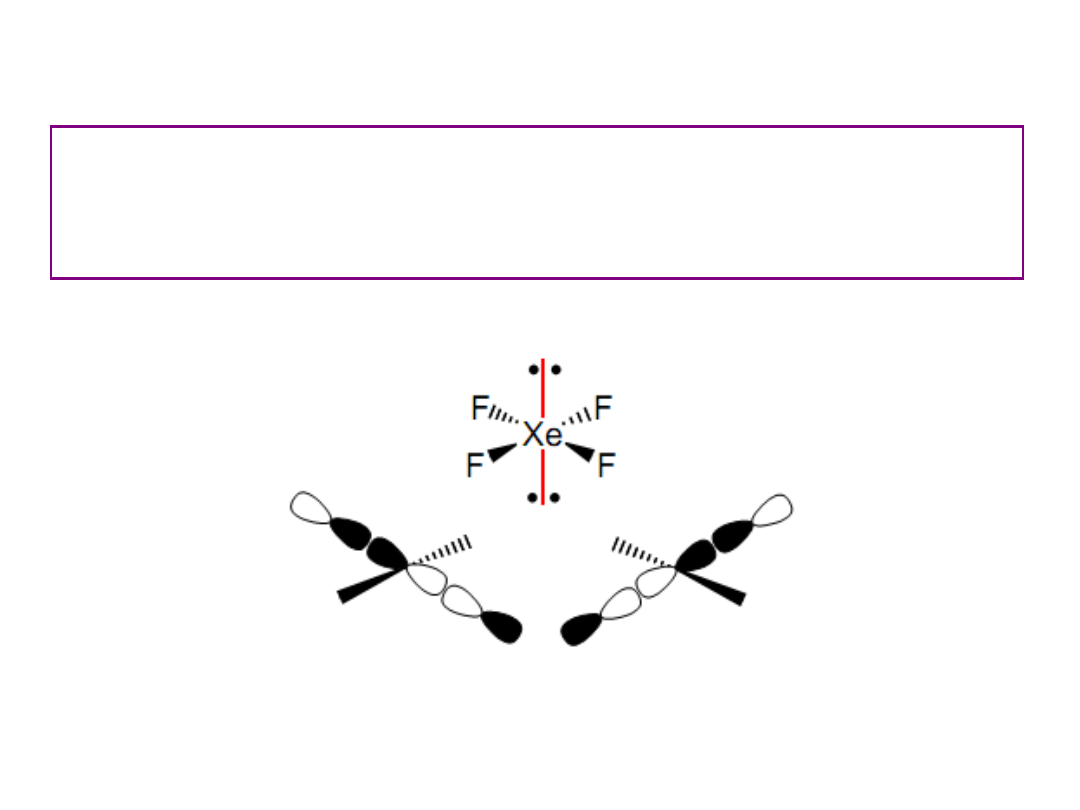
XeF
4
ma strukturę płaską, kwadratową i podobnie do XeF
2
tworzy wiązanie
3c-4e.
Leżące w płaszczyźnie orbitale wiążące są całkowicie zapełnione, stąd 2
elektrony rozdzielone są na 4 wiązania Xe-F dając rząd wiązania Xe-F równy ½.
Struktura cząsteczki XeF
Struktura cząsteczki XeF
4
4
22
XeF
4
kwadratowa
Stereochemia związków
Stereochemia związków
ksenonu
ksenonu
F
–
Xe
+
–F F–Xe
+
F
–
23
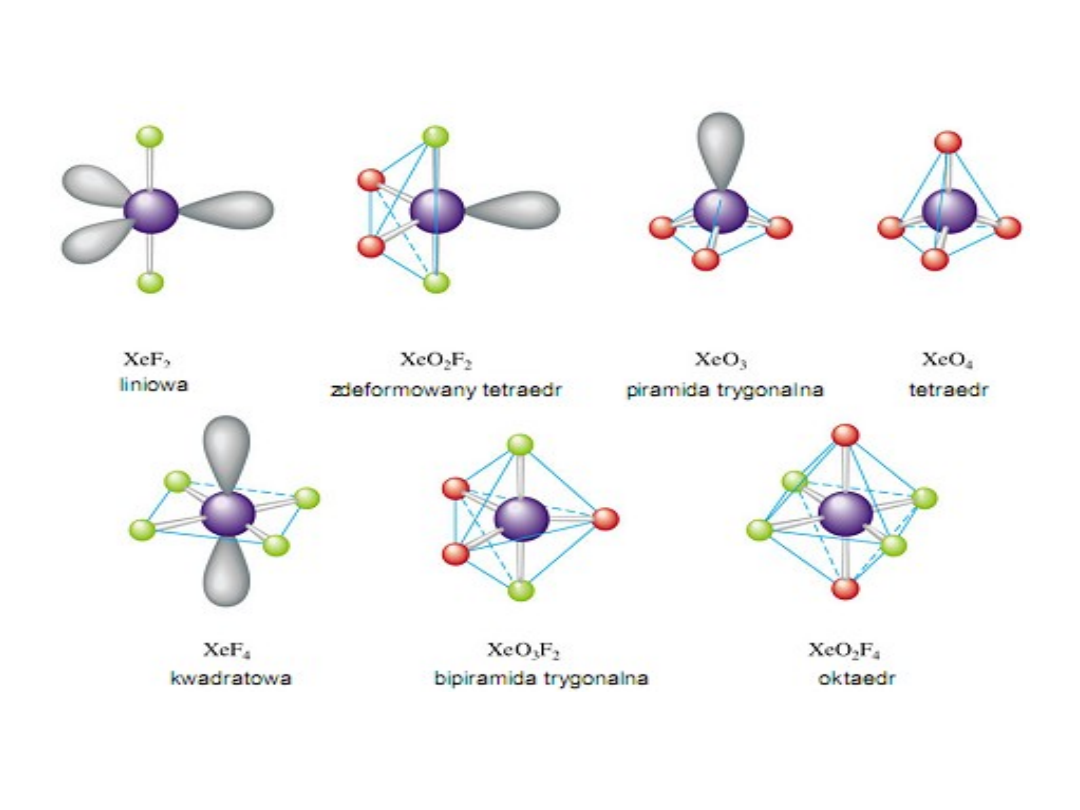
Struktury przestrzenne związków ksenonu.

Wśród związków ksenonu występują fluorki (XeF
2
, XeF
4
, XeF
6
), oksyfluorki
(XeOF
2
, XeOF
4
, XeO
2
F
2
, XeO
3
F
2
, XeO
2
F
4
) i tlenki (XeO
3
i XeO
4
).
Znane są XeCl
2
oraz XeBr
2
.
Tworzone są kationy jak np. XeF
5+
powstający w wyniku dysocjacji XeF
6
w
ciekłym HF.
Ksenon tworzy też z fluorowcami struktury mostkowe jak np. Xe
2
F
3+
- rolę
mostka pełni tu jon F
-
.
Połączenia z innymi pierwiastkami: HXeH, HXeCl, HXeBr, HXeI, HXeCN,
HXeNC, HXeOH, HXeSH – ten ostatni jest pierwszym otrzymanym związkiem
helowca z siarką.
Posumowanie - związki
Posumowanie - związki
ksenonu
ksenonu
24

KrF
2
jest termodynamicznie nietrwały (energia wiązania Kr-F wynosi
60kJ/mol), ale tworzy trwałe związki kompleksowe jak KrF
2
·2SbF
5
czy
KrF
2
·xAsF
5
.
Trwałe są kationy KrF
+
lub Kr
2
F
3+
- występujące w związkach jak np. [KrF
+
]
[PtF
6-
]. Kationy te powstają w reakcjach z silnymi kwasami Lewisa.
Otrzymanie KrF
4
jest niepotwierdzone.
Zgłoszono istnienie związków z wiązaniem Kr – N.
Inne związki: HKrCl, HKrCN, HKrNC.
Próby otrzymania w miarę trwałych połączeń kowalencyjnych helu i neonu
jak na razie kończą się niepowodzeniem.
Argon tworzy związki typu ArMF
6
(M = Sb, As). W związkach tych występują
kationy ArF
+
.
Podsumowanie - związki
Podsumowanie - związki
innych helowców
innych helowców
25

W 2000 roku otrzymano nietrwały HArF.
W 2003 roku zsyntezowano ArF
2
.
Chemia radonu jest stosunkowo słabo poznana. Wynika to z jego
radioaktywności – najtrwalszy izotop radonu
222
Rn ma okres półtrwania 3.83
dnia.
Znane są RnF
2
czy [RnF
+
][SbF
6-
]
Próby otrzymania w miarę trwałych połączeń kowalencyjnych helu i neonu
jak na razie kończą się niepowodzeniem.
Podsumowanie - związki
Podsumowanie - związki
innych helowców
innych helowców
26
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
PIERWIASTKI I ICH ZWIĄZKI
NIEMETALE I ICH ZWIĄZKI
P Krokosz Joannici i ich związki z ziemiami polskimi (recenzja)
ZWIĄZKI REFRAKCYJNE I METODY ICH USUWANIA ZE ŚCIEKÓW, Technologia Wody i Ścieków
Kształtowanie się zawartości związków azotowych w mleku klaczy i kumysie oraz ich liofilizatach
Związki zawodowe Zasady ich tworzenia i ich organizacja
Chemia Natura związków organicznych i ich budowa
Związki nieorganiczne węgla i ich właściwości 1, Chemia(2)
zwiazki zawodowe i ich rola w polskich zakladach pracy
biofizyka, błony, Budowa i właściwości struktur biologicznych zależy nie tylko od właściwości związk
Związki nieorganiczne węgla i ich właściwości, Chemia(2)
Związki frazeologiczne i kryteria ich podziału
ZWIĄZKI HELOWCÓW
Zagadnienia do seminarium z cukrów i ich pochodnych, Biotechnologia POLSL, Semestr V, Chemia Związkó
Ważniejsze klasy związków i ich wzory ogólne
Zwiazki chemiczne w otoczeniu czlowieka i ich zast osowanie
Związki Helowców
więcej podobnych podstron