
WYKŁAD 10
Białka

Białka
• POLIPEPTYD
• Aminokwasy
połączone
wiązaniami
amidowymi
(peptydowymi) i
disiarczkowymi
• POLIPEPTYD
+
fragment
niebiałkowy
• Gliko
proteiny
• Metalo
proteiny
• Fosfo
proteiny
• Lipo
proteiny
• Nukleo
proteiny
Budowa białek
20 aminokwasów
N
H
2
H
R
COOH
L-aminokwas
Neutralne:
Phe, Ala, Leu,
Ile, Met, Trp, Pro, Val
Cys, Gly, Gln, Asn, Ser,
Tyr, Thr
Kwasowe:
Asp, Glu
Zasadowe:
His, Arg, Lys
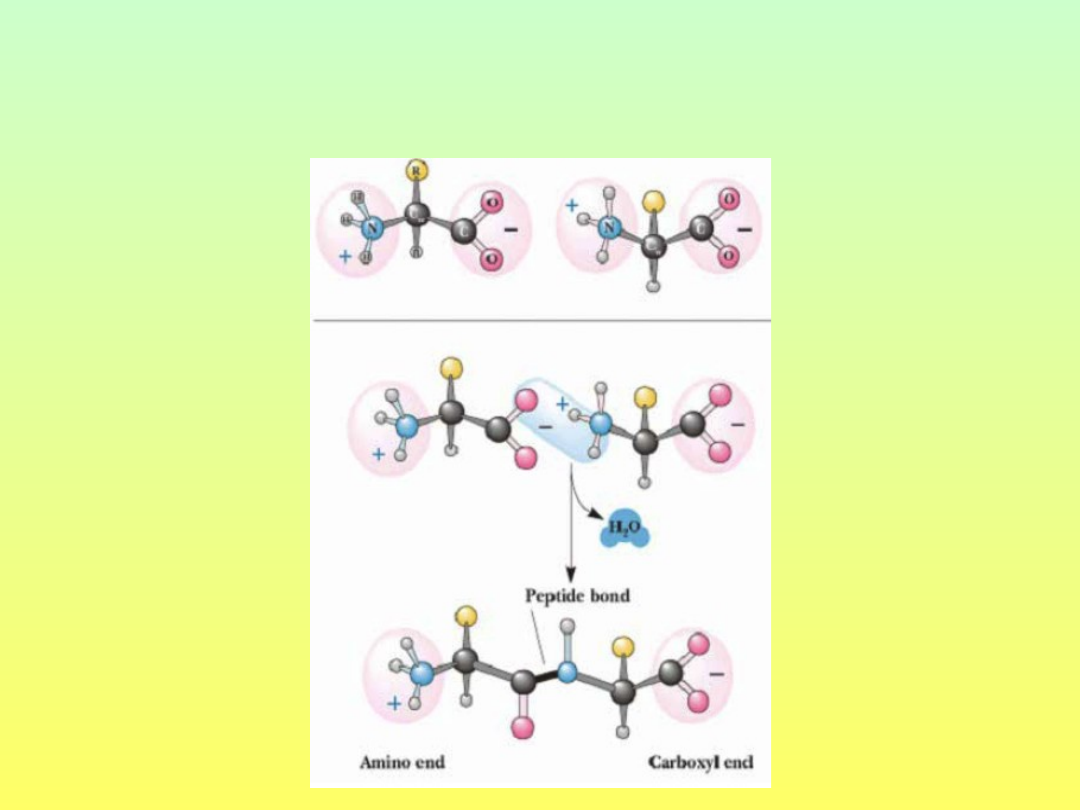
Jak powstaje wiązanie
peptydowe?
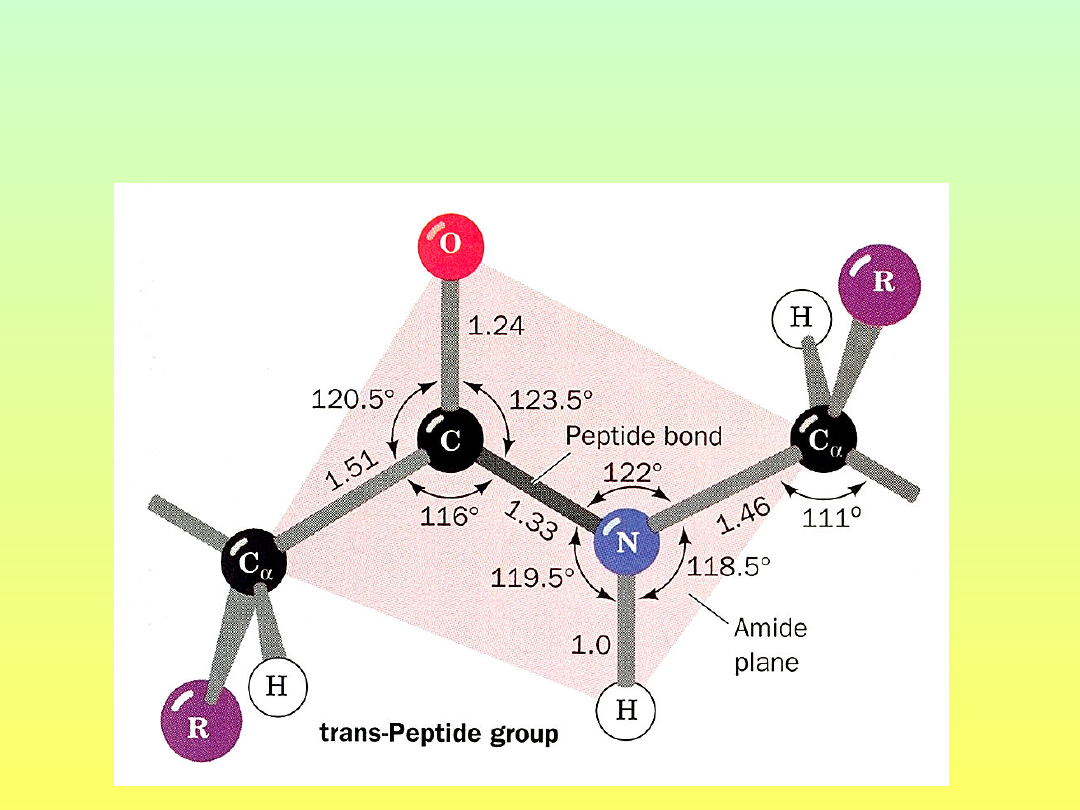
Wiązanie
peptydowe
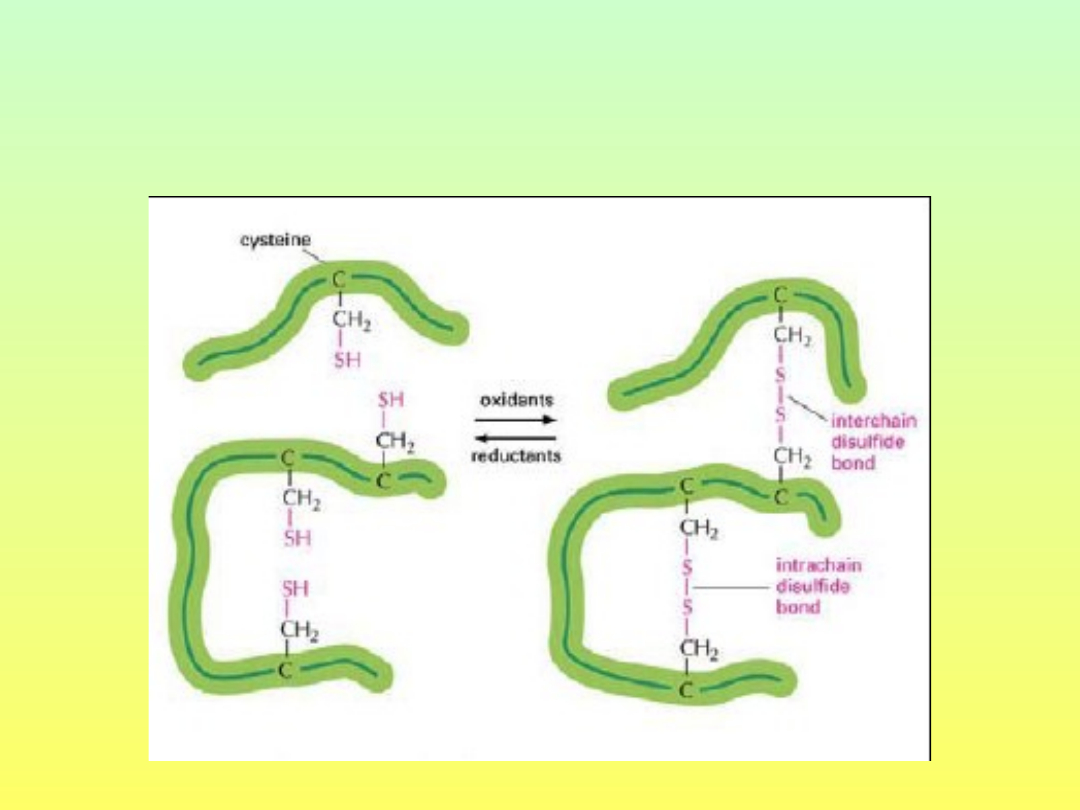
Mostki disiarczkowe

Budowa białek
Struktura I-rzędowa
Struktura II-rzędowa
Struktura III-rzędowa
Struktura IV-rzędowa
Sekwencja aminokwasów
Struktura , -helisa
Konformacja cząsteczki
Aglomeracja cząsteczek
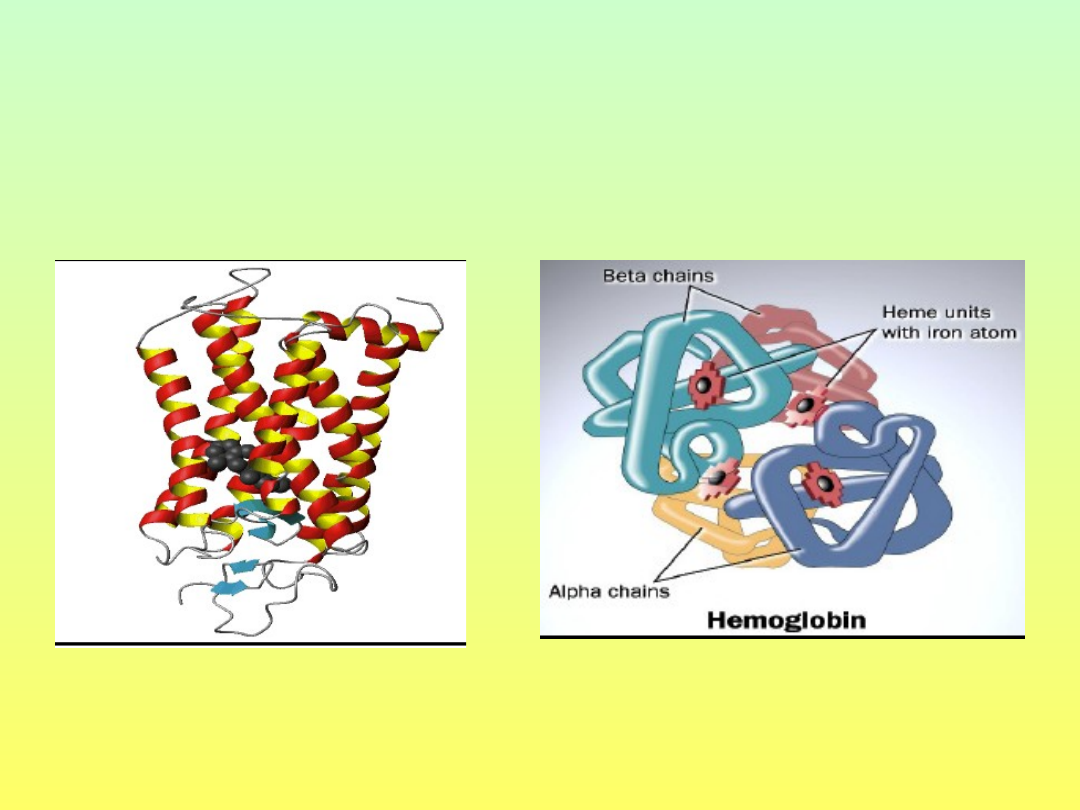
Budowa białek

Biologiczne funkcje
białek
• Enzymy
• Hormony
• Białka zapasowe
• Białka budulcowe
• Białka
transportujące
• Białka ochronne
• Białka kurczliwe
• Toksyny

Właściwości białek
• GLOBULARNE
(rozpuszczalne w
H
2
O)
• Lizozym
• Insulina
• Mioglobina
• FIBRYLARNE
(nierozpuszczalne
w H
2
O)
• Kolagen
• Elastyna
• Keratyna

Struktura białek
Aminokwasy hydrofobowe – wewnątrz
cząsteczki osłonięte przed kontaktem z
wodą
Aminokwasy hydrofilowe – na zewnątrz
cząsteczki oraz w centrach katalitycznych
enzymów
Imidazol histydyny – donor lub akceptor
protonu przy fizjologicznym pH (centra
katalityczne enzymów)
Grupy – CH
2
OH i CH
2
SH (seryna, cysteina)
działają jako nukleofile podczas katalizy
enzymatycznej

Denaturacja białek
Rozpad wiązań stabilizujących strukturę II i III-rzędową
Czynniki powodujące denaturację:
•Podwyższona temperatura (60-70C)
•Niskie i wysokie pH
•Promieniowanie
•Ultradźwięki
•Detergenty
•Rozpuszczalniki organiczne
•Obecność jonów

Skład aminokwasowy białek
żywności
Niezbędne
Ile
Zawartość
4-5%
Wzorzec
FAO
4%
Pozostałe
Arg
Zawartość
4-6%
Leu
Lys
Met
7-9%
6-9%
1-3%
7%
5.5%
His
Ala
Asp+Asn
2-3%
3-6%
9-12%
Cys
Phe
Tyr
1-2%
4-5%
3-4%
Glu+Gln
Gly
Pro
17-33%
2-5%
4-10%
Thr
Trp
Val
4-5%
1-2%
4-7%
4%
1%
5%
Ser
4-8%
}
3.5%
}
6.0%

Reakcje białek podczas
przetwarzania
i przechowywania żywności
•Działanie podwyższonej
temperatury
•Ekstremalne pH
•Obecność utleniaczy
•Obecność węglowodanów,
lipidów
Obróbka termiczna i przemysłowe
przetwarzanie powodują:
Skutki korzystne:
•Ograniczenie psucia się
•Przedłużenie czasu przechowywania
Efekty niekorzystne:
•Obniżenie wartości odżywczej
•Utrata właściwości funkcjonalnych
•Powstawanie produktów toksycznych
•Korzystne i niekorzystne zmiany zapachu i smaku

Obróbka termiczna do 100C:
•Zmniejszenie rozpuszczalności białek
globularnych
•Struktura pierwszorzędowa nienaruszona
•Inaktywacja enzymów
•Destrukcja toksyn i czynników
przeciwżywieniowych
•Poprawa przyswajalności

Obróbka termiczna > 115C:
•Degradacja cysteiny i cystyny (powstaje H
2
S,
(CH
3
)
2
S, kwas cysteinowy
•Reakcje deamidacji (powstaje NH
3
, zmiana
pI, kowalencyjne sieciowanie)
•W obecności tlenu – degradacja tryptofanu

Obróbka termiczna > 200C
oraz zasadowe środowisko:
•Izomeryzacja (obniżenie przyswajalności i
wartości odżywczej)
•Powstawanie cyklicznych pochodnych o
działaniu mutagennym)
•Degradacja w środowisku zasadowymj (Arg,
Cys, Ser, Thr, Lys)

Obróbka termiczna 200-300C
•Sieciowanie – grupy aminowe Lys i Arg reagują z
karboksylowymi Glu i Asp (obniżenie
przyswajalności, zmiany wł. funkcjonalnych)
•Powstawanie cyklicznych pochodnych o działaniu
mutagennym, kancerogennym
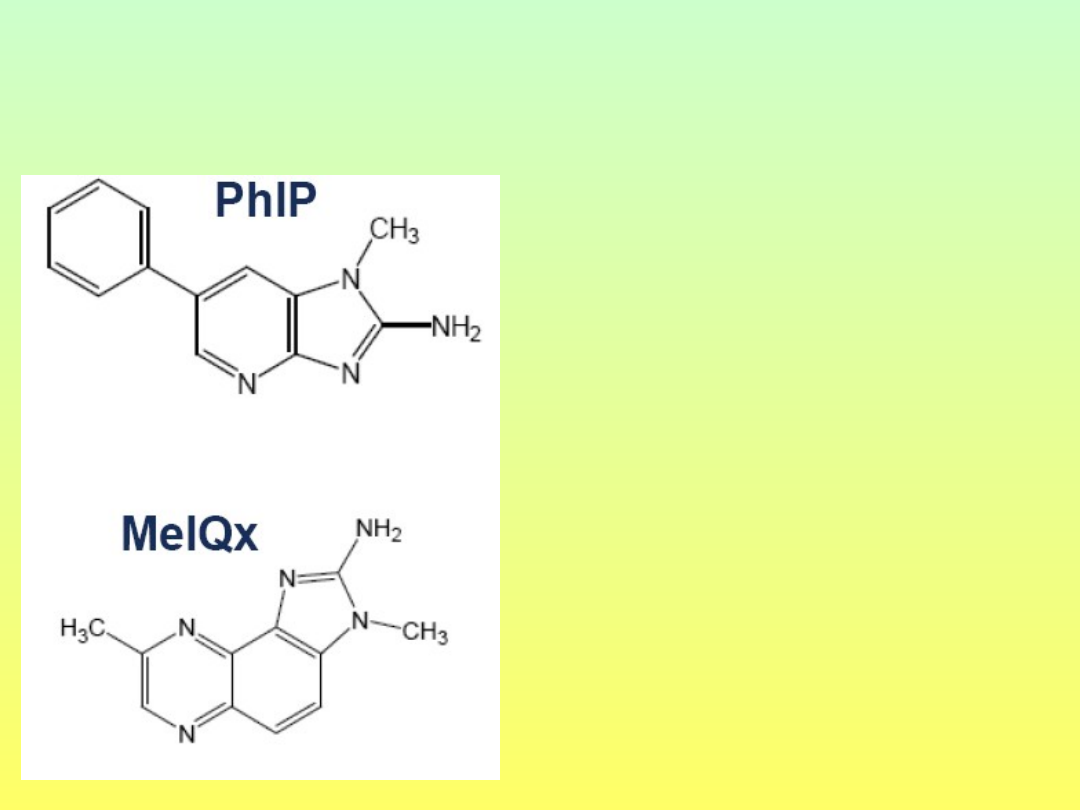
Obróbka termiczna > 300C
Fenyloimidazolopirydyna
(PhIP)
Metyloimidazolochinoksalina
(MeIQx)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
10 dźwigniaid 10541 ppt
10 4id 10454 ppt
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
10 integracjaid 11290 ppt
10 mnoznikid 10954 ppt
10 Neuroradiologiaid 10583 ppt
10 ROZSTĘPYid 10627 ppt
10 23id 10410 ppt
10 mostid 10959 ppt
10 spekulacjeid 10632 ppt
Prez 10 08 00 ppt
10 Histeroskopiaid 10552 ppt
10 energiaid 11288 ppt
10 XSLTid 11208 ppt
PRO LAT31 10 03 09A ppt
10 Successio testamentaria ppt
więcej podobnych podstron