
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.
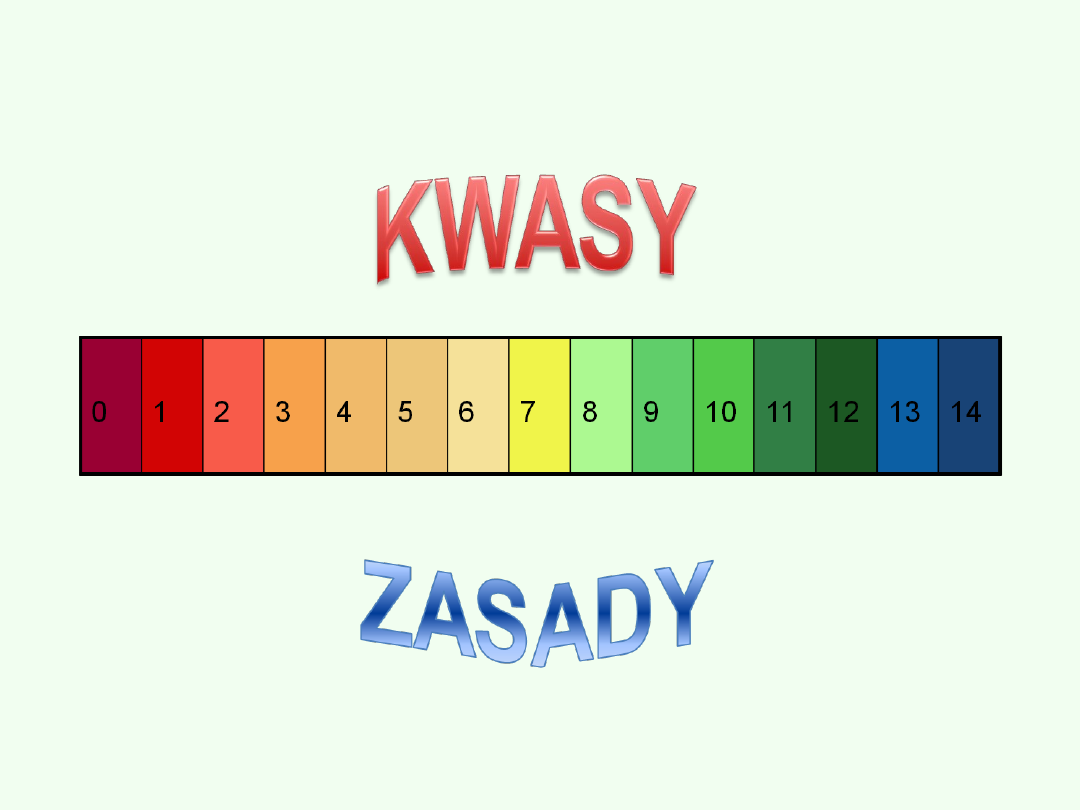

W1661 roku Robert Boyle w swoim dziele "Chemik Sceptyk" podał podstawy
klasyfikacji substancji chemicznych, dzieląc je na: pierwiastki, ziemie, kwasy,
zasady i sole. Odkrył też zmiany barwy lakmusu pod działaniem kwasów i zasad
oraz pierwszy wprowadził do prac chemicznych papierki wskaźnikowe.
KLASYCZNA TEORIA ARRHENIUSA
KLASYCZNA TEORIA ARRHENIUSA
W 1884 roku Arrhenius sformułował teorię dysocjacji
elektrolitycznej.
W 1887 roku poszerzył ją o definicję kwasu i zasady.
Kwasem jest substancja odszczepiająca
w roztworze wodnym jony wodorowe
Zasadą jest substancja odszczepiająca
w roztworze wodnym jony wodorotlenowe
W wyniku zobojętnienia kwasu zasadą (i odwrotnie) powstaje sól i
woda.
Reakcje zobojętniania rozpatruje się, zgodnie z tą teorią, tylko w
środowisku wodnym.
+
+
-
-
A-H
A + H
MOH
M + OH
Teoria zawodzi, gdy trzeba wyjaśnić pojęcia oraz reakcje kwasów i zasad
w innych rozpuszczalnikach. Teoria klasyczna nie tłumaczy zasadowego
zachowania się amin organicznych. Trudno też rozpatrywać sole, które w
roztworze kwaśnym mają wszystkie cechy zasady, jak np. Na
2
CO
3
, bądź
też kwasu, jak NaHSO
4
.
Znacznym rozszerzeniem teorii Arrheniusa jest ogłoszona w 1923 roku,
niezależnie przez J.N. Brønsteda i T.M. Lowry'ego, tzw
. teoria
protolityczna (również protonowa) kwasów i zasad.
TEORIA BRØNSTEDA I LOWRY'EGO
TEORIA BRØNSTEDA I LOWRY'EGO
Wg teorii Brønsteda i Lowry'ego
Kwasem
jest substancja, która może oddawać proton innej, jest więc
donorem protonów.
Zasady
mogą przyjmować protony, są więc
akceptorami protonów
.
Reakcje odłączania i przyłączania protonu są odwracalne, cząsteczka
(lub jon) utworzona wskutek odłączenia protonu od kwasu może więc z
powrotem przyłączać proton.
Tak więc w odwracalnej reakcji odłączenia protonu od donora
(kwasu) powstaje akceptor (zasada).
kwas ↔ zasada + p
Kwasem lub zasadą może być zarówno obojętna cząsteczka, jak i
jon - kation lub anion
Równowaga kwasowo-zasadowa Brönsteda i Lowry’ego zakłada, że z
każdym kwasem musi być sprzężona jakaś zasada.
"p" oznacza proton przenoszony w reakcji kwas-zasada , w odróżnieniu
od symboli H
+
lub H
3
O
+
oznaczających uwodniony proton, który może
istnieć tylko w roztworach wodnych.
"p" oznacza proton przenoszony w reakcji kwas-zasada , w odróżnieniu
od symboli H
+
lub H
3
O
+
oznaczających uwodniony proton, który może
istnieć tylko w roztworach wodnych.
H
p
1
1

Przykłady
H
NH
NH
H
HCOO
HCOOH
H
OH
O
H
H
O
H
O
H
zasada
3
kwas
4
zasada
kwas
zasada
kwas
2
zasada
2
kwas
3
Wszelkie reakcje typu kwas-zasada polegają na przeniesieniu protonu z
cząsteczki kwasu do cząsteczki zasady.
W roztworach wolne protony nie mogą samodzielnie istnieć, wobec
tego muszą połączyć się z inną cząsteczką lub jonem.
Taka cząsteczka lub jon ma charakter akceptora protonu, a więc zasady.
Dlatego w rzeczywistości nie przebiegają reakcje odłączenia protonu od
kwasu, a jedynie reakcje przeniesienia protonu do cząsteczki innej
zasady, będącej mocniejszym akceptorem protonów od zasady
sprzężonej z danym kwasem.
Jednocześnie przebiegają reakcje
dwóch sprzężonych par:
I. Kwas 1 ↔ p + zasada 1
II. Zasada 2 + p ↔ kwas 2
Sumaryczna reakcja:
kwas 1 + zasada 2 ↔ zasada 1 + kwas 2

Reakcje kwas-zasada zachodzą często w roztworach z udziałem
rozpuszczalnika. Cząsteczki wody, jako rozpuszczalnik, mogą zarówno
łączyć się z protonami, tworząc jon hydroniowy H
3
O
+
, jak też oddawać
proton, przechodząc w jon wodorotlenowy OH
-
.
Związki, które według tej teorii mogą pełnić rolę zarówno kwasu jak i
zasady nazywamy związkami amfiprotycznymi
►
Jeśli substancja ma właściwości donorowe mocniejsze niż cząsteczki
wody, to przebiegnie reakcja z wytworzeniem jonów H
3
O
+
i substancję
tę będziemy w roztworach traktowali jako kwas.
Przykłady
zasada2
3
kwas1
3
zasada1
2
kwas2
4
zasada2
kwas1
3
zasada1
2
kwas2
NH
O
H
O
H
NH
Br
O
H
O
H
HBr
W reakcjach tych woda występuje
zawsze jako zasada.
►
Jeśli woda ma mocniejsze właściwości donorowe niż substancja
rozpuszczona, to obecność tej ostatniej w roztworze wodnym spowoduje
powstanie jonów OH
-.
Wówczas taką substancję określamy jako zasadę
Przykład
kwas2
2
zasada1
kwas1
2
zasada2
S
H
OH
O
H
HS

Jeśli w roztworze wodnym znajduje się substancja, która jest mocniejszym
akceptorem protonów (zasadą) niż woda bądź mocniejszym donorem
protonów (kwasem) niż woda, to jej udział będzie dominujący.
Przykład
Amoniak wprowadzony do roztworu wodnego kwasu
octowego jest mocniejszym akceptorem, a więc silniejszą
zasadą niż woda. Zachodzi w przeważającym stopniu
reakcja
CH
3
COOH + NH
3
↔ CH
3
COO
-
+ NH
4
+
Ogólna reguła charakteryzująca reakcje kwas-zasada
- kwasy reagują w pierwszej kolejności z najmocniejszą w danych
warunkach zasadą, zaś zasady - z najmocniejszym kwasem.
Jeśli zatem porównamy z sobą substancje pod względem zdolności do
odłączania i przyłączania protonów, to stwierdzimy, że im kwas ma
mocniejsze właściwości donorowe, tym mniej chętnie sprzężona z nim
zasada łączy się z protonem, jest więc tym słabszym akceptorem.
Odwrotnie, im zasada ma bardziej zdecydowane właściwości
akceptorowe, tym sprzężony z nią kwas jest słabszy.
Ogólna reguła charakteryzująca reakcje kwas-zasada
- kwasy reagują w pierwszej kolejności z najmocniejszą w danych
warunkach zasadą, zaś zasady - z najmocniejszym kwasem.
Jeśli zatem porównamy z sobą substancje pod względem zdolności do
odłączania i przyłączania protonów, to stwierdzimy, że im kwas ma
mocniejsze właściwości donorowe, tym mniej chętnie sprzężona z nim
zasada łączy się z protonem, jest więc tym słabszym akceptorem.
Odwrotnie, im zasada ma bardziej zdecydowane właściwości
akceptorowe, tym sprzężony z nią kwas jest słabszy.

ELEKTRONOWA TEORIA LEWISA
ELEKTRONOWA TEORIA LEWISA
Lewis zwrócił uwagę na fakt, że zasadami są przeważnie cząsteczki,
atomy lub jony bogate w wolne pary elektronowe.
Efekt ten jest widoczny w oddziaływaniu cząsteczki wody i cząsteczki
amoniaku z jonem wodorowym:
Według tej teorii kwasy to substancje będące akceptorami pary
elektronowej, natomiast zasady to substancje będące donorami
pary elektronowej.
Przykłady
3
3
2
3
2
2
)NO
(NH
CO
)
(NH
HNO
)
(NH
CO
)
(NH
W reakcji kwas azotowy(V) pełni rolę kwasu, a mocznik
zasady.
W ogólności, reakcję kwasowo-zasadową wg Lewisa można zapisać w
postaci:
Lewisa)
(sol
zasadowy
wasowo
kompleks_k
(donor)
zasada
(akceptor)
kwas
B
A
B
:
A

Teoria Usanowicza
Jeszcze bardziej ogólną teorię sformułował M. Usanowicz w 1939 r.
Zgodnie z nią kwasem nazywamy substancję, której cząsteczka
odszczepia kation, przyłącza anion lub elektron i zdolna jest do
zobojętniania zasad i tworzenia soli.
Z kolei zasadą jest substancja, której cząsteczki odszczepiają anion,
przyłączają kation i zdolna jest do zobojętniania zasad i tworzenia soli.
Dzięki wprowadzonym modyfikacjom praktycznie wszystkie kwasy i
zasady, zarówno Arrheniusa, jak i Brønsteda-Lowry'ego, są
sklasyfikowane jak poprzednio, natomiast można dodatkowo
sklasyfikować nowe związki.
Na przykład w reakcji amoniaku z wodorkiem boru można ten ostatni
uważać za kwas, czego nie dałoby się objaśnić poprzednimi teoriami

Bibliografia
„Repetytorium maturzysty_chemia” Iwona Król
„ Chemia od A do Z” M. Klimaszewska
http://pl.wikipedia.org
http://atos.wmid.amu.edu.pl/
http://www.mlyniec.gda.pl/
http://oen.dydaktyka.agh.edu.pl
Document Outline
Wyszukiwarka
Podobne podstrony:
W08s-Slabe kwasy i zasady wieloprotonowe, chemia, szkolka
kwasy i zasady
1 Równowagi w roztworach elektrolitów Kwasy i zasady
KWASY I ZASADY OZNACZENIE STĘŻENIA
Kwasy zasady (sprzężone)
06 Kwasy i zasady
kwasy i zasady (2)
kwasy i zasady (1)
W06 kwasy i zasady, rozpuszczalniki, si^a jonowa
Kwasy i zasady
004elektrolit, ELEKTROLITY, KWASY, ZASADY I SOLE
Biochemia 4, KWASY i zasady, KWASY I ZASADY wg ARRHENIUSA
Kwasy i zasady w chemii organicznej
12 Elektrolity, kwasy, zasady i sole
Zadania rachunkowe do tematu kwasy i zasady, Farmacja, Chemia ogólna i nieorganiczna
Kwasy i zasady w chemii organicznej
1 Rwnowagi w roztworach elektrolitw Kwasy i zasady
więcej podobnych podstron