
1
1
Struktura kryształów
• http://www.mif.pg.gda.pl/homepages/maria/pd
f/Krys_06_10.pdf
• http://www.mah.se/upload/TS/Crystal%20structures.pdf
• http://130.15.85.210/courses/MECH270/documents/Lect
ure5-DefectsinCrystallineSolids.pdf
• http://www.cmse.ed.ac.uk/MSE3/Topics/MSE2-
06/Lecture%20micro.pdf
• http://www.google.pl/search?client=firefox-
a&rls=org.mozilla%3Apl
%3Aofficial&channel=s&hl=pl&q=ionic+crystals
%2Blecture
%2BPower+Point&lr=&btnG=Szukaj+w+Google
• http://firstyear.chem.usyd.edu.au/Lectures/lecture
%201901_18_2007.pdf – ciekłe kryształy
• http://www.cus.cam.ac.uk/~jae1001/teaching/mphil/MP
10/MP10_3.pdf -ciekłe kryształy

2
2
Najbardziej typowe sieci
jonowe
AB
NaCl B
1
CsCl B
2
-ZnS (blenda cynkowa) B
3
AB
2
CaF
2
C
1
TiO
2
C
4
3
3
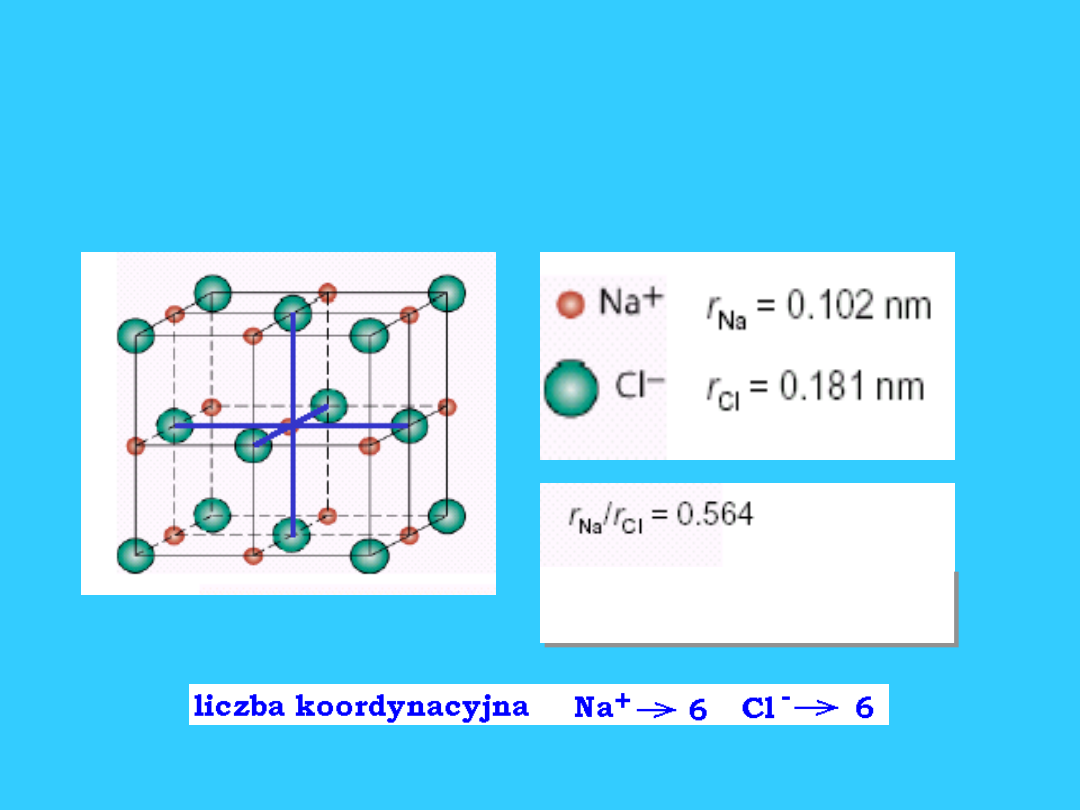
Struktura NaCl
Kationy preferują luki
oktaedryczne
Kationy preferują luki
oktaedryczne
4
4
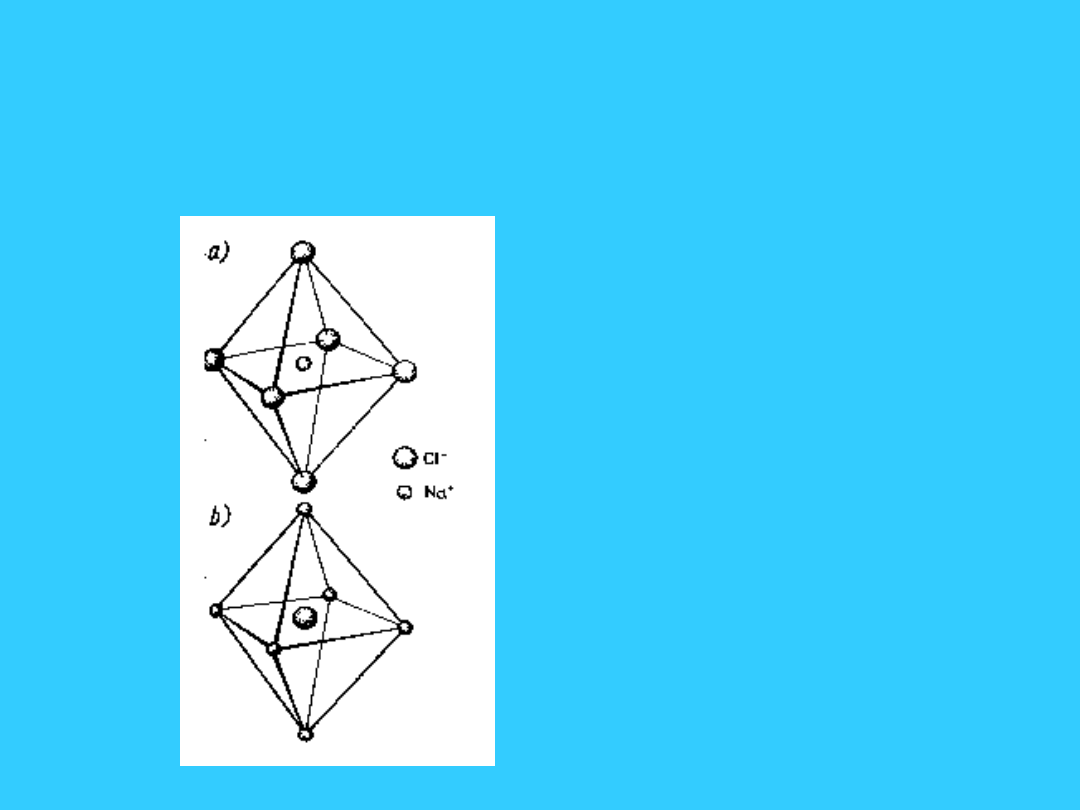
Struktura typu NaCl
• a) liczba koordynacji
dla jonu Cl
-
• b) liczba koordynacji
dla jonu Na
+

5
5
Struktura typu NaCl
• Sieć typu NaCl - regularna zewnętrznie
centrowana (B
1
)
• Wyprowadzić ją można z sieci A
1
w
lukach oktaedrycznych tej sieci złożonej
z anionów Cl
-
są kationy Na
+
. Są to więc
dwie sieci typu A
1
zbudowane z różnych
indywiduów tj. Na
+
i Cl
-
.
• Przykłady sieci typu NaCl: AgCl, AgBr,
PbS
6
6
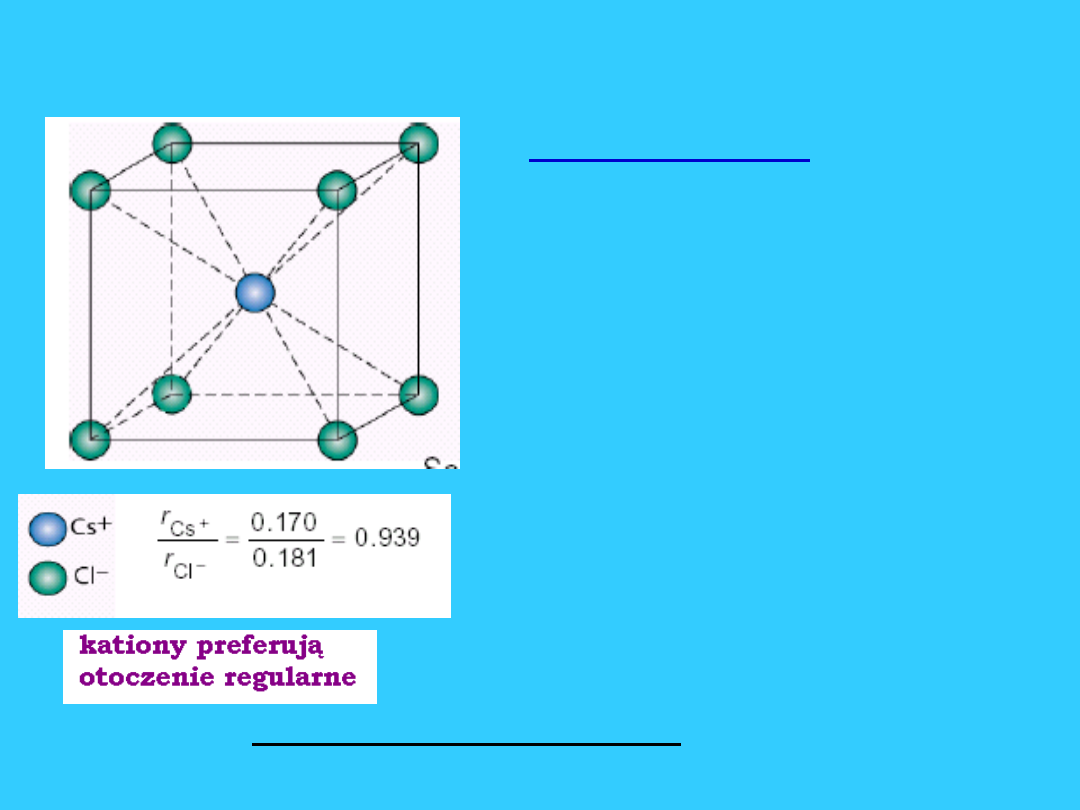
Struktura typu CsCl (B
2
)
• Sieć typu CsCl - regularna
wewnętrznie centrowana.
• Można ją wyprowadzić z
sieci A
2
w środku
komórki jest kation Cs
+
, a
w narożach aniony Cl
-
(może być odwrotnie).
• Liczba jonów w komórce
elementarnej : kationy
Cs
+
=1
aniony Cl
-
= 1
• Liczby koordynacji: Cs
+
8 Cl
-
8
Przykłady sieci typu CsCl : TlCl,
NH
4
Cl, NH
4
Br
7
7
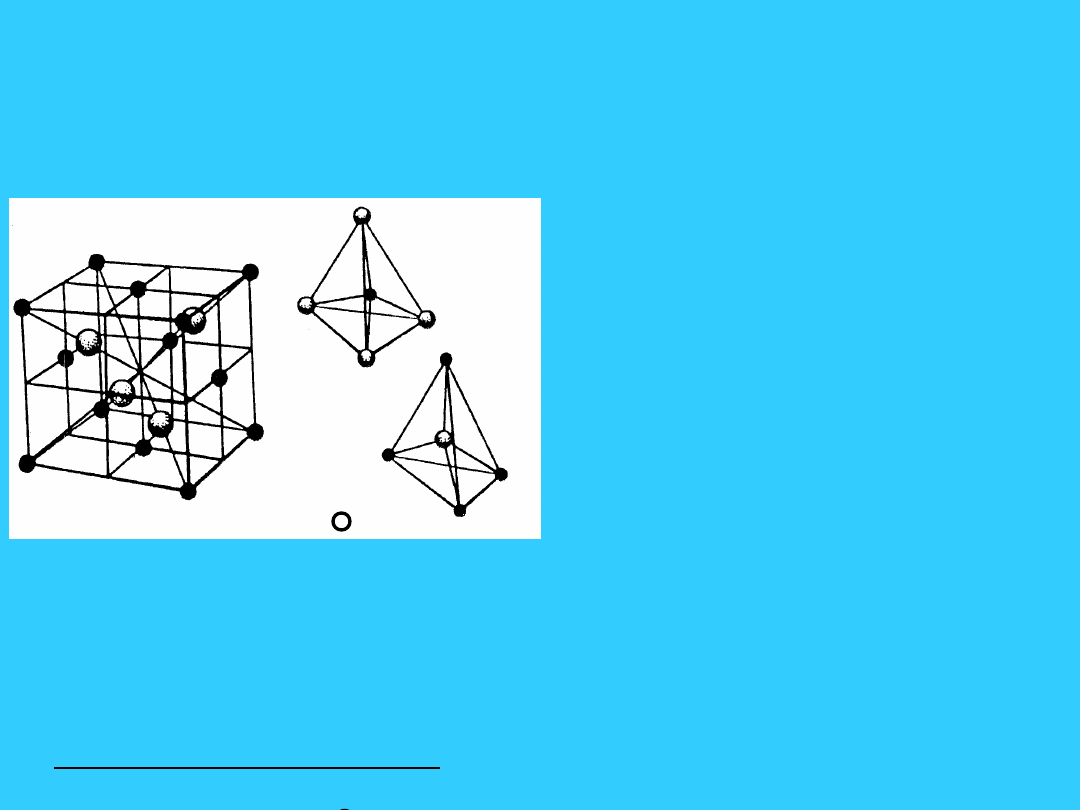
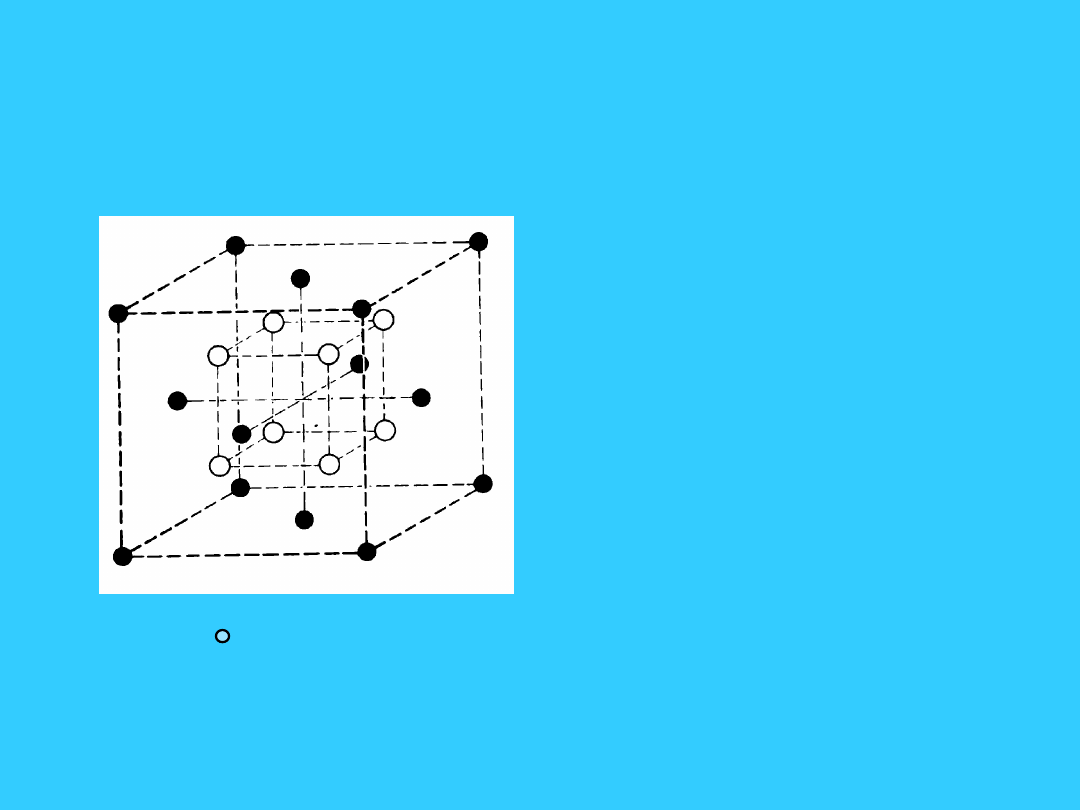
Sieć typu -ZnS (blendy
cynkowej) - B
3
• Jest to sieć typu diamentu.
W
komórce
regularnej
zewnętrznie centrowanej
złożonej z kationów Zn
2+
są 4 aniony S
2-
w środkach
co
drugiej
1/8
części
komórki.
• liczba koordynacji Zn
2+
4
• liczba koordynacji S
2-
4
• Liczebność komórki:
• Zn
2+
=8*1/8+6*1/2 = 4
• S
2-
= 4*1 = 4
Zn
2+
, S
2-
J est to sieć tworzona gdy różnica elektroujemności anionu i kationu jest
niewielka oprócz wiązania jonowego jest pewien procent wiązania
kowalencyjnego
Przykłady sieci typu - ZnS : CuCl, CuBr, AgI , HgS, ZnSe, HgSe
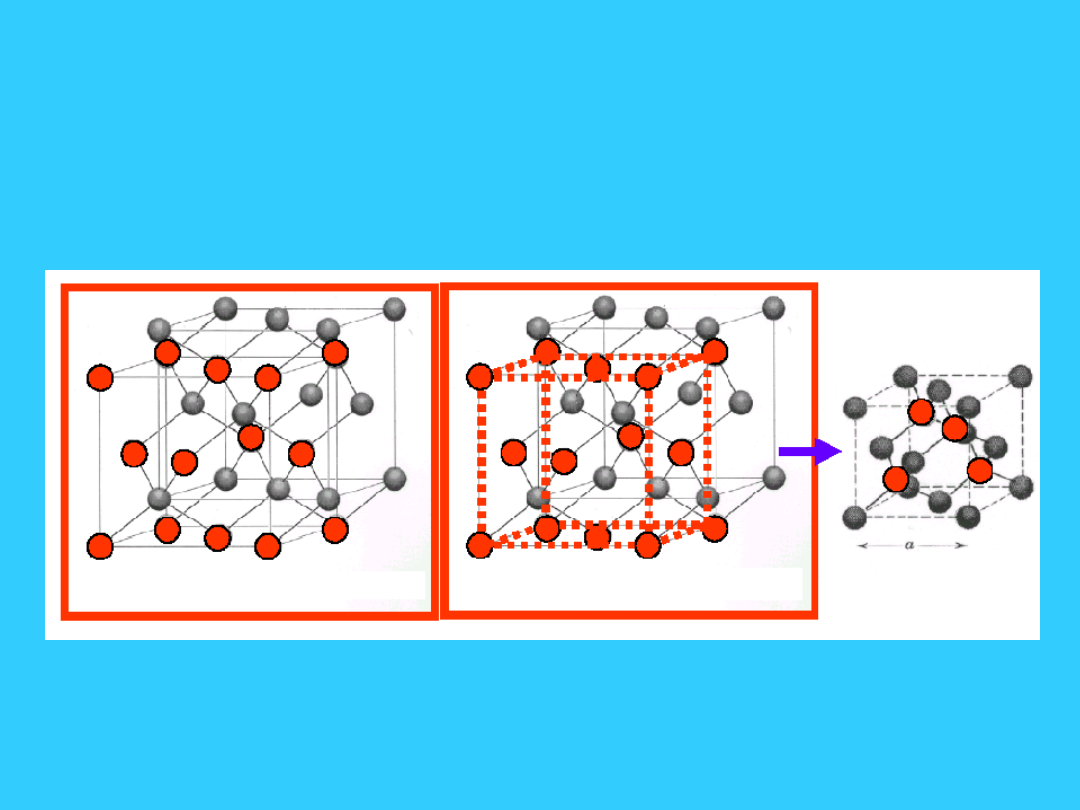
8
8
Struktura blendy cynkowej jest
kombinacją dwóch struktur
regularnych centrowanych na
ścianach
9
9
Sieć typu fluorytu (CaF
2
)-
C
1
S
2-
• Tą sieć można wyprowadzić
z sieci A
1
. W tej sieci naroża
i środki ścian są wypełnione
kationami Ca
2+
. Wszystkie
luki tetraderyczne w sieci są
zapełnione anionami F
-
.
• Komórka ulega znacznemu
rozepchnięciu.
Ca
2+
F
-
Liczebność komórki:
Ca
2+
=8*1/8+6*1/2 = 4
F
-
= 8
l.k. Ca
2+
= 8
l.k. F
-
= 4
Przykłady sieci typu CaF
2
: SrF
2
, BaF
2
,
PbF
2
, LiO
2
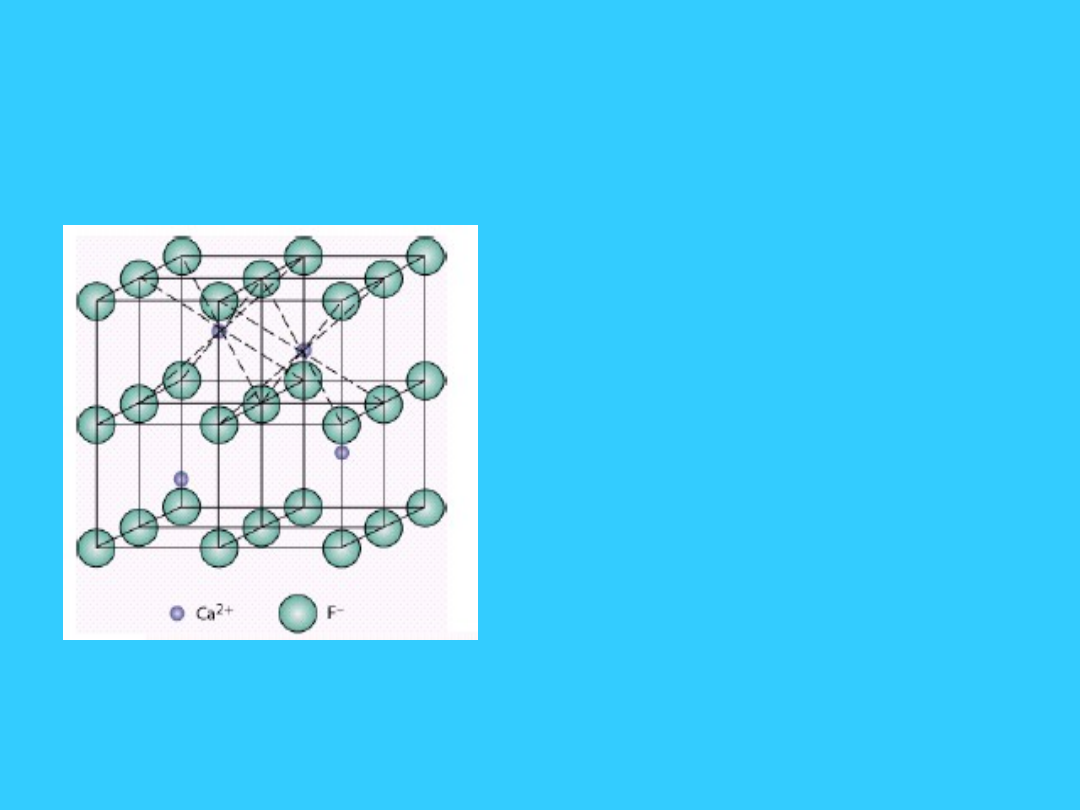
10
10
Sieć typu antyfluorytu
(CaF
2
)
• Może
też
wystąpić
sieć
odwrotna, tj. kationy będą na
miejscu anionów, a aniony na
miejscu kationów - jest to
struktura antyfluorytu.
• Przykłady takiej sieci: Li
2
S,
Na
2
S, Cu
2
S
• • Fluorek wapnia (CaF
2
)
• •r
Ca
= 0.10 nm
• •r
F
= 0.13 nm
• •r
Ca
/r
F
= 0.752
• • kationy w lukach regularnych
Przykłady takiej sieci: Li
2
S, Na
2
S, Cu
2
S
11
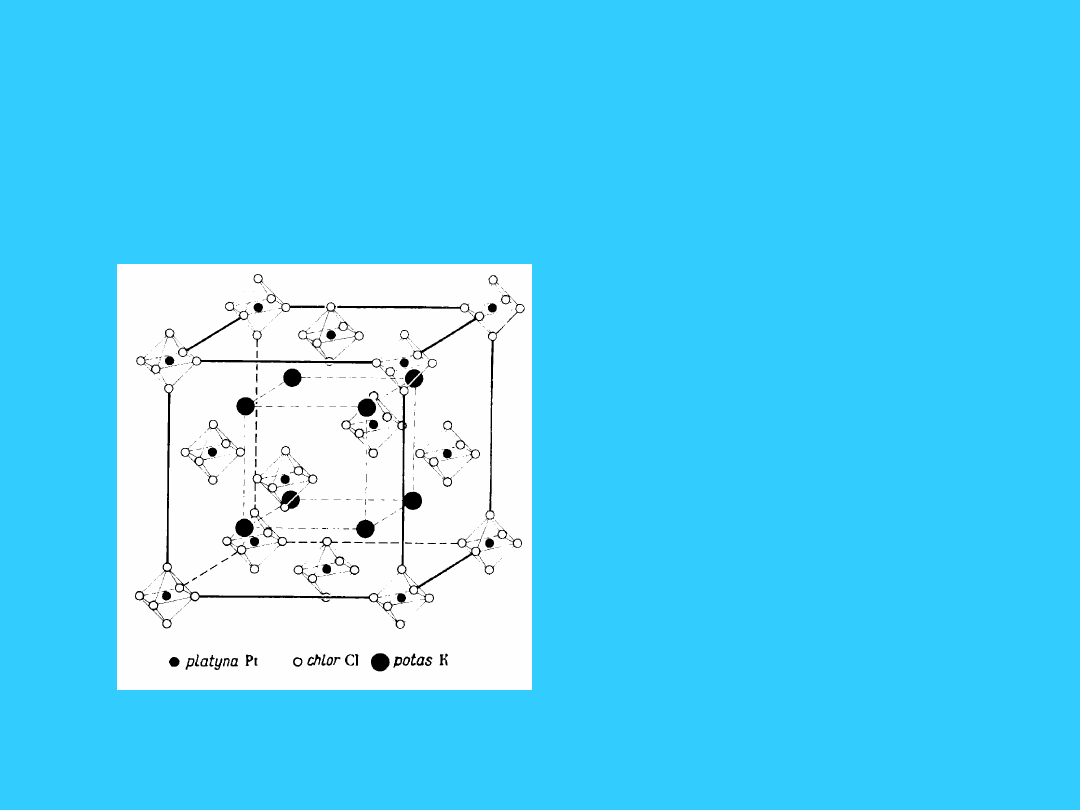
11
Inne sieci jonowe
(struktury bardziej
złożone)
• związki
kompleksowe:
• K
2
PtCl
6
• K
+
PtCl
62-
• [Ni(NH
3
)
6
]Cl
2
• [Ni(NH
3
)
6
]
2+
Cl
-
• struktura
oktaedryczna

12
12
• Wymaga uwspólnienia elektronów
• Przykład: CH
4
C: ma 4 elektrony walencyjne,
potrzebuje jeszcze 4
H: ma 1 el. walencyjny,
potrzebuje jeszcze 1
Porównywalne elektroujemności.
Uwspólnione elektrony
od atomu węgla
Uwspólnione elektrony od
atomów wodoru
H
H
H
H
C
CH4
Wiązanie kowalencyjne
13
13
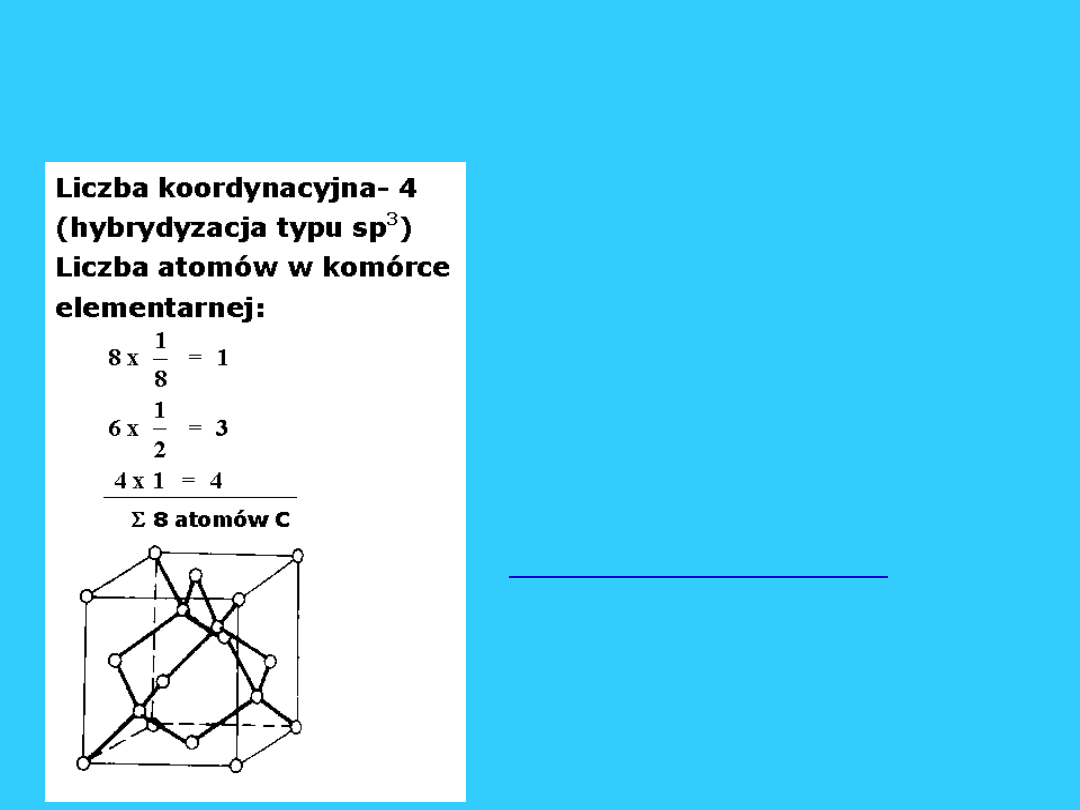
Sieci kowalencyjne (atomowe)
Sieć typu - A
4
(sieć diamentu)
Sieć w której krystalizuje diament -
sieć regularna zewnętrznie
centrowana z dodatkowymi atomami
węgla, które są na przemian w środku
co drugiej kostki (komórkę dzielimy
na 8 równych kostek).
–
W węzłach sieci występują atomy
między którymi są silne wiązania
kowalencyjne.
–
W komórce jest 8 luk
tetraedrycznych i połowę z nich
zajmują atomy węgla a druga połowa
jest pusta.
• Tutaj w węzłach są atomy a nie zręby
atomowe - nie ma więc swobodnych
elektronów - jest do dielektryk (słabo
przewodzi prąd elektryczny).

14
14
Sieci molekularne
(cząsteczkowe)
• W węzłach sieciowych występują cząsteczki.
•
Przykładem sieci cząsteczkowej jest sieć stałego chloru,
jodu, azotu, wodoru czy tlenu. Cząsteczki X
2
(X = Cl, Br, N, H, O).
W węzłach sieciowych mogą też występować wieloatomowe, np.:
P
4
, S
8
, B
12
lub C
60
.
•
Również
gazy
szlachetne
krystalizują
w
sieciach
molekularnych z tym, że w węzłach są pojedyncze atomy.
•
Wreszcie w sieciach molekularnych występują takie związki
nieorganiczne jak dwutlenek węgla, amoniak czy woda.
•
Tutaj w węzłach są cząsteczki, a oddziaływania między nimi
to słabe oddziaływania typu van der Waalsa lub wiązania
wodorowe.

15
15
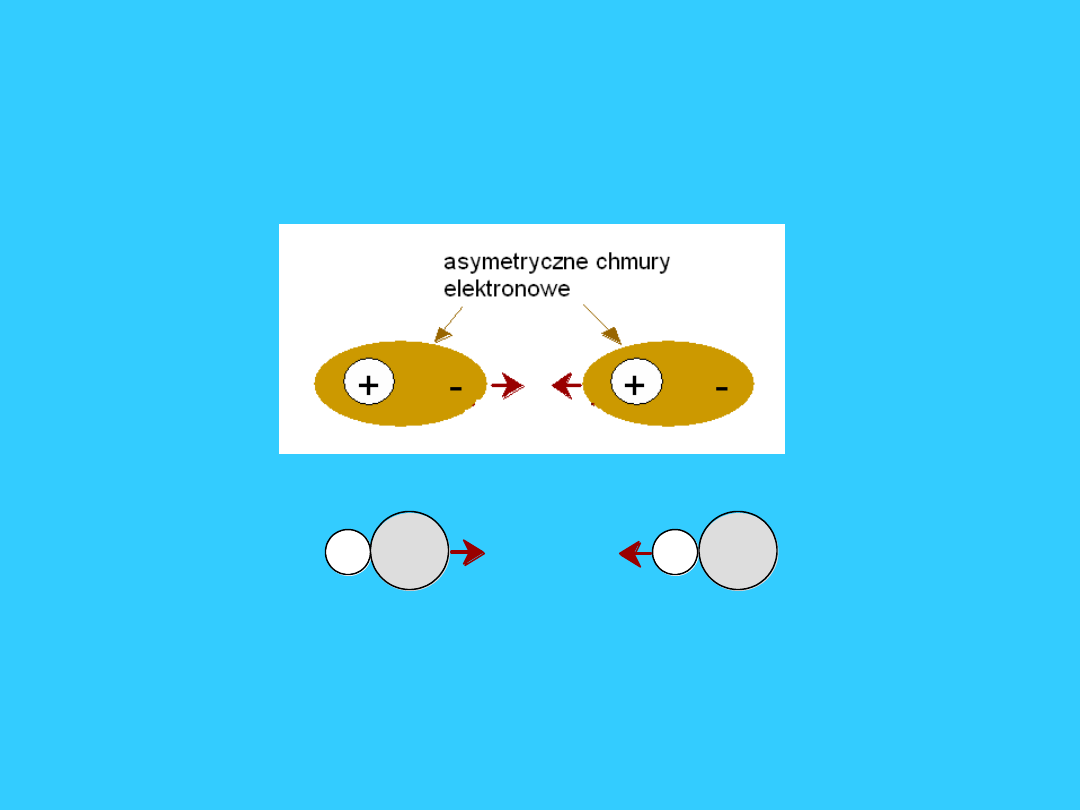
Wiązanie Van der Waalsa

16
16
Wiązanie Van der Waalsa
17
17
Wynika z oddziaływania pomiędzy dipolami
• Trwałe dipole – dipole indukowane
• Chwilowe dipole
+ -
secondary
bonding
+ -
Wiązanie Van der Waalsa
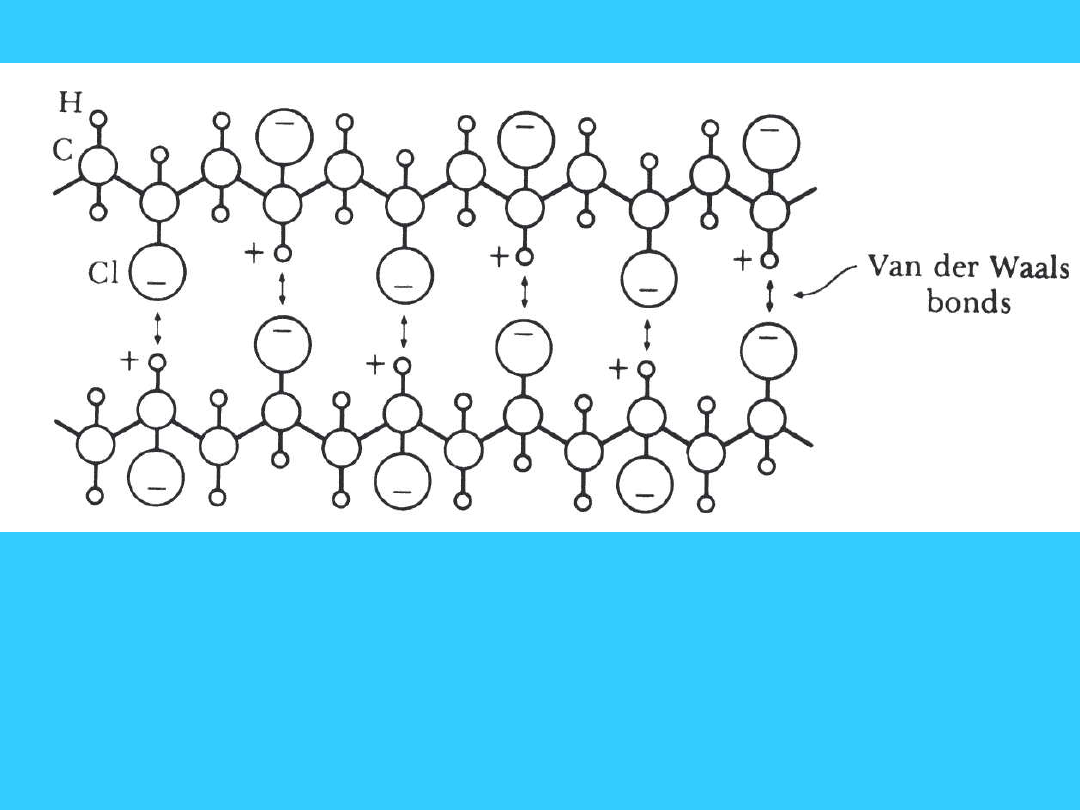
18
18
Wiązanie Van der Waalsa pomiędzy
łańcuchami polimerowymi
19
19
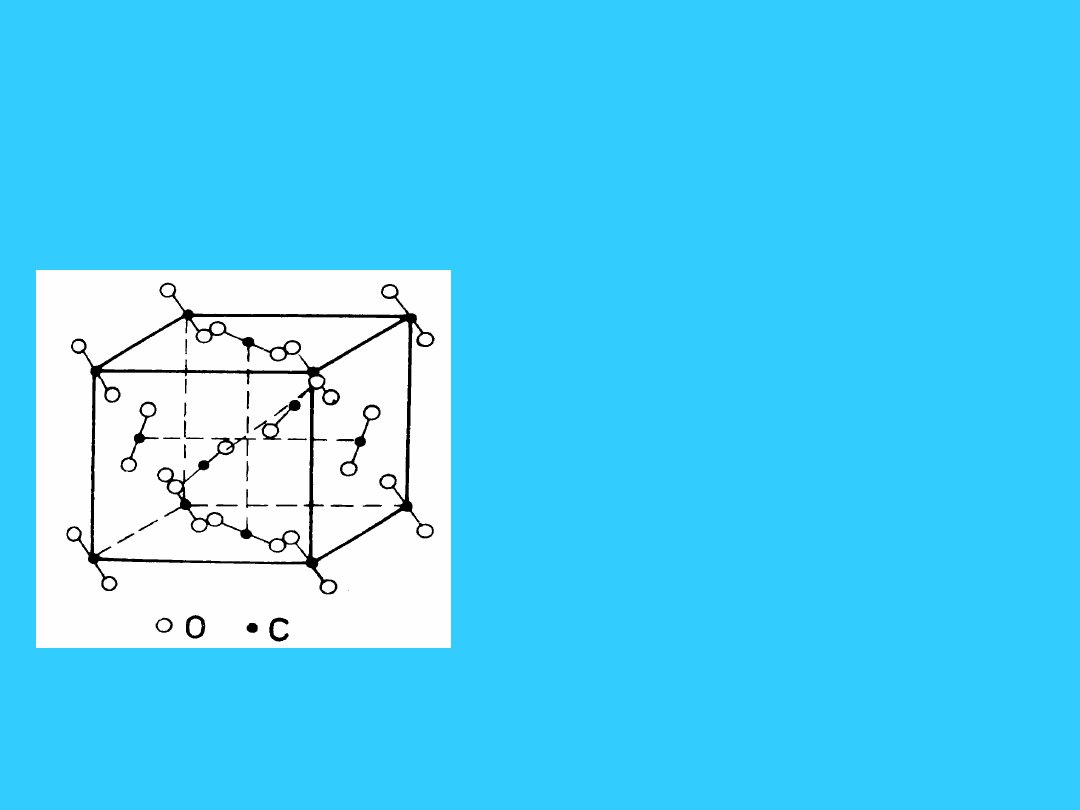
Sieci molekularne
(cząsteczkowe) - Struktura
krystaliczna
stałego CO
2
- sieć typu A
1
• Cząsteczki CO
2
występują:
• a) w narożach sześcianu
• b) w środkach ścian
• Razem 4 cz. CO
2
w
komórce elementarnej

20
20
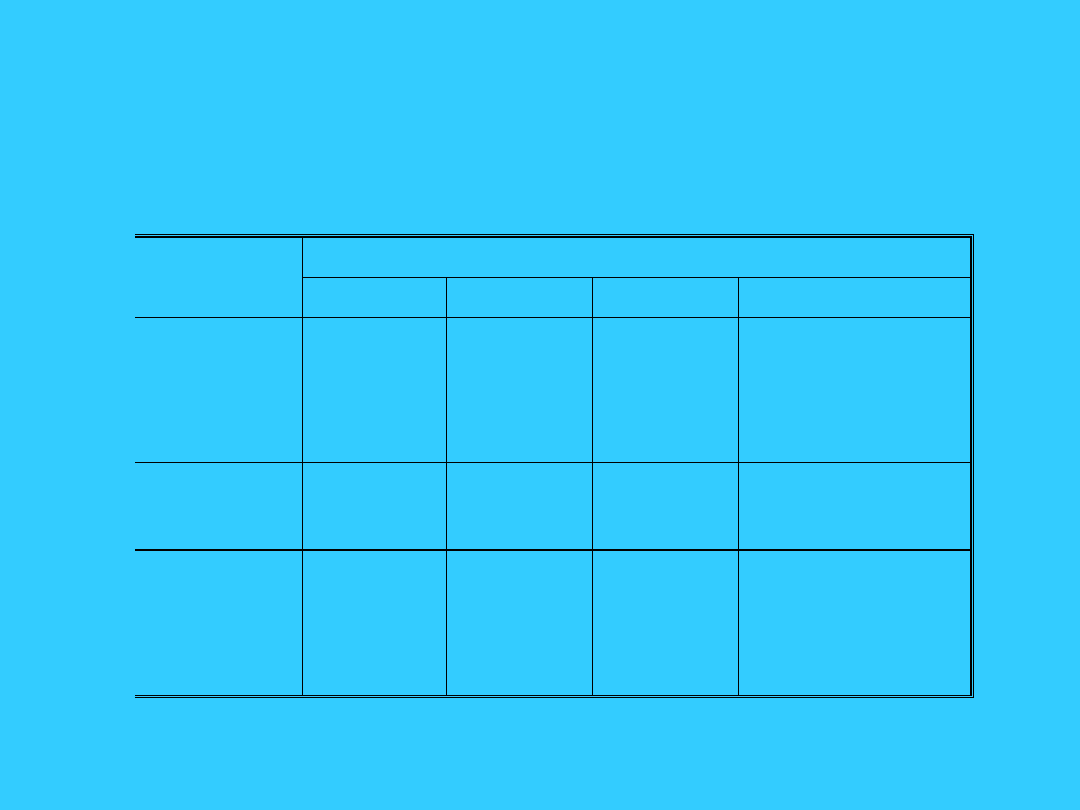
Zestawienie typów sieci
Właściwości fizykochemiczne
kryształów a rodzaj sieci
Kryształy
molekularne
kowalencyjne
jonowe
metaliczne
J ednostki
cząsteczki
atomy
kationy
i aniony
dodatkowo
naładowane
rdzenie atomowe
i swobodne
elektrony
Siły wiążące
Van der
Waalsa
wiązania
kowalencyjne
wiązania
jonowe
oddz. rdzeni
atomowych
z elektronami
Energia
sieciowa,
kJ / mol
He: 2,5
CO
2
: 23,5
H
2
O: 53,5
C (diament):
710
SiO
2
: 1720
NaCl: 770
CaF
2
: 2610
W: 840
Na: 105
Wytrzymałoś
ć
mechaniczna
i twardość
mała,
miękkie
duża,
twarde
duża
zazwyczaj duża,
ciągliwe
Temperatura
topnienia
niska
wysoka
wysoka
zmienia się
w szerokich
granicach
Współczynnik
rozszerzalnoś
ci cieplnej
duży
mały
mały
duży
21
21
Zestawienie typów sieci
Właściwości fizykochemiczne
kryształów a rodzaj sieci
Kryształy
molekularne
kowalencyjne
jonowe
metaliczne
Przewodnictwo
elektryczne w
stanie stałym
małe
(izolatory)
bardzo małe
nie
przewodzą
prądu
w stanie
stałym
(x)
duże
Przewodnictwo
w stanie
stopionym
bardzo
małe
bardzo małe duże
duże
Przykłady
helowce,
H
2
, O
2
,
N
2
,
I
2
,
P
4
, C
60
,
CO
2
, H
2
O
C (diament),
Si, - Sn,
SiC,
SiO
2
NaCl,
CsCl,
KNO
3
,
Na
2
SO
4
Cu, Ag, Au,
W, Mo, Mg

22
22
Defekty struktur
krystalicznych
• Wiele istotnych cech ciał stałych nie da się wytłumaczyć na
podstawie prawidłowości struktury kryształu. Źródłem ich
są odstępstwa budowy kryształu od stanu idealnego, czyli
defekty strukturalne.
• Zaburzenia idealnego stanu sieci krystalicznej, polegające
na drganiach termicznych atomów czy cząsteczek,
nazywamy zakłóceniami energetycznymi. Ten typ zakłóceń
występuje w każdej sieci krystalicznej. Intensywność drgań
zwiększa się ze wzrostem temperatury.
• Drugi rodzaj zaburzeń struktury kryształu stanowią defekty
atomowe, czyli nieprawidłowości w obsadzeniu węzłów sieci
przestrzennej.
Ze względu na układ defektów
atomowych można wyróżnić: defekty
punktowe, liniowe i powierzchniowe.
• W każdej rzeczywistej strukturze wszystkie typy zakłóceń
występują jednocześnie, ale ich nasilenie może być różne i
różny wpływ na właściwości elektryczne, mechaniczne i
optyczne kryształu.

23
23
Defekty punktowe-
Defekty Schottky’ego
• W sieci występuje
równoważna liczba luk
kationowych i
anionowych. Ten
rodzaj defektów
występuje w sieciach
o dużej liczbie
koordynacyjnej i
zbliżonych
promieniach kationów
i anionów.

24
24
Defekty punktowe-
Defekty Frenkla
• Jon w pozycji
międzywęzłowej i
utworzenie
odpowiedniej luki. Z
powodu mniejszego
promienia kationu w
porównaniu z
anionem jest to
najczęściej
kombinacja kationu
międzywęzłowego i
luki anionowej
25
25
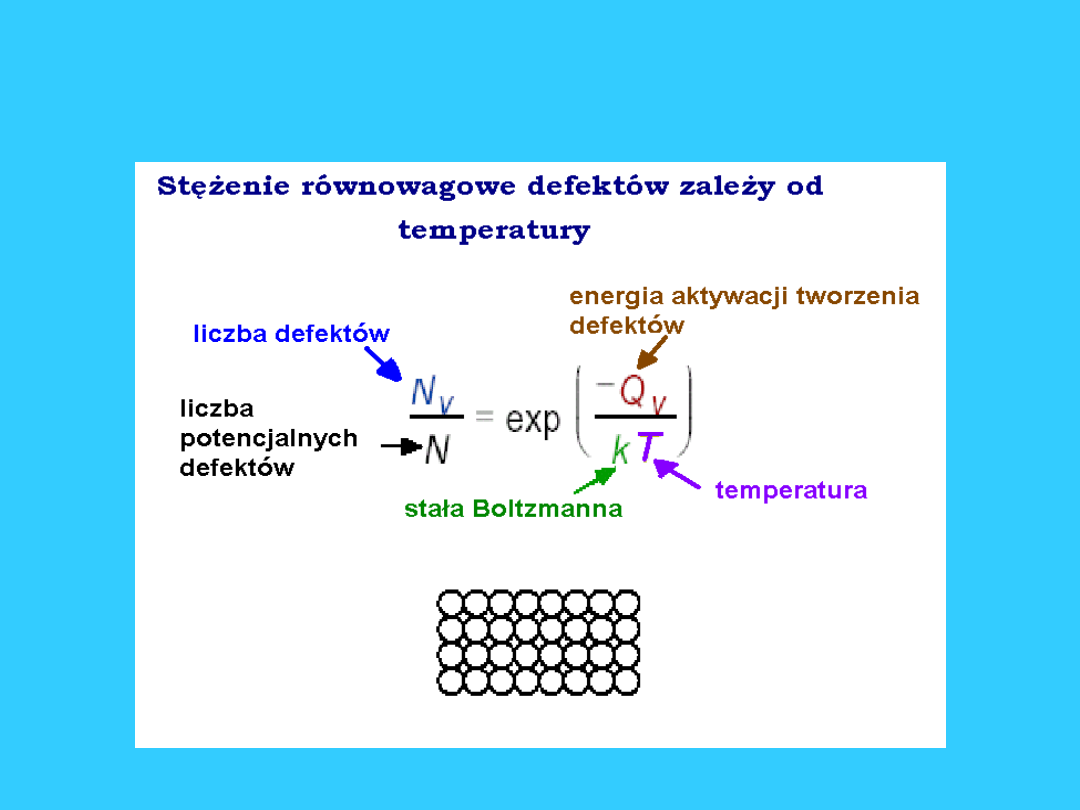
Stężenie defektów
punktowych
26
26
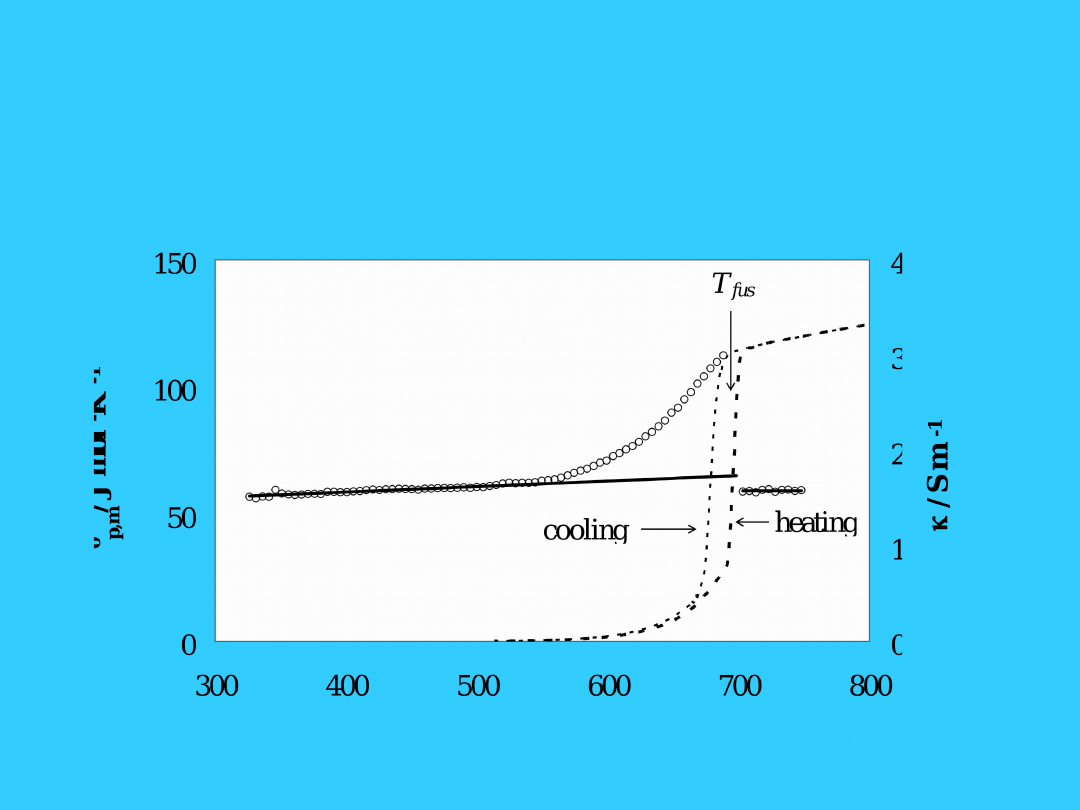
Ciepło molowe i
przewodnictwo
elektryczne stałego AgBr
27
27
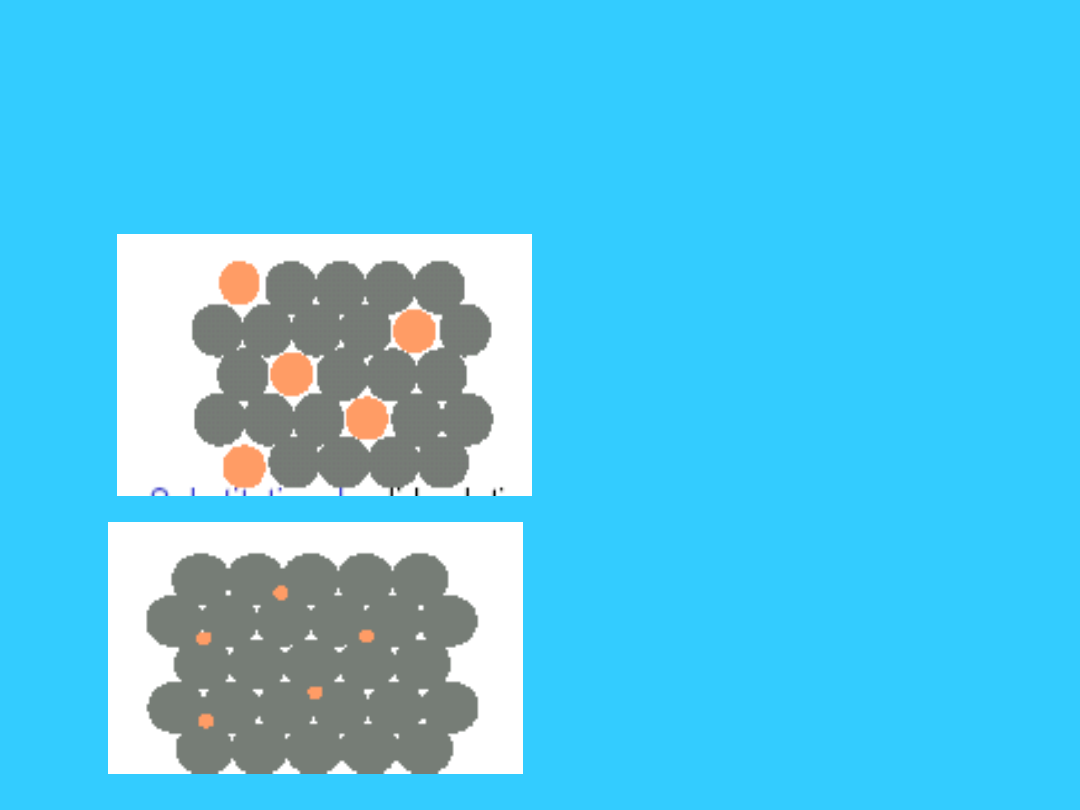
Defekty punktowe
• Defektem punktowym
sieci krystalicznej
może być obcy atom
(zanieczyszczenie)
ulokowany w węźle
sieci (stałe roztwory
substytucyjne) np. Cu
w Ni
• lub w pozycji
międzywęzłowej np.
C w Fe

28
28
Defekty punktowe
• W
luki
sieciowe
mogą
się
wbudowywać elektrony.
• W wyniku oddziaływania pomiędzy
defektami jonowymi i elektronami
mogą powstawać centra barwne. I tak
na przykład obserwuje się zabarwione
kryształy
halogenków
litowców
(niebieska sól kamienna).
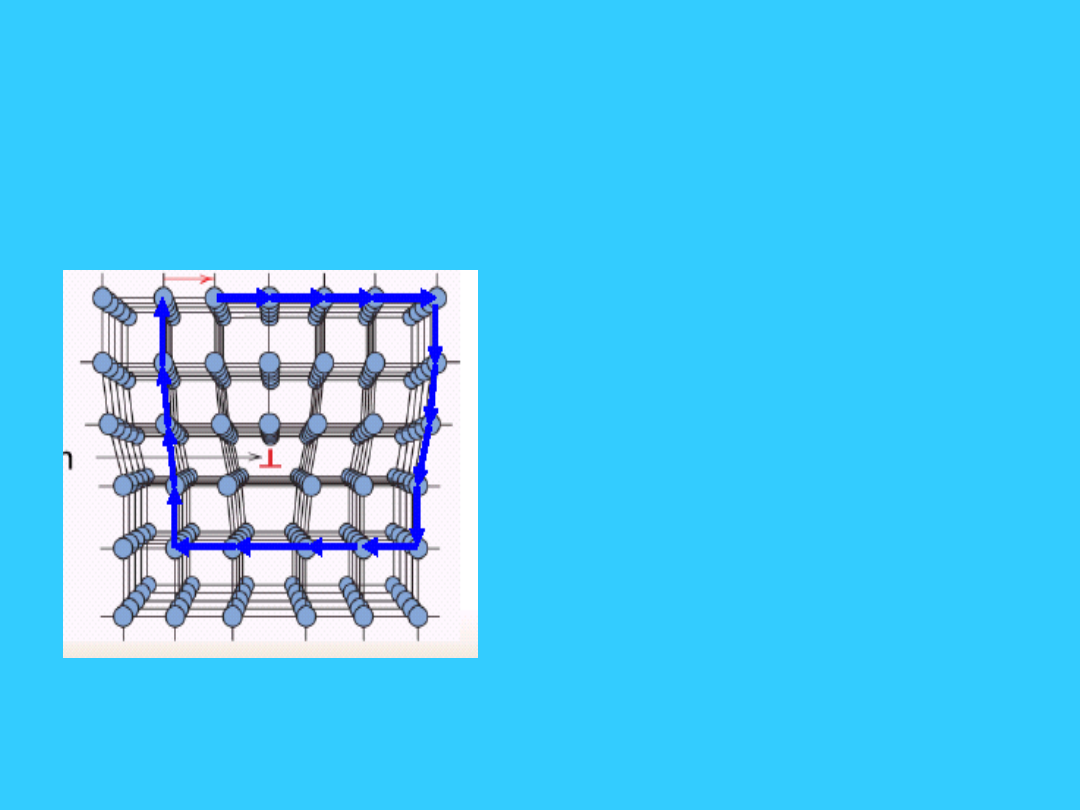
29
29
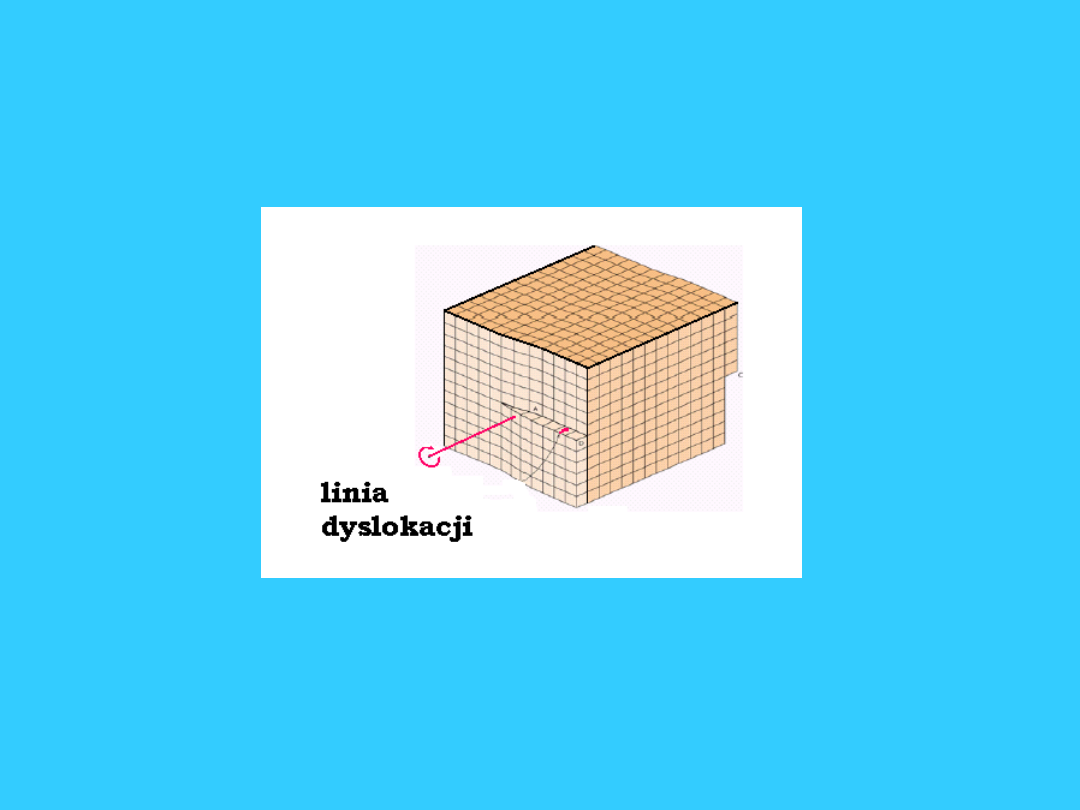
Defekty liniowe
• Dyslokacja
krawędziowa
-
jest wynikiem
obecności wewnątrz
sieci półpłaszczyzny,
czyli płaszczyzny
kończącej się
wewnątrz kryształu.
Krawędź tej
płaszczyzny oznaczona
na rysunku, stanowi
linię dyslokacji, która
jest prostopadła do
rysunku
30
30
Defekty liniowe
• Dyslokacja śrubowa
jest efektem
przemieszczania się części atomów kryształu
względem pozostałych

31
31
Izomorfizm
– Substancje o:
–
tym samym typie wzoru chemicznego,
– tym samym typie sieci,
– takimi samymi lub zbliżonymi rozmiarami komórki sieciowej
nazywamy substancjami izomorficznymi
• Substancje izomorficzne mają :podobne właściwości
chemiczne, poddane współkrystalizacji tworzą roztwory
stałe (kryształy mieszane).
Zjawisko polega na tym, że
w czasie krystalizacji wydzielają się kryształy
homogeniczne składające się z obydwu substancji.
Skład kryształów zależy od składu roztworu.

32
32
Przykłady kryształów
mieszanych
- oliwin
(Mg,Fe)
2
SiO
4
- apatyt
Ca
3
(PO
4
)
2
Ca(F,Cl)
2
w jonowych sieciach
krystalicznych są
na przemian:
Mg
2+
, Fe
2+
- oliwin
F
-
, Cl
-
- apatyt

33
33
Izomorfizm
• Z punktu widzenia wewnętrznej struktury
kryształu tworzenie kryształów mieszanych
polega na tym, że atomy czy jony wykazujące taki
sam ładunek oraz zbliżone wymiary mogą się
wzajemnie zastępować w sieci przestrzennej.
• KCl i KBr mają identyczne sieci przestrzenne i
wykazują zdolność tworzenia stałych roztworów,
gdyż promienie jonów Cl
-
(167 pm) i Br
-
(187 pm)
niezbyt różnią się od siebie.
KCl i KBr są więc
izomorficzne.
• W przypadku KCl i NaCl izomorfizm nie występuje.
Promienie jonu potasu (152 pm) i sodu (116 pm)
wykazują zbyt duże różnice aby jony te mogły
zastępować się w sieci przestrzennej.

34
34
Polimorfizm
• Polimorfizm polega na tym, że jedna i ta sama
substancja chemiczna, zależnie od warunków,
występuje w dwóch (lub więcej) odmianach
różniących się postacią krystaliczną i strukturą sieci
przestrzennej.
• Przykłady :
• 1) ZnS - siarczek cynku:
• wurcyt - heksagonalny, blenda cynkowa - regularny
• 2) CaCO
3
- węglan wapnia:
• kalcyt - heksagonalny │ aragonit - rombowy
• Dla
pierwiastków
posługujemy
się
terminem
ALOTROPIA
• Węgiel : diament, grafit, fullereny
• Tlen : tlen(O
2
) i ozon (O
3
)

35
35
Związki
niestechiometryczne
• Prawo stosunków stałych, Proust (1799):
– Każdy związek chemiczny ma stały i
niezmienny skład ilościowy (np. CO
2
, H
2
O).
• Dzisiaj prawo to nadal obowiązuje dla substancji
ciekłych lub gazowych. Ale dla substancji w
stanie stałym są pewne odstępstwa. Dotyczy to
związków chemicznych, w sieci których nie można
wyodrębnić oddzielnych cząsteczek.
• Dla przykładu uzyskano tlenki tytanu o składzie :
•
od TiO
0,716
do TiO
1,250
• przy czym wszystkie mają strukturę NaCl.

36
36
Związki
niestechiometryczne
• Są to związki o składzie
niestechiometrycznym.
• Tego typu związki tworzą pierwiastki
d-elektronowe z tlenowcami.
• Przyczyna - kryształy rzeczywiste
różnią się od idealnych (tj.
• doskonale uporządkowanych)
zaburzeniami, tj. defektami sieci.

37
37
Daltonidy, bertolidy
• Fe
0,93
O
1,00
- jest to związek
niestechiometryczny?. Możemy to inaczej
zapisać jako Fe
93
O
100
. Uwzględniając obecność
w tym związku jonów Fe
3+
można napisać:
Fe
79II
Fe
14III
O
100
• Suma dodatnich stopni utlenienia Żelazo:
(79 x 2 + 14 x 3) = 200
• Suma ujemnych stopni utlenienia Tlen:
100 x 2 = 200
• Jest to skład stechiometryczny. Nie jest więc
uzasadnione wiązanie stechiometrii tylko z
liczbami całkowitymi.

38
38
Daltonidy, bertolidy
• Unikamy określenia związek
niestechiometryczny, zastępując
go terminem BERTOLID.
• DALTONID-y
odpowiadają
zwykłym związkom chemicznym,
a ich
skład
można
wyrazić
używając
niewielkich
liczb
całkowitych (np. CO
2
).
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
Wyszukiwarka
Podobne podstrony:
4. Budowa ciala stałego, pwr biotechnologia(I stopień), II semestr, Chemia nieorganiczna, Wykłady Ap
4 Budowa ciala stalego id 3714 Nieznany
Budowa ciała stałego
Budowa ciała stałego 2
4 Budowa ciala stalego id 3714 Nieznany
Budowa ciała stałego 2
Leszek wyklad9 teoria pasmowa ciala stalego
Wykład 5. Teoria pasmowa ciała stałego
Fizyka ciała stałego, STUDIA, SEMESTR I, Mechanika, Mechanika Wyklady, Mechanika net
więcej podobnych podstron