Odpowiedź
nieswoista
Seminarium 5
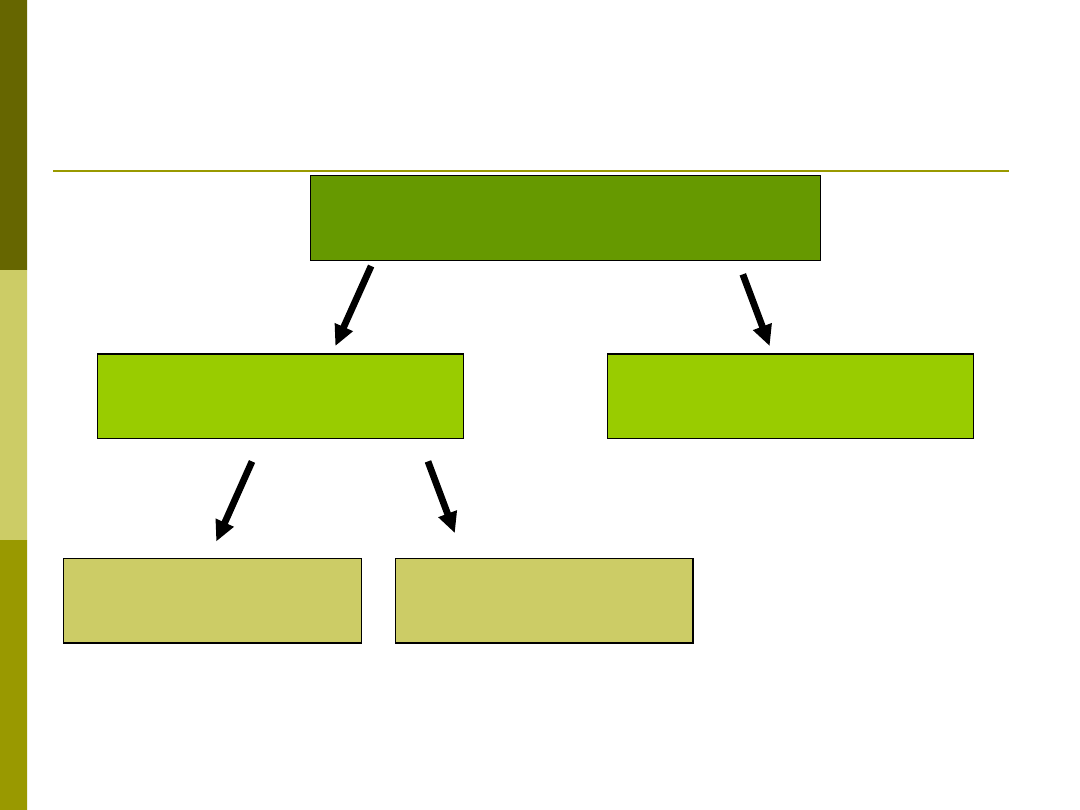
ODPORNOŚĆ
swoista
komórkowa
humoralna
nieswoista

Odporność nieswoista

Współdziałanie odpowiedzi
swoistej i nieswoistej
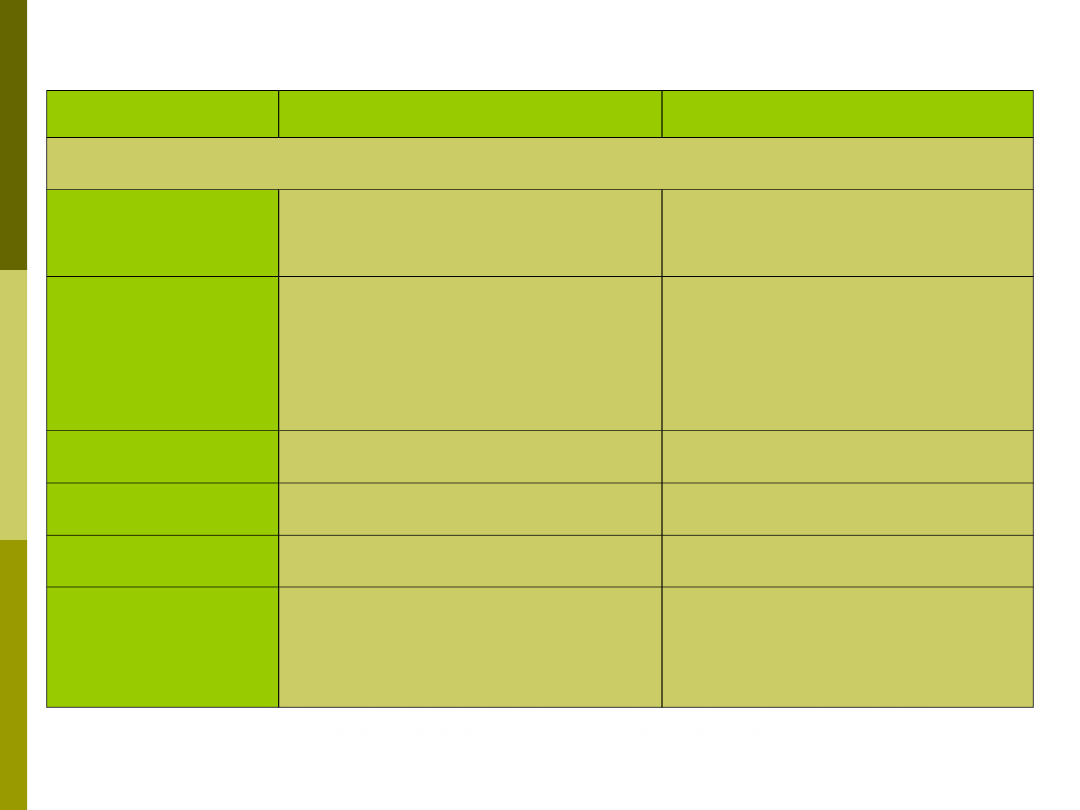
Odpowiedź
NIESWOISTA
SWOISTA
Cechy charakterystyczne:
Specyficzność
Dla struktur charakterystycznych
dla grupy organizmów
Dla antygenów
(mikroorganizmów i in.)
Zróżnicowanie
Ograniczone
Szerokie (mutacje somatyczne,
rekombinacje, zmienność na
złączach; wielość genów dla
Ig i TCR)
Pamięć
Nie
Tak
Autotolerancja
Tak
Tak
Czas aktywacji
Szybko (godziny od ekspozycji)
Wolno (dni od ekspozycji)
Genetyka
Całkowicie dziedziczona (nie
zmienia się w trakcie życia)
Nabywana w trakcie życia i
kolejnych ekspozycji na
antygeny
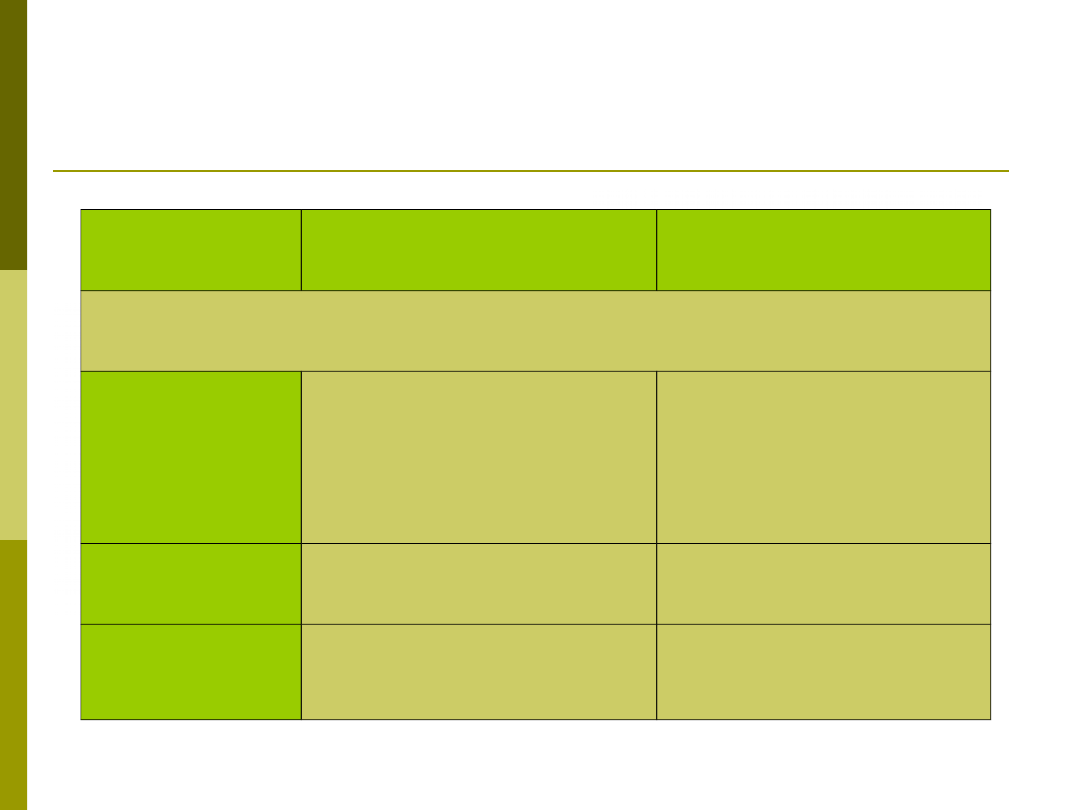
Odpowiedź
NIESWOISTA
SWOISTA
Składniki:
Bariery
fizyczne i
chemiczn
e
Skóra, błony śluzowe,
związki
bakteriobójcze
Limfocyty w
nabłonkach,
przeciwciała (gł.
IgA)
Białka krwi
Dopełniacz
Przeciwciała
Komórki
NK, makrofagi,
neutrofile
Limfocyty

Jak rozpoznać wroga?

Jak rozpoznać wroga?

Jak rozpoznać wroga? –
problemy
Większość drobnoustrojów mutuje
z nieporównywalnie większą
częstością niż komórki
kręgowców
Niektóre cząsteczki krytyczne dla
przeżycia drobnoustrojów nie
mogą się jednak zbyt drastycznie
zmieniać w wyniku mutacji, gdyż
zmiany te mogłyby okazać się
letalne

Jak rozpoznać wroga?

Wzorce molekularne związane
z patogenami – PAMP
Najbardziej charakterystyczne cząsteczki
drobnoustrojów, selektywnie
rozpoznawane przez komórki odpowiedzi
nieswoistej, określane są jako
wzorce
molekularne związane z patogenami –
PAMP
przykłady: LPS, mannany, kwas
tejchojowy, dwuniciowe RNA

Receptory rozpoznające
wzorce - PRR
Najogólniej receptory PRR
można podzielić na trzy
grupy:
receptory wydzielane
(lektyny np. MBL, opsoniny
np. CRP)
receptory powierzchniowe
(gł. udział w fagocytozie;
np. receptory zmiatacze,
receptory lektynowe)
receptory
wewnątrzkomórkowe (TLR,
aktywacja komórek)

Fagocytoza bakterii

Mechanizmy zabijania w
fagosomie

TLR poznano podczas badań
nad Drosophila Melanogaster

Ekspresja TLR na komórkach
Specyficzność TLR

Specyficzność TLR

Komórka tuczna
głównym zadaniem komórek
tucznych jest amplifikacja
wszelkich wstępnych sygnałów
informujących o inwazji
drobnoustrojów
powierzchnia komórek tucznych
„najeżona” jest receptorami TLR,
wśród których można znaleźć:
TLR 2, 4, 6 i 8

Rola komórki tucznej w
zapoczątkowaniu procesu zapalnego

Udział
komórki
tucznej
w
zapaleni
u
Układ dopełniacza

Co to jest układ
dopełniacza?
Jules Bordet (koniec XIX w.) odkrył, że:
osocze owcy immunizowanej przecinkowcem
cholery (V. cholerae) powoduje lizę bakterii
po podgrzaniu osocza traci ono opisaną
właściwość
Dodanie do inaktywowanego osocza
dodatkowej porcji osocza owcy
nieimmunizowanej przeciwko V. cholerae
przywracało utracone właściwości

Wnioski z doświadczeń
Bordeta
Zdolność lityczna osocza jest zależna od dwóch
substancji:
opornych na ogrzewanie
przeciwciał
– które
rozpoznają antygeny bakterii
dodatkowych białek
inaktywowanych wysoką
temperaturą, które wykazują właściwości lityczne
wobec „wyznakowanych” przeciwciałami
drobnoustrojów

Układ dopełniacza

Układ dopełniacza (komplementu)
należy
do odporności nieswoistej
, gdyż sam
nie rozpoznaje precyzyjnie antygenów i
aktywowany jest, przynajmniej w
klasycznej drodze aktywacji, przez
przeciwciała.
Jest to jeden z przykładów ścisłych
powiązań między swoistymi i
nieswoistymi mechanizmami
odporności
.

Filogenetycznie układ dopełniacza wraz z komórkami
żernymi należy do
najstarszych mechanizmów
nieswoistej odporności
przeciw mikroorganizmom.

Składniki układu
dopełniacza
układ składa się z ok. 35 białek
rozpuszczalnych i błonowych
sytnetyzowane gł. w wątrobie
, ale także przez
monocyty/makrofagi i komórki nabłonka układów
pokarmowego i moczowo-płciowego, adipocyty, astrocyty,
komórki błony maziowej i in.
wydzielane w postaci proenzymów
aktywowanych następnie wg określonej
kolejności w „łańcuchowej reakcji
aktywacji”

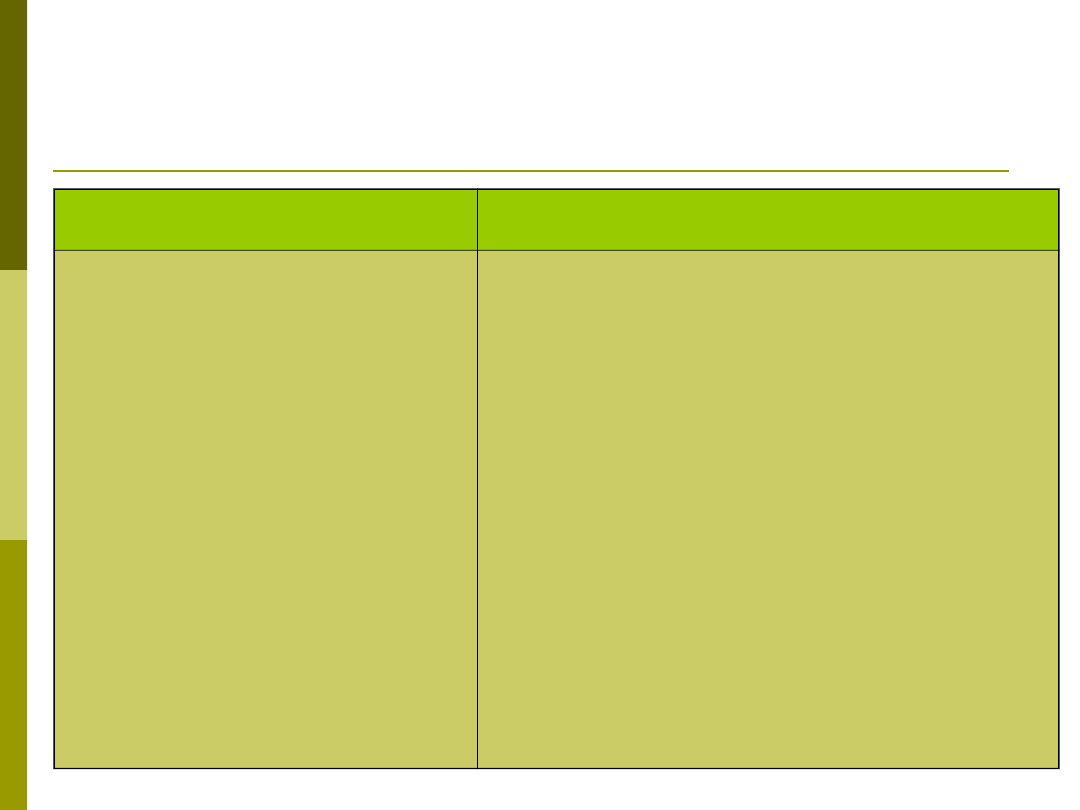
Funkcje układu dopełniacza
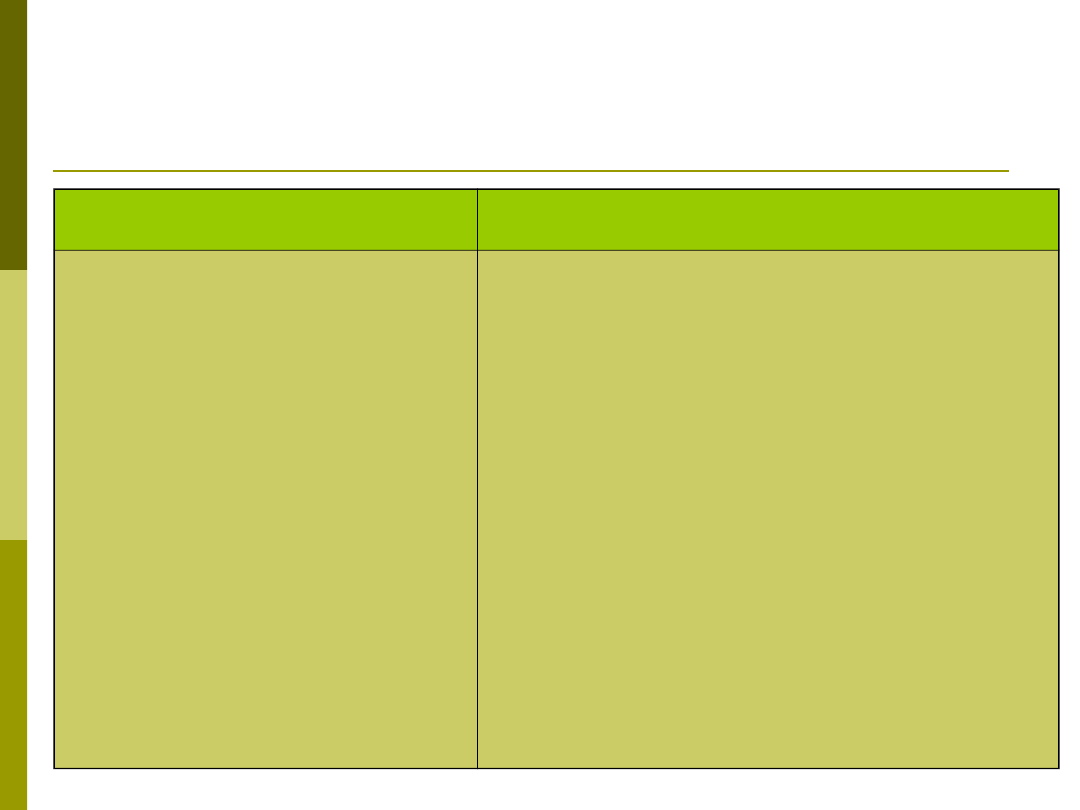
Funkcje układu dopełniacza
Funkcja
Składniki dopełniacza
Opsonizacja
Chemotaksja i aktywacja
leukocytów
Wzmaganie odpowiedzi
humoralnej
Rozwój pamięci
immunologicznej
Usuwanie kompleksów
immunologicznych i komórek
apoptotycznych
C3 i C4
C5a, C3a, C4a
C3b i C4b połączone kompleksem
antygen-przeciwciało wiązane przez
receptory CR2 na limfocytach B
C3b i C4b połączone kompleksem
antygen-przeciwciało wiązane przez
receptory CR2 i CR3 na komórkach
dendrytycznych grudek
C1q i fragmenty składników C3 i C4
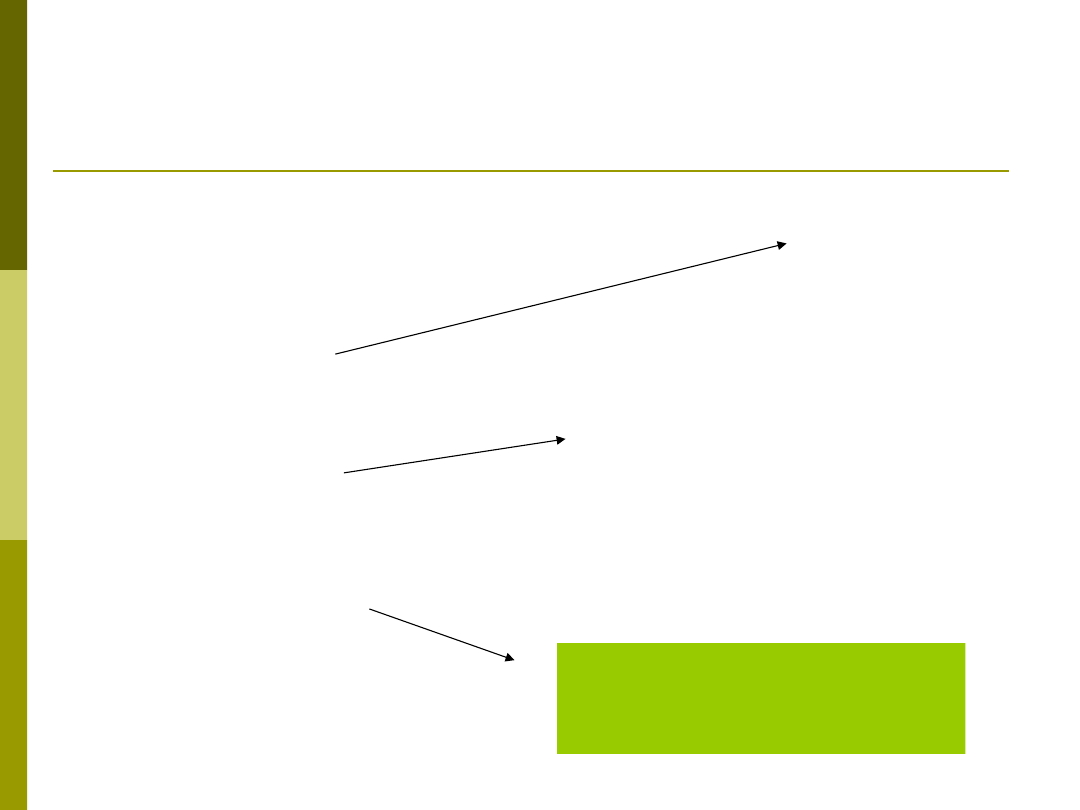
Drogi aktywacji dopełniacza
Istnieją trzy drogi
aktywacji dopełniacza:
klasyczna
lektynowa
alternatywna
SAMOISTNIE
(przy braku inhibitorów)
Aktywacja
dopełniacza drogą
klasyczną
aktywacja przy pomocy
przeciwciał

Przeciwciała
potrafią precyzyjnie
rozpoznać antygeny obecne na
powierzchni intruzów, same nie są jednak
w stanie ich zniszczyć.
Ta druga rola przypada różnym czynnikom
nieswoistym, np.
dopełniaczowi lub
komórkom żernym

IgM

Struktura kompleksu C1

Struktura kompleksu C1
C1q składa się z 6 identycznych
podjednostek, w których można
wyróżnić główkę i
kolagenopodobny ogonek.
C1q łączy się główkami z
przeciwciałem związanym z
antygenem, ulegając zmianom
konformacyjnym
Wiązanie C1q z jedną
cząsteczką IgG jest słabe, a
wiązanie kilku IgG i
wykorzystanie 2 lub więcej
"tulipanowych" główek C1q
znacznie zwiększa siłę wiązania
wyzwalając proces aktywacji
dopełniacza.

C1q przyłącza się do
przeciwciała związanego z
antygenem
↓
Zmiana konformacji C1q
indukuje zmianę konformacji
C1r (aktywacja proteazy Ser)
↓
C1r aktywuje C1s

C1s rozkłada
C4
na C4a i C4b
oraz
C2
na C2a i
C2b
↓
C4b wiąże się z
C1, a C2a z C4b
↓
powstaje
konwertaza C3
drogi
klasycznej
(kompleks
C4b2a)

konwertaza C3 rozkłada C3
na C3a i C3b
↓
C3b
przyłącza się do C4b2a
tworząc
konwertazę C5
(C4b2a3b)

C3b pozwala na przyłączenie
C5 do kompleksu C4b2a3b
↓
C4b2a rozkłada C5 na C5a i
C5b

C5b przyłącza
fragment C6 inicjując
przyłączenie kolejnych
fragmentów
dopełniacza (
C6, C7,
C8
) i powstanie
kompleksu
akatującego błonę
zawierającego
polyC9

Droga klasyczna
Droga
lektynowa
Droga
alternatywna

Lityczna funkcja układu
dopełniacza
Regulacja układu
dopełniacza

Regulacja układu
dopełniacza
Zabezpieczenie przed działaniem
dopełniacza obejmuje:
zdolność niektórych składników dopełniacza do
spontanicznego rozkładu
, np.:
T
½
konwertaz C3 i C5 drogi klasycznej = ok. 5 minut
T
1/2
konwertaz C3 i C5 drogi alternatywnej = ok. 12
minut
czynne mechanizmy dezaktywacji

Czynne mechanizmy
dezaktywacji dopełniacza
mechanizmy i czynniki regulujące można
podzielić na
związane z błonami komórkowymi (np. DAF,
MCP, protektyna, CR1)
działające w płynach tkankowych, głównie w
osoczu (czynnik I, czynnik H, C1Inh, C4BP)
Inne właściwości
układu dopełniacza
Funkcje układu dopełniacza
Funkcja
Składniki dopełniacza
Opsonizacja
Chemotaksja i aktywacja
leukocytów
Wzmaganie odpowiedzi
humoralnej
Rozwój pamięci
immunologicznej
Usuwanie kompleksów
immunologicznych i komórek
apoptotycznych
C3 i C4
C5a, C3a, C4a
C3b i C4b połączone kompleksem
antygen-przeciwciało wiązane przez
receptory CR2 na limfocytach B
C3b i C4b połączone kompleksem
antygen-przeciwciało wiązane przez
receptory CR2 i CR3 na komórkach
dendrytycznych grudek
C1q i fragmenty składników C3 i C4

Anafilatoksyny
Składniki dopełniacza
C3a, C4a i C5a
nazywane
są anafilatoksynami ze względu na następujące
właściwości:
chemotaksja monocytów i netutrofili
degranulacja komórek tucznych i bazofilów (uwalnianie z
nich preformowanych mediatorów anafilaksji)
stymulacja syntezy metabolitów kwasu arachidonowego
w wielu komórkach, (np. leukotrienów w komórkach
tucznych, makrofagach i neutrofilach)
obkurczanie mięśniówki gładkiej (naczyń, oskrzeli)

Opsonizacja i aktywacja
fagocytozy

Usuwanie kompleksów
immunologicznych
Cytotoksyczność
komórkowa

Cytotoksyczność limfocytów
Mechanizmy cytotoksyczności limfocytów
odgrywają główną rolę w odpowiedzi
immunologicznej przeciwko
patogenom
wewnątrzkomórkowym
. Mogą również
uczestniczyć w niszczeniu
komórek
nowotworowych
oraz
komórek
allogenicznego przeszczepu
.

Infekcja wirusowa – etapy
odpowiedzi
Cytotoksyczność
komórkowa
cytotoksyczność
naturalna
ADCC

Cytotoksyczność limfocytów
Dwa podstawowe mechanizmy
cytotoksyczności komórkowej
wykorzystywane przez limfocyty to:
mechanizm związany
z uwolnieniem zawartości
cytoplazmatycznych ziaren
, określanych jako
ziarna cytolityczne
mechanizm związany z
aktywacją receptorów
dla cząsteczek nadrodziny TNF
obecnych na
komórkach docelowych;

Komórka NK
są limfocytami mającymi
właściwości
spontanicznego (bez
uprzedniej immunizacji)
zabijania komórek
docelowych
(niektóre komórki
nowotworowe i komórki
zakażone wirusem)

Mechanizmy zabijania przez
komórki NK
zawartość ziarnistości: perforyna, proteazy
serynowe - określane jako granzymy, granulizyna
oraz białko TIA-1
Fas-L i TRAIL

Cytotoksyczność naturalna
komórek NK
regulowany jest przez dwa
rodzaje przeciwstawnych
sygnałów: aktywujące i
hamujące, przekazywane
przez odpowiednie receptory
znajdujące się na powierzchni
tych komórek
za pośrednictwem receptorów
aktywujących wyzwalane są
mechanizmy lityczne
prowadzące do śmierci
komórki docelowej
interakcja receptorów
hamujących z odpowiednimi
cząsteczkami na komórce
docelowej prowadzi natomiast
do blokowania reakcji
cytotoksycznej

Sygnały aktywujące i
hamujące
w zależności od
tego, które z
sygnałów
przeważają,
komórka
docelowa jest
eliminowana lub
oszczędzana

Jak komórka NK „namierza
cel”?

Receptory KIR
rozpoznają epitopy w
łańcuchu α
klasycznych
cząsteczek MHC klasy
I (krytyczne dla
rozpoznania są
aminokwasy w pozycji
77 i 80)

Tc i komórka docelowa –
formowanie litycznej synapsy
immunologicznej

Polaryzacja i tworzenie
synapsy litycznej

Ziarna cytolityczne Tc
Czynnik
Mechanizm działania
perforyna
granzymy
granulizyna
enzymy
lizosomalne
TIA-1 (GMP-17)
tworzenie porów w błonie komórkowej,
współuczestniczenie w apoptozie
proteoliza białek cytoplazmy i białek jądrowych,
indukcja apoptozy
uszkadzanie błon komórkowych, indukcja apoptozy
proteoliza białek cytoplazmy i białek jądrowych,
uczynnianie granzymów (katepsyna C) indukcja
apoptozy
stymulacja degradacji DNA

Perforyny

Pory w błonie komórkowej
(polimeryzacja perforyn)

Ziarna cytolityczne Tc
Czynnik
Mechanizm działania
perforyna
granzymy
granulizyna
enzymy
lizosomalne
TIA-1 (GMP-17)
tworzenie porów w błonie komórkowej,
współuczestniczenie w apoptozie
proteoliza białek cytoplazmy i białek jądrowych,
indukcja apoptozy
uszkadzanie błon komórkowych, indukcja apoptozy
proteoliza białek cytoplazmy i białek jądrowych,
uczynnianie granzymów (katepsyna C) indukcja
apoptozy
stymulacja degradacji DNA

Limfocyty cytotoksyczne
formowanie
synapsy litycznej
polaryzacja Tc
degranulacja
recyrkulacja

Mechanizmy
cytotoksycznoś
ci zależne od
białek z
rodziny TNF

Fas i FasL

Aktywacja apoptozy przez receptor z
grupy TNFR
Przyłączenie ligandu

Aktywacja apoptozy przez receptor z
grupy TNFR
Trimeryzacja

Aktywacja apoptozy przez receptor z
grupy TNFR
Transdukcja
sygnału i
aktywacja
białek
efektorowych
apoptozy

Procesy szlaku indukcji
apoptozy

ADCC
(zależna od przeciwciał cytotoksyczność
komórkowa)

ADCC

Apoptoza

Interferony
typu I - IFN-α,
IFN-β
typu II - IFN-γ
IL-28, IL-29 (IFN-
λ)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
Wyszukiwarka
Podobne podstrony:
Seminarium 5 Odpowiedz nieswoista FARMACJA
Seminarium 6 Immunologia transplantacyjna farmacja 2
ODPOWIEDZIALNOSC PRAWNA, Farmacja, Kwalifikowana pierwsza pomoc
SEMINARIUM 1 Z FARMAKOGNOZJI, materiały farmacja, Materiały 3 rok, Od Ani, Farmakognozja, Farmakogno
seminaria program, Płyta farmacja Poznań, III rok, Biologia molekularna
SEMINARIUM II, materiały farmacja, Materiały 3 rok, mat 3 rok, Biochemia
Odpowiedź nieswoista 2
Seminarium 6 Immunologia transplantacyjna farmacja 2
odpowiedź nieswoista
seminaria biol mol onkogeneza, Płyta farmacja Poznań, III rok, Biologia molekularna, 2009, sem 6
kolo 1 podzial, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, kolokwiaa, kolo 1
pytania leki 3 kolo sem 914, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, kolokwiaa, kol
Farmakoekonomika Seminarium 1, Płyta farmacja Poznań, V rok, Farmakoekonomika, koło 1, ekonomika
text prezentacji, Płyta farmacja Poznań, III rok, Chemia leków, seminaria, seminaria mix
semquiz 12-5a, farmacja I i II, chemia organiczna, seminaria
nieswoiste zapalenia jelit, SEMINARIUM NIESWOISTE ZAPALENIA JELIT
więcej podobnych podstron