
Wykład 3
Wykład 3
STANY SKUPIENIA
MATERII

Stan gazowy
Stan gazowy
Faza gazowa przyjmuje
kształt pojemnika w
którym się znajduje
Właściwości fizyczne
gazu słabo zależą od
rodzaju gazu
Stan gazowy opisują
prawa gazowe

Prawa gazowe
A. Równania stanu gazu
doskonałego
pv=nRT
p - ciśnienie
v - objętość
n - liczność (liczba moli)
R - stała gazowa
T - temperatura
Przypadki szczególne:
prawo Boyle’a-Mariotte’a, Gay-
Lussaca

B. Równanie gazu
rzeczywistego
nRT
nb)
)(v
v
an
(p
2
a - stała charakteryzująca oddziaływania van
der Waalsa
b -stała charakteryzująca objętość własną
molekul gazowych
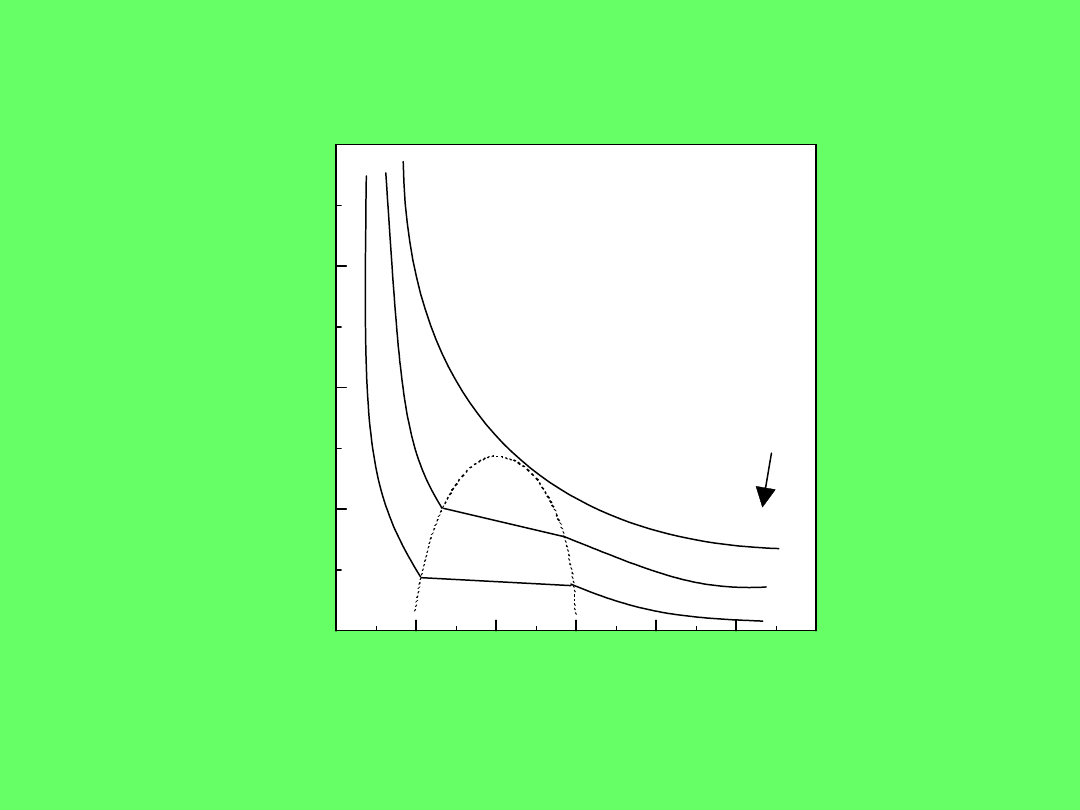
0
100
200
300
400
500
600
0.0x10
00
4.0x10
06
8.0x10
06
1.2x10
07
1.6x10
07
273K
293K
304K
temp. krytyczna
CO
2
p, N/m
2
V, cm
3
/mol

Stan ciekły
Stan ciekły
-stan pośredni między stanem stałym a
gazowym
-brak równania (typu van der Waalsa)
opisującego ciecze
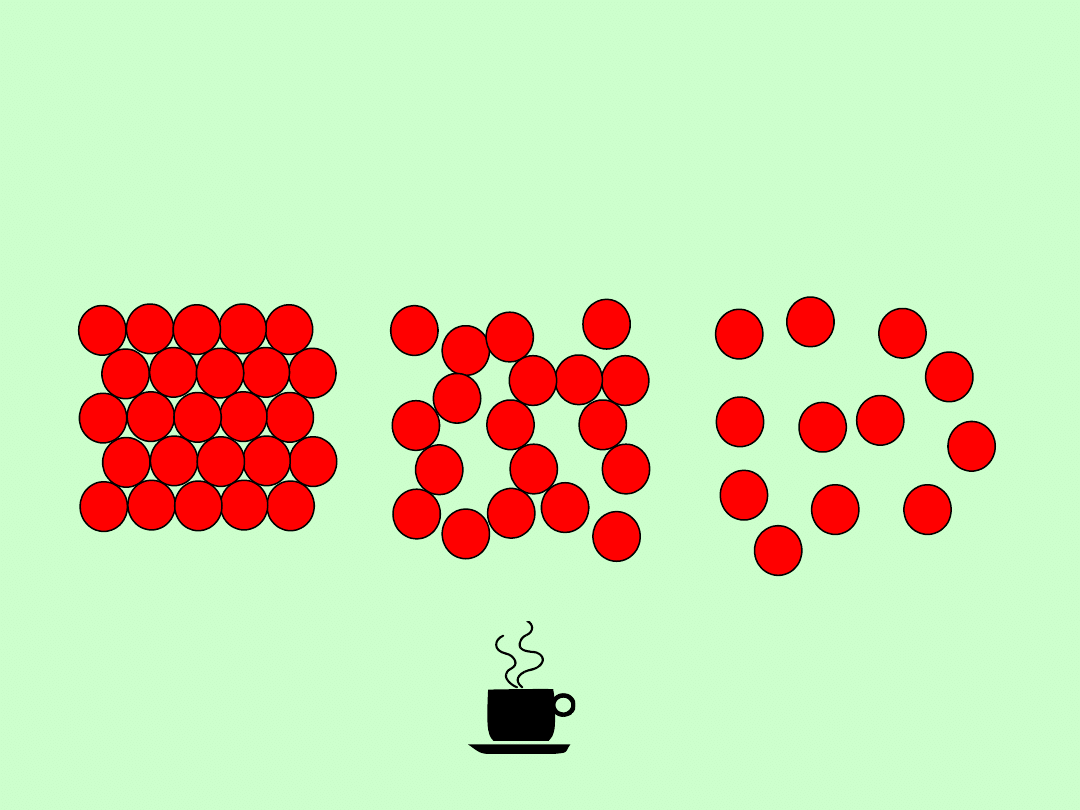
Stan ciekły
Stan ciekły
ciało stałe
ciecz
gaz
Stan stały
Stan stały
-sprężystość
-kształt geometryczny
-prawidłowa budowa
wewnętrzna
Podział:
-kryształy
-ciekłe
kryształy
-szkła
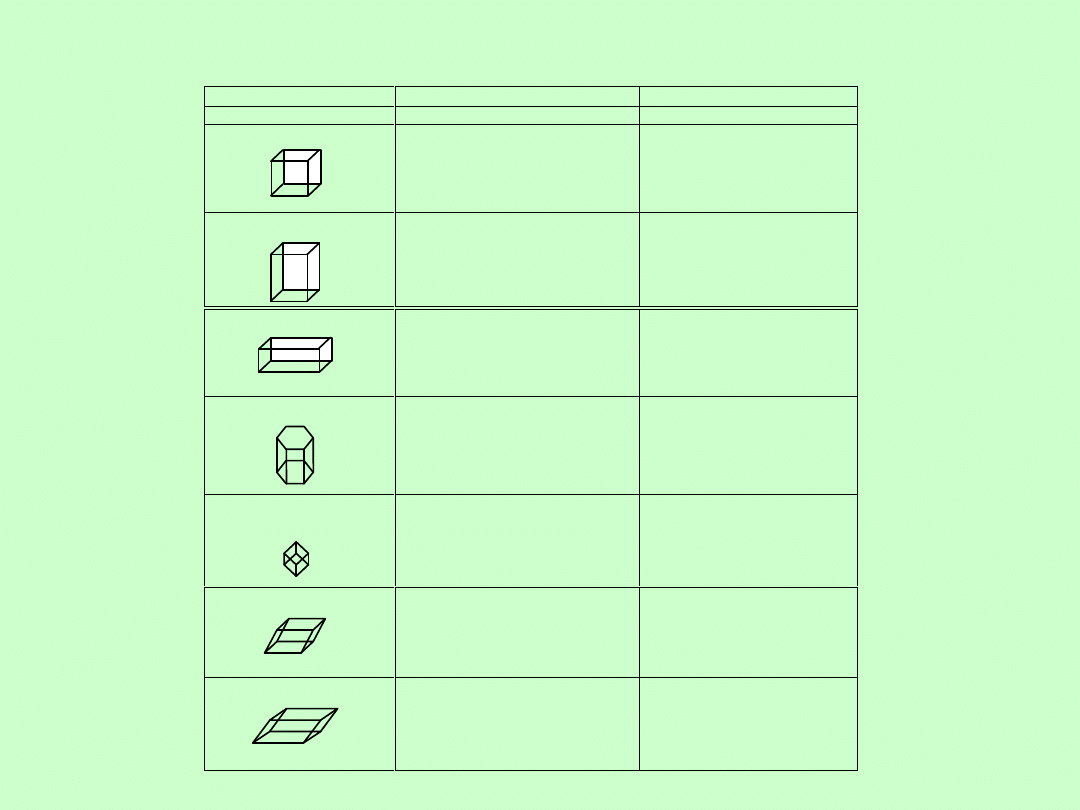
Tabela 1.1. Krystalograficzna klasyfikacja krystalicznych ciał stałych
Układ
Kształt komórki elementarnej
Minerały
1
2
3
1. Regularny (C
)
sześcian
a = b = c
=
=
= 90
o
halit (NaCl)
galena (PbS)
fluoryt (CaF
2
)
sfaleryt (ZnS)
2. Tetragonalny (Q)
prostopadłościan
o podstawie kwadratowej
a = b c
=
=
= 90
o
rutyl (TiO
2
)
cyrkon (ZrSiO
4
)
hausmanit (Mn
3
O
4
)
kasyteryt (SnO
2
)
3. Rombowy (O)
prostopadłościan
o podstawie prostokątnej
a b c
=
=
= 90
o
siarka (S)
baryt (BaSO
4
)
stybnit (Sb
2
S
3
)
anhydryt (CaSO
4
)
4. Heksagonalny (H)
prostopadłościan
o podstawie romboidalnej
a = b c
=
= 90
o
,
= 120
o
grafit (C)
wurcyt (ZnS)
korund (Al
2
O
3
)
kowelin (CuS)
5. Trygonalny (T
)
(romboedryczny)
romboedr
a = b = c
=
=
90
o
-kwarc (SiO
2
)
kalcyt (CaCO
3
)
dolomit (MgCa(CO
3
)
2
)
hematyt (Fe
3
O
4
)
6. Jednoskośny (M)
równoległościan
a b c
=
= 90
o
,
120
o
arsenopiryt (FeSAs)
gips (CaSO
4
·2H
2
O)
kryolit (Na
3
AlF
6
)
diopsyd (CaMgSi
2
O
6
)
7. Trójskośny (A)
równoległościan
a b c
90
o
albit (NaAlSi
3
O
8
)
mikroklin (KAlSi
3
O
8
)
anortyt (CaAl
2
Si
2
O
8
)
kaolinit (Al
4
Si
4
O
10
(OH)
8
)
Substancje krystaliczne
Ciekłe kryształy
Szkł
a
struktura szkła kwarcowego
Szkłotwórcze tlenki: SiO
2
, GeO
2
, B
2
O
3
, P
2
O
5
, As
2
O
5,
V
2
O
5
, Sb
2
O
5

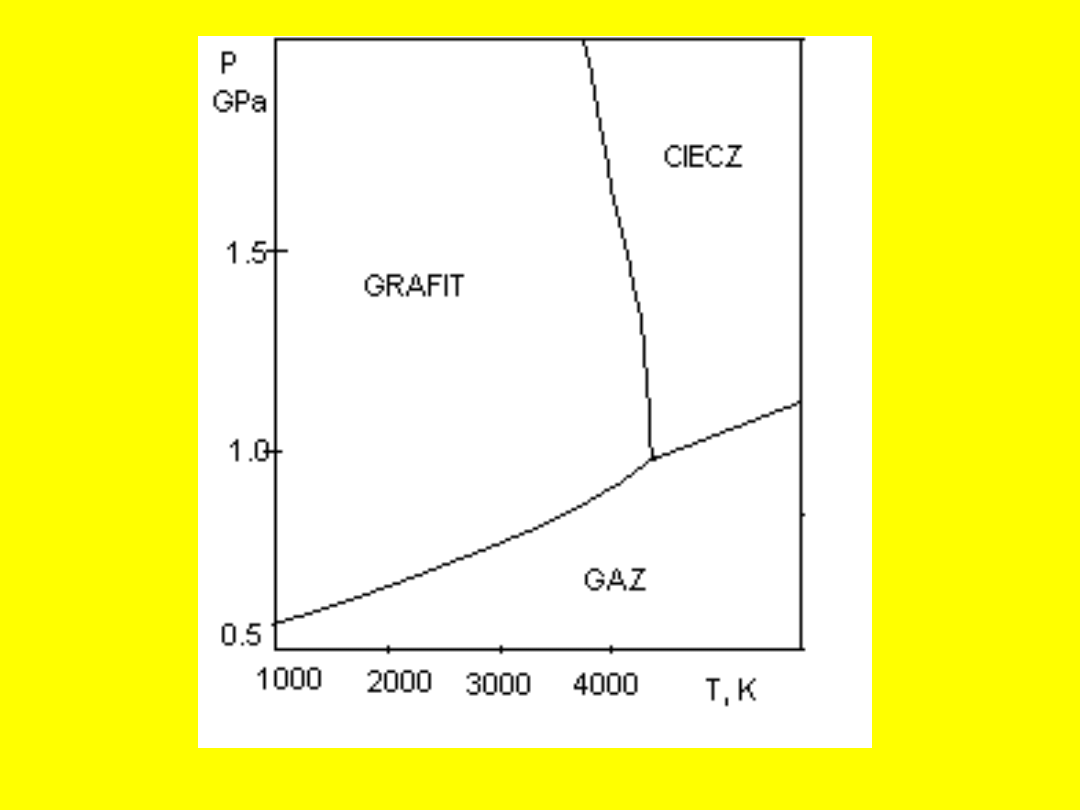
Przemiany fazowe
:
zmiany stanu skupienia materii lub zmiany
struktury
FAZA
: jednolita część układu o
jednakowych właściwościach fizycznych w
całej masie, oddzielonych od reszty
układu wyraźną powierzchnią graniczną
UKŁADY FAZOWE
- podstawowe
pojęcia
Odmiany alotropowe
: odmiany
pierwiastka różniące się budową
cząsteczki lub strukturą sieci
Odmiany polimorficzne
: odmiany zw.
chemicznego rózniące się budową
sieci krystalicznej

Reguła faz Gibbsa
s = n - f + 2
s - liczba stopni swobody
f - liczba faz
n - liczba niezależnych składników
układu
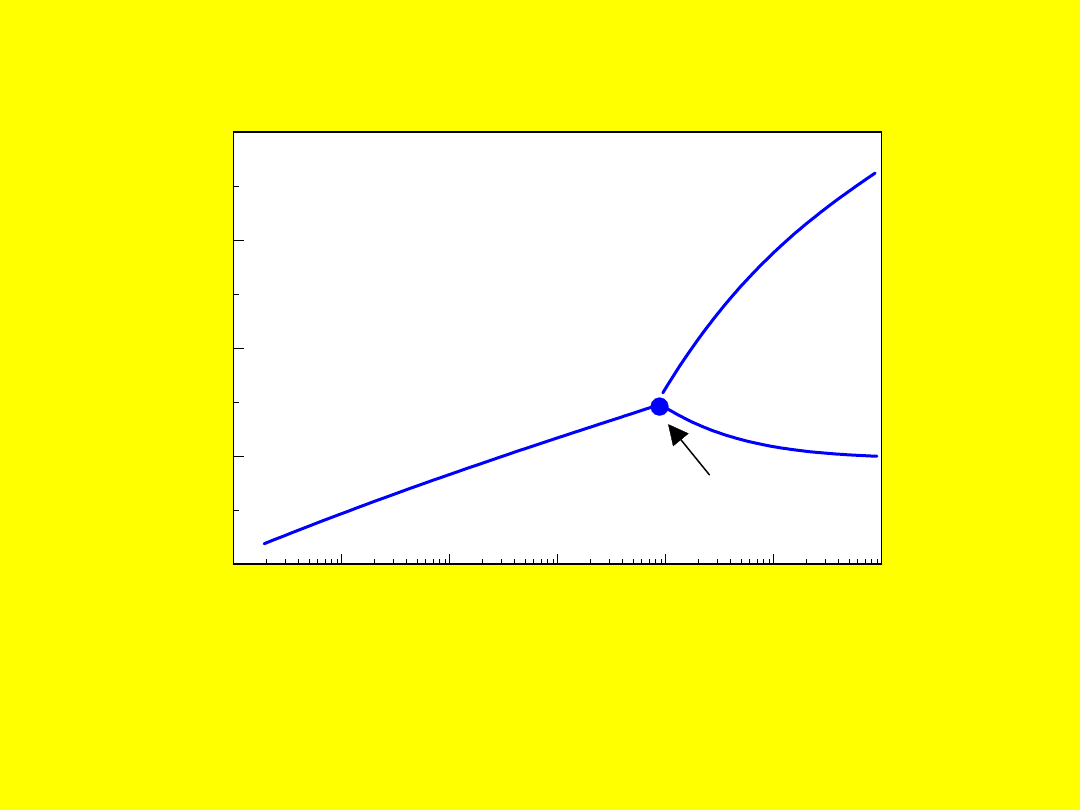
0.1
1
10
100
1000
10000
100000
Ciśnienie pary wodnej, N/m
2
200
250
300
350
400
Te
m
p
e
ra
tu
ra
,
K
Lód
Ciecz
Para wodna
Punkt potrójny
Układy
jednoskładnikowe
Punkt potrójny wody: 612,9 Pa;
273,1 K

O d m i a n y a l o tr o p o w e wę g l a
L p .
O d m i a n a a l o tro p o w a
H y b ry d y z a c j a
S tru k tu ra
D I A M E N T
1
d i a m e n t
s p
3
C
n
l o n s d a l e i t
s p
3
C
n
G R A F I T
2
g ra fi t
s p
2
C
n
g ra fi t
s p
2
C
n
g ra fi to w e w h i s k e rs y
s p
2
C
n
K A R B I N
3
c h a o i t
s p
1
C
C
x
k u m u l e n
s p
1
C
C
x
F U L L E R E N
4
f u l e re n y
s p
2
C
n
n 3 2 , n - p a rz y s te
ru rk i wę g l o w
s p
2
C
n
C Y K L O ( N ) K A R B O N
5
c y k l o ( n ) c a rb o n
s p
1
C
n
1 0 < n 3 0
N – K A R B O N
6
n - k a rb o n
s p
1
C
n
n 1 0
H I P O T E T Y C Z N E
7 ?
W y s o k o c iś n i e n i o w e o d m i a n y
d i a m e n tu : H 3 , B C 8 , R 8 , S T 1 2 ,
S C 4 6 , m e ta l i c z n y d i a m e n t
s p
3
C
n
(a)
(b)
(c)
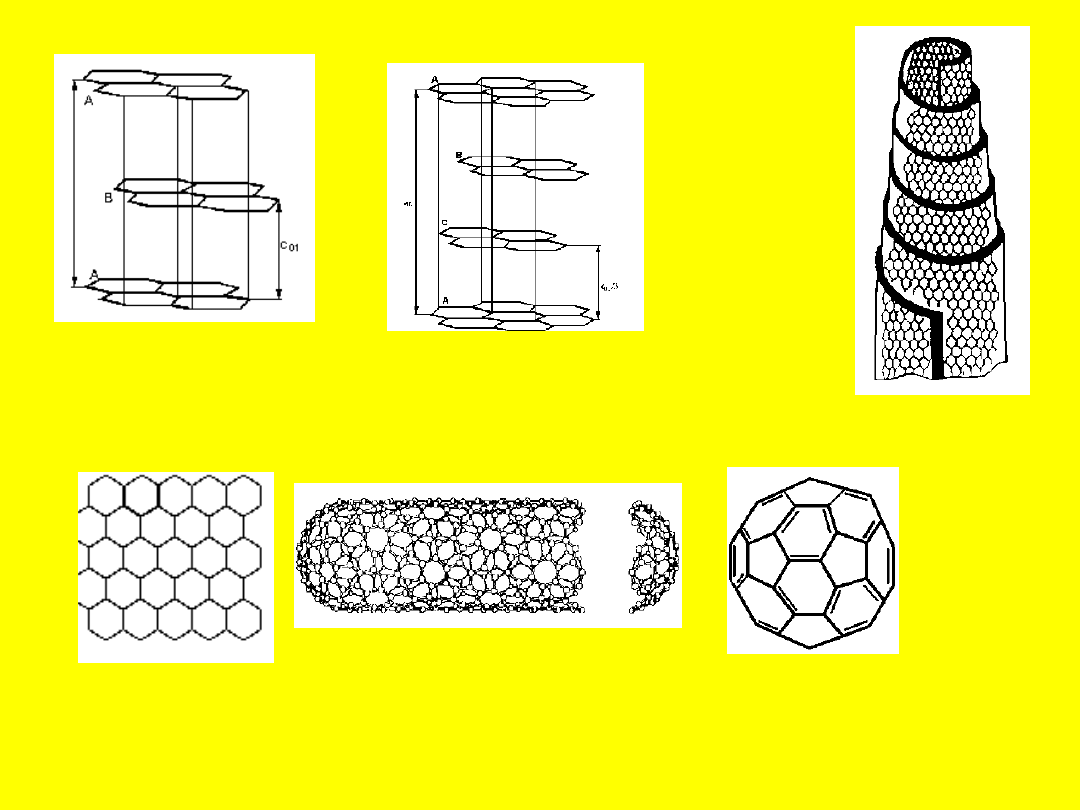
Rys. 13. Przejście warstewki grafitowej (a) poprzez nanorurkę (b) do fullerenu (c)
Grafit alfa
Grafit beta
Grafitowy
whiskers
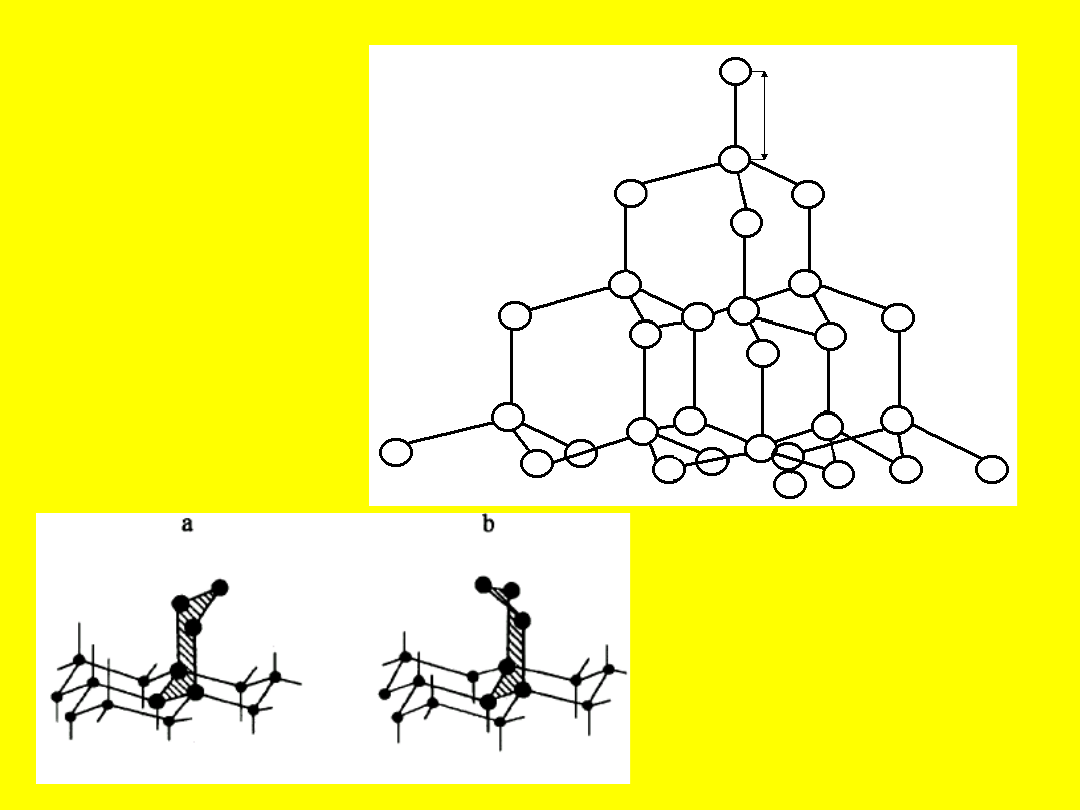
0.154 nm
Struktura diamentu
a - diament
b - lonsdaleit

K arbiny to węgle o hybrydyzacji sp
1
. Węgle o tym typie hybrydyzacji mogą
tworzyć ze sobą wiązania typu inowego:
C
C
x
lub kumulenowego:
C
C
x
Z literatury wiadomo, że atomy węgla tworzyć zarówno proste
niskocząsteczki liniowe (Ebbesen, 1997) i rozgałęzione (K ryszewski, 1995) jak i
długie łańcuchy typu polimerowego (Rice, 1983; Diederich, 1992) jak i łączyć się
w cząsteczki cykliczne (Diederich, 1992).
A
B
T
T
A
T
B
E
A+B
L
L+B
L+A
0
100%
0
100%
A
B
T
T
A
T
B
E
A(
B
)+B(
A
)
L
L+B(
A
)
L+A(
B
)
0
100%
0
100%
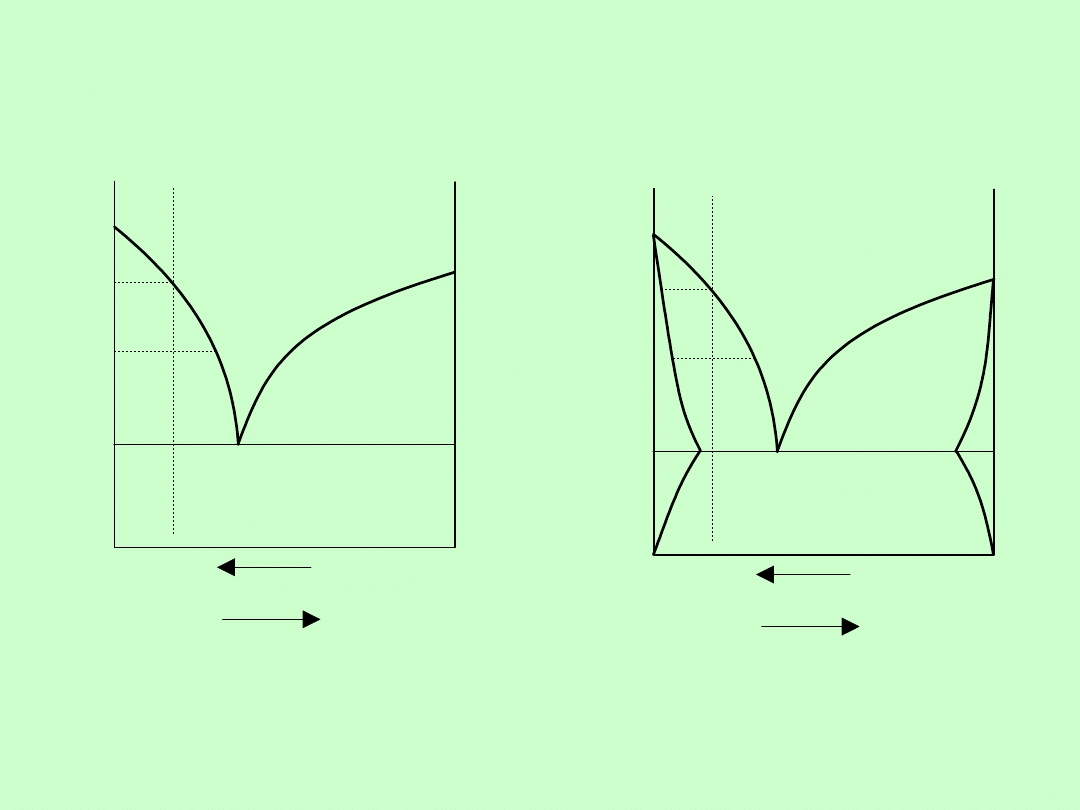
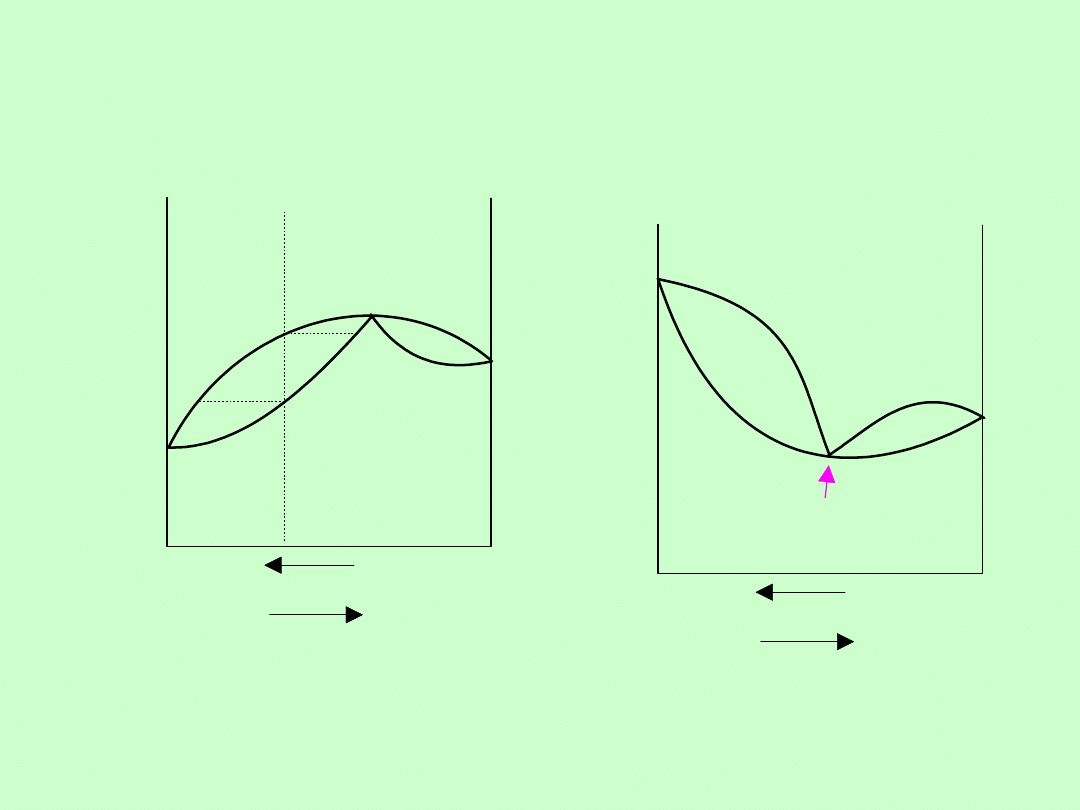
Układy fazowe dwuskładnikowe
Bez
mieszania w
fazie stałej
Ograniczone
mieszania w fazie
stałej
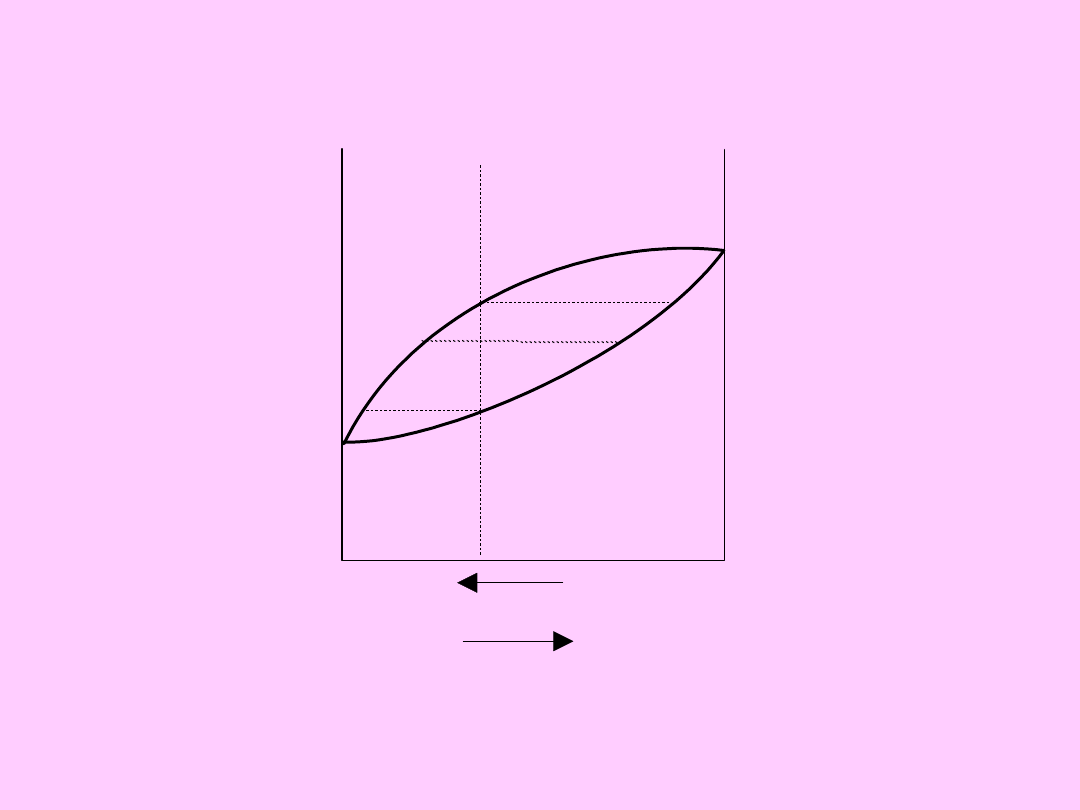
A
B
T
T
A
T
B
S
L
L+S
0
100%
0
100%
Układ dwuskładnikowy z nieograniczona
mieszalnością
A
B
T
T
A
T
B
S
L
L+S
0
100%
0
100%
L+S
A
B
T
T
A
T
B
ciecz
para
cie
cz
+
p
ar
a
0
100%
0
100%
c+p
azeotrop dodatni
Układ dwuskładnikowy azeotropowy
100%
80
80
80
100%
100%
60
60
60
40
40
40
20
20
20
0
0
w
od
ór
tle
n
węgiel, C
celuloza
lignina
antracyt
grafit
brunatny
kamienny
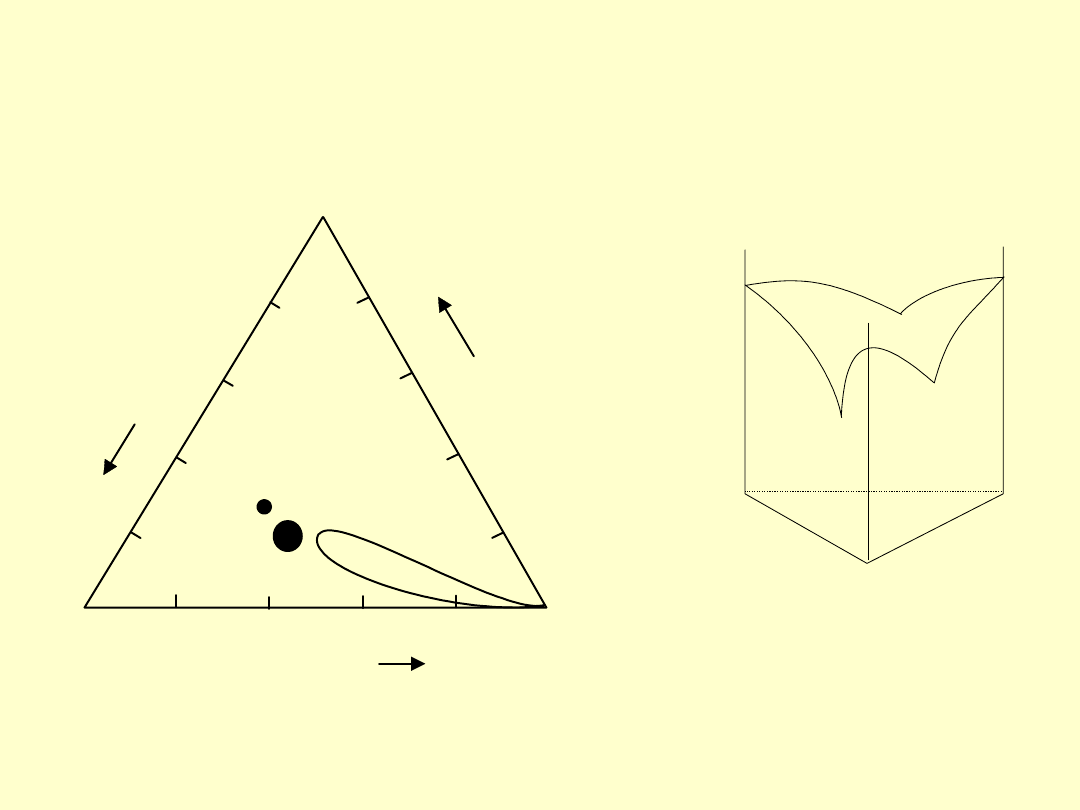
Układy trójskładnikowe
A
B
C
T

Koniec
wykład
u
Ustalić terminy
egzaminów!!!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
metody statystyczne w chemii 8
metody statystyczne w chemii 5
instrukcje cw z chemii
PROGRAM CWICZEN Z CHEMII ORGANICZNEJ BIOLOGIA 2010 2011
material obowiazujacy do kolokwiow z chemii analitycznej iiwf 2014
2011Wykład1 chemii ogólnej 5fantastic pl
hydrobiologia 30.11.2011, ►► UMK TORUŃ - wydziały w Toruniu, ► WYDZIAŁ Biologii, WYDZIAŁ Chemii, Bio
zestaw51 04, WIiTCH, semestr I, podstawy chemii, zestawy obliczenia chemiczne
Zadanie z kartkówki z chemii, Inżynieria środowiska ZUT, Chemia
Przepisy na domowe środki czystości, hobby#=, Dom bez chemii
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
Kąpiel, Ekologia, Dom bez chemii
więcej podobnych podstron