Wykłady z chemii ogólnej
dr Grażyna Orzeszko
Katedra Chemii
Budynek 32, pokój 2056 tel. 225937624
adres e-mail: grazyna_orzeszko@sggw.pl

Podręczniki
Praca zbiorowa – Ćwiczenia z chemii nieorganicznej i analitycznej–
Wyd. SGGW 2011 (
niezbędny do realizacji ćwiczeń
)
E.Białecka-Florjańczyk, J.Włostowska – Ćwiczenia laboratoryjne z
chemii organicznej Wyd.SGGW 1997 lub późniejsze (wybrane
zagadnienia realizowane na ćwiczeniach)
Podręczniki uzupełniające
Tadeusz Drapała - Chemia ogólna i nieorganiczna z zadaniami
Wyd. SGGW 1997
Adam Bielański –Podstawy chemii nieorganicznej PWN1998
(wybrane zagadnienia)
Dowolne podręczniki dla liceum z chemii (chemia ogólna,
nieorganiczna i organiczna) ułatwiające przypomnienie i
powtórzenie materiału z zakresu szkoły średniej.




Chemia
Chemia
nieorganiczna
Chemia
organiczna
Chemia
fizyczna
Chemia
teoretyczna
Chemia
analityczna
Elektrochemia
Krystalografia
Chemia
kwantowa
Chemia
spożywcza
Chemia
jądrowa
Petrochemia
Rolnictwo
Chemia nawozów
i środków
ochrony roślin
Biologia
Biochemia
Medycyna
Farmacja
Geologia
Ochrona
środowiska
Chemia
medyczna
Chemia leków
Geochemia
Chemia
środowiska
Inżynieria
materiałowa
Chemia
materiałów
przemysłowych

CH
2
CH
2
NH
2
2-fenyloetyloamina
nnnnn

Wszystko
to
chemia...

Chemia ogólna- minimum programowe (wykład 30 godz.)
Elementy chemii nieorganicznej (klasyfikacja i właściwości związków
nieorganicznych, podstawowe prawa chemiczne, równowagi w roztworach
elektrolitów – kwasowość środowiska), klasyfikacja reakcji chemicznych,
budowa atomu i układ okresowy pierwiastków.
Elementy chemii organicznej (istota chemii organicznej- chemii związków
węgla, klasyfikacja i właściwości związków organicznych, reakcje w chemii
organicznej).
Elementy termodynamiki i kinetyki chemicznej.
Podstawy analizy jakościowej i ilościowej związków nieorganicznych
i organicznych
Program wykładów i ćwiczeń przesłany będzie drogą mailową ,
program ćwiczeń i regulamin zaliczenia zostanie również przekazany na
ćwiczeniach.

Ćwiczenia (30 godz.) odbywać się będą w:
w salach Katedry Chemii II piętro budynek 32 (budynek
biało-zielony).
Początek ćwiczeń 18.10.2010
Każdy student uczestniczący w ćwiczeniach musi
posiadać odzież ochronną (fartuch), ubrania wierzchnie
należy pozostawić w szatni.
Na ćwiczenia należy przynieść ze sobą podręcznik
Ćwiczenia z chemii nieorganicznej i analitycznej – Wyd.
SGGW 2011
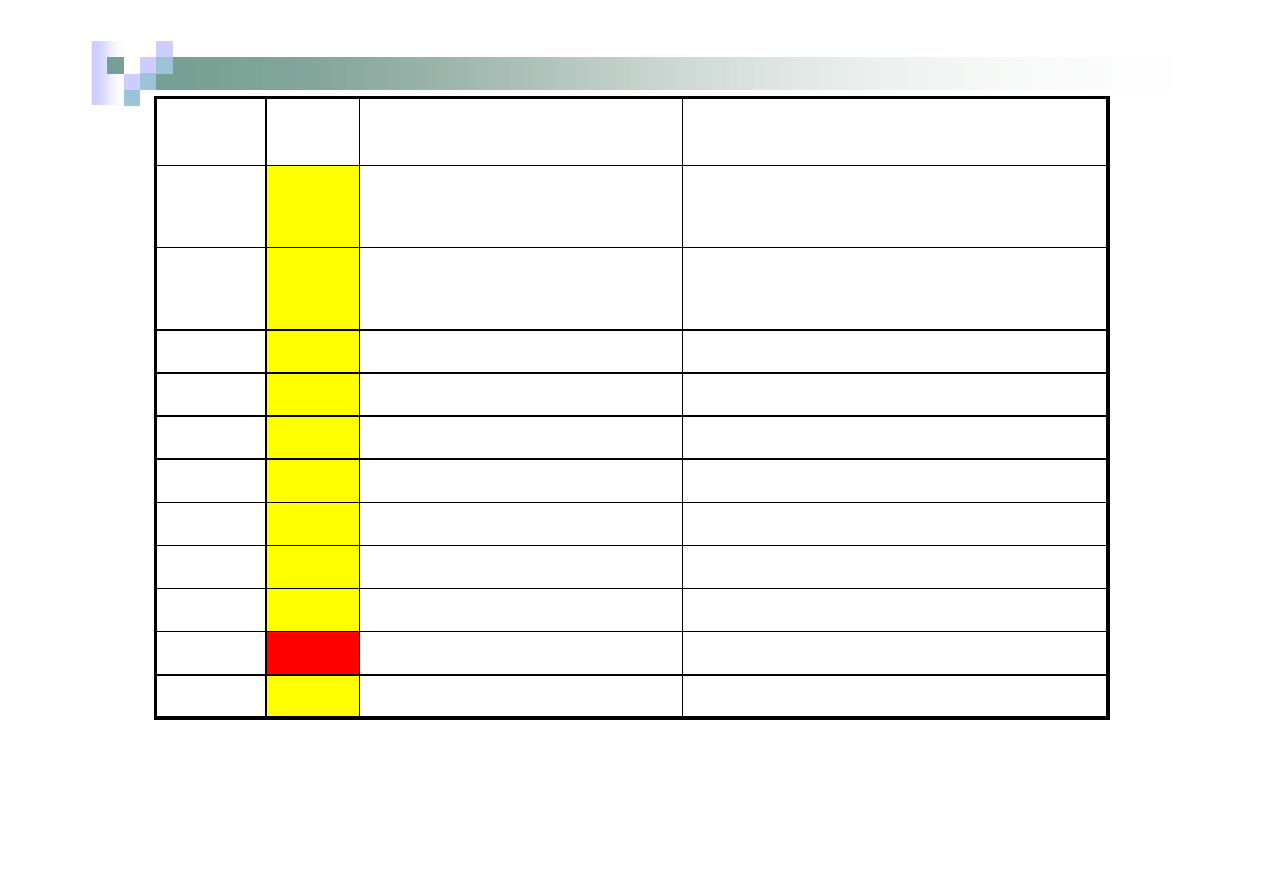
Harmonogram ćwiczeń
1.
18.10.2011
2.
25.10.2011
Zadanie kontrolne
3.
15.11.2011
Kolokwium 1
4.
22.11.2011
Zadanie kontrolne (ZK)
5.
29.11.2011
Kolokwium 2
6.
6.12.2011
Zadanie kontrolne (ZK)
7.
13.12.2011
Kolokwium 3
ZK zesp
.
8.
20.12.2011
Kolokwium 4
ZK zesp
10.
10.01.2012 (2 godz.)
Uzupełnienie
załegłości
9.
3.01.2012
Kolokwium 5
(ZK)
Metody oczyszczania
związków
chemicznych
17.01.2012 (1 godz.)
Kolokwium wyjściowe
Termin zostanie podany
Kolokwium wyjściowe poprawkowe
Analiza ilościowa
Reakcje
przebiegające w
roztworach wodnych-
bez zmiany i ze
zmianą stopnia
utlenienia
pierwiastków

Regulamin zaliczenia ćwiczeń i wykładów
Regulamin zaliczenia ćwiczeń – zostanie przedstawiony na
pierwszych ćwiczeniach
Uwaga:
Obecność na ćwiczeniach jest obowiązkowa!
Maksymalnie można (niezależnie od powodów) opuścić zajęcia
laboratoryjne (ćwiczenia) dwukrotnie
Trzecia nieobecność uniemożliwia zaliczenie ćwiczeń!
Przedmiot po uzyskaniu zaliczenia ćwiczeń kończy się
egzaminem.
Egzamin odbędzie się w sesji zimowej (I termin- pytania otwarte)
Egzamin można poprawiać tylko raz (II termin możliwe do50%
pytań testowych)
Osoby, które nie zdadzą egzaminu poprawkowego mogą zwrócić
się do Pana Dziekana o wyznaczenie egzaminu komisyjnego.
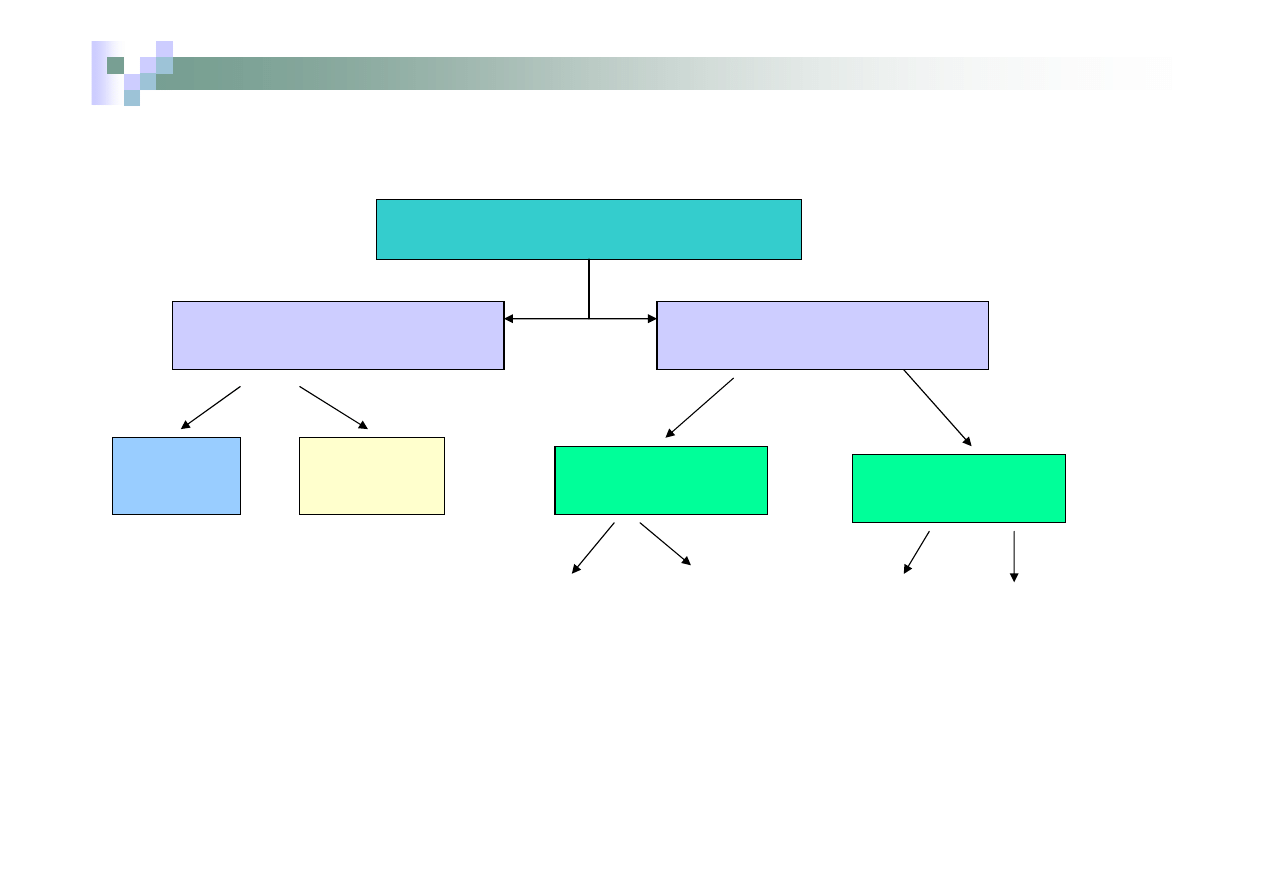
Klasyfikacja i nazewnictwo związków nieorganicznych
Materia (zbiór substancji)
Substancje proste
(pierwiastki chemiczne)
Substancje złożone
Metale
Niemetale
stan
skupienia:
ciała stałe,
ciecz Hg
stan skupienia:
stałe C, P,S, I
2
ciecze: Br
2
gazy: H
2
,O
2
, Cl
2,,
N
2
:
Związki
chemiczne
Związki
organiczne
Związki
nieorganiczne
Mieszaniny
(C, H, O, N,
P, S)
tlenki, wodorki,
kwasy,
wodorotlenki,
sole
jednorodne
nie-
jednorodne
Związki nieorganiczne
Tlenki
Tlenkami nazywamy dwuskładnikowe połączenia pierwiastków z tlenem.
Otrzymuje się je w wyniku:
bezpośredniej reakcji z tlenem pierwiastków lub związków (utlenianie,
katalityczne utlenianie, spalanie)
SO
2
O
2
SO
3
katalizator
2
2
CO
O
2
2
2 CO
2
C
O
2
CO
2
Cu
O
2
CuO
2
2
CH
4
O
2
CO
2
H
2
O
C
6
H
12
O
6
O
2
6
CO
2
6
6 H
2
O
2
2
oraz
w wyniku reakcji redukcji (odtleniania) związków zawierających tlen lub
wyniku termicznego rozkładu związków tlenowych.
Fe
2
O
3
C
2 FeO
CO
MnO
2
H
2
MnO
H
2
O
Żaden z podanych sposobów nie ma znaczenia ogólnego.
Chcąc otrzymać dany tlenek, znaleźć w literaturze indywidualny
sposób jego otrzymywania
CaCO
3
CaO
CO
2
Cu(OH)
2
CuO
H
2
O
N
2
O
5
NO
2
O
2
2
4
Podział tlenków
Tlenki
tlenki metali
Tlenki niemetali
K
2
O, Na
2
O, CaO, BaO,
CuO, Cu
2
O, FeO, Fe
2
O
3
,
MnO, MnO
2
, Mn
2
O
7
SO
2
, SO
3
,
P
2
O
5
,
CO,
CO
2
,
H
2
O
,
NO
2
, N
2
O
5,
NO, N
2
O
3
, Cl
2
O, Cl
2
O
7
,
SiO
2
Tlenki metali są zwykle
ciałami stałymi
o dość dużej gęstości
i wysokich temperaturach topnienia (500
0
-3000
0
C),
tlenki niemetali to najczęściej
gazy,
rzadziej
ciała stałe
lub
ciecze
Właściwości chemiczne tlenków
Właściwości chemiczne tlenków są bardzo zróżnicowane.
Można je podzielić na cztery grupy na podstawie ich zachowania w stosunku
do kwasów, zasad i wody.
Tlenki
Tlenki kwasowe
Tlenki obojętne
Tlenki
amfoteryczne
Tlenki zasadowe

Są to tlenki metali.
Jednak
nie wszystkie tlenki metali są zasadowe.
Tlenki zasadowe reagują z kwasami lub z tlenkami kwasowymi dając sole.
MnO + 2 HCl →
MnCl
2
+ H
2
O
chlorek manganu (II)
3 BaO + 2 H
3
PO
4
→ Ba
3
(PO
4
)
2
+ 3H
2
O
fosforan baru
K
2
O + 2 HNO
3
→ 2 KNO
3
+ H
2
O
aztonan (V) potasu
3 CaO + P
2
O
5
→ Ca
3
(PO
4
)
2
fosforan wapnia
Tlenki zasadowe nie reagują z zasadami.
Tlenki niektórych metali (dotyczy to przede wszystkim tlenków metali grupy
I i II) reagują z wodą dając wodorotlenki.
CaO + H
2
O → Ca(OH)
2
wodorotlenek wapnia
Na
2
O + H
2
O → 2 NaOH
wodorotlenek sodu
Roztwory wodne wodorotlenków nazywamy zasadami , a stężone roztwory
zasad (głównie wodorotlenków NaOH, KOH) nazywamy ługami.
Tlenki zasadowe
Tlenki kwasowe mogą być tlenkami metali
(w których metal wykazuje
wyższą wartościowość np: Mn
2
O
7
)
lub tlenkami niemetali
.
Rozpuszczalne w wodzie tlenki kwasowe, reagują z nią tworzą związki
zwane kwasami tlenowymi (oksokwasy). Te tlenki nazywamy często
bezwodnikami kwasowymi, np.:
SO
2
+ H
2
O → H
2
SO
3
kwas siarkowy (IV)
SO
3
+ H
2
O → H
2
SO
4
kwas siarkowy (VI)
Nie wszystkie tlenki kwasowe są tworzą z wodą oksokwasy.
SiO
2
+ H
2
O → brak reakcji (SiO
2
nie rozpuszcza się w H
2
O)
Tlenki kwasowe reagują z zasadami oraz tlenkami zasadowymi:
CO
2
+ 2NaOH → Na
2
CO
3
+ H
2
O
CO
2
+ Na
2
O → Na
2
CO
3
węglan sodu
SiO
2
+ 2 KOH →
K
2
SiO
3
+ H
2
O
krzemian potasu
Tlenki kwasowe nie reagują z kwasami
Tlenki kwasowe
Tlenki amfoteryczne powstają w wyniku połączenia niektórych pierwiastków
z tlenem. Przykłady tlenków amfoterycznych:
ZnO
tlenek cynku,
SnO
tlenek cyny (II),
PbO
tlenek ołowiu (II),
Al
2
O
3
tlenek glinu,
MnO
2
tlenek manganu (IV),
Cr
2
O
3
tlenek chromu (III),
As
2
O
3
tlenek aresenu (III)
Tlenki amfoteryczne reagują kwasami i zasadami tworząc sole.
ZnO + 2 HCl →
ZnCl
2
+ H
2
O
chlorek cynku
ZnO + 2KOH →
K
2
ZnO
2
+ H
2
O
cynkan sodu
Al
2
O
3
+ 6 HCl →
2
AlCl
3
+ 3H
2
O
chlorek glinu
Al
2
O
3
+ 2 NaOH →
2 Na
AlO
2
+ H
2
O
glinian sodu
można się spotkać z zapisem
Al
2
O
3
+ 6 NaOH → 2Na
3
AlO
3
+ 3H
2
O
Al
2
O
3
+ 6NaOH + 3H
2
O → 2Na
3
[Al(OH)
6
]
Tlenki amfoteryczne nie reagują z wodą w temperaturze pokojowej.
Tlenki amfoteryczne

Tlenki obojętne nie reagują z wodą, kwasami i zasadami. Przykłady tlenków
obojętnych:
CO
tlenek węgla (II)
NO
tlenek azotu (II)
Tlenki obojętne

Nazewnictwo tlenków cd
Nazwa systematyczna
Wzór
System przedrostków
System Stocka
SO
2
ditlenek siarki
(dwutlenek siarki)
tlenek siarki (IV)
bezwodnik siark
awy
SO
3
tritlenek siarki
(trójtlenek siarki)
tlenek siarki (VI)
bezwodnik siark
owy
N
2
O
tlenek diazotu
(tlenek dwuazotu)
tlenek azotu (I)
podtlenek azotu
NO
tlenek azotu
tlenek azotu (II)
N
2
O
3
tritlenek diazotu
tlenek azotu (III)
trójtlenek azotu
NO
2
ditlenek azotu
tlenek azotu (IV)
N
2
O
4
ditlenek diazotu
N
2
O
5
pentatlenek diazotu
(pięciotlenek dwuazotu)
tlenek azotu (V)
pięciotlenek azotu
Nazwa tradycyjne
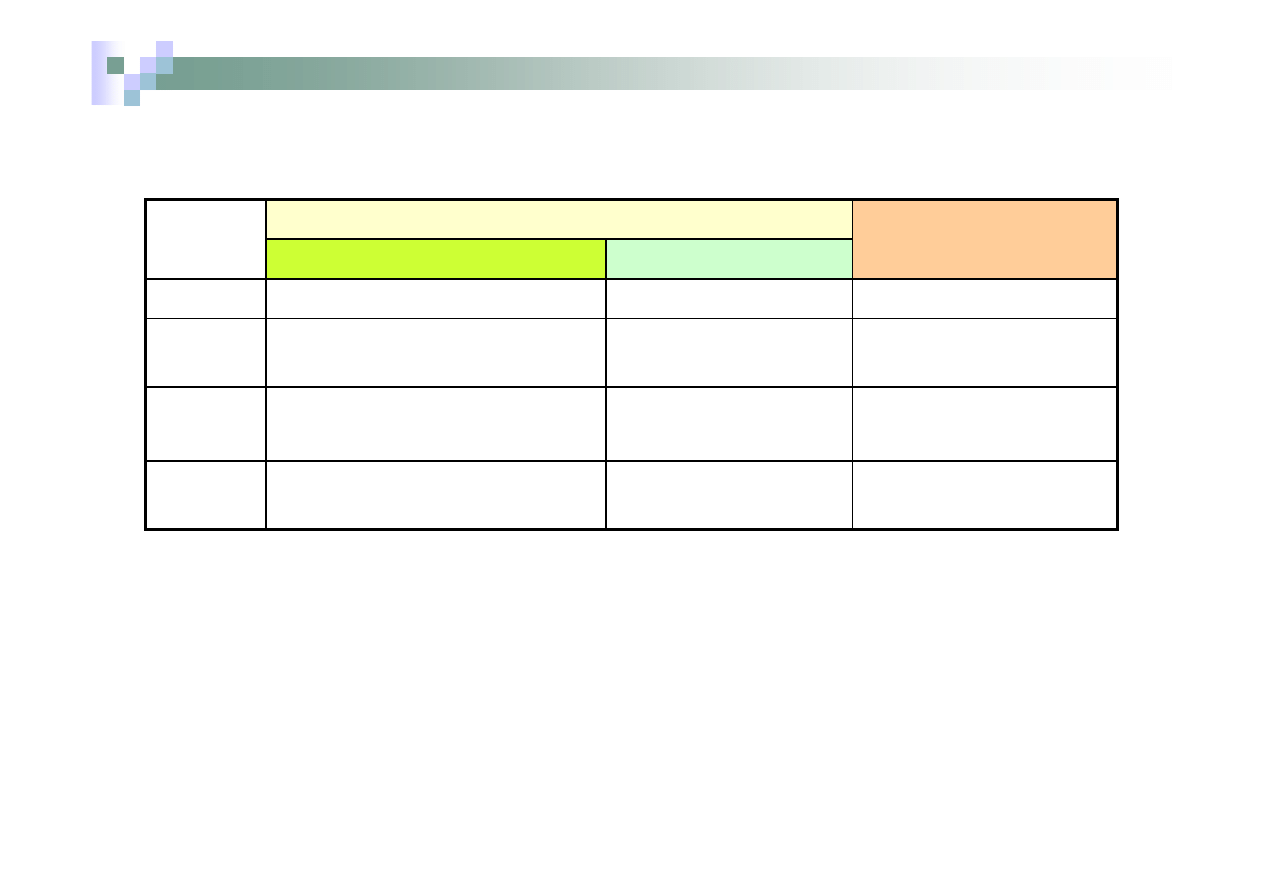
Nazewnictwo tlenków cd
Nazwa systematyczna
Wzór
System przedrostków
System Stocka
MnO
tlenek manganu
tlenek manganu (II)
tlenek manganawy
Mn
2
O
3
tritlenek dimanganu
(trójtlenek dwumanganu)
tlenek manganu (III)
tlenek manganowy
MnO
2
ditlenek manganu
(dwutlenek manganu)
tlenek manganu (IV)
dwutlenek manganu,
brausztyn
Mn
2
O
7
heptatlenek dimanganu
(siedmiotlenek dwumanganu)
tlenek manganu (VII)
bezwodnik kwasu
nadmanganianowego
Nazwa tradycyjne

Nazewnictwo tlenków cd
Nazwa systematyczna
Wzór
System przedrostków
System Stocka
Cl
2
O
tlenek dichloru
tlenek chloru (I)
podtlenek chloru
Cl
2
O
3
tritlenek dichloru
(trójtlenek chloru)
tlenek chloru (III)
* nietrwały w temp.
pokojowej
ClO
2
ditlenek chloru
(dwutlenek chloru)
tlenek chloru (IV)
dwutlenek chloru
Cl
2
O
6
heksatlenek dichloru
(sześciotlenek dwuchloru)
tlenek chloru (VI)
sześciotlenek chloru
Cl
2
O
7
heptatlenek dichloru
(siedmiotlenek dwuchloru)
tlenek chloru (VII)
siedmiotlenek chloru
Nazwa tradycyjne

Nadtlenki
Są to tlenki, w których tlen występuje na (-I) stopniu utlenienia, a więc wyższym niż
w omawianych dotychczas tlenkach, w których ten pierwiastek wykazuje stopień
utlenienia (-II).
Przykładami nadtlenków są:
Na
2
O
2
nadtlenek sodu, K
2
O
2
nadtlenek potasu, BaO
2
nadtlenek baru,
H
2
O
2
nadtlenek wodoru.
W związkach tych występuje wiązanie pomiędzy atomami tlenu:
Wszystkie nadtlenki metali pod wpływem kwasów rozkładają się z wydzielaniem
nadtlenku wodoru
K
2
O
2
+ 2 HCl
→ 2 KCl + H
2
O
2
BaO
2
+ H
2
SO
4
→ BaSO
4
+ H
2
O
2
O
O
Ba
O
O
H
H
Wodorki
Są związki wodoru z metalami lub niemetalami.
Otrzymuje się je w większości przypadków w wyniku bezpośredniej reakcji
pierwiastka z wodorem.
H
2
+ Cl
2
→ 2 HCl
(chlorowodór)
H
2
+ S → H
2
S
(siakowodór)
3 H
2
+ N
2
→ 2 NH
3
(amoniak, azan)
Ca + H
2
→ CaH
2
(wodorek wapnia)
Wodorki
Wodorki metali
Wodorki niemetali

Właściwości fizyczne
Wodorki metali są ciałami stałymi, a wodorki niemetali – przeważnie gazami .
Właściwości chemiczne
W wodorkach metali (związki o budowie jonowej) wodór występuje na (-I)
stopniu utlenienia, podczas gdy w wodorkach niemetali (wiązanie miedzy
atomami kowalencyjne) wodór występuje na (+I) stopniu utlenienia.
Wodorki cechuje wielka różnorodność właściwości chemicznych.
Wodorki metali reagują z wodą z wydzieleniem wodoru.
NaH + H
2
O → NaOH + H
2
↑
CaH
2
+ 2 H
2
O → Ca(OH)
2
+ 2 H
2
↑
Wodorki fluorowców i tlenowców rozpuszczając się w wodzie dają
odpowiednie kwasy beztlenowe:
HCl – kwas solny
H
2
S kwas siarkowodorowy
HI – kwas jodowodorowy
HBr – kwas bromowodorowy

Amoniak (NH
3
) rozpuszczając się w wodzie daje roztwór o odczynie
zasadowym.
Metan (CH
4
) zaliczany jest do związków organicznych, nie rozpuszcza się
w wodzie. Pod wysokim ciśnieniem tworzy połączenia nietrwałe termicznie
połączenia z wodą zwane hydratami.
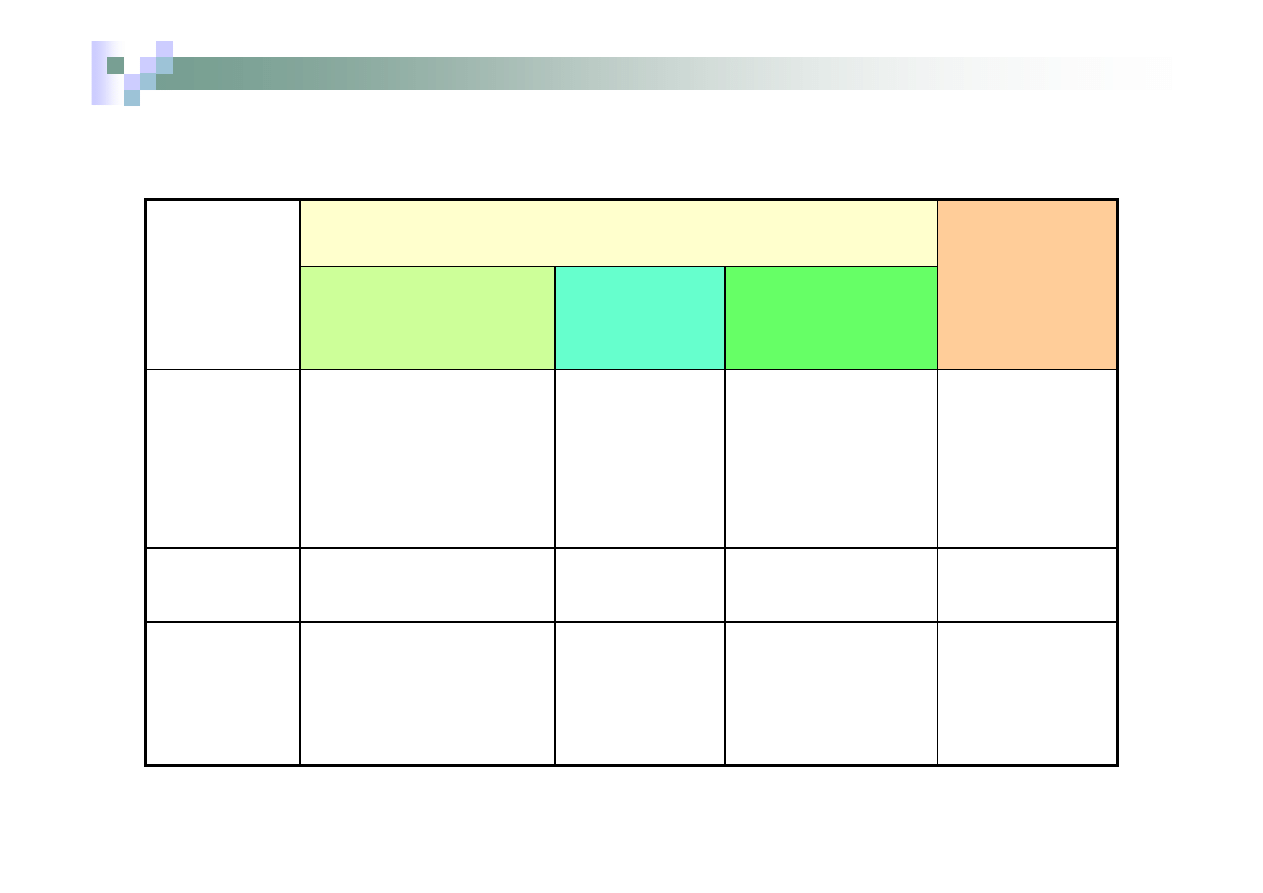
Nazwy wodorków
Nazwa systematyczna
Wzór
dwuwyrazowa
z
przyrostkiem
-an
z zakończeniem
-wodór
Nazwa
zwyczajowa
HF
HCl
HBr
HI
nie stosuje się
nie stosuje
się
fluorowodór
chlorowodór
bromowodór
jodowodór
H
2
S
nie stosuje się
sulfan
siarkowodór
NH
3
N
2
H
4
PH
3
wodorek azotu
tetrawodorek diazotu
wodorek fosforu
azan
diazan
fosfan
azotowodór
diazototetrawodór
fosforowodór
amoniak
hydrazyna
fosforiak
Nazwy wodorków
Nazwa systematyczna
Wzór
dwuwyrazowa
z
przyrostkiem
-an
z zakończeniem
-wodór
CaH
2
wodorek wapnia
nie używa się nie używa się
Nazwa
zwyczajowa
CH
4
SiH
4
nie używa się
wodorek krzemu
nie używa się
silan
nie używa się
krzemowodór
metan
BH
3
AlH
3
nie stosuje się
wodorek glinu
boran
nie używa się
borowodór
nie używa się
NaH
wodorek sodu
nie używa się nie używa się

Wodorotlenki
Związki o ogólnym wzorze Me
(OH)
x
, gdzie Me oznacza kation metalu a
–
OH stanowi grupę wodorotlenową, zwaną też grupą hydroksylową, x
oznacza liczbę grup wodorotlenowych
obecnych w cząsteczce związku.
Liczba grup wodorotlenowych zależy od wartościowości (stopnia
utlenienia metalu). Gdy mamy do czynienia z kationem o stopniu
utlenienia (+1) nie piszemy dolnego indeksu, np.; NaOH
Do związków , których roztwór wodny wykazuje odczyn zasadowy
zalicza się także produkt rozpuszczania amoniaku w wodzie NH
3
• H
2
O
NH
3
+ H
2
O → NH
3
• H
2
O
Woda amoniakalna zawiera niewielką ilość jonów amonowych NH
4
+
powstających na skutek reakcji amoniaku z wodą, zachodzącej zgodnie z
równaniem:
NH
3
+ H
2
O
NH
4
+
+ OH
-

Z istnienia szeregu różnych soli amonowych (zawierających kation
NH
4
+
oraz z powodu zasadowego odczynu wody amoniakalnej
wnoszono o istnieniu związku o nazwie wodorotlenek amonu o
wzorze NH
4
OH.
W rzeczywistości związek taki nie został wykryty w żadnym układzie
woda-amoniak.
Wg opinii większości chemików nie należy używać nazwy
„wodorotlenek amonu" oraz wzoru NH
4
OH lecz stosować nazwę
„wodny roztwór amoniaku” zapisywany jako NH
3
• H
2
O

Wodorotlenki litowców (pierwiastki I grupy) i berylowców (pierwiastki
II grupy)
otrzymuje się dwiema metodami:
¾
w reakcji odpowiedniego tlenku metalu z wodą , np.:
Na
2
O + H
2
O → 2 NaOH wodorotlenek sodu
CaO + H
2
O → Ca(OH)
2
wodorotlenek wapnia
¾
w reakcji odpowiedniego metalu z wodą
2 Na + 2 H
2
O → 2 NaOH + H
2
↑
Ca + 2 H
2
O → Ca(OH)
2
+ H
2
↑

Inne metale i ich tlenki w większości przypadków nie reagują z
wodą, odpowiednie wodorotlenki można otrzymać z rozpuszczalnej
w wodzie soli tego metalu oraz wodorotlenku o silnych
właściwościach zasadowych (NaOH, KOH).
CuSO
4
+ 2 NaOH → Cu(OH)
2
↓ + Na
2
SO
4
FeCl
3
+ 3 NaOH → Fe(OH)
3
↓ + 3 NaCl
Wodorotlenek miedzi (II) i wodorotlenek żelaza (III) wytrącają się w
postaci trudno rozpuszczalnego osadu, co zaznaczamy w równaniu
chemicznym strzałką skierowaną w dół.

Właściwości fizyczne
Wodorotlenki w większości przypadków są ciałami stałymi. Wodorotlenki o
silnych właściwościach zasadowych są nazywane alkaliami (są to NaOH,
KOH), a ich stężone roztwory wodne naszą nazwę ługów.
Praca z wodorotlenkami stałymi i wodnymi roztworami alkaliów wymaga
szczególnej ostrożności . Kontakt z tymi odczynnikami i ich stężonymi
roztworami może powodować bolesne i trudno gojące się oparzenia skóry.
Szczególnie istotna jest ochrona oczu – niezbędne jest stosowanie
okularów ochronnych
.

Właściwości chemiczne
Podstawową i najważniejszą reakcją wodorotlenków jest reakcja z
kwasami, produktem tych reakcji są odpowiednie sole i woda.
NaOH + HCl → NaCl
+ H
2
O
Zn(OH)
2
↓ + H
2
SO
4
→ ZnSO
4
+ 2 H
2
O
Wodorotlenki mogą również reagować z tlenkami kwasowymi, dając
sól i wodę
2 NaOH + CO
2
→ Na
2
CO
3
+ H
2
O
3 Ba(OH)
2
+ P
2
O
5
→ Ba
3
(PO
4
)
2
+ 3 H
2
O
Podział wodorotlenków
Wodorotlenki można pod względem właściwości chemicznych podzielić na
dwie grupy:
Wodorotlenki
Wodorotlenki zasadowe
Wodorotlenki amfoteryczne
Reagują z kwasami
Reagują z zasadami
Reagują z kwasami
Nie reagują z zasadami
Ca(OH)
2
+ H
2
SO
4
→
CaSO
4
+ 2 H
2
O
Ca(OH)
2
+ NaOH →
nie reaguje
Zn(OH)
2
+ H
2
SO
4
→
ZnSO
4
+ 2H
2
O
Zn(OH)
2
+ 2NaOH →
Na
2
[Zn (OH)
4
]
tetrahydroksocynkan sodu
Wodorotlenki zasadowe
Wodorotlenki amfoteryczne
Przykłady:
KOH, NaOH,
Ca(OH)
2
, Mg(OH)
2
, Ba(OH)
2
Cu(OH)
2
, Mn(OH)
2,
, Co(OH)
2,
Przykłady:
Zn(OH)
2
, Al(OH)
3
, Pb (OH)
2,
Sn(OH)
2
, Cr(OH)
3
,
Sb(OH)
3
↓ Mn(OH)
2
+ 2 HCl → MnCl
2
+ 2 H
2
O
↓ Mn(OH)
2
+ KOH→ nie reaguje w
↓ Al(OH)
3
+ 3 HCl → AlCl
3
+ 3 H
2
O
↓ Al(OH)
3
+ NaOH → Na[Al(OH)
4
]
tetrahydroksoglinian sodu
↓ Mg(OH)
2
+ 2 HNO
3
→ Mg(NO
3
)
2
+
2 H
2
O
↓ Mg(OH)
2
+ KOH→ nie reaguje
↓Pb(OH)
2
+ 2HNO
3
→ Pb(NO
3
)
2
+
2 H
2
O
↓Pb(OH)
2
+ 2KOH → K
2
[Pb(OH)
4
]
Tetrahydroksoołowian (II) potasu

Fe(OH)
2
+ 2 HCl → FeCl
2
+ 2 H
2
O
↓ Fe(OH)
2
+ KOH→ nie reaguje w temperaturze pokojowej z
rozcieńczonym roztworem zasady
↓ Fe(OH)
3
+ 3 HNO
3
→ Fe(NO
3
)
3
+ 3 H
2
O
↓ Fe(OH)
3
+ KOH→ nie reaguje temperaturze pokojowej z
rozcieńczonym roztworem zasady

Wodne roztwory rozpuszczalnych wodorotlenków (zasad) powodują
zmianę zabarwienia tzw. indykatorów (wskaźników) – wskazując
tym samym na zasadowy charakter wodnych roztworów tych
związków.
Zasady w świetle teorii Arrheniusa
Zasadami wg Arrheniusa są związki , które po rozpuszczeniu w wodzie
dysocjują całkowicie lub częściowo (czyli rozpadają się pod wypływem
cząsteczek wody) na
aniony OH
–
(jony wodorotlenowe) oraz
kationy
wchodzące w skład danej zasady.
W zależności od tego, czy dysocjacji pod wpływem wody ulegają
wszystkie cząsteczki zasady, czy też tylko ich część zasady dzielimy
na:
zasady mocne
zasady słabe
Zasadami mocnymi są te wodorotlenki, które w wodzie
ulegają całkowitej dysocjacji na jony.
NaOH → Na
+
+ OH
-
Ca(OH)
2
→ Ca
2+
+ 2OH
-
→
pojedyncza strzałka oznacza całkowity rozpad wszystkich
cząsteczek na jony
Do mocnych zasad ulegających całkowitej dysocjacji pod wpływem
wody należą:
LiOH, NaOH, KOH, Ca(OH)
2
, Ba(OH)
2
Mocne zasady
W przypadku zasad posiadających więcej niż jedną grupę
wodorotlenową dysocjacja zachodzi stopniowo:
Ca(OH)
2
→ Ca (OH)
+
+ OH
-
Ca(OH)
+
→ Ca
2+
+ OH
-
(dysocjacja w tym etapie przebiega
w mniejszym stopniu niż w etapie pierwszym)
Nasza umowa:
dla uproszczenia przyjmujemy, że mocne zasady są całkowicie
zdysocjowane na kationy i jony OH
–
i pomijamy fakt
występowania dysocjacji stopniowej
Ca(OH)
2
→ Ca
2+
+ 2OH
-
Mocne zasady
Zasadami słabymi są te wodorotlenki, które w wodzie nie ulegają całkowitej
dysocjacji na jony.
W przypadku mocnych zasad (lub ogólniej wyrażając - mocnych elektrolitów)
tzw.
stopień dysocjacji,
oznaczany jako
α
,
określający stosunek liczby cząsteczek, które uległy dysocjacji do liczby
wszystkich cząsteczek danego związku rozpuszczonego w wodzie dąży to
jedności
liczba cząsteczek zdysocjowanych
α
=
liczba wszystkich cząsteczek
Zasadami mocnymi są te wodorotlenki, które w wodzie ulegają całkowitej
dysocjacji na jony,
α
= 1
Zasady słabe w wodzie nie ulegają całkowitej dysocjacji na jony i ich stopień
dysocjacji
α
<<1.
Zasadami słabymi pozostałe zasady. Większość wodorotlenków, poza
wodorotlenkami litowców (pierwiastki I grupy) jest trudno rozpuszczalna w
wodzie. Słabymi zasadami są także wszystkie wodorotlenki amfoteryczne.
Słabe zasady
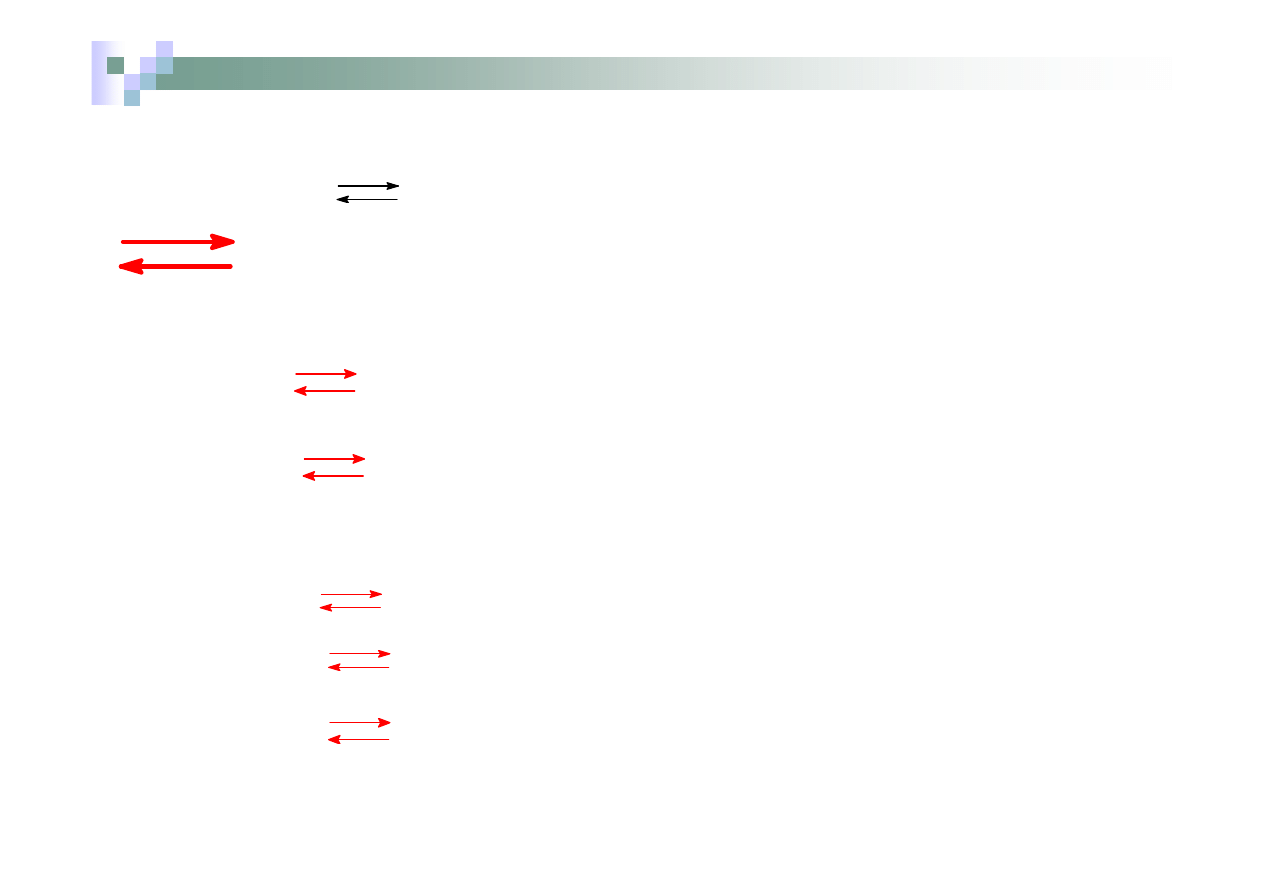
Przykłady słabych zasad:
NH
3
.
H
2
O
NH
4
+
+ OH
-
Strzałki podwójne skierowane w przeciwne strony oznaczają,
że dysocjacja
nie przebiega całkowicie
i w roztworze ustala się
stan równowagi dynamicznej pomiędzy liczbą cząsteczek
zdysocjowanych i niezdysocjowanych na jony
Mg (OH)
2
Mg
2+
+ 2 OH
-
Fe (OH)
3
Fe
3+
+ 3 OH
-
W przypadku słabych zasad wielowodorotlenowych dysocjacja również
zachodzi stopniowo:
Fe(OH)
3
Fe(OH)
2
+
+ OH
-
stopień dysocjacji największy
Fe(OH)
2
+
Fe (OH)
2+
+ OH
-
stopień dysocjacji mniejszy niż w
etapie pierwszym
Fe(OH)
2+
Fe
3+
+ OH
-
stopień dysocjacji najmniejszy
Nazewnictwo wodorotlenków (przykłady)
Związek
Rodzaj
wodoro-
tlenku
Moc
zasa-
dy
Amf. w
stęż.gorą
-cych
roztw.
ługów
Nazwa systematyczna
Nazwa zwyczajowa
NaOH
KOH
wodorotlenek sodu
wodorotlenek potasu
wodorotlenek sodu
wodorotlenek potasu
Ca(OH)
2
Ba(OH)
2
wodorotlenek wapnia
wodorotlenek baru
wodorotlenek wapnia
wodorotlenek baru
Al(OH)
3
Zn(OH)
2
Pb(OH)
2
wodorotlenek glinu
wodorotlenek cynku
wodorotlenek ołowu (II)
wodorotlenek glinu
wodorotlenek cynku
wodorotlenek ołowiawy
Fe(OH)
2
Fe(OH)
3
wodorotlenek żelaza (II)
wodorotlenek żelaza (III)
wodorotlenek żelozawy
wodorotlenek żelazowy
Mn(OH)
2
wodotlenek manganu (II)
wodorotlenek manganawy
Nie ma wodorotlenków
amfoteryczny
mocna zasada
Uwaga: spełniających warunek = amfoteryczny i równocześnie mocna zasada

Kwasy
Są to związki o ogólnym wzorze
H
R, gdzie R - stanowi tzw. resztę
kwasową.
Reszta kwasowa może być złożona i zawierać atomy tlenu (kwas
tlenowy - oksokwas).
H
NO
3
,
H
ClO
3
,
H
NO
2
,
H
2
SO
3
,
H
2
SO
4
,
H
3
PO
4
,
H
ClO
Są też kwasy, w których reszta kwasowa nie zawiera atomów tlenu
(kwasy beztlenowe). Formalnie biorąc kwasy beztlenowe – są
wodorkami niemetali.
H
Cl,
H
Br,
H
CI,
H
2
S.
W zależności od liczby atomów wodoru, które w cząsteczce kwasu
mogą zostać zastąpione przez atomy metalu wyróżniamy kwasy
jednoprotonowe (HCl, HNO
3
, HClO
4
)
i kwasy wieloprotonowe(H
2
SO
4
, H
3
PO
4)
).

W cząsteczkach większości kwasów nieorganicznych wszystkie atomy
wodoru mogą być podstawione metalem, istnieją jednak kwasy, w których
nie wszystkie atomy wodoru mają „charakter kwasowy”.
Do takich kwasów należą kwasy organiczne , np.:
kwas octowy o wzorze CH
3
COO
H -
jedynie
wodór związany z tlenem jest
wodorem „kwasowym”,
pozostałe trzy atomy wodoru związane z atomem
węgla nie wykazują właściwości kwasowych.
Wśród kwasów nieorganicznych takie przypadki należą do rzadkości
(przykład kwas fosfonowy H
3
PO
3
właściwszy zapis H
2
PHO
3
)

Kwasy w świetle teorii Arrheniusa
W świetle teorii
Arrheniusa,
kwasami
są związki, w których wodnych
roztworach dysocjują na kationy H
+
oraz aniony reszt kwasowych.
W zależności od tego, czy dysocjacji pod wpływem wody ulegają
wszystkie cząsteczki kwasu, czy też tylko ich część kwasy dzielimy na:
Kwasy mocne
Kwasy słabe
Kwasami mocnymi są te kwasy, które w wodzie ulegają całkowitej
dysocjacji na jony,
α
= 1 Do mocnych zasad ulegających całkowitej
dysocjacji pod wpływem wody należą:
HCl, HNO
3
, HClO
4
, HBr, HI, H
2
SO
4
(tylko w przypadku odłączenia
jednego jonu H
+
)
HCl → H
+
+ Cl
-
HNO
3
→ H
+
+ NO
3
-
H
2
SO
4
→ 2 H
+
+ SO
4
2
-
Kwasy wieloprotonowe dysocjują stopniowo, np.:
H
2
SO
4
→ H
+
+ HSO
4
-
HSO
4
-
H
+
+ SO
4
2
-
(w drugim stopniu dysocjacji α < 1)
Kwasy mocne

→
pojedyncza strzałka oznacza całkowity rozpad wszystkich
cząsteczek kwasu na jony
Nasza umowa:
dla uproszczenia przyjmujemy, że
mocne kwasy
wieloprotonowe są całkowicie zdysocjowane na jony pomijamy
fakt występowania dysocjacji stopniowej
H
2
SO
4
→ 2 H
+
+ SO
4
2
-

Kwasy słabe
Kwasy słabe w wodzie nie ulegają całkowitej dysocjacji na jony i
ich stopień dysocjacji
α
<<1. Do słabych kwasów należą nie
wymienione poprzednio kwasy
Przykłady słabych kwasów:
HNO
2
H
+
+ NO
2
-
H
2
SO
3
2H
+
+ SO
3
2
-
H
3
PO
4
3H
+
+ PO
4
3
-
W przypadku słabych kwasów wieloprotonowych dysocjacja
zachodzi stopniowo, przy czym każdy kolejnym stopień
dysocjacji jest mniejszy od poprzedniego.

H
3
PO
4
H
+
+ H
2
PO
4
-
α
1
< 1
H
2
PO
4
-
H
+
+ HPO
4
2
-
α
2
< α
1
HPO
4
2
-
H
+
+ PO
4
3
-
α
3
< α
2
Strzałki podwójne skierowane w przeciwne strony oznaczają,
że dysocjacja przebiega niecałkowicie i w roztworze ustala się
stan równowagi dynamicznej pomiędzy liczbą cząsteczek
zdysocjowanych i niezdysocjowanych na jony
Nazewnictwo kwasów
Oprócz wyrazu „kwas” w nazwie związku umieszcza się przymiotnik (z końcówką –owy)
określający nazwę lub rdzeń nazwy pierwiastka wchodzącego obok tlenu w skład
reszty kwasowej.
Jeżeli dany pierwiastek tworzy więcej niż jeden kwas wartościowość tego pierwiastka
podaje się w systemie Stocka.
W przypadku kwasów beztlenowych używa się przymiotnikowej nazwy wodorku z końcówką
–wodorowy.
Dla wielu kwasów stosowane są nazwy zwyczajowe.
Wzór
Moc
kwasu
Nazwa systematyczna
Nazwa zwyczajowa
H
2
SO
4
kwas siarkowy (VI)
kwas siarkowy
H
2
SO
3
kwas siarkowy (IV)
[kwas siarkawy
]*(
nie zalecana
przez PTCh)
HNO
3
kwas azotowy (V)
kwas azotowy
HNO
2
kwas azotowy (III)
[kwas azotawy]
Wzór
Moc
kwasu
Nazwa systematyczna
Nazwa zwyczajowa
H
3
PO
4
H
2
CO
3
kwas węglowy
kwas węglowy
H
2
SiO
3
kwas metakrzemowy
kwas krzemowy
HClO
kwas chlorowy (I)
[kwas podchlorawy]
*
HClO
3
kwas chlorowy (V)
kwas chlorowy
HClO
2
kwas chlorowy (III)
[kwas chlorawy]
*
HClO
4
kwas chlorowy (VII)
[kwas nadchlorowy
*
]
H
4
SiO
4
kwas ortokrzemowy
kwas fosforowy (V)
kwas ortofosforowy (V)
kwas fosforowy (ortofosforowy)
H
4
P
2
O
7
kwas dwufosforowy (V)
kwas pirofosforowy (V)
kwas pirofosforowy
HPO
3
kwas metafosforowy (V)
kwas metafosforowy
H
3
BO
3
kwas borowy
Wzór
Moc
kwasu
Nazwa systematyczna
Nazwa zwyczajowa
HCl
H
2
S
kwas siarkowodorowy
kwas chlorowodorowy
kwas solny
HBr
kwas bromowodorowy
HI
kwas jodowodorowy
Stosowanie nazw zwyczajowych podanych w nawiasie [ ] nie jest zalecane
Przez Polskie Towarzystwo Chemiczne
PTCh

Otrzymywanie kwasów
Kwasy tlenowe
Większość kwasów tlenowych może otrzymana w
wyniku bezpośredniej reakcji odpowiedniego tlenku
kwasowego (bezwodnika kwasowego) z wodą, np.:
SO
2
+ H
2
O → H
2
SO
3
kwas siarkowy (IV)
SO
3
+ H
2
O → H
2
SO
4
kwas siarkowy (VI)
CO
2
+ H
2
O → H
2
CO
3
kwas węglowy
N
2
O
3
+ H
2
O → 2 HNO
2
kwas azotowy (III)
N
2
O
5
+ H
2
O → 2 HNO
3
kwas azotowy (V)

P
2
O
5
+ 3 H
2
O → 2 H
3
PO
4
bardziej poprawny zapis
P
4
O
10
+ 6H
2
O → 4 H
3
PO
4
kwas ortofosofrowy
P
4
O
10
+ 4H
2
O → 2 H
4
P
2
O
7
kwas pirofosofrowy
P
4
O
10
+ 2H
2
O → 4HPO
3
kwas metafosofrowy
B
2
O
3
+ 3 H
2
O → 2 H
3
BO
3
Nie wszystkie tlenku kwasowe (bezwodniki) reagują z wodą
SiO
2
+ H
2
O → brak reakcji

Otrzymywanie kwasów c.d.
W przypadku braku reakcji bezwodnika kwasowego z wodą, odpowiedni
kwas można otrzymać z rozpuszczalnej w wodzie soli tego kwasu działając
na tę sól innym (mocniejszym) kwasem:
Na
2
SIO
3
+ 2 HCl →
↓ H
2
SiO
3
+ 2 NaCl
krzemian kwas solny
kwas krzemowy chlorek sodu
sodu
Kwasy beztlenowe
Kwasy beztlenowe otrzymuje się przez rozpuszczenie w wodzie
odpowiedniego wodorku
↑HCl
+
H
2
O
→
HCl
aq
chlorowodór
roztwór wodny chlorowodoru
gaz
(gaz rozpuszczony w wodzie)- kwas solny
(aq = aqua = woda)

Właściwości fizyczne
Kwasy są przeważnie cieczami. Znane są także kwasy będące ciałami
stałymi (są to głównie kwasy organiczne).
Rozcieńczanie stężonych roztworów kwasów – zawsze należy wlewać kwas
do wody (umożliwia to równomierne mieszanie roztworu- gęstość
stężonego kwasu jest większa od gęstości wody).
Podczas pracy z kwasami ( a zwłaszcza ich stężonymi roztworami) należy
zachować szczególną ostrożność (kwasy mają właściwości żrące) i
bezwzględnie stosować okulary ochronne.
H
2
O
kwas

Wodne roztwory kwasów powodują zmianę zabarwienia tzw.
indykatorów (wskaźników) – wskazując tym samym na kwaśny
charakter wodnych roztworów tych związków
.
Wskaźnikami stosowanymi do badania kwasowości (lub
zasadowości) stosuje się pojedyncze wskaźniki (lakmus,
fenoloftaleina, oranż metylowy i inne) lub papierki wskaźnikowe
nasycone kilkoma wskaźnikami), co umożliwia dokładniejsze
określenie stężenia jonów odpowiedzialnych za kwasowość
środowiska.

Właściwości chemiczne
1.
Najważniejsza reakcja kwasów - reakcja z zasadami (reakcja zobojętniania)
kwas
+
zasada
→
sól
+
woda
2 NaOH
+ H
2
SO
4
→
Na
2
SO
4
+ 2 H
2
O
Mn(OH)
2
+ 2 HCl →
MnCl
2
+ 2 H
2
O
Al(OH)
3
+ 3 HNO
3
→ Al(NO
3
)
3
+ 3 H
2
O
2.
Większość kwasów reaguje z wieloma metalami wg schematu
kwas
+
metal
→
sól
+
wodór
↑
Zn + H
2
SO
4
→ ZnSO
4
+ H
2
↑
2 Al + 6 HCl
→ 2 AlCl
3
+ 3H
2
↑
(
uwaga:
Al nie reaguje „na zimno” ze stężonym kwasem siarkowym a także
rozcieńczonym i stężonym kwasem azotowym nawet na gorąco na skutek
pasywacji tego metalu)

Nie wszystkie metale reagują z kwasami z wydzieleniem wodoru.
Reakcji tej nie ulegają metale szlachetne (Au, Pt) i półszlachetne (Cu, Ag)
a także kilka innych metali (znajdujących się w tzw. ”szeregu napięciowym
metali” za wodorem).
Nie oznacza to jednak, że metale te w ogóle nie reagują z kwasami. W
odpowiednio dobranych warunkach (dobór stężenia kwasu, ogrzewanie),
nawet te metale mogą reagować z kwasami tlenowymi o właściwościach
utleniających, reakcji tej jednak nie towarzyszy wydzielanie wodoru. Np.
Cu + 2 H
2
SO
4 (stężony)
→ CuSO
4
+ SO
2
↑ + 2H
2
O
Ag + 2 HNO
3 (stężony)
→ AgNO
3
+ NO
2
↑ + H
2
O
3 Cu + 8 HNO
3 (średnio stężony)
→ 3 Cu(NO
3
)
2
+ 2 NO↑ + 4H
2
O
Cu + 4 HNO
3 (stężony)
→ Cu(NO
3
)
2
+ 2 NO
2
↑ + 2 H
2
O
Cu + HCl → nie reaguje bez względu na stężenie kwasu i temperaturę

3.
Kolejną reakcja kwasów jest reakcja kwasów z tlenkami metali
kwas
+
tlenek metalu
→
sól
+
woda
CuO + H
2
SO
4
→ CuSO
4
+ H
2
O
CaO + 2 HCl → CaCl
2
+ H
2
O
Nie wszystkie tlenki metali reagują ze wszystkimi kwasami.
Do tlenków nie reagujących z kwasami należą np:
Al
2
O
3
(odmiana α -korund), Fe
3
O
4
, Cr
2
O
3,
i SnO
2.
Znane są również tlenki reagujące z jednymi kwasami, ale nie
ulegające reakcji z innymi kwasami
, np.
CrO + 2 HCl → CrCl
2
+ H
2
O
CrO + HNO
3 (rozcieńczony)
→ reakcja nie zachodzi
MnO
2
+ 4 HCl → MnCl
2
+ Cl
2
+ 2 H
2
O
MnO
2
+ HNO
3
→ reakcja nie zachodzi

Sole
Sole są związkami zawierającymi kation metalu lub kation NH
4
+
(podobnie
jak zasady), oraz aniony reszt kwasowych. Ogólny wzór soli może być
przedstawiony jako:
Me
x
R
Y
gdzie Me oznacza kation (metalu lub NH
4
+
),
R oznacza resztę kwasu tlenowego
lub beztlenowego
x i y to współczynniki wynikające
z wartości ładunków odpowiednich
kationów i anionów
np.:
KCl
kation K
+
anion
Cl
-
Al
2
(SO
4
)
3
sól kationu Al
3+
i anionu SO
4
2
-

Formalnie biorąc sole mogą być traktowane jako
pochodne kwasów
,
w których jeden lub więcej kationów wodorowych (w przypadku
kwasów wieloprotonowych) zostało zastąpionych przez kationy
metalu lub kationy NH
4
+
,
lub też
jako
pochodne wodorotlenków
, w których jedna lub więcej grup
wodorotlenowych (w przypadku wodorotlenków
wielohydroksylowych) zostało zastąpione resztami kwasowymi.

Reakcje otrzymywania soli
1.
Podstawową reakcją otrzymywania soli jest reakcja zobojętniania.
W zależności od zastosowanej zasady i oraz użytego kwasu mogą
powstawać następujące produkty reakcji:
sole, w których cząsteczkach nie występują atomy wodoru oraz nie
występują grupy hydroksylowe (wodorotlenowe)
np.:
H
Cl + Na
OH
→ NaCl +
H
2
O
H
2
SO
4
+
2
K
OH
→ K
2
SO
4
+
2 H
2
O
Al
(OH)
3
+
3 H
NO
3
→ Al(NO
3
)
3
+
3 H
2
O
W reakcjach tych liczba reagujących grup OH
-
jest równa liczbie
wprowadzonych do reakcji kationów H
+
, co prowadzi do powstawania
takiej samej liczby cząsteczek wody

Jeżeli liczba obecnych w reakcji grup wodorotlenowych (nadmiar
zasady) jest mniejsza niż liczba wprowadzonych do reakcji kationów
wodorowych (niedomiar kwasu) w wyniku reakcji nie tworzy się sól
obojętna (zbudowana tylko z z kationów i anionów reszt kwasowych)
lecz produktem reakcji jest
hydoksosól
zawierająca obok anionów
reszty kwasowej także aniony
OH
-
Ca
(OH)
2
+
H
NO
3
→ Ca
(OH)
NO
3
+
H
2
O
azotan (V) hydroksowapnia
lub aztoan (V) wodorotlenek wapnia
Al
(OH)
3
+
H
2
SO
4
→ Al
(OH)
SO
4
+
2 H
2
O
Fe
(OH)
3
+
H
NO
3
→ Fe
(OH)
2
NO
3
+
H
2
O
azotan (V) dihydroksożelaza (III)
lub azotan (V) diwodorotlenek żelaza
Fe
(OH)
3
+
2 H
NO
3
→ Fe
(OH)
(NO
3
)
2
+
2 H
2
O
azotan (V) hydroksożelaza (III)
lub azotan (V) wodorotlenek żelaza

Jeżeli liczba obecnych w reakcji kationów
H
+
(nadmiar kwasu) jest większa
niż liczba wprowadzonych do reakcji anionów wodorotlenowych (niedomiar
zasady) w wyniku reakcji nie tworzy się sól obojętna (zbudowana tylko z z
kationów i anionów reszt kwasowych) lecz produktem reakcji jest
wodorosól
zawierająca obok kationów metalu lub kationu NH
4
+
także
kationy wodorowe (H
+
).
H
3
PO
4
+ Na
OH
→ Na
H
2
PO
4
+
H
2
O
diwodorofosforan (V) sodu lub ortodwuwodorofosforan(V)
sodu
H
3
PO
4
+
2
Na
OH
→ Na
2
H
PO
4
+
2 H
2
O
wodorofosforan (V) sodu lub wodorofosforan (V) disodu
H
2
SO
4
+ K
OH
→ K
H
SO
4
+
H
2
O
wodorosiarczan (VI) potasu
2 H
2
S + Mg
(OH)
2
→ Mg(
H
S)
2
+
2 H
2
O
bis –wodorosiarczek magnezu

2.
Sole można także otrzymywać w reakcji metali z kwasami (patrz
reakcje kwasów) – w zależności od zastosowanego metalu i kwasu
produktem reakcji obok soli może być wodór lub reakcja może
przebiegać bez wydzielania wodoru
3.
Sole mogą być otrzymywane w reakcji niektórych tlenków metali
(zasadowe lub amfoteryczne) z kwasami (patrz reakcje kwasów)
4.
Sole można otrzymać w reakcji zasad z niektórymi tlenkami
niemetali (bezwodnikami kwasowymi)- produktem reakcji jest sól i
woda
Ca(OH)
2
+ CO
2
→ CaCO
3
+ H
2
O
6 NaOH + P
2
O
5
→ 2 Na
3
PO
4
+ 3H
2
O
2 KOH + N
2
O
5
→ 2 KNO
3
+ H
2
O
5.
Sole mogą być również otrzymane w reakcji bezwodników
kwasowych z niektórymi tlenkami zasadowymi (bezwodnikami
zasadowymi) – produktem reakcji jest sól
MgO + SO
2
→ MgSO
3

6.
Sole kwasów beztlenowych można otrzymać w wyniku
bezpośredniej syntezy metalu i niemetalu
Fe + S → FeS
2 Na + Cl
2
→ 2 NaCl
7.
Sole mogą być także otrzymywane w reakcji kwasu z inną solą-
warunkiem przebiegu takiej reakcji jest zastosowanie kwasu
mocniejszego i mniej lotnego niż kwas, od którego pochodzi użyta
do reakcji sól
Na
2
CO
3
+ 2
HNO
3
→ 2NaNO
3
+
H
2
CO
3
(słaby, nietrwały kwas)
(mocny kwas)
H
2
O + CO
2
↑
CaCl
2
+
H
2
SO
4
→ CaSO
4
+ 2
HCl (kwas bardziej lotny)
(kwas mniej lotny, większa masa molowa)
Na
2
SiO
3
+ 2HCl → ↓
H
2
SiO
3
+ 2 NaCl
(słaby trudnorozpuszczalny kwas)

Sole mogą być również otrzymane w reakcji soli z kwasem,
jeżeli w wyniku reakcji powstaje sól trudnorozpuszczalna
BaCl
2
+ H
2
SO
4
→ ↓ BaSO
4
+ NaCl
Cu (NO
3
)
2
+ H
2
S → ↓ CuS
+ 2 HNO
3
8.
Sole otrzymuje się także w reakcji mocnych zasad z solami
słabych zasad w wyniku tej reakcji powstaje słaba zasada i
nowa sól
NH
4
Cl +
NaOH
→ NaCl +
NH
4
OH (słaba zasada)
(mocna zasada)
↑NH
3
+ H
2
O
Al
2
(SO
4
)
3
+ 6 KOH → ↓
2 Al(OH)
3
+ 3 K
2
SO
4
(słaba zasada, trudnorozpuszczana)
∆
(ogrzewanie)

9.
Sole można otrzymać w reakcji
rozpuszczalnej soli z inną
rozpuszczalną solą
, jeżeli w wyniku reakcji powstaje sól
trudnorozpuszczalna
AgNO
3
+
KCl
→
KNO
3
+ AgCl ↓
BaCl
2
+
K
2
SO
4
→
2KCl
+ BaSO
4
↓
Na
2
S
+
CuSO
4
→
Na
2
SO
4
+ CuS ↓

Właściwości fizyczne
Sole są na ogół substancjami stałymi, krystalicznymi, najczęściej
białymi, choć zdarzają się sile o innych barwach np.
niebieskiej (CuSO
4
X
5 H
2
O) – hydrat
fioletowej (KMnO
4
)
żółtej (PbI
2
)
czarnej (CuS)
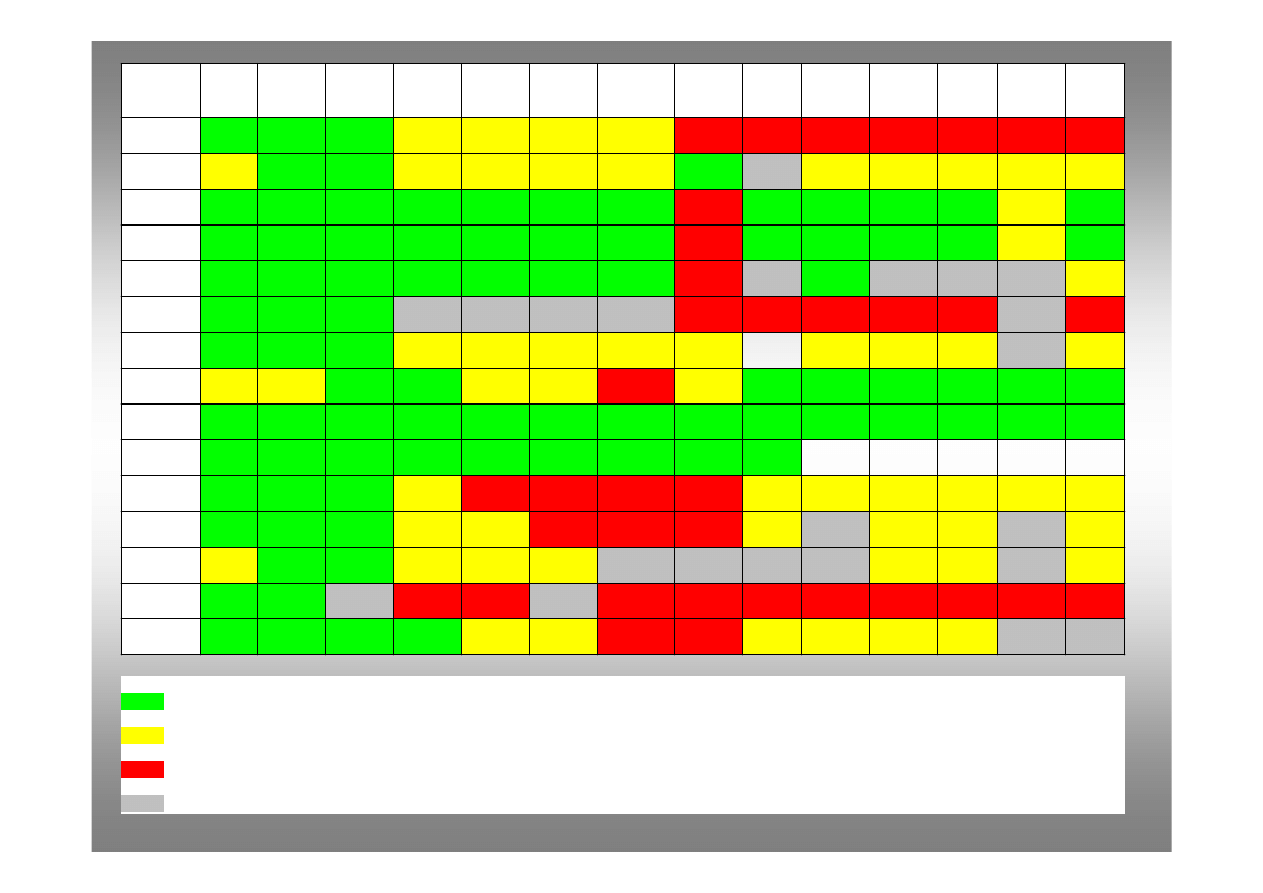
Kation
Anion
Na
+
K
+
NH
4
+
Mg
2+
Ca
2+
Sr
2+
Ba
2+
Ag
+
Cu
2+
Zn
2+
Al
3+
Mn
2+
Cr
3+
Fe
2+
OH
-
r
r
r
s
s
s
s
n
n
n
n
n
n
n
F
-
s
r
r
s
s
s
s
r
o
s
s
s
s
s
Cl
-
r
r
r
r
r
r
r
n
r
r
r
r
s
r
Br
-
r
r
r
r
r
r
r
n
r
r
r
r
s
r
I
-
r
r
r
r
r
r
r
n
o
r
o
o
o
s
S
2-
r
r
r
o
o
o
o
n
n
n
n
n
o
n
SO
3
2-
r
r
r
s
s
s
s
s
-
s
s
s
o
s
SO
4
2-
s
s
r
r
s
s
n
s
r
r
r
r
r
r
NO
2
-
r
r
r
r
r
r
r
r
r
r
r
r
r
r
ClO
3
-
r
r
r
r
r
r
r
r
r
-
-
-
-
-
PO
4
3-
r
r
r
s
n
n
n
n
s
s
s
s
s
s
CO
3
2-
r
r
r
s
s
n
n
n
s
o
s
s
o
s
HCO
3
-
s
r
r
s
s
s
o
o
o
o
s
s
o
s
SiO
3
2-
r
r
o
n
n
o
n
n
n
n
n
n
n
n
CrO
4
2-
r
r
r
r
s
s
n
n
s
s
s
s
o
o
r - substancje dobrze rozpuszczalne
s- substancje słabo rozpuszczalne ( wytrąca się w formie osadu tylko ze stężonego roztworu)
n- substancja praktycznie nierozpuszczalna ( wytrąca się w formie osadu z rozcieńczonego roztworu)
o- substancja w roztworze wodnym nie istnieje

Właściwości chemiczne
• W odróżnieniu od kwasów i zasad, sole mają tzw.
charakter
obojętny
.
• Wodne roztwory wielu soli nie zmieniają zabarwienia papierków
uniwersalnych nasyconych wskaźnikami wskazującymi kwaśny lub
zasadowy charakter środowiska.
• Wiele jednak soli ulega pod wpływem cząsteczek wody reakcji
hydrolizy, co powoduje wystąpienie odczynu kwaśnego lub
zasadowego wodnych roztworów soli hydrolizujących.

Nazewnictwo soli
Sole obojętne M
n
R
m
Nazwa soli składa się z dwóch wyrazów.
Pierwszy określa resztę kwasową i tworzy się go od nazwy kwasu ,
który zawiera tę resztę:
¾
jeżeli nazwa kwasu ma końcówkę
- owy
, to nazwa reszty kwasowej
przyjmuje końcówkę
- an
(siarkowy – siarczan), należy także podać
wartościowość niemetalu w tej reszcie (siarczan (VI); siarczyn (IV))
¾
jeżeli stosujemy nazwę zwyczajową kwasu z końcówką
–awy
to
nazwa reszty kwasowej w nazwie zwyczajowej przyjmuje końcówkę
–yn
(azotawy – azotyn)
¾
reszty kwasowe kwasów beztlenowych mają w nazwie końcówkę
-ek
(chlorek, bromek, jodek, siarczek).
Drugi wyraz w nazwie soli określa kation (metal, lub kation złożony
niemetaliczny NH
4
+
,w razie potrzeby w przypadku metalu podaje
się jego wartościowość wyrażoną liczbą Stocka).

Nazwy wodorosoli („sole kwaśne”) M
n
(HR)
m
Sole te składają się z metalu i „zwykłej” reszty kwasowej zawierającej
dodatkowo wodór. Mogą powstawać w reakcjach, w których nie
wszystkie wodory kwasów wieloprotonowych zostaną zastąpione
przez atomy metalu lub NH
4
+
,
, np.:
NaHSO
4
, Ca (HSO
4
)
2
KH
2
PO
4
, K
2
HPO
4,
, MgHPO
4
, NH
4
HSO
3
.
Przy ustalaniu wzorów wodorosoli należy wodór traktować jako
składową reszty kwasowej .
Wartościowość takiej reszty kwasowej oblicza się odejmując od
wartościowości „zwykłej” reszty kwasowej (np. III dla reszty kwasu
H
3
PO
4
) liczbę atomów wodoru, znajdujących się w „kwaśnej”
reszcie.
H
3
PO
4
reszta PO
4
3-
(III wartościowa)
H
2
PO
4
-
(I wartościowa)
HPO
4
2-
(II wartościowa)

Nazwy wodorosoli składają się z dwóch wyrazów. W
pierwszym wyrazie po przedrostku
wodoro-
(o ile
występuje więcej niż jeden atom wodoru należy podać
odpowiedni liczebnik) podaje się nazwę reszty kwasowej
z uwzględnieniem wartościowości niemetalu, a nastpnie
podaję nazwę kationu (z ewentualnym podaniem
wartościowości wg Stocka) w formie rzeczownikowej.
Przykłady:
KHSO
3
wodorosiarczan (IV) (potasu dawniej kwaśny
siarczyn potasu)
NaH
2
PO
4
diwodorofosforan (V) sodu (dwuwodorofosforan
sodu)
Na
2
HPO
4
wodorofosforan (V) sodu, wodorofosforan disodu

Hydroksosole („sole zasadowe” dawniej hydroksysole)
[M(OH)
k
]
n
R
m
Hydroksosole składają się z reszty kwasowej (R) oraz tzw. Reszty
zasadowej [Me(OH)
k
] , w skład której wchodzi metal i jedna (k=1)
lub kilka (k=2,3….) grup OH , związanych z kationem metalu.
Hydroksosole są produktami niecałkowitego podstawienia grup OH
w cząsteczce wodorotlenku (zawierającego więcej niż jedną grupę
wodorotlenową) przez reszty kwasowe, np.:
Mg(OH)Cl, Al(OH)
2
Cl, Al(OH)Cl
2
, Al(OH)SO
4.
Przy ustalaniu wzorów hydroksosoli należy traktować grupy OH jako
integralną część reszty zasadowej. Wartościowość reszty
zasadowej ustala się odejmując od wartościowości metalu (np. dla
Al (III) liczbę grup OH w reszcie zasadowej, czyli reszta Al(OH)
2
+
jest jednowartościowa (III - 2
x
I = I).

Nazwy hydroksosoli
Nazwy hydroksosoli mogą być tworzone w dwojaki sposób:
¾
nazwa składa się trzech wyrazów, z których dwa pierwsze
(wymienione w kolejności alfabetycznej) określają liczbę grup OH
(związanych z jednym kationem metalu) i liczbę „zwykłych” reszt
kwasowych a trzeci wyraz – rodzaj metalu (ewentualnie, jeżeli
wymaga tego jednoznaczność określenia nazwy z uwzględnieniem
wartościowości wg Stocka), przy alfabetyzacji pomija się przedrostki
liczebnikowe
¾
nazwę tworzy się z dwóch wyrazów, pierwszy wyraz podaje nazwę
reszty kwasowej, drugi nazwę kationu z przedrostkiem „hydrokso-” z
uwzględnieniem liczby anionów grup wodorotlenowych

Przykłady:
Mg(OH)Cl - chlorek wodorotlenek magnezu
lub
chlorek hydroksomagnezu
Al(OH)
2
Cl – chlorek diwodorotlenek (lub dwuwodorotlenek) glinu
lub
chlorek dihydroksoglinu (dwuhydroksoglinu)
Al(OH)Cl
2
– dichlorek wodorotlenek glinu (dwuchlorek wodorotlenek
glinu)
lub
chlorek hydroksoglinu
Fe (OH)SO
4
- siarczan (VI) wodorotlenek żelaza (III)
lub
siarczan(VI) hydroksożelaza (III)
[Fe(OH)
2
]
2
SO
4
- siarczan (VI) diwodorotlenek (lub dwuwodorotlenek)
żelaza (III)
lub
siarczan (VI) dihydroksożelaza (III)

Sole złożone
Istnieją sole złożone - podwójne, potrójne itp., zawierające kilka
różnych kationów lub anionów. Nazwy takich soli tworzy się
podając nazwy jonów w kolejności alfabetycznej. We wzorze takich
soli symbole jonów również podajemy w kolejności alfabetycznej.
Nazwy kationów oddziela się łącznikowym
„i”
a nazwy anionów
podaje bez łącznika.
Przykłady:
KNaSO
4
siarczan (VI) potasu i sodu
CaNH
4
PO
4
fosforan (V) amonu i wapnia
Dla anionów w tym typie soli stosuje się przedrostki
zwielokrotniające:
„bis”, „tris” itd.
Ca
5
F(PO
4
)
3
fluorek tris(fosforan (V))pentawapnia

Uwaga:
Przedrostki „di”, „tri” itd. oznaczają jony skondensowane, np.:
difosforan (V) oznacza P
2
O
7
4-
(nazwa zwyczajowa pirofosforan),
natomiast
bis(fosforan (V) oznacza dwa aniony PO
4
3-
(nazwa zwyczajowa
ortofosforan), czyli (PO
4
3-
)
2

Nazwy soli uwodnionych (hydraty)
Sole, które zawierają wodę krystalizacyjną, czyli takie, które
wydzielają się w postaci kryształów zawierających cząsteczki wody
w sieci krystalicznej nazywamy
hydratami
.
Nazewnictwo takich soli podaje na początku liczbę cząsteczek wody
i słowo „hydrat, następnie nazwę soli.
Przykłady:
Na
2
CO
3
x
10 H
2
O dziesięciohydrat węglanu sodu
MgSO
4
x
7 H
2
O siedmiohydrat siarczanu (VI) magnezu
AlK(SO
4
)
2
x
12 H
2
O dwunastohydrat siarczanu (VI) glinu i potasu

Związki koordynacyjne
Związki koordynacyjne mogą między innymi stanowić szczególną
grupę soli, wodorotlenków lub kwasów, w których występuje tzw.
wiązanie koordynacyjne.
Wiązanie koordynacyjne, to wiązanie, w którym para elektronowa
tworząca to wiązanie pochodzi od tylko jednego z atomów
uczestniczących w tym wiązaniu.
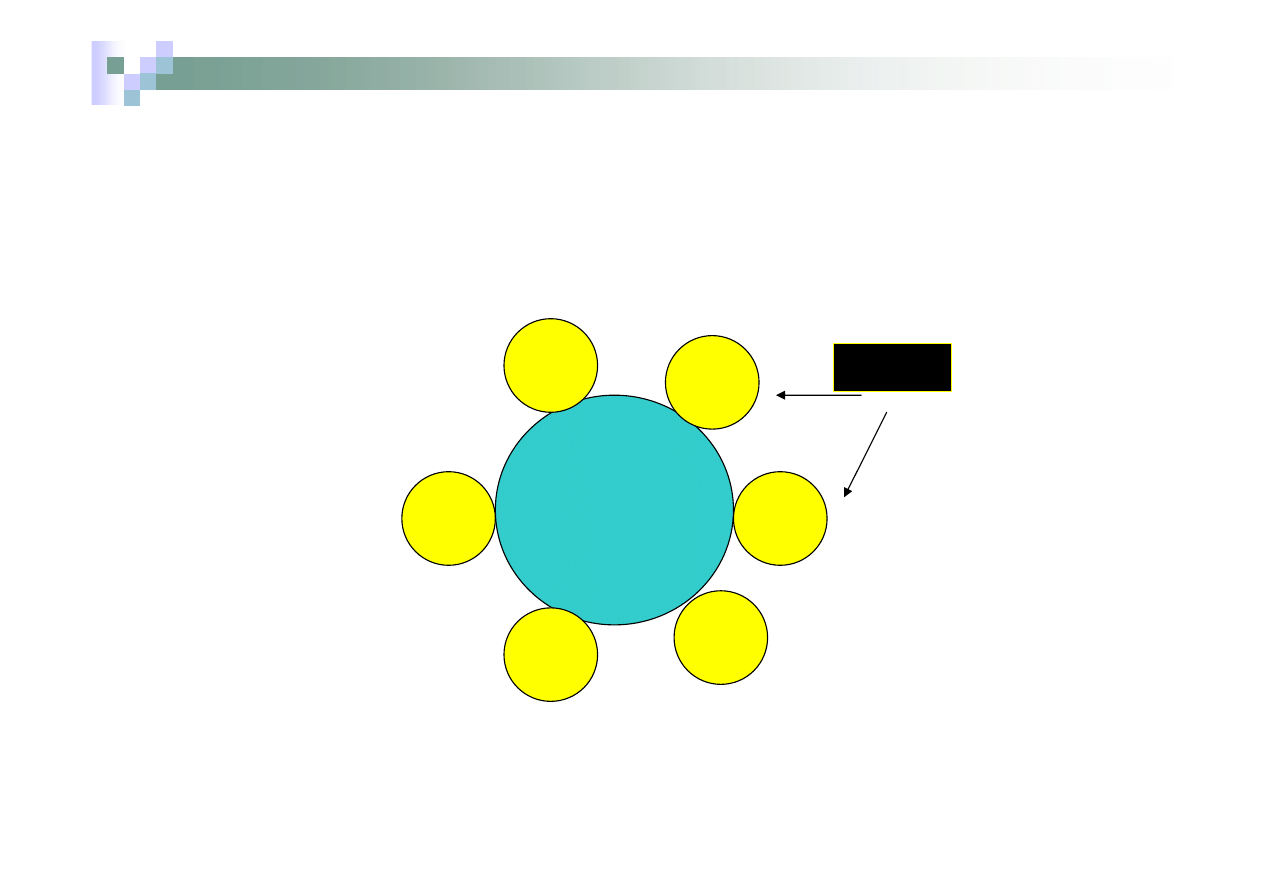
Związki koordynacyjne posiadają w swojej budowie centrum
koordynacji (jest nim atom lub jon centralny, którym jest zwykle
metal)- otoczony zespołami cząsteczek, atomów lub jonów (tzw.
ligandów), które są donorami par elektronowych we wiązaniu z
centrum koordynacji.
Liczbę ligandów dołączonych do centrum koordynacji, nazywamy
liczbą koordynacyjną. Liczba koordynacyjna może przyjmować
wartości 1,2,3,4,5,6,8,12. Szczególnie uprzywilejowane są liczby
2,4,6.
Utworzony kompleks może być kationem, anionem lub cząsteczką
obojętną (zależy to od ładunku centrum koordynacji i ładunków
ligandów).
Związek lub jon kompleksowy
Jon
lub
atom
centralny
ligandy
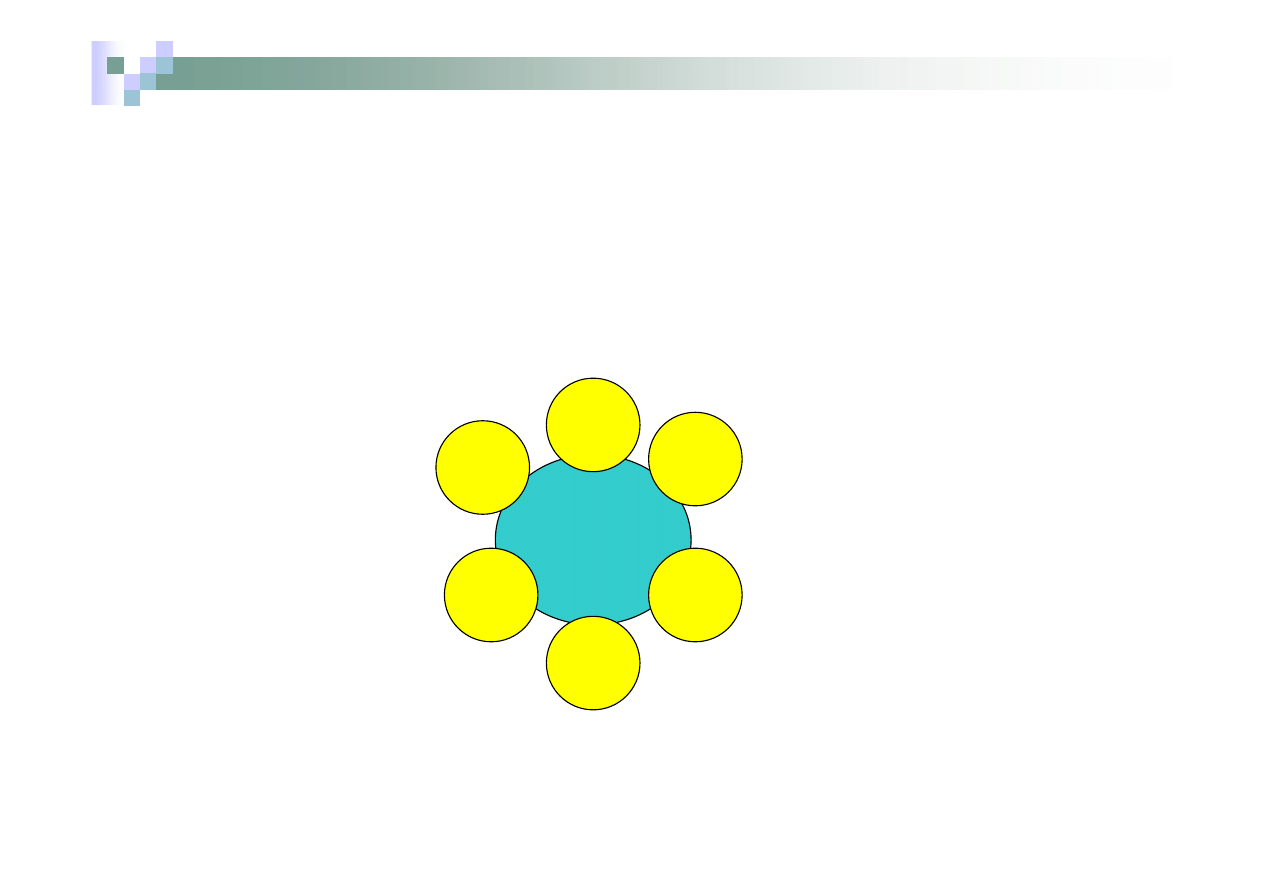
Związek lub jon kompleksowy np. K
3
[Fe(CN)
6
]
Jon kompleksowy-anion
Kation
np.
Fe
3+
CN
-
CN
-
CN
-
CN
-
CN
-
CN
-
Ładunek jonu =
6
.
(-1) + (+3)= -3
Liczba koordynacyjna = 6
Ligandy aniony CN
-
Jon heksacyjanożelaza (III)
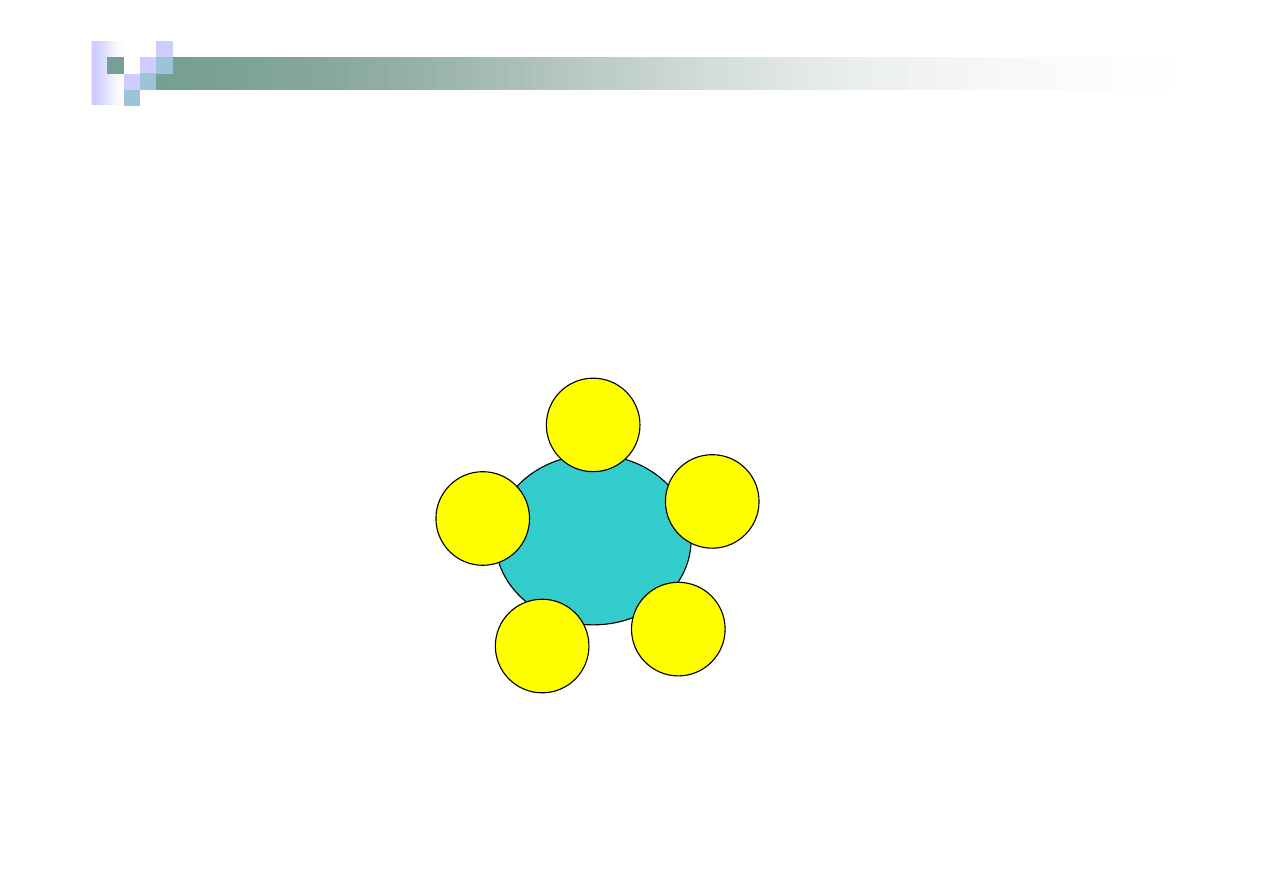
Związek lub jon kompleksowy np.[ Ag(NH
3
)
2
]OH
Jon kompleksowy-kation
Kation
np.
Ag
+
NH
3
Ładunek jonu =
+1 – 2
.
O = +1
NH
3
Ligandy – cząsteczki NH
3
Liczba koordynacyjna = 2
Jon (kation) diaminasrebra
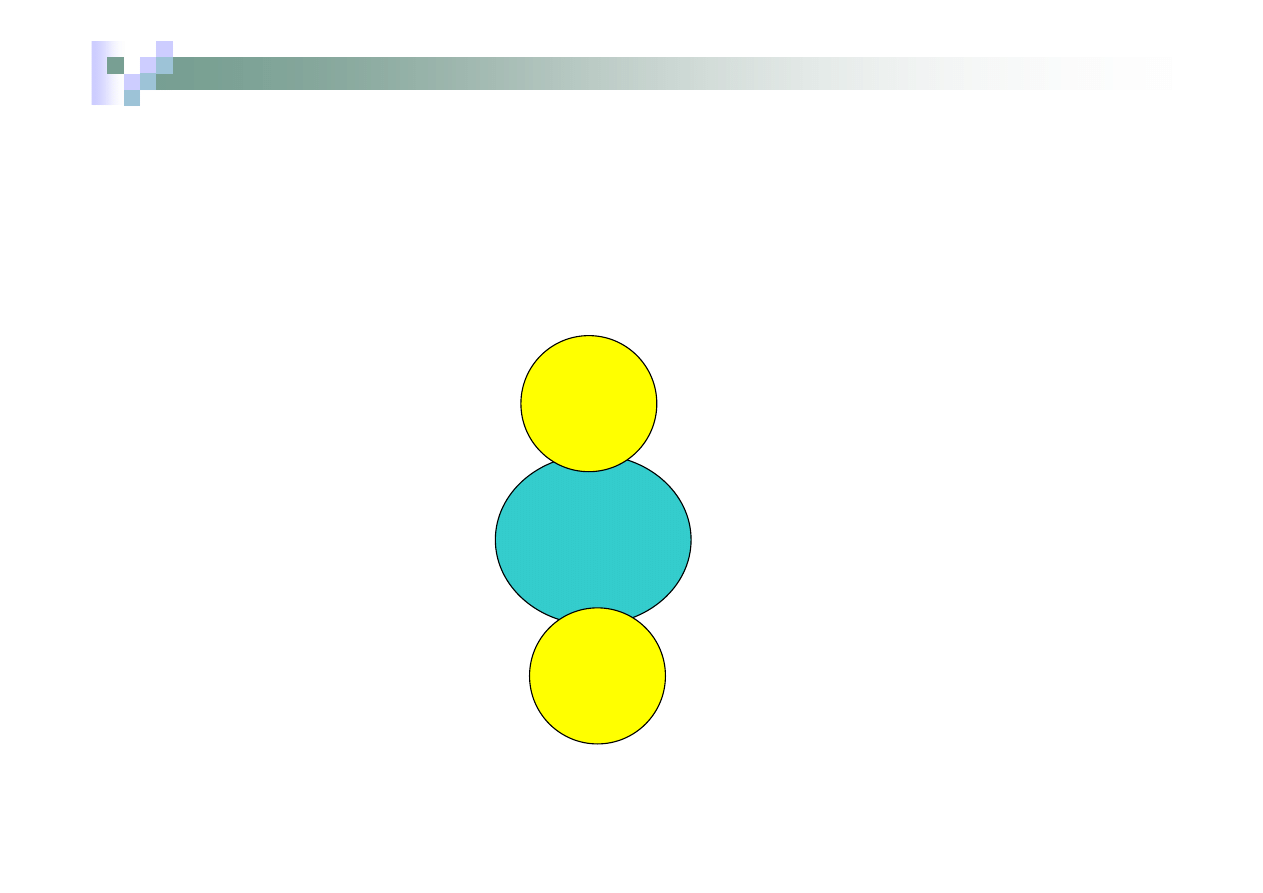
Związek lub jon kompleksowy
Związek kompleksowy
Fe
atom
CO
Ładunek =
0 + 5
.
0= 0
Liczba koordynacyjna =5
Ligandy cząsteczki CO
Pentakarbonylżelazo (0)
CO
CO
CO
CO

Liczbę ligandów (liczbę koordynacyjną) obliczamy w
następujący sposób:
od liczby elektronów gazu szlachetnego leżącego w układzie
okresowym za pierwiastkiem stanowiącym centrum koordynacji,
odejmujemy liczbę elektronów, jaka posiada atom lub jon
stanowiący centrum koordynacji;
otrzymany wynik dzielimy przez dwa (ponieważ każde wiązanie
stanowi para elektronowa , zatem ligand dostarcza do wiązania dwa
elektrony);
jeżeli w wyniku otrzymamy liczbę niecałkowitą, wynik zaokrąglamy
do liczby całkowitej

Przykład:
Kation Fe
3+
atom najbliższego gazu szlachetnego leżącego za żelazem to
Krypton
Kr
zawierający
36
elektronów;
atom
Fe
ma
26
elektronów,
natomiast jon
Fe
3+
ma: 26 – 3 =
23
elektrony.
różnica wynosi
36
–
23
= 13
czyli liczba liganów wynosi 13:2 = 6,5 (ponieważ szczególnie
uprzywilejowane jest liczba 6, a liczba 7 jako liczba koordynacyjne
nie występuje) , zatem liczba koordynacyjna wynosi w tym
przypadku 6.

Alternatywnym sposobem określania liczby koordynacyjnej jest
reguła, mówiąca, że liczba koordynacyjna jest podwojoną wartością
ładunku kationu, czyli:
¾
dla kationu jednododatniego (np.: Ag
+
) liczba koordynacyjna
wynosi 2
¾
dla kationu dwudodatniego (np.: Cu
+2
) liczba koordynacyjna
wynosi 4
¾
dla kationu trójdodatniego - 6.
Od podanej uproszczonej reguły występują jednak odstępstwa.
Niektóre kationy mogą tworzyć związki koordynacyjne więcej niż
jednej liczbie koordynacyjnej.
Przykład:
Zn(NH
3
)
4
2+
, Zn(NH
3
)
6
2+

Przykłady otrzymywania związków lub jonów kompleksowych
AgCl↓ + 2 NH
3
x
H
2
O →
[Ag(NH
3
)
2
]
+
+ Cl
-
+ 2H
2
O
(1)
Zn (OH)
2
+ 4 NH
3
x
H
2
O →
[Zn(NH
3
)
4
]
2+
+ 4H
2
O
(2)
FeCl
2
+ 6 KCN → K
4
[Fe (CN)
6
]
+ 2KCl
(3)
We wzorach jonów kompleksowych
(1) i (2)
liczba ligandów jest zgodna
z podaną uproszczoną regułą,
natomiast dla związku kompleksowego
(3)
liczba ligandów odpowiada
liczbie wynikającej z obliczeń (36-24): 2 = 6
Zapis jonu kompleksowego:
we wzorze złożonego jonu kompleksowego na początku umieszcza się symbol
atomu centralnego, a następnie ligandy anionowe , później obojętne , a na
końcu ligandy dodatnie. Jeżeli ligandy mają ten sam znak ładunku, wymienia
się je w kolejności alfabetycznej.
Jony kompleksowe zapisujemy w nawiasach kwadratowych.

Nazewnictwo związków koordynacyjnych
¾
Nazwy związków koordynacyjnych zawierających
kation kompleksowy
tworzy się podając nazwę anionu a następnie
nazwę kationu kompleksowego, w której określamy liczbę ligandów,
ich nazwy tworzą jeden wyraz z nazwę atomu centralnego (stopień
utlenienia atomu (jonu) centralnego podaje się zgodnie z systemem
Stocka, czyli stosując cyfry rzymskie w nawiasie).
Liczba ligandów podawana jest z wykorzystaniem liczebników
greckich w formie przedrostków:
mono- = jedno-, di- = dwu-, tri- = trój-, tetra- = cztero-, penta- = pięcio-,
heksa- = sześcio-, hepta- = siedmio-, okta- = ośmio-.
Dopuszczalne jest zastosowanie liczebników polskich.
Liczebnik mono- czyli jedno- jest pomijany przy podawaniu nazwy
związku.

¾
Nazwy związków koordynacyjnych zawierających anion
kompleksowy
podaje się określając liczby ligandów i ich nazwy
połączonych z atomem centralnym a następnie nazwy atomu
centralnego z końcówką
–an
. Po nazwie atomu (lub jonu)
centralnego umieszcza się jego stopień utlenienia wg systemu
Stocka (cyfra rzymska w nawiasie). W zakończeniu nazwy podaje
się liczbę i nazwę kationu (kationów).
¾
Nazwy związków kompleksowych, które nie zawierają jonów
kompleksowych
tworzy się przez podanie liczby i nazwy ligandów ,
a na końcu nazwy atomu centralnego.
Nazwy ligandów o ładunku dodatnim lub ujemnym mają końcówkę
–o.
Ligandy obojętne mają w nazwie końcówkę: -a, -yl, -il.

Nazwy wybranych ligandów nieorganicznych:
Ligand
Nazwa
Ligand
Nazwa
F
-
fluoro
OH
-
hydrokso
Br
-
bromo
S
2
O
3
2-
tiosiarczano
I
-
jodo
SCN
-
tiocyjaniano
O
2-
okso
NH
2
-
amido
S
2-
tio
C
2
O
4
2-
szczawiano
Cl
-
chloro
CO
karbonyl (można
też spotkać
karbonylo)
NO
2
-
azotyno
(nitrito-N
lub nitrito-O)
H
2
O
akwa
NH
2-
imido
NH
3
amina
CN
-
cyjano
NO
nitrozyl (można
też spotkać
nitrozylo)

Przykłady nazewnictwa związków koordynacyjnych
¾
Nazwy związków koordynacyjnych zawierających
kation kompleksowy
[Ag (NH
3
)
2
] (OH) wodorotlenek diaminasrebra (I)
[Zn(NH
3
)
4
]Cl
2
dichlorek tetraminacynku (II)
[CoCl
2
(NH
3
)
4
]Cl – chlorek tetraaminadichlorokobaltu(III)
[Pt(NH
3
)
6
]Cl
4
– chlorek heksaaminaplatyny(IV)

¾
Nazwy związków koordynacyjnych zawierających anion
kompleksowy
K
3
[Fe(CN)
6
] heksacyjanożelazian(III) tripotasu lub heksacyjanożelazian
(III) potasu
dawniej żelazicyjanek potasu
K
4
[Fe(CN)
6
] heksacyjanożelazian(II) tetrapotasu lub
heksacyjanożelazian (II) potasu
dawniej żelazocyjanek potasu
Fe
4
[Fe(CN)
6
]
3
heksacyjanożelazian (II) żelaza (III) – „błękit pruski”
Fe
3
[Fe(CN)
6
]
2
heksacyjanożelazian (III) żelaza (II) – „błękit Turnbulla”
Na
2
[Fe(CN)
5
NO] pentacyjanonitrozylżelazian (III) disodu
Na
2
[HgI
4
] – tetrajodortęcian (II) sodu
K
4
[Fe(CN)
6
] - heksacyjanożelazian(II) potasu
[Ag (NH
3
)
2
]
2
SO
4
– siarczan (VI) diaminasrebra (I)
(NH
4
)
3
[Fe(SCN)
6
] heksatiocyjanioanozelazian (III)amonu

¾
Nazwy związków kompleksowych, które nie zawierają jonów
kompleksowych
tworzy się przez podanie liczby i nazwy ligandów ,
a na końcu nazwy atomu centralnego
Fe (CO)
5
pentakarbnylżeloazo (0) dawniej pentakarbonylożelazo (0)
Document Outline
- Wykłady z chemii ogólnej
- Podręczniki
- Harmonogram ćwiczeń
- Regulamin zaliczenia ćwiczeń i wykładów
- Klasyfikacja i nazewnictwo związków nieorganicznych
- Związki nieorganiczne
- Podział tlenków
- Właściwości chemiczne tlenków
- Tlenki zasadowe
- Tlenki kwasowe
- Tlenki amfoteryczne
- Tlenki obojętne
- Nazewnictwo tlenków cd
- Nazewnictwo tlenków cd
- Nazewnictwo tlenków cd
- Nadtlenki
- Nazwy wodorków
- Nazwy wodorków
- Zasady w świetle teorii Arrheniusa
- Słabe zasady
- Nazewnictwo wodorotlenków (przykłady)
- Kwasy w świetle teorii Arrheniusa
- Kwasy słabe
- Nazewnictwo kwasów
- Otrzymywanie kwasów
- Otrzymywanie kwasów c.d.
- Właściwości fizyczne
- Właściwości chemiczne
- Sole
- Właściwości fizyczne
- Właściwości chemiczne
- Nazewnictwo soli Sole obojętne MnRm
- Nazwy wodorosoli („sole kwaśne”) Mn(HR)m
- Hydroksosole („sole zasadowe” dawniej hydroksysole) [M(OH)k]nRm
- Nazwy hydroksosoli
- Sole złożone
- Nazwy soli uwodnionych (hydraty)
- Związki koordynacyjne
- Związek lub jon kompleksowy
- Związek lub jon kompleksowy np. K3[Fe(CN)6]
- Związek lub jon kompleksowy np.[ Ag(NH3)2]OH
- Związek lub jon kompleksowy
- Przykłady otrzymywania związków lub jonów kompleksowych
- Nazewnictwo związków koordynacyjnych
- Nazwy wybranych ligandów nieorganicznych:
- Przykłady nazewnictwa związków koordynacyjnych
Wyszukiwarka
Podobne podstrony:
2011Wykład2część2 5fantastic pl
2011Wykład3cz1analiza kationów 5fantastic pl
2011Wykład2część1 5fantastic pl
fizjologia 5fantastic pl
POPRAWA WSZYSTKICH KOLOKWIËW. 5fantastic.pl , Ćwiczenia
Osocze a mocz. 5fantastic.pl , Ćwiczenia
Zjazd5s1 v2. 5fantastic.pl , Ćwiczenia
egzocytoza2000 5fantastic pl
wykład 1. 5fantastic.pl , Ćwiczenia
podstawy chemii ogolnej temat 5
podstawy produkcji roślinnej. 5fantastic.pl , Ćwiczenia(2)
Dobrostan owiec. 5fantastic.pl , Wykłady(1)
więcej podobnych podstron