Wykład 2
część 2
Reakcje przebiegające
w roztworach wodnych

Hydroliza soli
Rozpuszczaniu w wodzie niektórych soli towarzyszą reakcje jonów tych
soli (powstałych w roztworze w wyniku ich dysocjacji)
z cząsteczkami wody.
Rozpatrzmy zachowanie w wodzie soli pochodzących od różnych
kwasów (mocnych i słabych) oraz zasad (mocnych i słabych).
Omówimy zachowanie w wodzie soli:
słabej zasady i mocnego kwasu
słabego kwasu i mocnej zasady
słabej zasady i słabego kwasu
mocnego kwasu i mocnej zasady

Hydroliza soli
Sól mocnego kwasu i słabej zasady, np:
NH
4
Cl chlorek amonu (sól
mocnego kwasu HCl
i
słabej zasady
NH
3
.
H
2
O
)
H
2
O
NH
4
Cl →
NH
4
+
+ Cl
-
(sól rozpuszczalna w H
2
O, całkowicie
zdysocjowana na jony)
powstające w wyniku dysocjacji soli jony NH
4
+
reagują
z cząsteczkami wody
NH
4
+
+ H
2
O
NH
3
.
H
2
O + H
+
(tworzy się słaba niezdysocjowana zasada, kationy NH
4
+
wiążą
aniony OH
-
pochodzące z wody, w środowisku reakcji pojawiają się
kationy H
+
)
Możemy również spotykać zapis:
NH
4
+
+ H
2
O NH
3
+ H
3
O
+
(H
3
O
+
= w uproszczeniu H
+
)
Cl
-
+ H
2
O aniony Cl
-
nie reagują
z cząsteczkami wody i nie tworzą
niezdysocjowanych cząsteczek HCl z H
+
pochodzącymi z H
2
O, ponieważ
HCl jest kwasem mocnym całkowicie zdysocjowanym w H
2
O na jony
H
+
+ Cl
-
również pojawiające się w środowisku reakcji H
+
(H
3
O
+
) nie reagują Cl
-
i nie tworzą niezdysocjowanych cząsteczek mocnego kwasu
Zapis cząsteczkowy reakcji hydrolizy NH
4
Cl nie jest zapisem
oddającym poprawnie istotę tej reakcji, ponieważ nie
odzwierciedla rzeczywistego przebiegu reakcji, w której faktycznie z
cząsteczkami wody reaguje kation NH
4
+
powstający w wyniku
dysocjacji soli pod wpływem cząsteczek wody.
Podany zapis nie wyjaśnia odczynu soli hydrolizującej,
nie należy
go stosować:
NH
4
Cl + H
2
O
NH
4
OH + HCl (
zapis nieprawidłowy
)
Zapis jonowy (pełny) jest bardziej poprawny
NH
4
+
+ Cl
-
+ H
2
O
NH
3
.
H
2
O + H
+
+
Cl
-
Zapis jonowy skrócony oddaje istotę przebiegającej reakcji:
NH
4
+
+ H
2
O NH
3
.
H
2
O +
H
+
Odczyn roztworu: kwaśny
(wskazuje na to pojawienie się w
środowisku reakcji hydrolizy - kationów
H
+
)
Hydroliza kationowa,
ponieważ reakcji z cząsteczkami wody
ulegają kationy tej soli.

Prawidłowy zapis reakcji hydrolizy tej soli:
H
2
O
NH
4
Cl NH
4
+
+ Cl
-
( α = 1, sól całkowicie dysocjuje na jony)
NH
4
+
+ H
2
O
NH
3
.
H
2
O +
H
+
Odczyn kwaśny, czyli pH < 7

Hydroliza soli
Sól słabego kwasu i mocnej zasady, np:
NaNO
2
(sól
słabego kwasu HNO
2
kwas azotowy (III)
i
sól
mocnej zasady NaOH wodorotlenek sodu)
H
2
O
NaNO
2
→
Na
+
+ NO
2
-
(sól rozpuszczalna w H
2
O całkowicie zdysocjowana na jony α =1)
powstające w wyniku dysocjacji soli jony NO
2
-
reagują
z cząsteczkami
wody
NO
2
-
+ H
2
O
HNO
2
+ OH
-
(
tworzy się słaby niezdysocjowany kwas, aniony NO
2
-
pobierają kationy
H
+
od cząsteczek wody, w środowisku reakcji pojawiają się aniony OH
-
)
Na
+
+ H
2
O
kationy Na
+
nie reagują z H
2
O
i nie tworzą niezdysocjowanych cząsteczek NaOH z OH
-
,
ponieważ NaOH jest mocną zasadą całkowicie zdysocjowaną w H
2
O na jony
Na
+
+ OH
-

Zapis cząsteczkowy reakcji hydrolizy NaNO
2
nie jest zapisem oddającym
poprawnie istotę tej reakcji, ponieważ nie odzwierciedla rzeczywistego
przebiegu reakcji, w której faktycznie z cząsteczkami wody reaguje anion
NO
2
-
powstający w wyniku dysocjacji soli pod wpływem cząsteczek wody.
Podany zapis nie wyjaśnia odczynu soli hydrolizującej nie należy go
stosować
NaNO
2
+ H
2
O HNO
2
+ NaOH )
zapis nieprawidłowy
Nie należy stosować takiego zapisu.
Poprawniejszy jest zapis jonowy (pełny)
Na
+
+ NO
2
-
+ H
2
O HNO
2
+ Na
+
+ OH
-
Zapis jonowy skrócony oddaje istotę tej reakcji:
NO
2
-
+ H
2
O HNO
2
+
OH
-
Odczyn roztworu: zasadowy
(wskazuje na
to pojawienie się w
środowisku reakcji hydrolizy anionów
OH
-
).
Hydroliza anionowa, bo reakcji z cząsteczkami wody ulegają
aniony soli.

Prawidłowy zapis reakcji hydrolizy tej soli:
H
2
O
NaNO
2
→
Na
+
+ NO
2
-
( α = 1, sól całkowicie dysocjuje na jony)
NO
2
-
+ H
2
O
HNO
2
+
OH
-
Odczyn zasadowy pH > 7

Hydroliza soli
Sól słabego kwasu i słabej zasady, np:
NH
4
NO
2
(sól
słabego kwasu HNO
2
kwas azotowy (III)
i
słabej zasady
NH
3
.
H
2
O
)
NH
4
NO
2
→ NH
4
+
+ NO
2
-
(sól rozpuszczalna w H
2
O, α = 1)
powstające w wyniku dysocjacji soli jony (
kationy
i
aniony
) reagują z
cząsteczkami wody
NO
2
-
+ H
2
O
HNO
2
+ OH
-
(
tworzy się słaby niezdysocjowany kwas, ponieważ aniony NO
2
-
pobierają
kationy H
+
od cząsteczek wody, więc w środowisku reakcji pojawiają się
aniony OH
-
)
NH
4
+
+ H
2
O
NH
3
.
H
2
O + H
+
(
lub NH
4
+
+
H
2
O
H
3
O
+
+ NH
3
)
(tworzy się słaba niezdysocjowana zasada, kationy NH
4
+
wiążą aniony OH
-
od
cząsteczek wody w środowisku wodnym w wyniku tej reakcji pojawiają się
kationy H
+
)
Kationy H
+
i aniony OH
-
tworzą niezdysocjowane cząsteczki wody
H
+
+ OH
-
→ H
2
O

Zapis cząsteczkowy reakcji hydrolizy nie jest zapisem oddającym
poprawnie istotę tej reakcji, ponieważ nie odzwierciedla rzeczywistego
przebiegu reakcji, w której faktycznie z cząsteczkami wody reaguje
zarówno anion NO
2
-
jak i kation NH
4
+
powstające w wyniku dysocjacji
soli pod wpływem cząsteczek wody. Zatem zapisu cząsteczkowego
nie należy stosować.
NH
4
NO
2
+ H
2
O
NH
4
OH + HNO
2
zapis nieprawidłowy, nie należy
stosować takiego zapisu
Zapis jonowy (pełny)
NH
4
+
+ NO
2
-
+ H
2
O
NH
3
.
H
2
O + HNO
2
Zapis jonowy skrócony w tym przypadku jest identyczny z zapisem pełnym:
NH
4
+
+ NO
2
-
+ H
2
O
NH
3
.
H
2
O + HNO
2
Odczyn roztworu: zbliżony do obojętnego
(w środowisku reakcji hydrolizy nie
pojawiają się aniony
OH
-
ani kationy
H
+
)
Hydroliza anionowo-kationowa, ponieważ reakcji z cząsteczkami
wody ulegają zarówno aniony jaki kationy soli.
Prawidłowy zapis reakcji hydrolizy tej soli:
H
2
O
NH
4
NO
2
→
NH
4
+
+ NO
2
-
( α = 1, sól całkowicie dysocjuje na jony)
hydroliza
NH
4
+
+ NO
2
-
+ H
2
O
HNO
2
+ NH
3
.
H
2
O
zobojętnianie
W środowisku reakcji nie pojawiają się kationy H
+
(H
3
O
+
)
ani aniony OH
-
Odczyn roztworu jest zbliżony do obojętnego (czyli pH ≈ 7).

Należy zdawać sobie sprawę, że odczyn soli słabego kwasu i słabej
zasady nie musi być idealnie obojętny, czyli pH nie musi być dokładnie
= 7 .
O odczynie będzie decydować moc słabego kwasu i moc słabej
zasady, co wyrażamy za pomocą wartości stałej dysocjacji kwasu i
zasady.
Jeżeli
stała dysocjacji kwasu
będzie większa
niż
stała dysocjacji zasady
(czyli kwas będzie mocniejszym kwasem niż
zasada) to odczyn takiej soli będzie lekko kwaśny,
jeżeli zasada będzie mocniejsza niż kwas tworzący tę sól,
to odczyn będzie soli będzie lekko zasadowy.
Jeżeli nie znamy wartości stałych dysocjacji słabego kwasu i słabej
zasady zaznaczamy, że w tym przypadku odczyn jest zbliżony do
obojętnego
czyli pH ≈ 7.

Hydroliza soli
Sól
mocnego kwasu
i
mocnej zasady,
np:
NaCl chlorek sodu (sól
mocnego kwasu HCl
i
mocnej zasady NaOH wodorotlenek sodu)
NaCl → Na
+
+ Cl
-
(sól rozpuszczalna w H
2
O, całkowicie
zdysocjowana na jony)
Na
+
+ H
2
O → kationy Na
+
nie reagują z H
2
O i nie tworzą
niezdysocjowanych cząsteczek NaOH z OH
-
, ponieważ NaOH jest
mocną zasadą całkowicie zdysocjowaną w H
2
O na jony
Cl
-
+ H
2
O →
aniony Cl
-
nie reagują z H
2
O i nie tworzą
niezdysocjowanych cząsteczek HCl , ponieważ HCl jest mocnym
kwasem całkowicie zdysocjowanym w H
2
O na jony
Na
+
+ Cl
-
+ H
2
O → reakcja nie przebiega
Odczyn roztworu: obojętny
(reakcja hydrolizy
nie przebiega
w
roztworze nie pojawiają się aniony
OH
-
ani kationy
H
+
)

Również w tej reakcji lepiej nie zapisywać tej reakcji cząsteczkowo,
jeżeli chcemy pokazać, że jony powstałe w wyniku dysocjacji nie
reagują z cząsteczkami H
2
O.
NaCl + H
2
O → reakcja nie przebiega
Poprawny zapis:
Na
+
+
Cl
-
+ H
2
O → reakcja nie przebiega
Odczyn roztworu jest obojętny, ponieważ mamy do czynienia z
roztworem, w którym nie występują w nadmiarze jony H
+
ani jony
OH
-

Badanie odczynu roztworów wodnych
Do stwierdzenia charakteru odczynu roztworu wodnego wykorzystuje
się specjalne substancje zwane wskaźnikami. Wskaźniki zmieniają
zabarwienie w zależności od stężenia jonów H
+
w roztworze
wodnym.
Roztwór ma odczyn kwaśny, jeżeli stężenie tych jonów (H
+
)
jest
większe niż stężenie jonów OH
-
.
Roztwór ma odczyn obojętny jeżeli stężenie kationów H
+
= stężeniu
anionów OH
-,
czyli w roztworze występują praktycznie tylko
niezdysocjowane cząsteczki wody
.
Jeżeli w roztworze występują nadmiar OH
-
w stosunku kationów
H
+
(H
3
O
+
) i w związku z powyższym nie są one związane w
niezdysocjowane cząsteczki wody roztwór ma charakter zasadowy.

Dla określenia odczynu wodnego roztworu stosowana jest skala pH
(jest to skala, wg której stężenie jonów H
+
, z uwagi na podaje
bardzo niewielkie wartości tego stężenia się w postaci
ujemnego logarytmu pH =
-
log [H
+
].
Zgodnie z tą skalą roztwór obojętny ma pH = 7,
roztwory o pH < 7, to roztwory o odczynie kwaśnym
roztwory o pH > 7 to roztwory o odczynie zasadowym.
Do określania odczynu roztworu można wykorzystywać roztwory
pojedynczych wskaźników,
lub tzw. papierki wskaźnikowe nasączone wieloma wskaźnikami, co
pozwala bardziej precyzyjnie określić odczyn roztworu.
Odczyn roztworu można także określić używając urządzeń zwanych
pH-metrami.

Roztwór HCl
z dodatkiem
oranżu metylowego
Roztwór NaOH
z dodatkiem
fenoloftaleiny
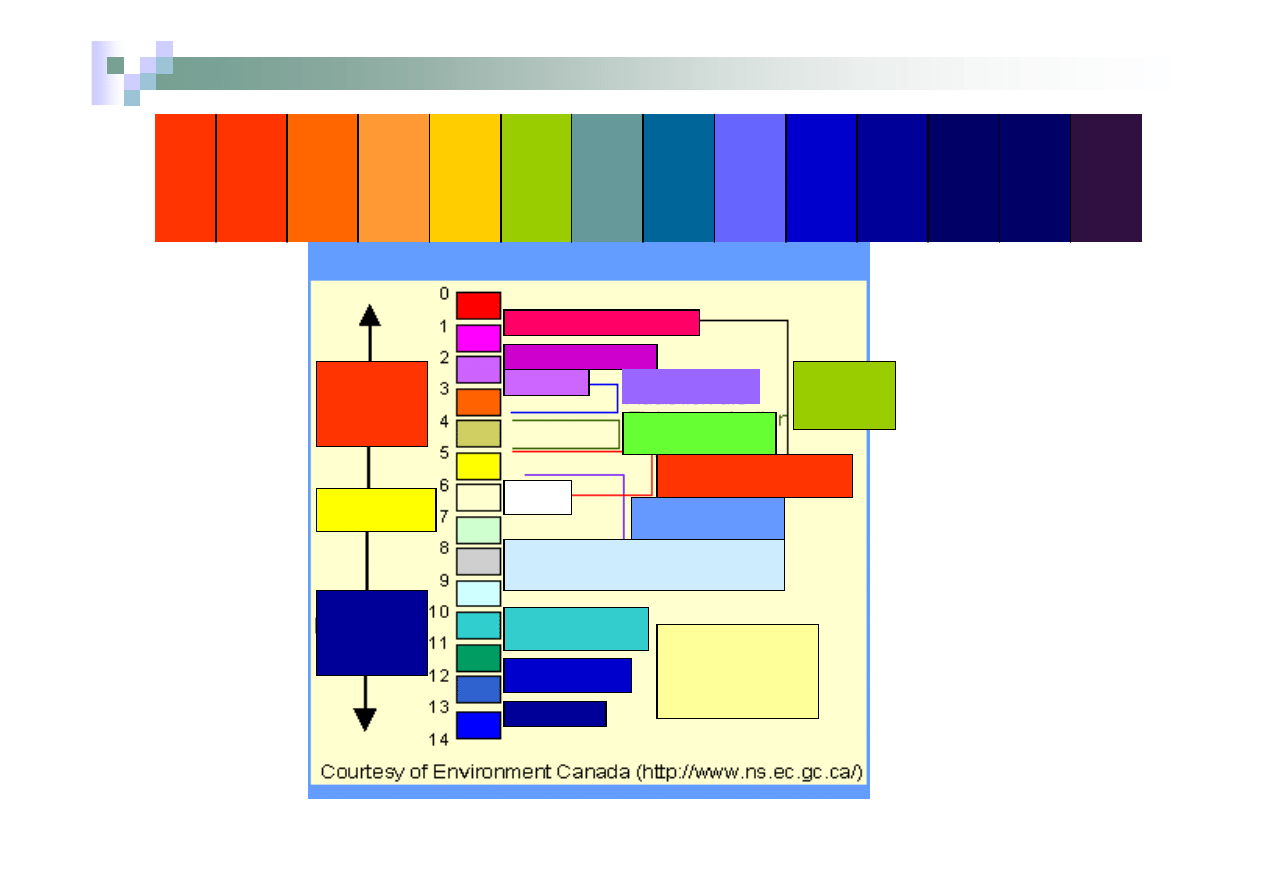
pH5
pH1
pH2
pH3
pH4
pH5
pH6
pH7
pH8
pH9
pH10
pH11
pH12
pH13
pH14
Kwas akumulatorowy
Sok cytrynowy
ocet
„Kwaśny”
deszcz
Zdechła ryba
Tarło
Zwykłe wody opadowe
Mleko
Para wodna
Proszek do pieczenia,
woda morska
Mleczko
magnezowe
amoniak
ług
Wzrost
kwasowości
Wzrost
zasadowości
obojętny
Skala pH

Zestaw papierków wskaźnikowych

Wskaźnik
pH
zmiany
barwy
Barwa dla
pH < pH
zm
Barwa dla
pH > pH
zm
Oranż metylowy
3.1 - 4.4
czerwona
pomarańczowa
Czerwień metylowa
4.4 - 6.2
czerwona
ż
ółta
Błękit bromotymolowy
6.2 -7.6
ż
ółta
niebieska
Fenoloftaleina
8.0 - 10.0
bezbarwna
malinowa
Ż
ółcień alizarynowa
10.0 -12.0
ż
ółta
zielona


pH-metr

Badanie odczynu soli hydrolizujących
Do 4 probówek zawierających sole dodano wody i za pomocą papierka
uniwersalnego zbadano ich odczyn. Badanymi solami były:
1)
Na
2
CO
3
2)
K
2
S
3)
ZnCl
2
4)
Al(NO
3
)
3
Napiszmy reakcje hydrolizy tych soli:
Na
2
CO
3
- sól mocnej zasady i słabego kwasu
2Na
+
+ CO
3
2-
+ 2H
2
O 2Na
+
+ 2OH
-
+ H
2
CO
3
Zapis skrócony, reakcja przebiega etapowo:
CO
3
2-
+ H
2
O HCO
3
-
+ OH
-
odczyn zasadowy
HCO
3
-
+ H
2
O H
2
CO
3
+ OH
-
odczyn zasadowy
Sumarycznie:
CO
3
2-
+ 2H
2
O 2OH
-
+ H
2
CO
3
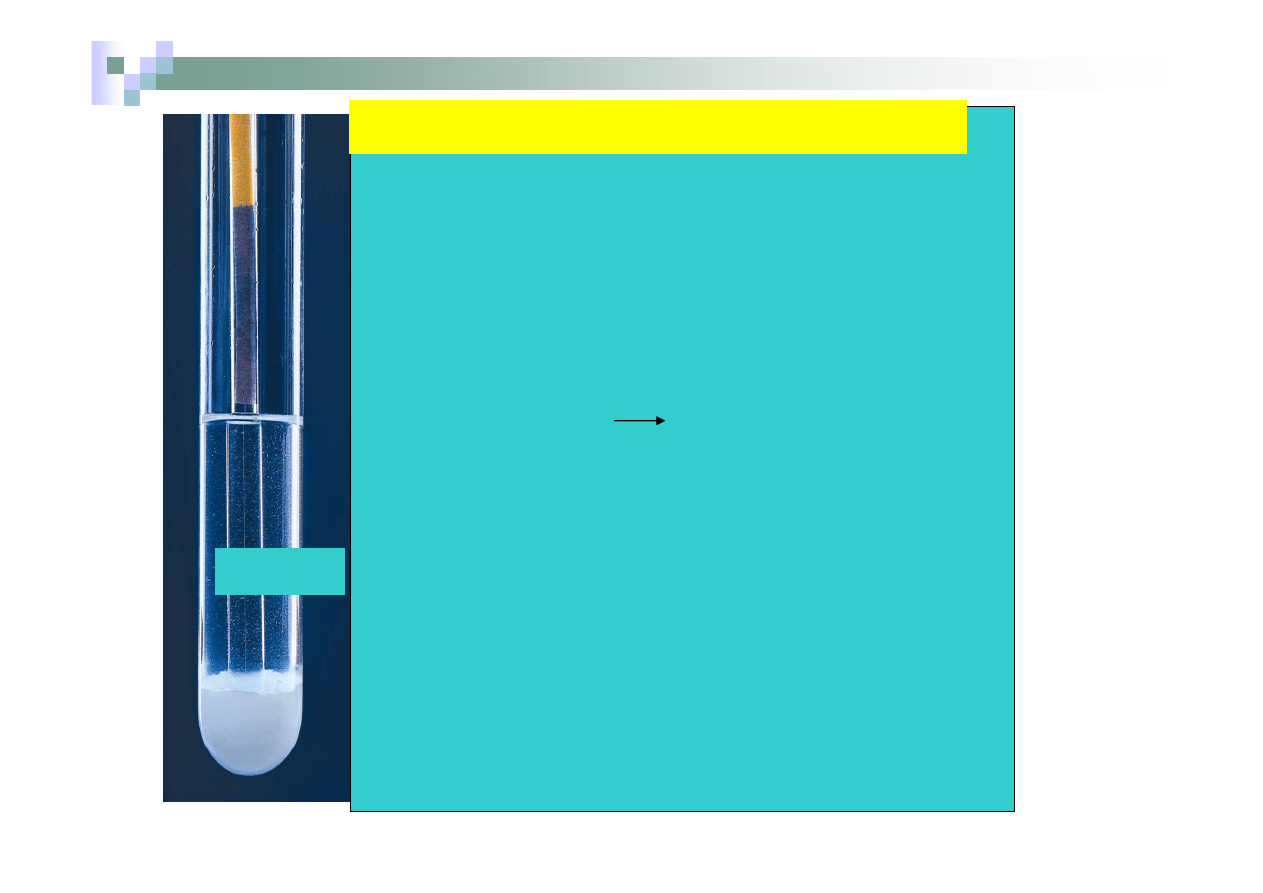
Badanie odczynu soli hydrolizujących
Na
2
CO
3
Na
2
CO
3
dysocjuje w wodzie na
jony
Na
2
CO
3
2Na
+
+CO
3
2-
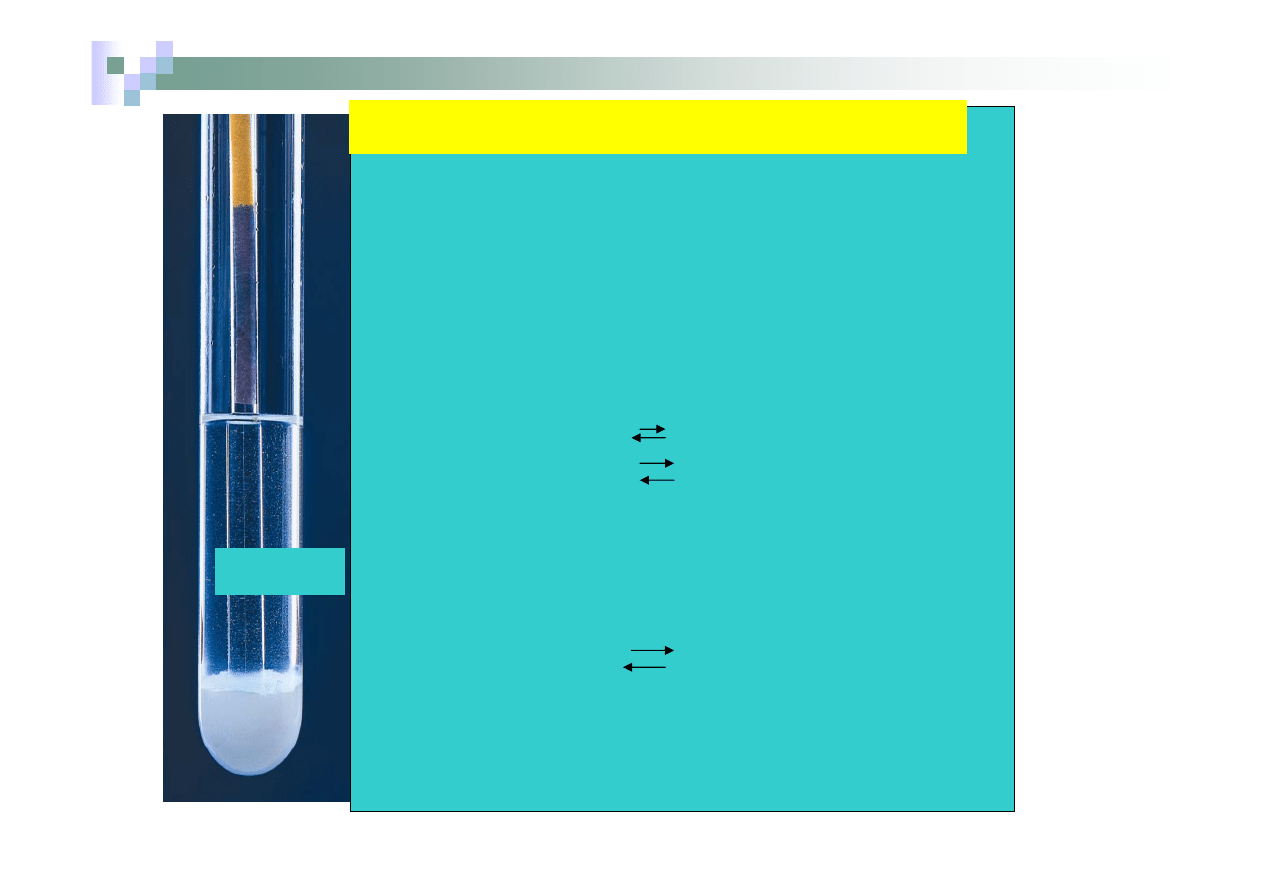
Zapis sumaryczny
CO
3
2-
+ 2H
2
O H
2
CO
3
+ 2OH
-
Badanie odczynu soli hydrolizujących
Na
2
CO
3
Kationy Na
+
nie reagują z cząsteczkami wody,
Aniony CO
3
2-
reagują z H
2
O
CO
3
2-
+ H
2
O HCO
3
-
+ OH
-
HCO
3
-
+ H
2
O CO
3
-
+ OH
-

K
2
S
Sól
mocnej zasady
KOH
i
słabego
kwasu H
2
S
K
2
S → 2K
+
+ S
2-
Zapis jonowy skrócony
reakcji anionu z wodą:
S
2-
+ H
2
O
HS
-
+ OH
-
HS
-
+ H
2
O
H
2
S + OH
-
Sumarycznie:
S
2-
+ 2H
2
O H
2
S + 2OH
-
K
2
S
Badanie odczynu
soli hydrolizujących

ZnCl
2
→
Zn
2+
+ 2Cl
-
ZnCl
2
Sól
słabej zasady
Zn(OH)
2
i
mocnego kwasu
HCl
ZnCl
2
Zn
2+
+ H
2
O Zn(OH)
+
+ H
+
Zn(OH)
+
+ H
2
O Zn(OH)
2
+ H
+
Zn
2+
+ 2H
2
O Zn(OH)
2
+ 2H
+
Kationy Zn
2+
reagują z
cząsteczkami H
2
O stopniowo:
Sumarycznie reakcja kationów
Zn
2+
z wodą:
Sól pod wpływem wody
dysocjuje:

Al(NO
3
)
3
Al(NO
3
)
2
Sól słabej zasady Al(OH)
3
i mocnego kwasu HNO
3
Al(NO
3
)
3
→ Al
3+
+ 3 NO
3
-
Al
3+
+ H
2
O Al(OH)
2+
+ H
+
Al(OH)
2+
+ H
2
O Al(OH)
2
+
+ H
+
Al(OH)
2
+
+ H
2
O Al(OH)
3
+ H
+
Sumarycznie:
Al
3+
+ 3H
2
O Al(OH)
3
+ 3H
+
Sól dysocjuje pod wpływem wody:
Kationy Al
3+
reagują z cząsteczkami wody
stopniowo:
Document Outline
- Wykład 2 część 2
- Hydroliza soli
- Hydroliza soli
- Hydroliza soli
- Hydroliza soli
- Hydroliza soli
- Badanie odczynu roztworów wodnych
- pH5
- Badanie odczynu soli hydrolizujących
Wyszukiwarka
Podobne podstrony:
2011Wykład2część1 5fantastic pl
2011Wykład1 chemii ogólnej 5fantastic pl
2011Wykład3cz1analiza kationów 5fantastic pl
2011Wykład1 chemii ogólnej 5fantastic pl
fizjologia 5fantastic pl
POPRAWA WSZYSTKICH KOLOKWIËW. 5fantastic.pl , Ćwiczenia
Osocze a mocz. 5fantastic.pl , Ćwiczenia
Zjazd5s1 v2. 5fantastic.pl , Ćwiczenia
egzocytoza2000 5fantastic pl
wykład 1. 5fantastic.pl , Ćwiczenia
podstawy produkcji roślinnej. 5fantastic.pl , Ćwiczenia(2)
Dobrostan owiec. 5fantastic.pl , Wykłady(1)
kolos 2. 5fantastic.pl , Ćwiczenia(1)
więcej podobnych podstron