Wykład 3
część 1
Analiza kationów

Systematyczna analiza kationów
Systematyczna analiza kationów pozwala podzielić
znane kationy na pięć grup analitycznych za pomocą
odczynników grupowych dających osady z
odpowiednimi grupami kationów.
Odczynnikami grupowymi są:
HCl (grupa I),
H
2
S w obecności HCl (grupa II),
H
2
S w obecności NH
3
.
H
2
O i NH
4
Cl (grupa III),
NH
4
CO
3
w obecności NH
3
.
H
2
O i NH
4
Cl ( grupa IV),
jeżeli w toku systematycznej analizy nie powstaje osad z
podanymi odczynnikami grupowymi, to kation należy do
grupy V.
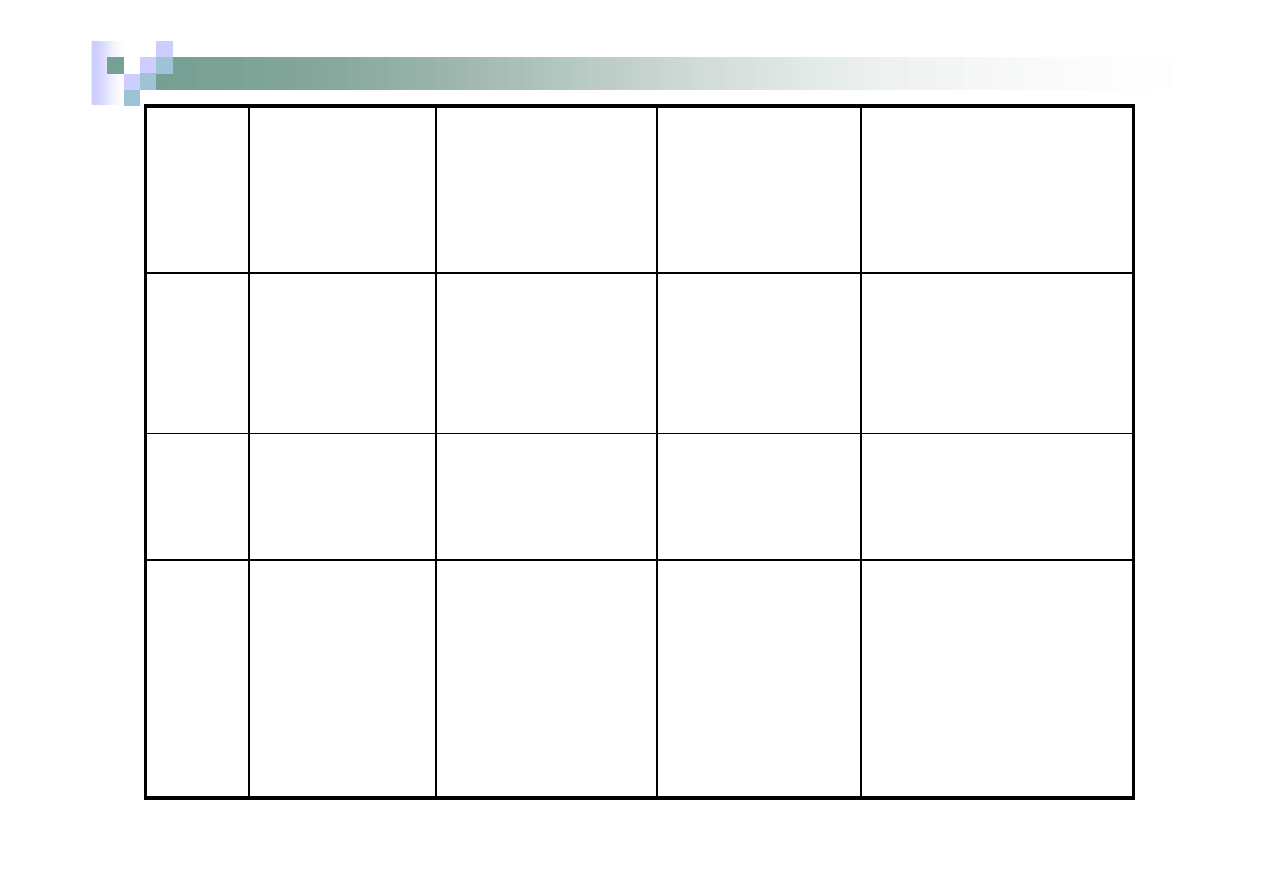
Nr
grupy
Odczynnik
grupowy
Kationy należące
do danej grupy
Skład i barwa
osadu
tworzonego
z odczynnikiem
grupowym
Rozpuszczalność
osadu
I
HCl
Ag
+
Pb
2+
Hg
2
2+
AgCl biały
PbCl
2
biały
Hg
2
Cl
2
biały
Osady
nierozpuszczalne w
H
2
O i w
rozcieńczonych
HCl i HNO
3
II
H
2
S
w obecności
HCl
Cu
2+
Hg
2+
As
3+
CuS czarny
HgS czarny
As
2
S
3
żółty
Osady
nierozpuszczalne w
H
2
O i w rozcieńczonym
HNO
3
(na zimno)
III
H
2
S
w obecności
NH
3
.
H
2
O i
NH
4
Cl
Al
3+
Zn
2+
Fe
2+
Fe
3+
Mn
2+
Co
2+
Al(OH)
3
biały
ZnS biały
FeS czarny
Fe
2
S
3
czarny
MnS cielisty
CoS czarny
Osady
nierozpuszczalne w
H
2
O, rozpuszczalne w
rozcieńczonych
kwasach
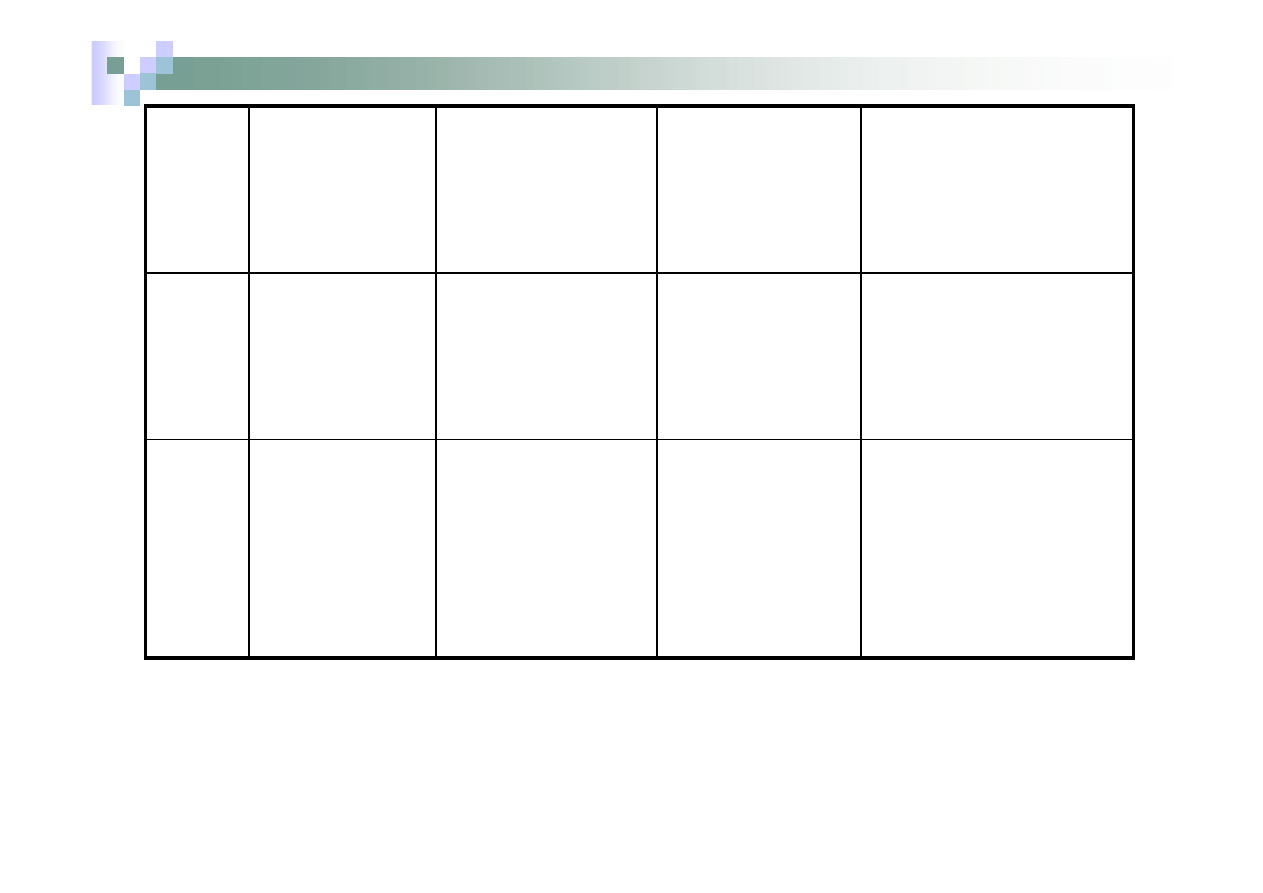
Nr
grupy
Odczynnik
grupowy
Kationy należące
do danej grupy
Skład i barwa
osadu
tworzonego
z odczynnikiem
grupowym
Rozpuszczalność
osadu
IV
(NH
4
)
2
CO
3
w obecności
NH
3
.
H
2
O i
NH
4
Cl
Ba
2+
Ca
2+
BaCO
3
biały
CaCO
3
biały
Osady
nierozpuszczalne w
H
2
O, rozpuszczalne w
rozcieńczonych
kwasach
V
Brak
odczynnika
grupowego
Mg
2+
K
+
NH
4
+
Nie wytracają
osadów
za pomocą
poprzednio
wymienionych
odczynników

Ponieważ H
2
S stosowany w jako odczynnik
grupowy dla grupy II i III jest uciążliwy
zapachowo i trudny do przechowywania, stosuje
się trwały roztwór amidu kwasu tiooctowego
(AKT).
Amid kwasu tiooctowego (AKT)
po ogrzaniu w obecności HCl wytwarza H
2
S
(odczynnik grupowy grupy II),
a ogrzewany w obecności NH
4
OH wytwarza
rozpuszczalną i zdysocjowaną w roztworze
wodnym sól (NH
4
)
2
S – odczynnik grupowy
grupy III.
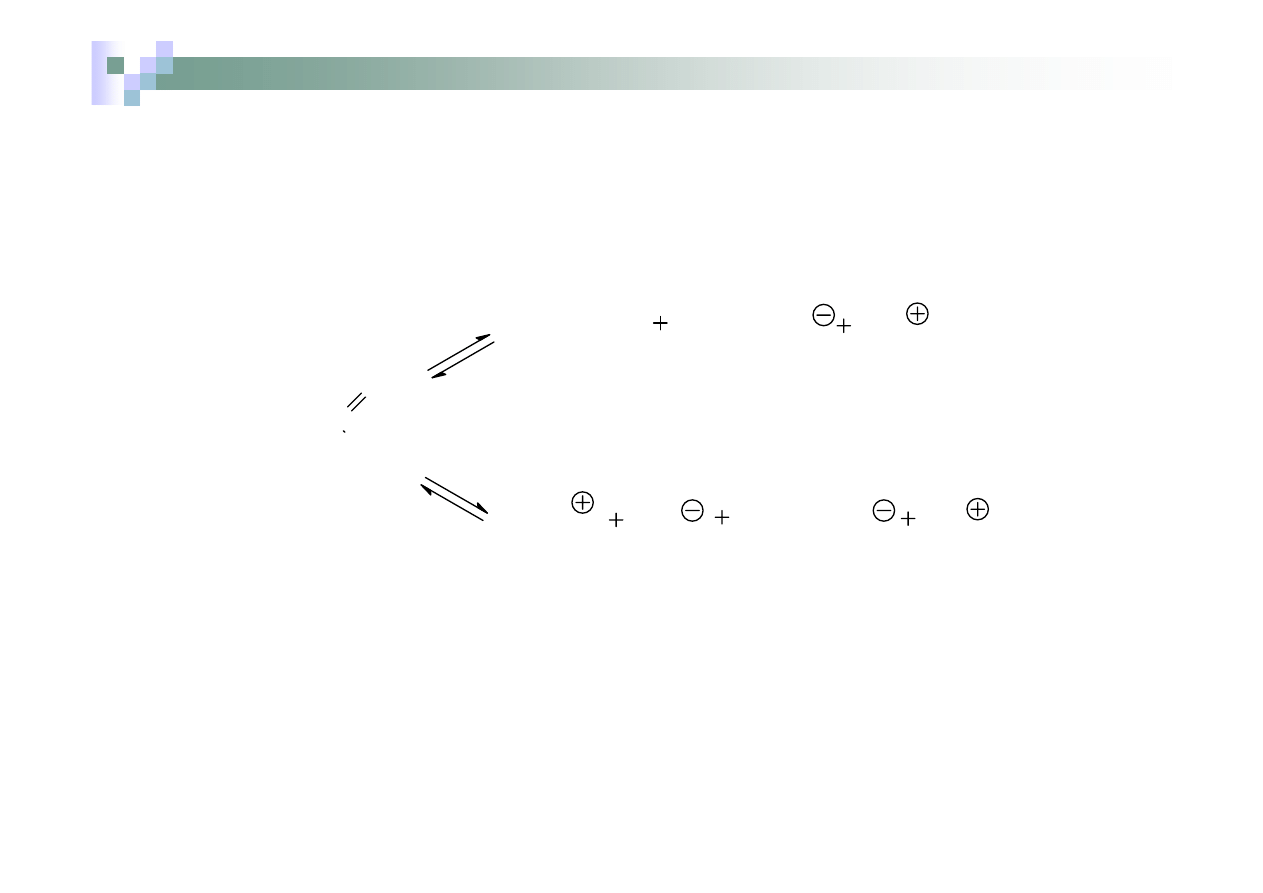
Wzór AKT i jego przemian podczas ogrzewania (bez
bilansowania reakcji)
CH
3
C
NH
2
S
H
2
O/HCl
H
2
S
CH
3
COO
NH
4
NH
4
OH
NH
4
Cl
NH
4
2
S
2
CH
3
COO
NH
4
AKT

Zastosowanie w przypadku kationów grupy III dodatku NH
3
·H
2
O
( podawanego też dla ułatwienia zrozumienia działania tego
odczynnika jako NH
4
OH) jest niezbędne w celu zmniejszenia
kwasowości środowiska (sole kationów tej grupy, są solami
hydrolizującymi z odczynem kwaśnym), co ma ograniczyć
rozpuszczanie osadów powstających w reakcji tych kationów z
odczynnikiem grupowym.
Dodatek NH
4
Cl na etapie stosowania odczynników grupowych grupy
III i IV ma na celu zapobieżenie wydzieleniu się razem z kationami III
lub IV grupy kationu Mg
2+
, który w obecności NH
3
·H
2
O tworzy
nierozpuszczalny Mg(OH)
2
. Wodorotlenek magnezu jest rozpuszczalny
w NH
4
Cl.
MgCl
2
+ 2 NH
3
·H
2
O Mg(OH)
2
↓ + 2 NH
4
Cl
Mg(OH)
2
↓ + 2 NH
4
Cl
MgCl
2
+ 2 NH
3
·H
2
O
Zapis jonowy tych reakcji:
Mg
2+
+ 2 NH
3
·H
2
O Mg(OH)
2
↓ + 2NH
4
+
Mg(OH)
2
↓ + 2NH
4
+
Mg
2+
+ 2 NH
3
·H
2
O

Odczynniki specyficzne
Po przypisaniu kationu do odpowiedniej grupy na podstawie reakcji z
odczynnikiem grupowym wykonuje się reakcje charakterystyczne z
wykorzystaniem tzw. odczynników specyficznych pozwalających
zidentyfikować poszczególne kationy w ramach danej grupy.
W identyfikacji kationów, poza reakcjami chemicznymi można
wykorzystać także próby płomieniowe, polegające na pojawieniu
się zabarwienia płomienia palnika podczas ogrzewania w płomieniu
palnika badanej substancji (stałej lub kropli roztworu) umieszczonej
na druciku platynowym).
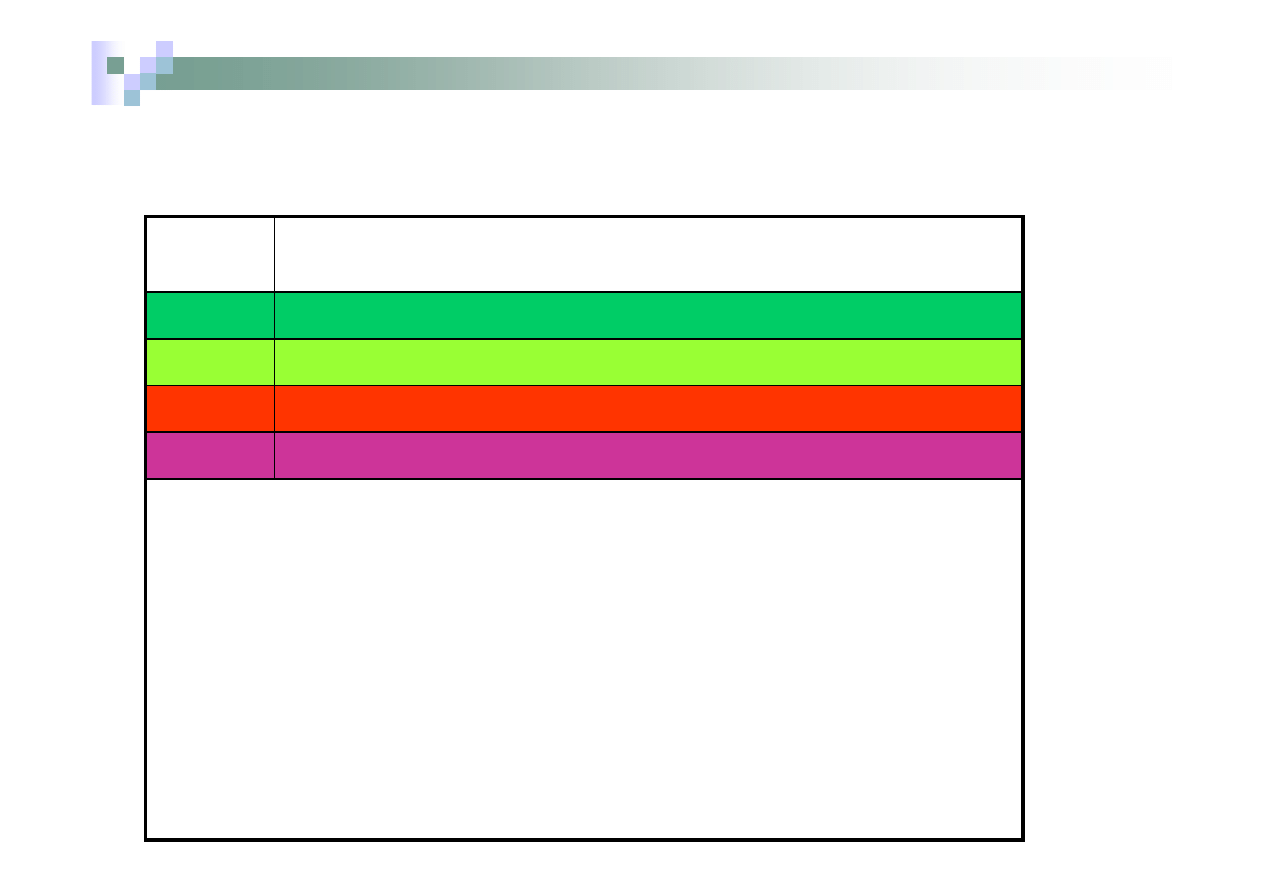
Zabarwienie płomienia w obecności wybranych kationów podano
poniżej:
Symbol
kationu
Barwa płomienia
Cu
2+
niebieskozielona lub zielona
Ba
2+
jasnozielona lub żółtozielona
Ca
2+
ceglastoczerwona
K
+
różowa lub różowofioletowa
Uwaga:
Próby płomieniowe, stanowią jedynie dodatkowe potwierdzenie
obecności danego kationu wykrytego na drodze odpowiedniej reakcji
charakterystycznej.
Nie należy opierać identyfikacji kationu jedynie na wykonaniu próby
płomieniowej. Wynik tej próby może okazać się zawodny w
przypadku braku doświadczenia osoby wykonującej analizę, (dotyczy
to zwłaszcza wykonywania analizy roztworu o niskim stężeniu
wykrywanego kationu, kiedy zaobserwowanie barwy płomienia może
być trudne, lub przypadku niedokładnego oczyszczenia drucika
platynowego).

Odczynniki specyficzne
Odczynnikami specyficznymi stosowanymi w analizie kationów są:
NaOH,
NH
3
·H
2
O
K
4
[Fe (CN)
6
], heksacyjnanożelazian (II) potasu
K
2
Cr
2
O
7
, chromian (VI) potasu
(NH
4
)
2
C
2
O
4
,szczawian amonu
KI, jodek potasu
H
2
SO
4
, kwas siarkowy (VI)
HClO
4
, kwas chlorowy (VII)
AgNO
3
,azotan (V) srebra
odczynik Nesslera K
2
[HgI
4
] zasadowy roztwór tetrajodortęcianu (II)
potasu

Podczas ćwiczeń nie będziemy wykonywali systematycznej analizy
kationów z uwagi na wskazania zdrowotne i środowiskowe.
Ograniczymy się do poznania reakcji wybranych kationów
(zaznaczonych na schemacie kolorem czerwonym) oraz zastosujemy
uproszczony sposób analizy kationów (opisany w podręczniku
„Ćwiczenia laboratoryjne z chemii nieorganicznej i analitycznej” rozdział 3.1
str.36-43) .
Podstawą analizy będzie wykorzystanie efektów reakcji wybranych
kationów z roztworem NaOH.
W przypadku braku możliwości rozróżnienia poszczególnych kationów
między sobą tylko w oparciu o reakcję z roztworem NaOH (kationy te
mogą dawać jednakowe efekty wizualne w reakcji z tym odczynnikiem)
wykorzystamy reakcje specyficzne, pozwalające na odróżnienie tych
kationów od siebie.
Szczegółowy sposób postępowania podczas analizy kationów
(oraz wykonania zadania kontrolnego) zostanie przedstawiony na
ćwiczeniach.
Materiał dotyczący uproszczonej analizy kationów będzie obowiązywał na
kolokwium.

Osoby zainteresowane klasyczną analizą kationów, mogą bliżej
zapoznać się ze sposobem prowadzenia takiej analizy korzystając
z materiału zawartego w podręczniku
„
Ćwiczenia laboratoryjne z chemii nieorganicznej
i analitycznej” rozdział 3.1 str.44-47) .
Materiał dotyczący pełnej klasycznej analizy kationów jest materiałem
dodatkowym dla zainteresowanych i nie będzie przedmiotem pytan
na kolokwium.
Document Outline
- Wykład 3 część 1
- Systematyczna analiza kationów
- Wzór AKT i jego przemian podczas ogrzewania (bez bilansowania reakcji)
- Odczynniki specyficzne
- Zabarwienie płomienia w obecności wybranych kationów podano poniżej:
- Odczynniki specyficzne
Wyszukiwarka
Podobne podstrony:
2011Wykład1 chemii ogólnej 5fantastic pl
2011Wykład2część2 5fantastic pl
2011Wykład1 chemii ogólnej 5fantastic pl
2011Wykład2część1 5fantastic pl
fizjologia 5fantastic pl
POPRAWA WSZYSTKICH KOLOKWIËW. 5fantastic.pl , Ćwiczenia
Osocze a mocz. 5fantastic.pl , Ćwiczenia
Zjazd5s1 v2. 5fantastic.pl , Ćwiczenia
egzocytoza2000 5fantastic pl
wykład 1. 5fantastic.pl , Ćwiczenia
podstawy produkcji roślinnej. 5fantastic.pl , Ćwiczenia(2)
Dobrostan owiec. 5fantastic.pl , Wykłady(1)
kolos 2. 5fantastic.pl , Ćwiczenia(1)
więcej podobnych podstron