Wykład 2
część 1
Reakcje przebiegające
w roztworach wodnych

Reakcje chemiczne w roztworach wodnych
Reakcje chemiczne polegają na przemianie substancji chemicznych
charakteryzujących się określonymi właściwościami fizycznymi
i chemicznymi (substraty reakcji chemicznej) w związki o innych
właściwościach chemicznych i fizycznych (produkty reakcji
chemicznej).
W roztworach wodnych związków chemicznych, będących
elektrolitami, następuje dysocjacja (rozpad cząsteczek związku pod
wypływem cząsteczek wody) na jony (
dodatnie
= kationy i
ujemne
=
aniony).
Dysocjacji ulegają: sole, wodorotlenki i kwasy.
Do nieelektrolitów, czyli substancji, które nie ulegają dysocjacji,
zaliczanych jest większość związków organicznych oraz tlenki i
wodorki nie reagujące z wodą.
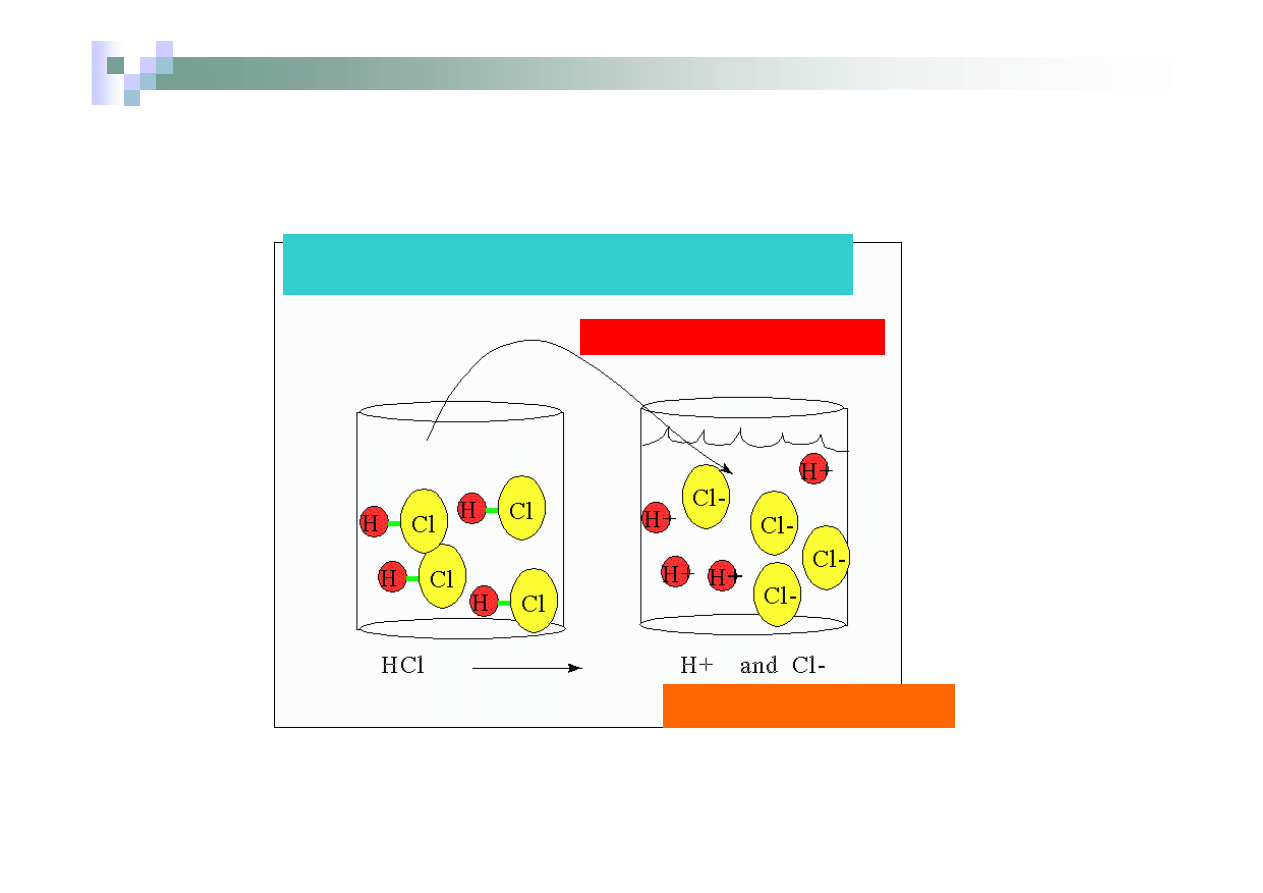
Mocny kwas dysocjuje całkowicie na jony pod wpływem
wody
Dodaj kwas do wody
Związki, które w roztworze wodnym ulegają całkowitej dysocjacji
na jony pod wpływem cząsteczek wody należą do mocnych
elektrolitów.
Dysocjacja 100%
Mocne kwasy i mocne
zasady
Wzory Nazwy
: kwas
HCl
chlorowodorowy
HBr
bromowodorowy
HI
bromowodorowy
HNO
3
azotowy(V)
HClO
4
chlorowy(VII)
H
2
SO
4
siarkowy(VI)
Mocne kwasy i mocne zasady
Wzory
Nazwy
:
wodorotlenek
NaOH
sodu
KOH
potasu
Ca(OH)
2
wapnia
Sr(OH)
2
strontu
Ba(OH)
2
baru

DYSOCJACJA KWASÓW
Kwasy monowodorowe dysocjują na kationy H
+
i aniony reszt
kwasowych, natomiast kwasy wielowodorowe ulegają dysocjacji
etapowej, w pierwszym etapie ulega odłączeniu tylko jeden kation
H
+
, natomiast w kolejnych etapach oddysocjowują następne jony H
+
.
HR
H
+
+ R
-
(mocny kwas)
HR
H
+
+ R
-
(słaby kwas)
Przy zapisie dysocjacji pomijamy napisanie nad strzałkami
H
2
O
(jako
oczywiste)
Kwasy wieloprotonowe
H
n
R
H
+
+ H
n-1
R
-
mocny kwas
H
n
R
H
+
+ H
n-1
R
-
słaby kwas
H
2
O
H
2
O

Kolejne etapy dysocjacji przebiegają w mniejszym stopniu niż pierwszy
etap dysocjacji (w przypadku mocnych kwasów)
H
n-1
R
-
H
+
+ H
n-2
R
2
-
itd.
Ogólnie dysocjację kwasów wieloprotonowych można zapisać
jako:
H
n
R
nH
+
+ R
n
-
(słabe kwasy oraz mocny kwas
na dalszych stopniach dysocjacji)
Umawiamy się,
że w przypadku mocnych kwasów (jeżeli nie zostanie podane
inaczej) dysocjacja w obu stopniach będzie zapisywana jako
dysocjacja całkowita, pomimo, że drugi stopień dysocjacji nie
przebiega w 100%
H
n
R
nH
+
+ R
n
-

DYSOCJACJA WODOROTLENKÓW
Wodorotlenki dysocjują na kationy metali (w przypadku NH
4
OH na kationy
amonowe) oraz aniony wodorotlenowe
MOH M
+
+ OH
-
(mocna zasada)
MOH M
+
+ OH
-
(słaba zasada)
Wodorotlenki zawierające kilka grup OH
-
dysocjują etapowo:
M(OH)
n
M(OH)
n-1
+
+ OH
-
M(OH)
n
+
M(OH)
n-2
2
+
+ OH
-
itd.
Ogólnie dysocjację słabej zasady i mocnej na drugim stopniu dysocjacji
można zapisać jako:
M(OH)
n
M
n
+
+ n OH
-
Umawiamy się,
że w przypadku mocnych zasad (jeżeli nie zostanie podane inaczej)
dysocjacja w obu stopniach będzie zapisywana jako dysocjacja całkowita
( → ) , pomimo, że drugi stopień dysocjacji nie przebiega w 100%

DYSOCJACJA SOLI
Sole dysocjują kationy metali (lub kationy amonowe) oraz aniony reszt
kwasowych.
M
n
R
m
nM
i+
+ mR
j -
gdzie
n
.
i = m
.
j ( liczba ładunków dodatnich = liczbie ładunków ujemnych)
Sole nieorganiczne, są to związki występujące na ogół (temperaturze
pokojowej) jako związki stałe, krystaliczne, o budowie jonowej. Po
wprowadzeniu do wody jony sieci krystalicznej na skutek
oddziaływań z cząsteczkami wody są uwalniane do roztworu.
Niektóre z jonów reagują z cząsteczkami wody (reakcje hydrolizy).
W przypadku soli praktycznie nierozpuszczalnych i trudno
rozpuszczalnych stężenie jonów w roztworze jest znikome
(stężenie to może być oznaczone w oparciu o tzw. iloczyn
rozpuszczalności soli K
ir
).
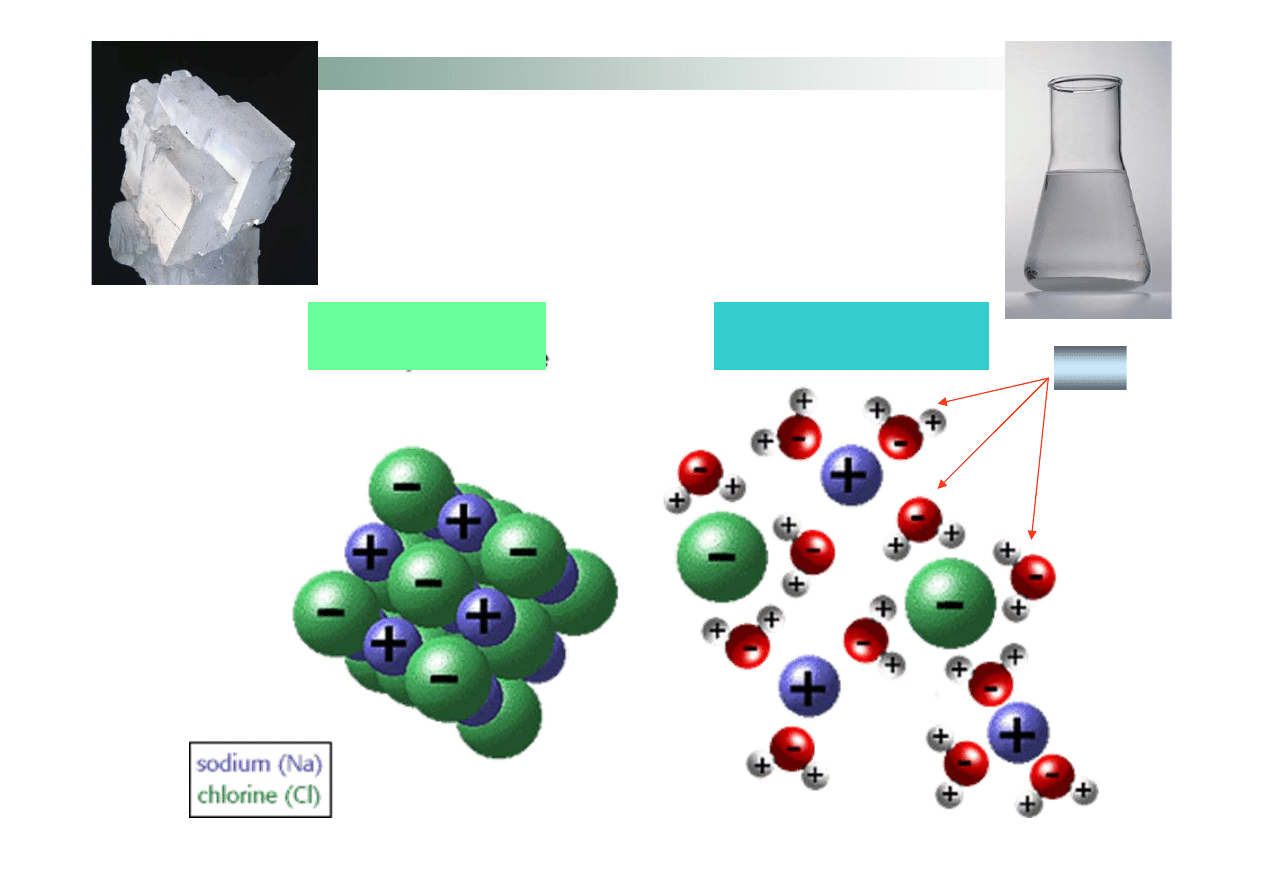
Rozpuszczanie substancji
jonowej w wodzie
NaCl struktura
krystaliczna
NaCl rozpuszczone w
wodzie
H
2
O

Tabela rozpuszczalności soli i wodorotlenków w wodzie:
NH
4
+
Na
+
K
+
Mg
2+
Ca
2+
Ba
2+
Cr
3+
Mn
2+
Fe
2+
Fe
3+
Co
2+
Ni
2+
Cu
2+
Ag
+
Au
3+
Zn
2+
Cd
2+
Hg
2+
Al
3+
Sn
2+
Pb
2+
Bi
3+
OH
-
R R R
NR
TR R
NR
NR NR
NR NR NR NR && NR
NR
NR
NR NR NR NR NR
F
-
R R R
NR
NR NR
NR
TR
TR NR
R
TR
NR R
R
NR
TR R TR
R NR
R
Cl
-
R R R R R R
R
R
R
R
R
R
R
NR
R
R R R R R TR
R
Br
-
R R R R R R
R
R
R
R
R
R
R
NR
R
R R TR R R TR
R
I
-
R R R R R R
R
R
R
&&
R
R
&& NR
TR
R R
NR
R TR NR
NR
S
2-
R R R
&&
TR R
NR
NR
NR NR NR NR NR NR NR
NR
NR
NR
&&
NR NR NR
SO
3
2-
R R R R NR NR
R
NR NR &&
NR NR
&& TR
NR
TR TR
&&
&& TR NR TR
SO
4
2-
R R R R TR
NR
R
R
R R
R
R
R TR R R R R R R
NR
R
NO
2
-
R R R R R R
R
R
R
NR
R
R
R TR &&
R R R R TR
R NR
NO
3
-
R R R R R R
R
R
R R
R
R
R R R R R R R R R R
PO
4
2-
R R R
NR
NR NR
NR
NR
NR NR
NR
NR NR NR NR
NR
NR
NR NR NR NR NR
CO
3
2-
R R R
NR
NR NR
NR
NR NR
&&
NR NR && NR NR
NR
NR
NR
&&
NR
NR NR
SiO
3
2-
R R R
NR
NR NR
&&
NR
NR NR
NR
NR && && && NR
NR
&& NR && NR &&
MnO
4
2-
R
R
R
R
R
R
R
&& &&
R
R
R
R
R
&&
R
R
&&
R
&&
R
R
CrO
4
2-
R
R
R
R
TR NR
NR
NR
&&
R
NR
NR
R NR
&&
TR NR
TR
NR NR
NR
NR
octan
R R R R R R
R
NR
R R
R
R
R R R R R R R R R R
Kolor tła odzwierciedla zabarwienie roztworu, białe tło wskazuje , że roztwór jest bezbarwny
R substancja dobrze rozpuszczalna w wodzie (rozpuszczalność powyżej 1 g /100 g H
2
O
TR substancja o niewielkiej rozpuszczalności, strącająca się przy odpowiednim stężeniu roztworu
(rozpuszczalność 0,1-1g/100g H
2
O)
NR - substancja praktycznie nierozpuszczalna, strąca się z rozcieńczonych roztworów
(rozpuszczalność poniżej 0,1 g w 100 g wody)
&& - zachodzą skomplikowane reakcje, lub substancja nie została otrzymana

Tabela rozpuszczalności soli i wodorotlenków w wodzie:
NH
4
+
Na
+
K
+
Mg
2+
Ca
2+
Ba
2+
Cr
3+
Mn
2+
Fe
2+
Fe
3+
Co
2+
Ni
2+
Cu
2+
Ag
+
Au
3+
Zn
2+
Cd
2+
Hg
2+
Al
3+
Sn
2+
Pb
2+
Bi
3+
OH
-
R R R
NR
TR R
NR
NR NR
NR NR NR NR && NR
NR
NR
NR NR NR NR NR
F
-
R R R
NR
NR NR
NR
TR
TR NR
R
TR
NR R
R
NR
TR R TR
R NR
R
Cl
-
R R R R R R
R
R
R
R
R
R
R
NR
R
R R R R R TR
R
Br
-
R R R R R R
R
R
R
R
R
R
R
NR
R
R R TR R R TR
R
I
-
R R R R R R
R
R
R
&&
R
R
&& NR
TR
R R
NR
R TR NR
NR
S
2-
R R R
&&
TR R
NR
NR
NR NR NR NR NR NR NR
NR
NR
NR
&&
NR NR NR
SO
3
2-
R R R R NR NR
R
NR NR &&
NR NR
&& TR
NR
TR TR
&&
&& TR NR TR
SO
4
2-
R R R R TR
NR
R
R
R R
R
R
R TR R R R R R R
NR
R
NO
2
-
R R R R R R
R
R
R
NR
R
R
R TR &&
R R R R TR
R NR
NO
3
-
R R R R R R
R
R
R R
R
R
R R R R R R R R R R
PO
4
2-
R R R
NR
NR NR
NR
NR
NR NR
NR
NR NR NR NR
NR
NR
NR NR NR NR NR
CO
3
2-
R R R
NR
NR NR
NR
NR NR
&&
NR NR && NR NR
NR
NR
NR
&&
NR
NR NR
SiO
3
2-
R R R
NR
NR NR
&&
NR
NR NR
NR
NR && && && NR
NR
&& NR && NR &&
MnO
4
2-
R
R
R
R
R
R
R
&& &&
R
R
R
R
R
&&
R
R
&&
R
&&
R
R
CrO
4
2-
R
R
R
R
TR NR
NR
NR
&&
R
NR
NR
R NR
&&
TR NR
TR
NR NR
NR
NR
octan
R R R R R R
R
NR
R R
R
R
R R R R R R R R R R
Kolor tła odzwierciedla zabarwienie roztworu, białe tło wskazuje , że roztwór jest bezbarwny
R substancja dobrze rozpuszczalna w wodzie (rozpuszczalność powyżej 1 g /100 g H
2
O
TR substancja o niewielkiej rozpuszczalności, strącająca się przy odpowiednim stężeniu roztworu
(rozpuszczalność 0,1-1g/100g H
2
O)
NR - substancja praktycznie nierozpuszczalna, strąca się z rozcieńczonych roztworów
(rozpuszczalność poniżej 0,1 g w 100 g wody)
&& - zachodzą skomplikowane reakcje, lub substancja nie została otrzymana

Uproszczone reguły dotyczące rozpuszczalności soli w wodzie:
sole sodowe, potasowe i amonowe są zazwyczaj dobrze rozpuszczalne w
wodzie (wyjątek KClO
4
)
Azotany (V), chlorany (VII), octany są na ogół dobrze rozpuszczalne w
wodzie
siarczany (VI) są na ogół dobrze rozpuszczalne w wodzie (wyjątki PbSO
4
,
BaSO
4
, SrSO
4
, przy dużych stężeniach Ag
2
SO
4
)
chlorki są dobrze rozpuszczalne w wodzie (wyjątki: AgCl, PbCl
2
, Hg
2
Cl
2
)
węglany, fosforany, krzemiany, siarczki są trudno rozpuszczalne w wodzie
(z wyjątkiem związków sodu, potasu i amonu)

Zapis cząsteczkowy i jonowy reakcji
Równanie przebiegającej reakcji może być przedstawione w postaci
cząsteczkowej lub jonowej.
Przykład zapisu cząsteczkowego dla reakcji mocnego kwasu z mocną
zasadą- reakcji zobojętniania:
NaOH + HCl → NaCl + H
2
O
Zapis jonowy pełny :
Na
+
+ OH
-
+ H
+
+ Cl
-
→ Na
+
+ Cl
-
+ H
2
O
Zapis jonowy skrócony:
H
+
+ OH
-
→ H
2
O
Zapis cząsteczkowy dla reakcji słabego kwasu ze słabą zasadą- reakcji
zobojętniania:
NH
3
.
H
2
O + HNO
2
→ NH
4
NO
2
+ H
2
O
Zapis jonowy pełny: NH
3
.
H
2
O + HNO
2
NH
4
+
+ NO
2
-
+ H
2
O
Zapis jonowy skrócony: H
+
+ OH
-
→ H
2
O

Zasady zapisu jonowego
W postaci jonowej piszemy:
Związki, które w roztworze wodnym są zdysocjowane na jony tj.:
mocne kwasy,
mocne zasady,
rozpuszczalne sole.
W postaci niejonowej (cząsteczkowej) zapisujemy:
słabe elektrolity, związki niezdysocjowane, czyli:
wodę,
słabe kwasy,
słabe zasady,
nierozpuszczalne w wodzie wodorotlenki,
nierozpuszczalne w wodzie sole,
atomy pierwiastków i cząsteczki wieloatomowe pierwiastków
substancje gazowe

Reakcja w roztworze wodnym przebiega, jeżeli w jej wyniku:
¾
tworzy się związek trudno rozpuszczalny,
przykłady:
Reakcja 1
Na
2
SiO
3
+ 2HCl → H
2
SiO
3
↓ + 2NaCl
2Na
+
+ SiO
3
2
-
+ 2H
+
+ 2Cl
-
→ H
2
SiO
3
↓ + 2Na
+
+ 2Cl
-
SiO
3
2
-
+ 2H
+
→ H
2
SiO
3
↓
Reakcja 2
NiSO
4
+ 2 NaOH → Ni(OH)
2
↓ + Na
2
SO
4
Ni
2
+
+ 2 OH
-
→ Ni(OH)
2
↓
Reakcja 3
CaCl
2
+ Na
2
SO
4
→ CaSO
4
↓ + 2NaCl
Ca
2
+
+ SO
4
2
-
→ CaSO
4
↓

Reakcja 4
KBr + AgNO
3
→ AgBr ↓ + KNO
3
Br
-
+ Ag
+
→ AgBr ↓
Reakcja 5
KI + AgNO
3
→ AgI ↓ + KNO
3
Ag
+
+ I
-
→ AgI ↓

1
2
3
4
5
Osad H
2
SiO
3
Osad Ni(OH)
2
Osad CaSO
4
Osad AgBr
Osad AgI

¾
rozpuszcza się osad
(związek trudno rozpuszczalny), przykłady:
Reakcja 1
Zn(OH)
2
↓ + 2 NaOH → Na
2
[Zn(OH)
4
] tetrahydroksocynkan sodu
Zn(OH)
2
↓ + 2 Na
+
+ 2OH
-
→ 2Na
+
+
Zn(OH)
4
2-
Zn(OH)
2
↓ + 2OH
-
→ Zn(OH)
4
2-
Reakcja 2
Ag
2
O ↓ + 4 NH
3
.
H
2
O → 2[Ag(NH
3
)
2
]OH + 3H
2
O
wodorotlenek
diaminasrebra
Ag
2
O ↓ + 4 NH
3
.
H
2
O → 2[Ag(NH
3
)
2
]
+
+ 2OH
-
+ 3H
2
O
Reakcja 3
Mg(OH)
2
↓ + 2NH
4
Cl → MgCl
2
+ 2 NH
3
.
H
2
O
Mg(OH)
2
↓ + 2NH
4
+
→ Mg
2+
+ 2 NH
3
.
H
2
O

¾
powstaje związek słabo zdysocjowany
, przykład:
reakcja 1
NaOH + HClO
4
→ NaClO
4
+ H
2
O
Na
+
+ OH
-
+ H
+
+ ClO
4
-
→ Na
+
+ ClO
4
-
+
H
2
O
OH
-
+ H
+
→ H
2
O
reakcja 2
NaOH + HCl → NaCl +
H
2
O
OH
-
+ H
+
→ H
2
O

NaOH +
fenoloftaleina

NaOH +
fenoloftaleina
Dodajemy HCl

NaOH +
fenoloftaleina
Dodajemy
HCl
Odbarwienie
fenoloftaleiny

reakcja 3
NH
4
Cl + KOH → KCl + NH
3.
.
H
2
O
NH
4
+
+ OH
-
→ NH
3.
.
H
2
O

¾
powstaje związek dobrze zdysocjowany
, przykłady:
reakcja 1
3 NH
3
+ H
3
PO
4
→ (NH
4
)
3
PO
4
3 NH
3
+ H
3
PO
4
→ 3NH
4
+
+ PO
4
3-
reakcja 2
CaO↓ + H
2
O → Ca(OH)
2
CaO ↓ + H
2
O → Ca
2+
+ 2 OH
-

¾
powstaje związek lotny
, przykład:
reakcja 1
2 NaCl + H
2
SO
4
→ Na
2
SO
4
+ 2HCl ↑
2Na
+
+ 2Cl
-
+ 2H
+
+ SO
4
2-
→ 2Na
+
+ SO
4
2-
+ 2HCl ↑
2Cl
-
+ 2H
+
→ 2HCl ↑
Cl
-
+ H
+
→ HCl ↑
rekacja 2
Δ
NH
3.
.
H
2
O →
NH
3
↑ + H
2
O
(Δ = ogrzewanie)
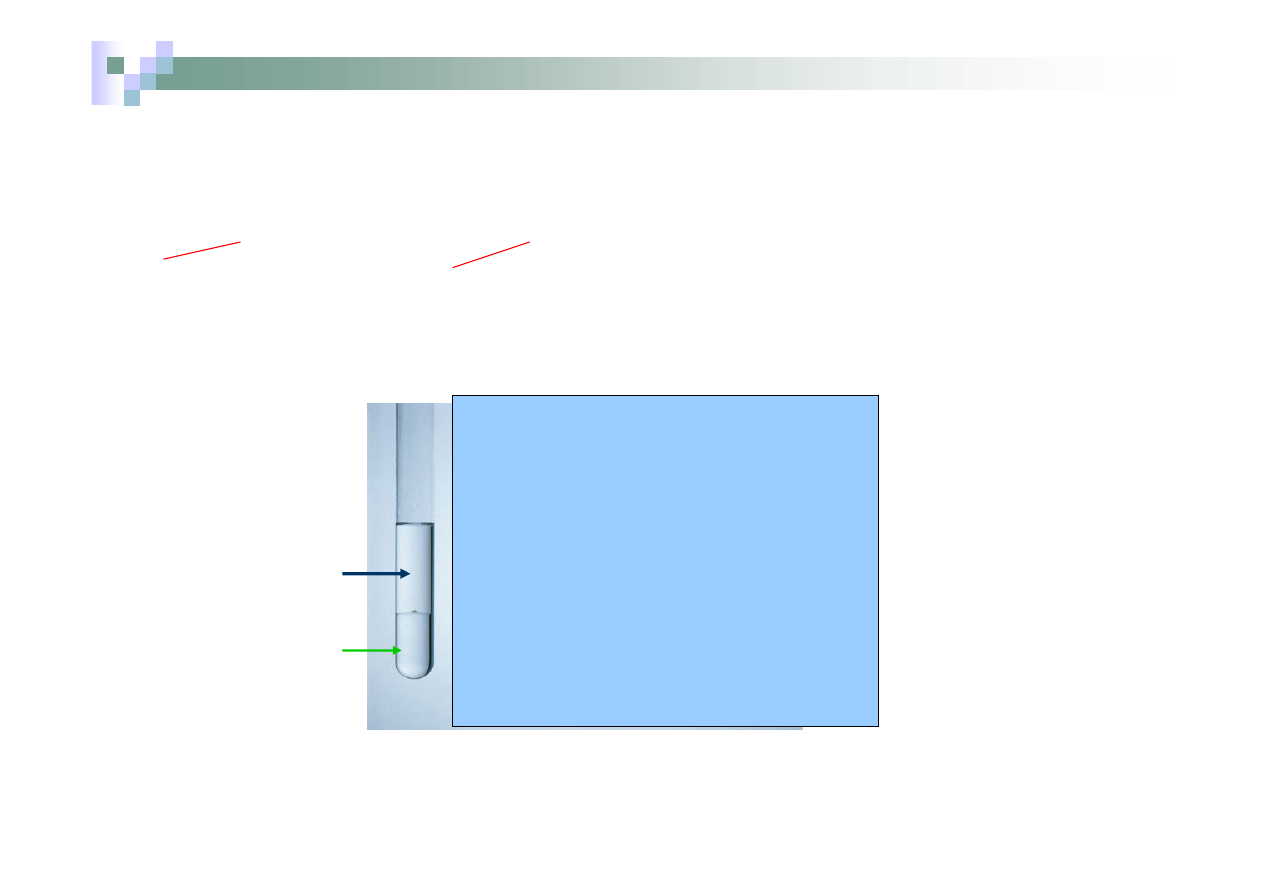
¾
następuje przekazywanie elektronów
, przykład:
reakcja 1
2NaBr + Cl
2
→ 2 NaCl + Br
2
2Na
+
+ 2Br
-
+ Cl
2
→ 2Na
+
+ 2Cl
-
+ Br
2
2Br
-
+ Cl
2
→ 2Cl
-
+ Br
2
roztwór wodny
NaBr
Chloroform
rozpuszczalnik
organiczny
nierozpuszczalny
w H
2
O
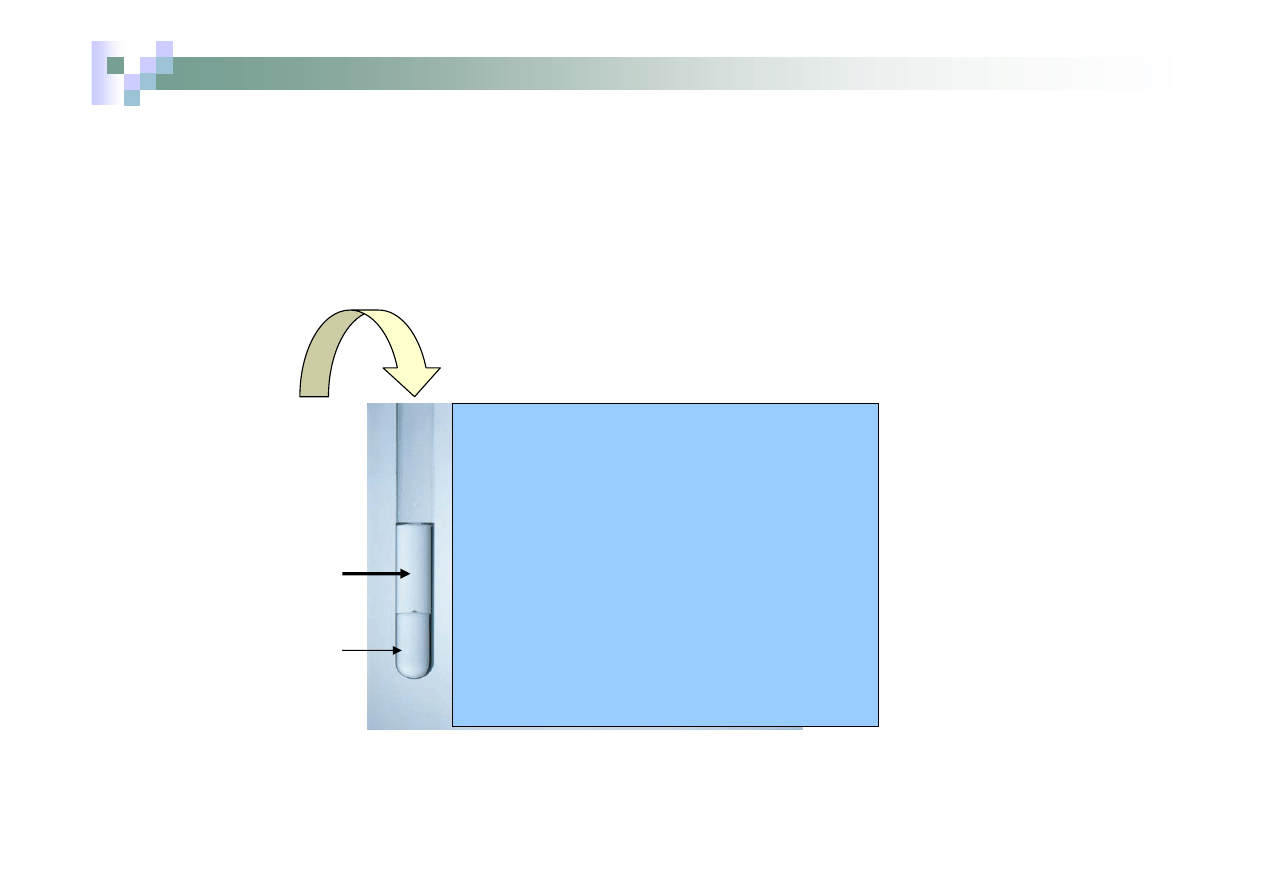
¾
następuje przekazywanie elektronów, przykład:
reakcja 1
2NaBr + Cl
2
→ 2 NaCl + Br
2
2Na
+
+ 2Br
-
+ Cl
2
→ 2Na
+
+ 2Cl
-
+ Br
2
2Br
-
+ Cl
2
→ 2Cl
-
+ Br
2
roztwór wodny
NaBr
Chloroform
rozpuszczalnik
organiczny
nierozpuszczalny
w H
2
O
dodajemy wody chlorowej (chlor gazowy
rozpuszczony w H
2
O)
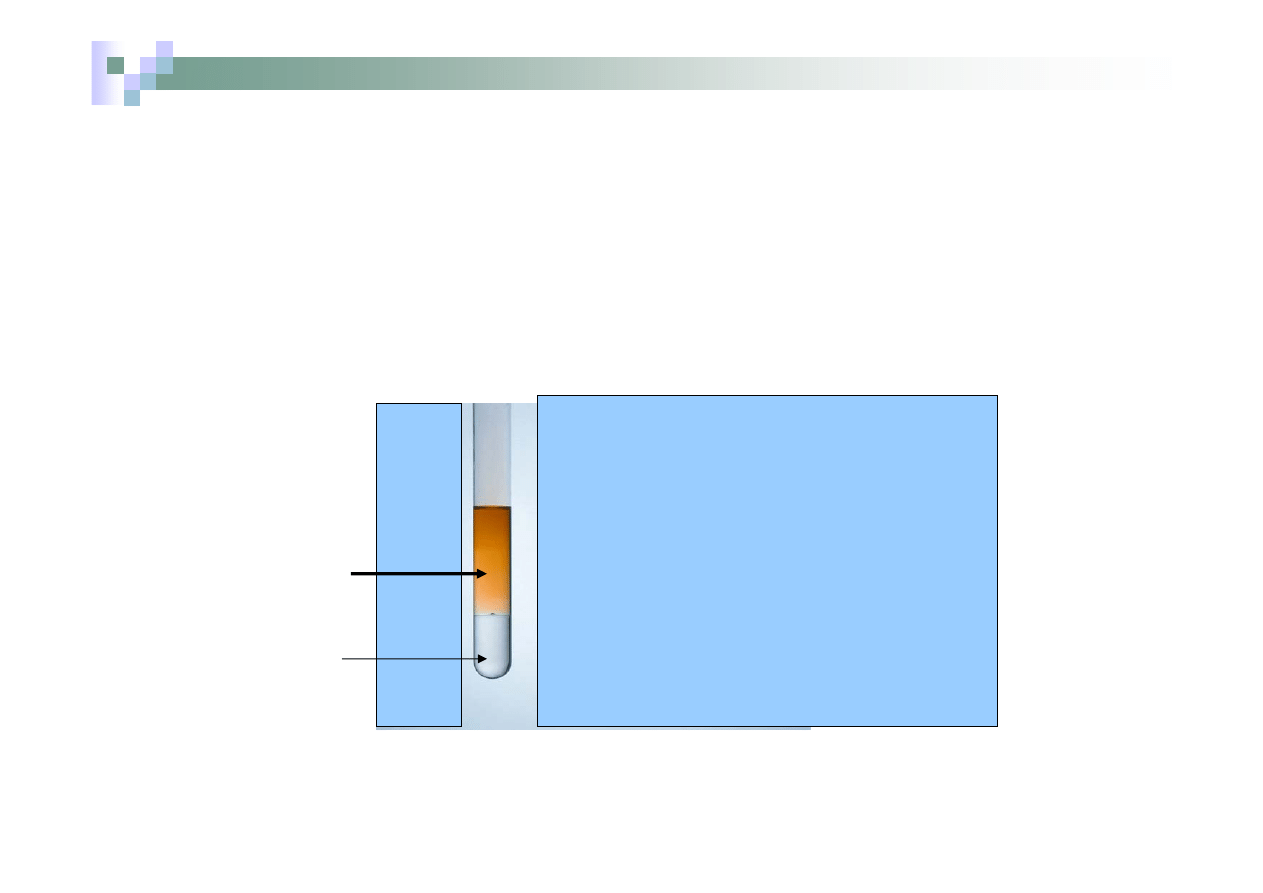
¾
następuje przekazywanie elektronów, przykład:
reakcja 1
2NaBr + Cl
2
→ 2 NaCl + Br
2
2Na
+
+ 2Br
-
+ Cl
2
→ 2Na
+
+ 2Cl
-
+ Br
2
2Br
-
+ Cl
2
→ 2Cl
-
+ Br
2
Po dodaniu wody chlorowej
wydzielający się brom
(ciecz o zabarwieniu brązowym)
zabarwia roztwór wodny na kolor
jasnobrazowy
roztwór wodny
NaCl + Br
2
Chloroform
rozpuszczalnik
organiczny
nierozpuszczalny w
H
2
O
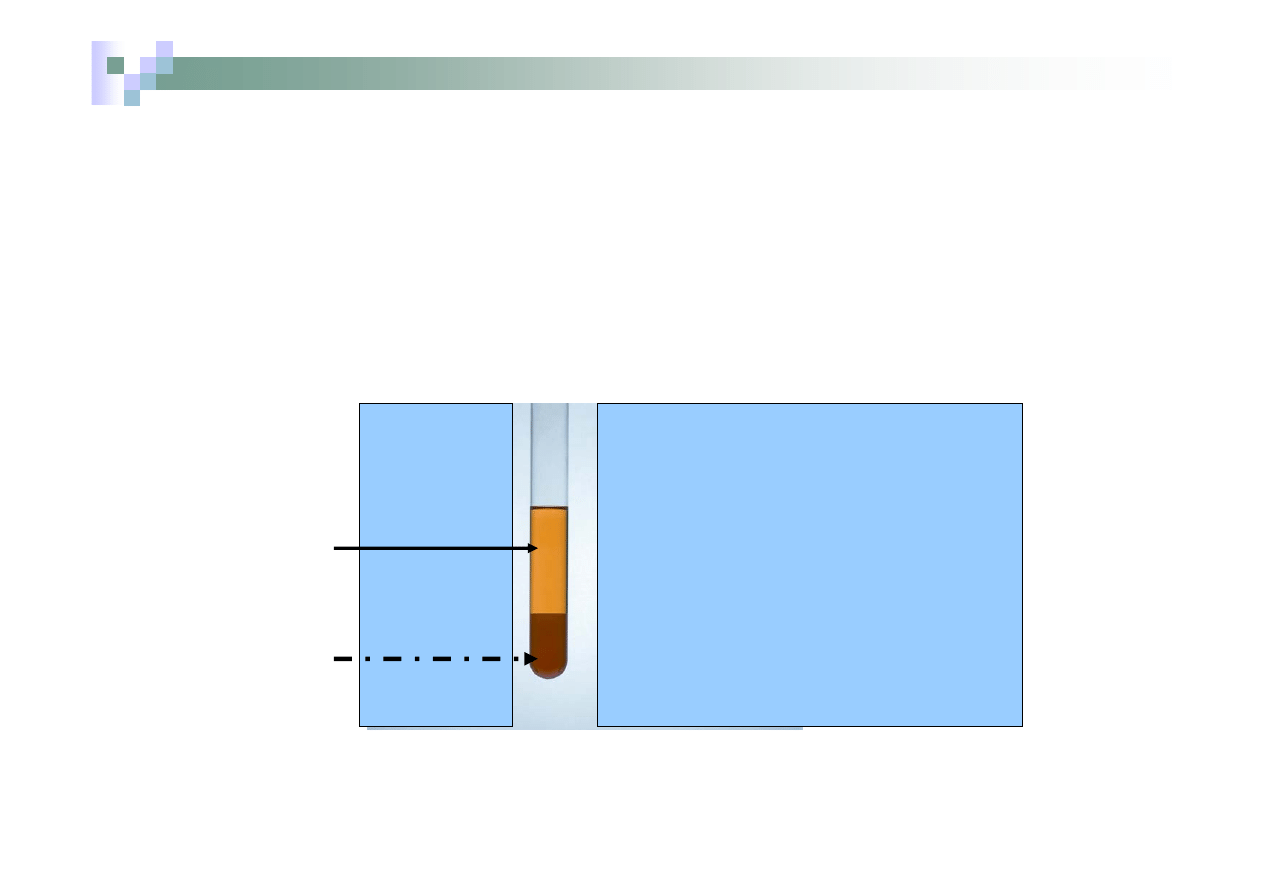
¾
następuje przekazywanie elektronów, przykład:
reakcja 1
2NaBr + Cl
2
→ 2 NaCl + Br
2
2Na
+
+ 2Br
-
+ Cl
2
→ 2Na
+
+ 2Cl
-
+ Br
2
2Br
-
+ Cl
2
→ 2Cl
-
+ Br
2
Chloroform
rozpuszczalnik
organiczny
nierozpuszczalny w
H
2
O + rozpuszczony
Br
2
Brom lepiej rozpuszcza się
w chloroformie niż wodzie
i dlatego
przechodzi do warstwy
cieczy organicznej
zabarwiając
ją na kolor brązowy
roztwór wodny
NaCl + Br
2
Amfoteryczność. Zapis jonowy reakcji
Amfoteryczność polega na zdolności do reagowania zarówno z
mocnym kwasem (przyjmowanie protonów od kwasu) jak i z
mocną zasadą (oddawanie protonów zasadzie).
Właściwości amfoteryczne mogą wykazywać:
niektóre metale, np.:
Reakcja z kwasem
Reakcja z zasadą
2Al + 6HCl → 2 AlCl
3
+ 3 H
2
↑
jonowo:
2Al + 6H
+
→ 2 Al
3+
+ 3 H
2
↑
2Al + 6 NaOH →2Na
3
AlO
3
+ 3H
2
jonowo:
2Al + 6OH
-
→ 2 AlO
3
3-
+ 3H
2
↑
Al, Zn

Reakcja glinu z HCl {1} i z NaOH {2}
{1}
{2}
Uwaga:
glin nie reaguje ze stężonym kwasem azotowym,
ponieważ w tych warunkach ulega pasywacji
HCl
NaOH

Pasywacja polega na wytworzeniu na powierzchni metalu cieniutkiej,
przylegającej do powierzchni metalu warstewki tlenku glinu, który nie reaguje
z HNO
3
stężonym, chroniąc tym samym metal przed dalszym utlenianiem.
Przedstawiona reakcja jest reakcją utleniania- redukcji (przekazywania
elektronów)

tleniki niektórych metali, np.:
Al
2
O
3
↓ + 6 HCl → 2 AlCl
3
+ 3 H
2
O
Al
2
O
3
↓ + 6H
+
→ 2 Al
3+
+ 3 H
2
O
Al
2
O
3
↓ + 2KOH → 2KAlO
2
+ H
2
O
Al
2
O
3
↓ + 2OH
-
→ 2AlO
2
-
+ H
2
O
Reakcję można zapisać również;
Al
2
O
3
↓ + 6KOH → 2K
3
AlO
3
+ 3H
2
O Al
2
O
3
↓ + 6OH
-
→ 2AlO
3
3-
+ 3H
2
O
ZnO, Al
2
O
3
, PbO
2
, Cr
2
O
3

Ponieważ tlenek glinu w tej reakcji zachowuje się jak
kwas, należałoby wyprowadzić kwasową formę
zawierającą glin.
W cząsteczce kwasu musi być wodór, a w tlenku glinu
nie ma wodoru, więc formę kwasową wyprowadzamy z
wodorotlenku glinu, a nie z tlenku glinu:
Al(OH)
3
H
3
AlO
3
HAlO
2
+ H
2
O
wodorotlenek
kwas
kwas
glinu
ortoglinowy
metaglinowy

Wodorotlenki niektórych metali lub, np.:
Be(OH)
2
, Zn(OH)
2
, Pb(OH)
2
, Sn(OH)
2
Al(OH)
3
, Cr(OH)
3
, Sb(OH)
3
Zn(OH)
2
↓ + 2HNO
3
→ Zn(NO
3
)
2
+ 2 H
2
O
Zn(OH)
2
↓ + 2H
+
→ Zn
2+
+ 2 H
2
O
Zn(OH)
2
↓
+ 2NaOH → Na
2
[Zn(OH)
4
]
tetrahydroksocynkan sodu
Zn(OH)
2
↓ + 2OH
-
→ Zn(OH)
4
2-
anion tetrahydroksocynku

Pb(OH)
2
↓ + 2HNO
3
→
Pb(NO
3
)
2
+ 2H
2
O
azotan (V) ołowiu(II)
Pb(OH)
2
↓ + 2H
+
→ Pb
2+
+ 2H
2
O
Pb(OH)
2
↓ + 2KOH →
K
2
[Pb(OH)
4
]
tetrahydroksoołowian (II) potasu
Pb(OH)
2
↓ + 2OH
-
→ Pb(OH)
4
2-
anion tetrahydroksoołowiu (II)
Al(OH)
3
↓ + 3HCl →
AlCl
3
+ 3H
2
O
chlorek glinu
Al(OH)
3
↓ + 3H
+
→ Al
3+
+ 3H
2
O
Al(OH)
3
↓ + NaOH →
Na[Al(OH)
4
]
tetrahydroksoglinan sodu
Al(OH)
3
↓ + OH
-
→ Al(OH)
4
–
anion tetrahydroksoglinu
Document Outline
- Wykład 2 część 1
- Reakcje chemiczne w roztworach wodnych
- Tabela rozpuszczalności soli i wodorotlenków w wodzie:
- Tabela rozpuszczalności soli i wodorotlenków w wodzie:
- Zapis cząsteczkowy i jonowy reakcji
- Zasady zapisu jonowego
- Amfoteryczność. Zapis jonowy reakcji
- tleniki niektórych metali, np.:
Wyszukiwarka
Podobne podstrony:
2011Wykład2część2 5fantastic pl
2011Wykład1 chemii ogólnej 5fantastic pl
2011Wykład3cz1analiza kationów 5fantastic pl
2011Wykład1 chemii ogólnej 5fantastic pl
fizjologia 5fantastic pl
POPRAWA WSZYSTKICH KOLOKWIËW. 5fantastic.pl , Ćwiczenia
Osocze a mocz. 5fantastic.pl , Ćwiczenia
Zjazd5s1 v2. 5fantastic.pl , Ćwiczenia
egzocytoza2000 5fantastic pl
wykład 1. 5fantastic.pl , Ćwiczenia
podstawy produkcji roślinnej. 5fantastic.pl , Ćwiczenia(2)
Dobrostan owiec. 5fantastic.pl , Wykłady(1)
kolos 2. 5fantastic.pl , Ćwiczenia(1)
więcej podobnych podstron