
Zjawiska
autoimmunizacyjne:
1. Tolerancja immunologiczna i autotolerancja
2. Naturalne mechanizmy zabezpieczające
przed autoagresją.
3. Mechanizmy indukujące autoagresję.
Seminarium 8

Autotolerancja
- limfocyty autoreaktywne,
- autoprzeciwciała:
prawidłowa składowa układu
odpornościowego
w większości wypadków nie prowadząc do
rozwoju choroby autoimmunizacyjnej.
Dzieje się to dzięki zjawisku
autotolerancji
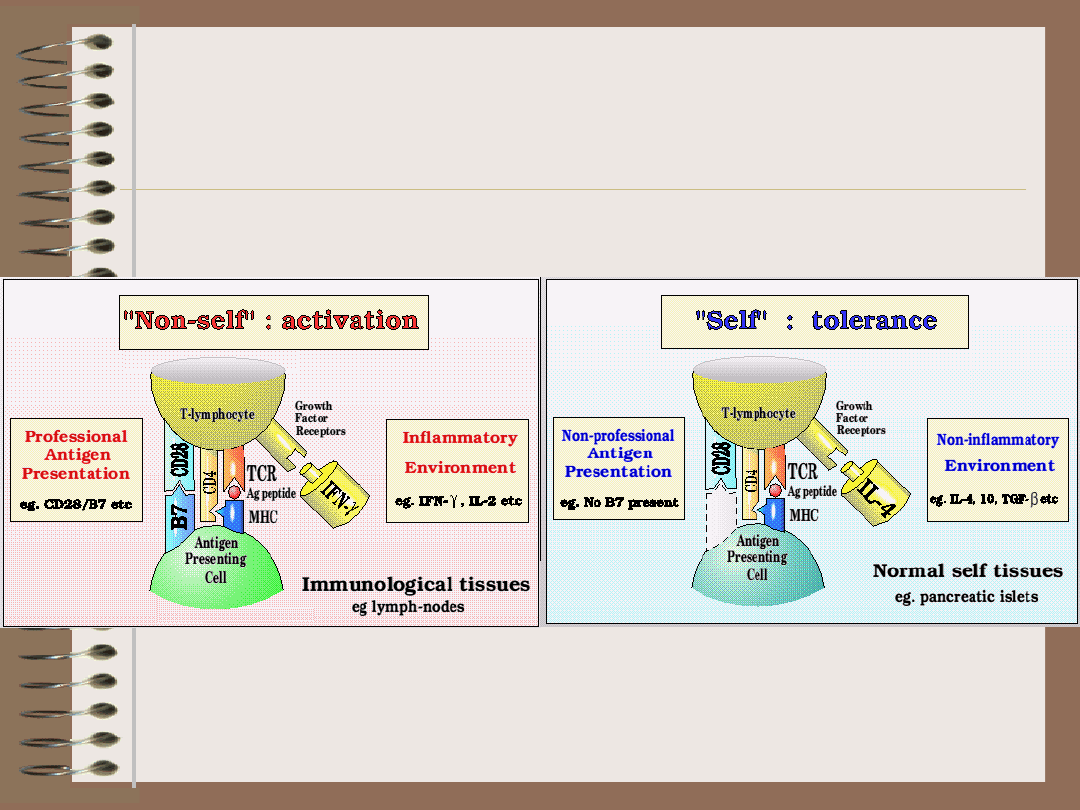
Swój czy obcy?

Teoria sygnału
niebezpieczeństwa
(danger signal) – Polly Matzinger
• decyzja o tym, czy rozpocząć
odpowiedź immunologiczną na dany
antygen czy go „zlekceważyć” nie
zostaje podjęta w zależności od tego
czy jest to antygen własny czy obcy,
ale w zależności od tego, czy jest on
postrzegany jako zagrażający zdrowiu
i życiu organizmu, czy jako
nieszkodliwy
• niezbędny jest zatem dodatkowy
sygnał, nazwany
„sygnałem
niebezpieczeństwa” („danger
signal”),
który komórka prezentująca
antygen musi otrzymać, aby taką
decyzję podjąć.

Teoria sygnału
niebezpieczeństwa
• "układ odpornościowy odróżnia
bezpieczne od niebezpiecznego”, a
nie „swoje od obcego”
• do powstania odpowiedzi
immunologicznej konieczne są:
– prezentacja antygenu
– sygnał niebezpieczeństwa, który
pozwala na prawidłową interpretację
zaistniałej sytuacji

Sygnały
niebezpieczeństwa:
• sygnały endogenne
– białka szoku cieplnego (HSP)
– cytokiny
– reaktywne formy tlenu ( ROS)
– substancje uwalniane z uszkodzonych komórek np.
nukleotydy
• sygnały egzogenne – wzorce molekularne
związane
z patogenami (PAMP)
– dwuniciowy RNA
– lipopolisacharyd ścian bakterii gramujemnych (LPS)
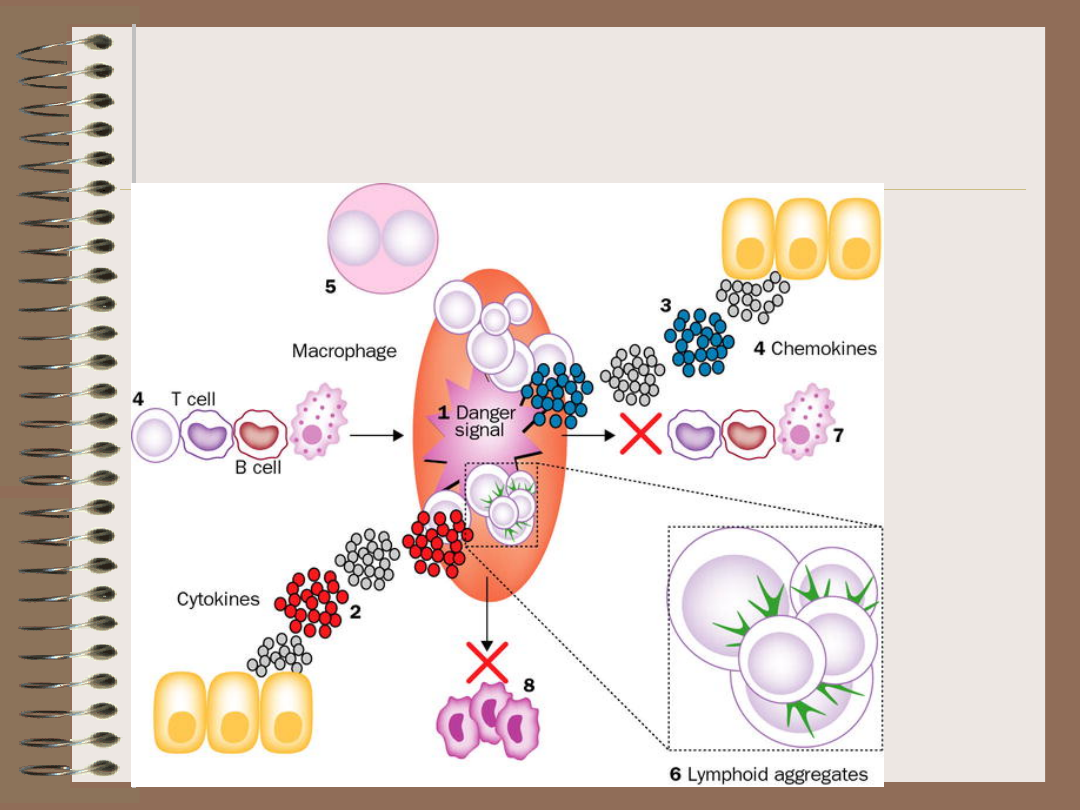
Teoria sygnału
niebezpieczeństwa
(danger signal) – Polly Matzinger
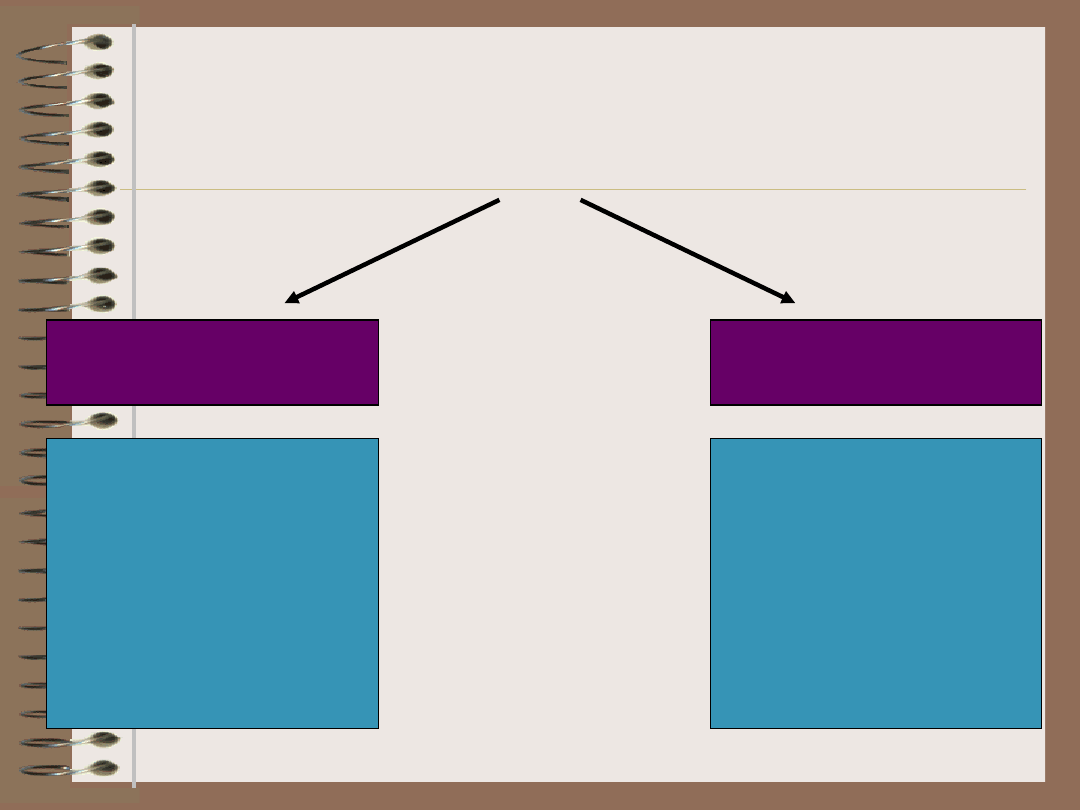
Mechanizmy
autotolerancji
CENTRALNE
OBWODOWE
•selekcja
negatywna
(delecja
klonalna)
limfocytów B i T
•delecja
klonalna
•ignorancja
(sekwestracja
antygenu)
•anergia
klonalna
•aktywna
supresja

Centralne mechanizmy
autotolerancji

Dojrzewanie limfocytów T
• Głównym celem procesów
zachodzących w grasicy
jest wytworzenie takich
limfocytów T, które:
– będą miały prawidłowo
zbudowany receptor TCR
(tzn. taki, który będzie
rozpoznawać antygeny
prezentowane przez własne
cząsteczki MHC)
– nie będą rozpoznawały
własnych antygenów.

Obwodowe mechanizmy
autotolerancji

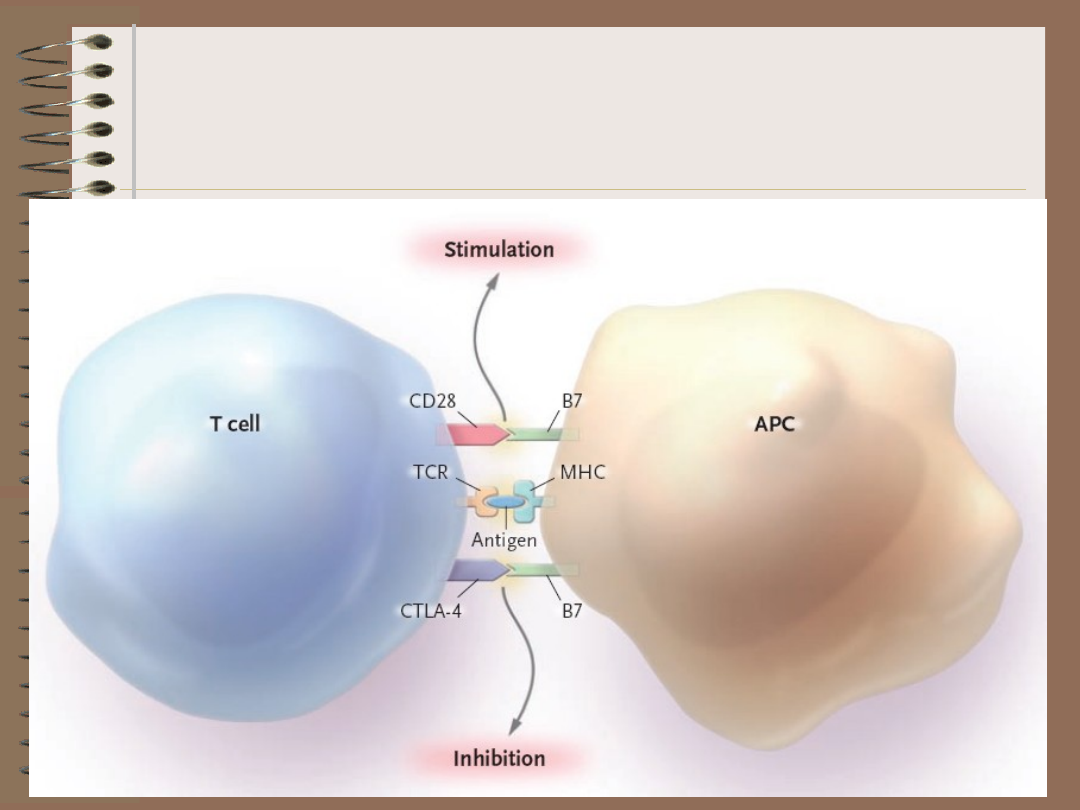
Kiedy DC
„unieszkodliwia” a kiedy
aktywuje limfocyt T?
• bardziej podatne na delecję są limfocyty o
wyższym powinowactwie do kompleksu
MHC-peptyd
• jeśli DC otrzyma sygnał aktywujący
poprzez interakcję ligandu dla cząsteczki
CD40 (CD152) na limfocycie Th z CD40 na
DC, dojdzie do aktywacji limfocytu
autoreaktywnego T CD8+ i potencjalnej
autoimmunizacji
• niespecyficzna aktywacja DC (cytokiny: IL-
1, TNF czy IFN-)
(delecja klonalna)
Jak to się dzieje?

Ignorancja
= sekwestracja antygenu
• sekwestracja
– anatomiczna
– molekularna
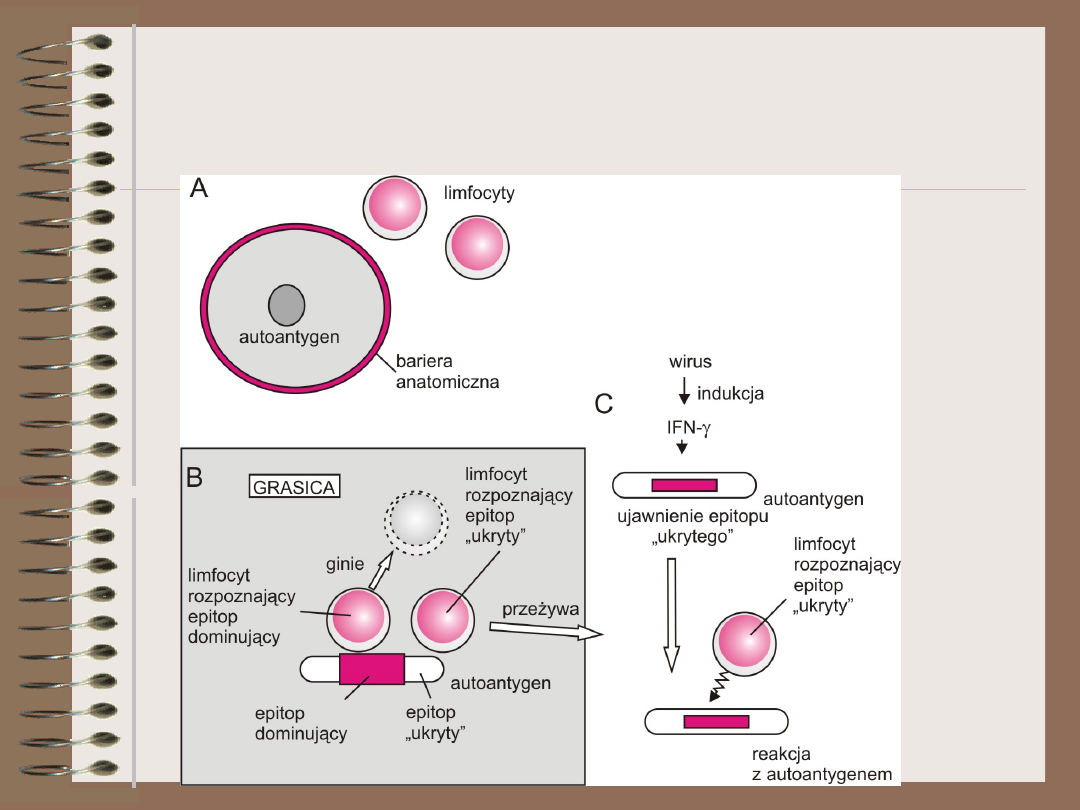
Epitopy dominujące i
ukryte
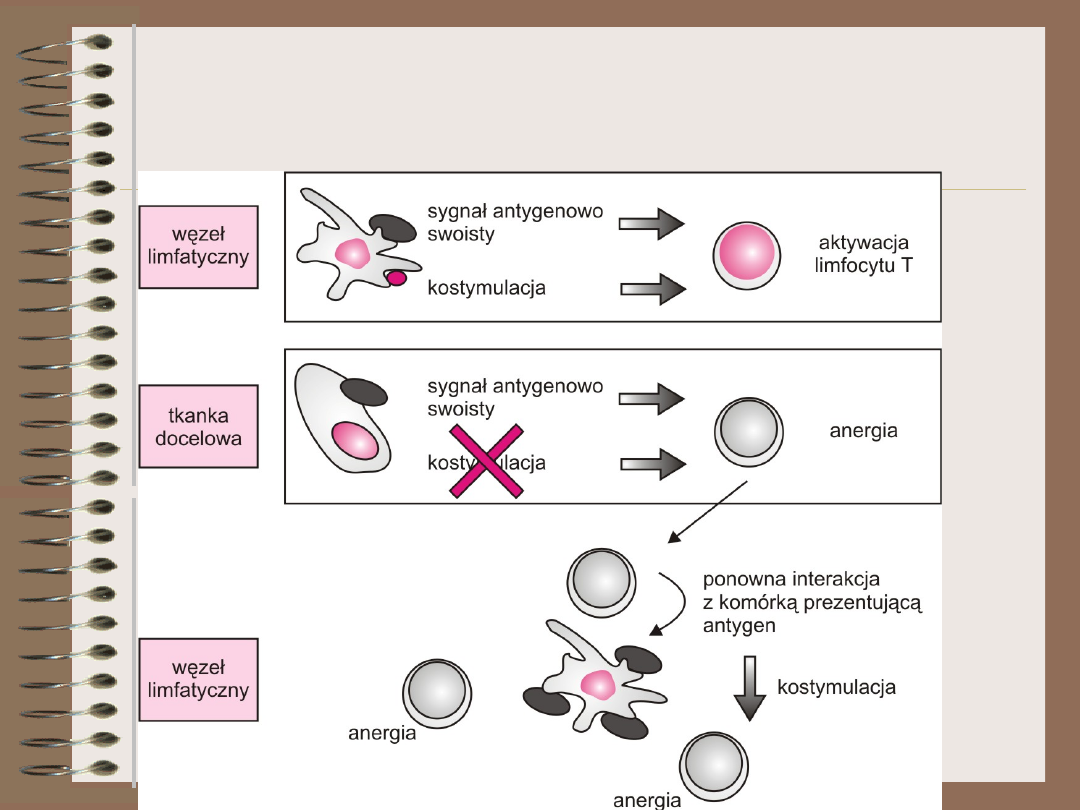
Anergia

Anergia klonalna
• jeśli limfocyt dziewiczy stymulowany
jest tylko za pośrednictwem TCR –
wejdzie w stan anergii
• stan ten charakteryzuje się brakiem
wytwarzania IL-2 i proliferacji w
odpowiedzi na antygen
• nasilenie procesu waha się od
obniżenia poziomu ekspresji TCR aż do
śmierci komórki
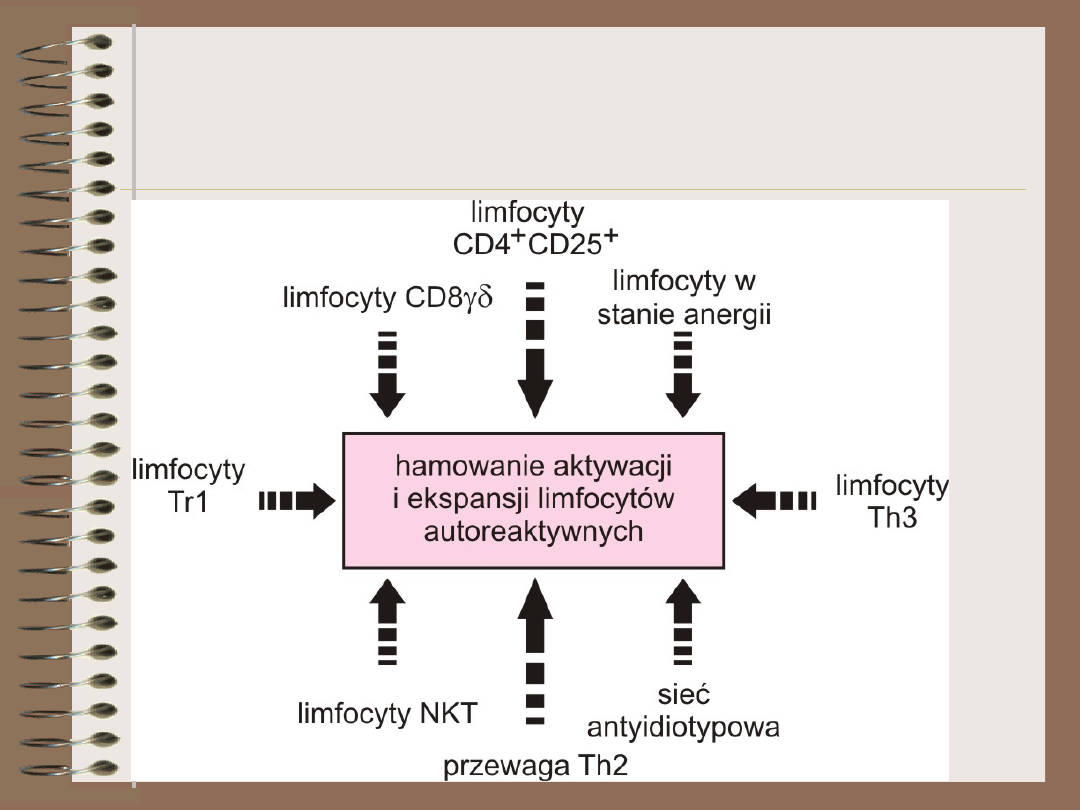
Aktywna supresja
(działanie komórek regulatorowych)
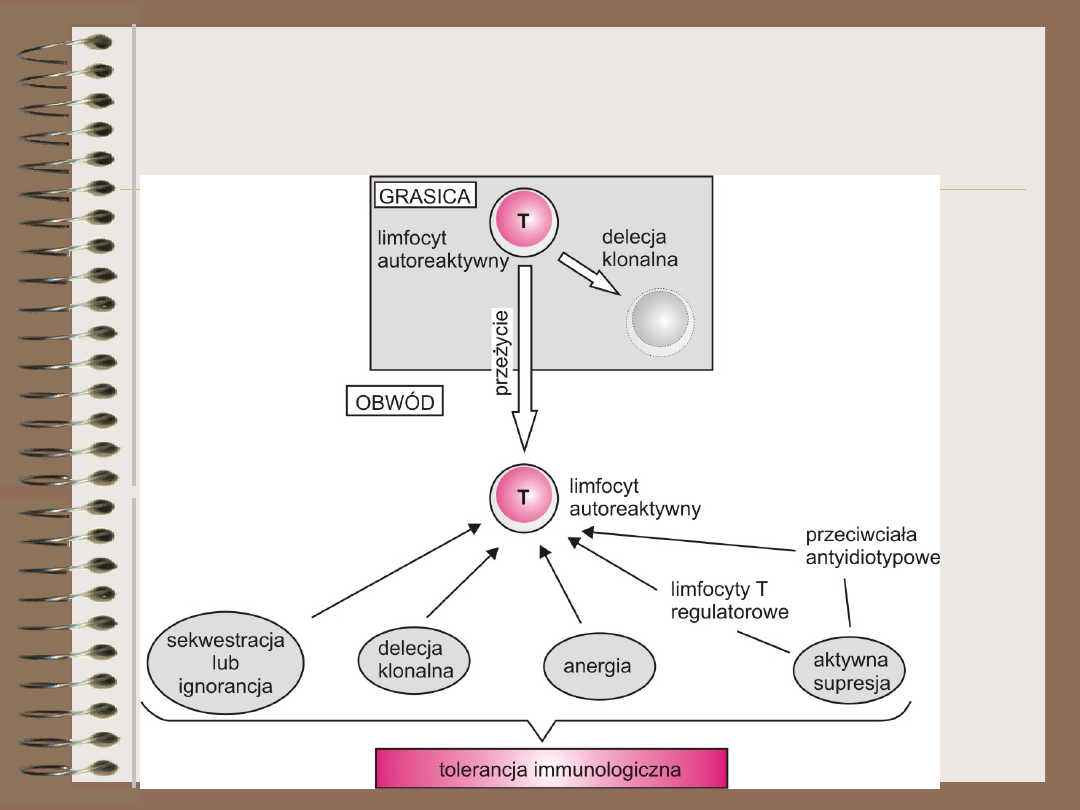
Tolerancja
immunologiczna

Co może wyindukować
proces
autoimmunizacyjny?
•czynniki endogenne
•czynniki egzogenne

Czynniki genetyczne
• haplotyp MHC (głównie klasy II)
np.:
– HLA-DR4 reumatoidalne zapalenie
stawów
– HLA-DQ8 cukrzyca typu 1
– HLA-DR2 stwardnienie rozsiane
• brak niektórych składników
dopełniacza (np. C1q, C4 SLE)

Zaburzenia funkcji
komórek regulatorowych
• brak równowagi pomiędzy komórkami
autoreaktywnymi a „trzymającymi je w
ryzach” limfocytami regulatorowymi
• uniezależnienie mechanizmów
efektorowych od komórek regulatorowych
poprzez selekcję limfocytów
autoreaktywnych o wysokim
powinowactwie do autoantygenu oraz
poprzez wpływ wysokiego stężenia cytokin
prozapalnych obecnych w chorych tkankach

Co stanowi większe
zagrożenie
autoimmunizacją
• autoreaktywny limfocyt B
• autoreaktywny limfocyt T
?

Hormony płciowe
• żeńskie hormony płciowe:
estrogeny i progesteron, mogą
– w niskich stężeniach (a więc poza
ciążą) nasilać wytwarzanie IFN-
przez limfocyty,
promując odpowiedź
Th1
– w wysokich stężeniach, tak jak to się
dzieje w ostatnim trymestrze ciąży,
mogą
działać immunosupresyjnie

Hormony płciowe
• kobiety stanowią aż 60-75% chorych na RZS,
SM czy miastenię, a ponad 80% chorych na
SLE, chorobę Gravesa, chorobę Hashimoto
czy twardzinę układową
• ciężarne, chore na SM czy RZS, zauważają
niekiedy w ciąży złagodzenie przebiegu
choroby (najczęściej w ostatnim trymestrze)
i jej nawrót po porodzie
• mężczyźni chorzy na RZS mają niższe
stężenie testosteronu niż mężczyźni zdrowi

„Przełamanie” ignorancji
• uraz
uszkodzenie tkanek
ujawniające antygeny ukryte za
barierami anatomicznymi
• zapalenie
wzrost stężenia IFN-
i TNF prowadzący do zwiększenia
prezentacji antygenów (w tym
antygenów „ukrytych”)

Czynniki infekcyjne
• rozwój chorób
autoimmunizacyjnych
często poprzedzają
infekcje
• jeden i ten sam limfocyt T
może rozpoznawać różne
peptydy prezentowane w
kontekście różnych
cząsteczek MHC
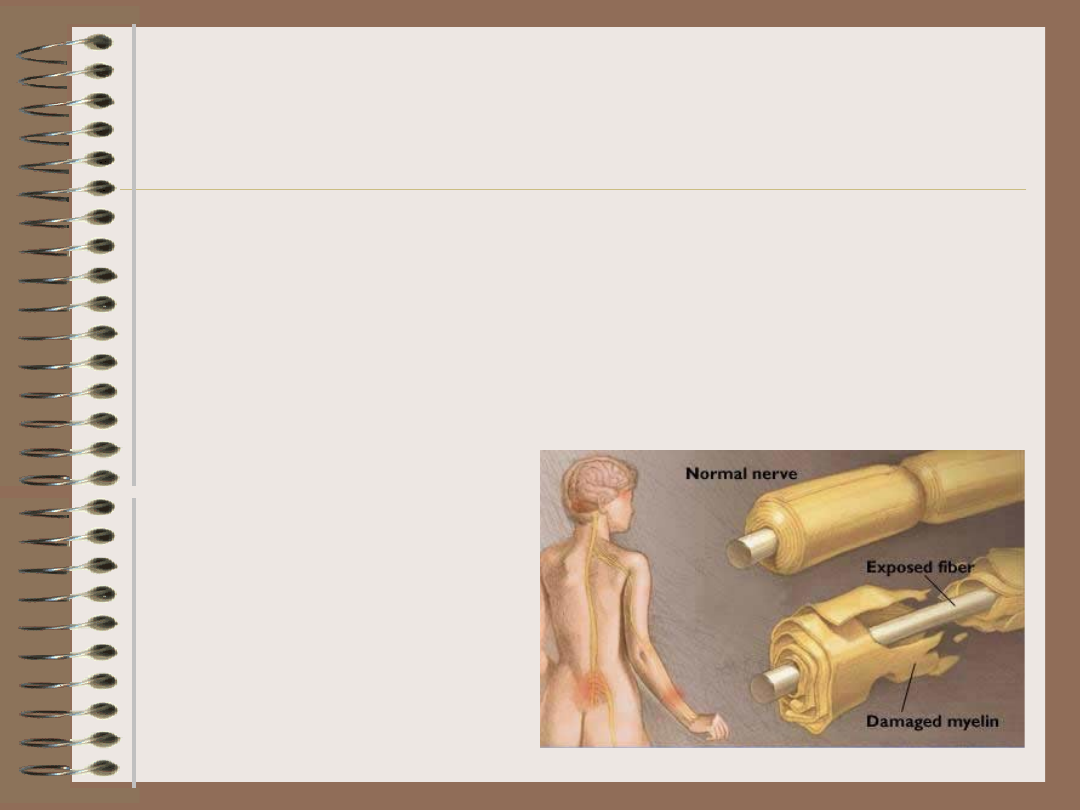
Czynniki infekcyjne
– teoria mimikry
molekularnej
• zakażenie wirusem lub bakterią
mającymi epitopy wykazujące
podobieństwo do antygenów gospodarza
może prowadzić do aktywacji limfocytów
autoreaktywnych i rozwoju odpowiedzi
na własne antygeny (np. gorączka
reumatyczna- Streptococcus, choroba
• Guillaina-Barre-
• Campylobacter jejuni)

Czynniki infekcyjne – źródła
sygnału niebezpieczeństwa
(TLR)
• DC dojrzewające pod wpływem
stymulacji TLR stają się
“odporne” na supresyjny efekt
limfocytów Treg, co potencjalnie
może prowadzić do przełamania
tolerancji na autoantygeny
• aktywacja TLR działa jako „sygnał
niebezpieczeństwa” dla DC
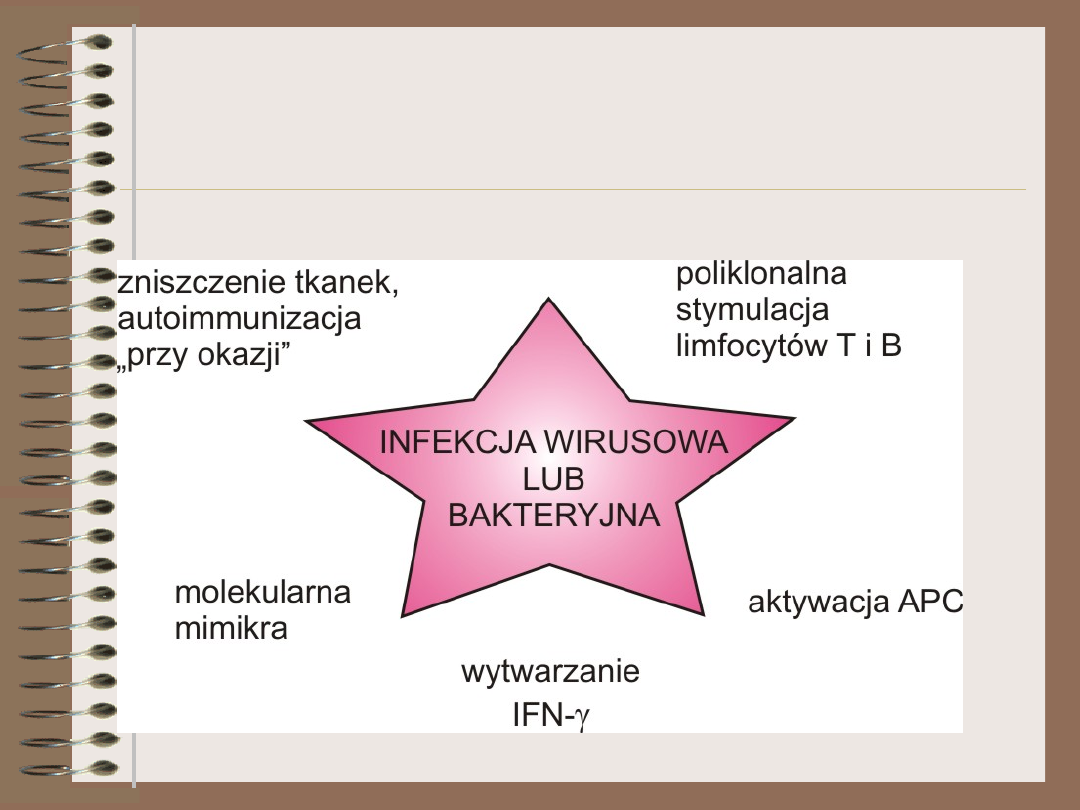
Czynniki infekcyjne –
podsumowanie

Czynniki środowiskowe
• UV toczeń układowy
rumieniowaty
• krzem, chlorek winylu twardzina
• dym papierosowy, rozpuszczalniki
organiczne zespół Goodpasture’a
• leki (hydralazyna, prokainamid,
hydantoina) toczeń

Choroby
autoimmunizacyjne

Choroby
autoimmunizacyjne
• schorzenia o przewlekłym
przebiegu
• charakteryzują się okresami
zaostrzeń i remisji
• cierpi na nie ok. 5% populacji
• liczba zachorowań wzrasta
Choroby
autoimmunizacyjne
z przewagą
odpowiedzi
komórkowej
z przewagą
odpowiedzi
humoralnej
•choroba Hashimoto
•cukrzyca typu 1
•stwardnienie rozsiane
•łysienie plackowate
•bielactwo
•pęcherzyca
•miastenia
•choroba Gravesa-
Basedowa
•niedokrwistość
hemolityczna
•toczeń układowy
rumieniowaty
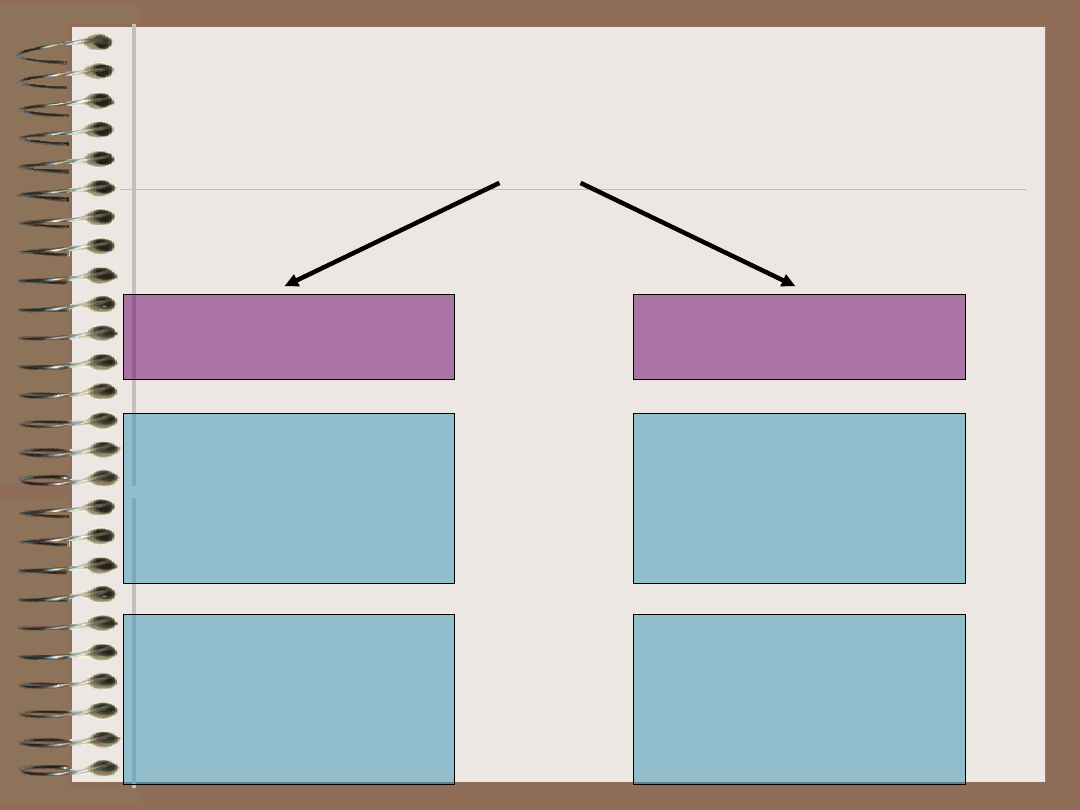
Choroby
autoimmunizacyjne
narządowo swoiste
układowe
występowanie danego
autoantygenu
ogranicza się do
konkretnego narządu
lub typu komórek
autoantygen
występuje
powszechnie w
ustroju, a zmiany
chorobowe mają
charakter
wielonarządowy
np.:
cukrzyca
stwardnienie rozsiane
pęcherzyca zwykła
np.:
toczeń układowy
rumieniowaty
twardzina układowa
reumatoidalne zapalenie
stawów

Choroba Gravesa-
Basedowa
Autoprzeciwciała przeciwko receptorowi
dla tyreotropiny- nasladujące
strukturalnie i funkcjonalnie hormon
tyreotropowy (TSH)- aktywujące
receptor!
Nadczynność
tarczycy

Należy się nauczyć tabeli
23.1

Terapia chorób
autoimmunizacyjnych

Strategie leczenia
• substytucja
(np. terapia insuliną)
• przeszczep narządu
(np. trzustki, nerek)
• leczenie immunosupresyjne
(antygenowo-nieswoiste)
• statyny (?)
• terapia antygenowo-swoista
– podawanie autoantygenu drogą
doustną/donosową
– podawanie APL (zmienionych ligandów
peptydowych
octan glatirameru

Strategie leczenia c.d.
• Terapia antygenowo nieswoista:
Neutralizacja cytokin prozapalnych:
TNF SM, cukrzyca t. I, RZS
Podawanie cytokin o działaniu
przeciwzapalnym IL-10, IFN-B
Hamowanie migracji
autoreaktywnych limfocytów T: anty
VLA4: SM
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
JP Seminarium 9 wersja dla studentów
JP Seminarium 9 wersja dla studentów
Leki hipolipemizujące wersja dla studentów
Fizjologia cyklu miesiaczkowego wersja dla studentow
orz wersja dla studentw, bhp
Filozofia (projekt) wersja dla studentów
Receptura wersja dla studentow
Pytania dla rzeczoznawcow majatkowych - wersja dla studentow-1, test
CHEMIAwSZKOLE wersja dla studentów
Leki antyhistaminowe wersja dla studentów
Receptura wersja dla studentow 2
4 Układ naczyniowy 01 12 06 wersja dla studentów
Replikacja, transkrypcja, translacja (wersja dla studentów)
Program Kierunków pedagogiki współczesnej - wersja dla studentów (1), Uczelnia
więcej podobnych podstron