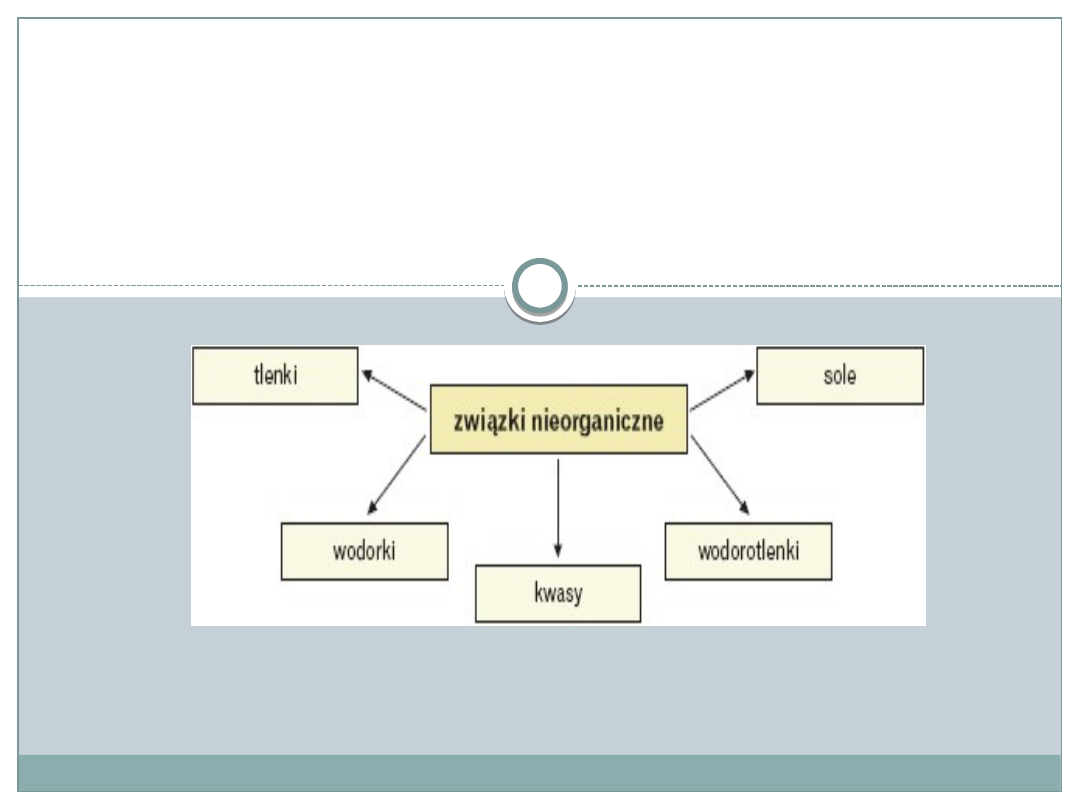
Związki nieorganiczne
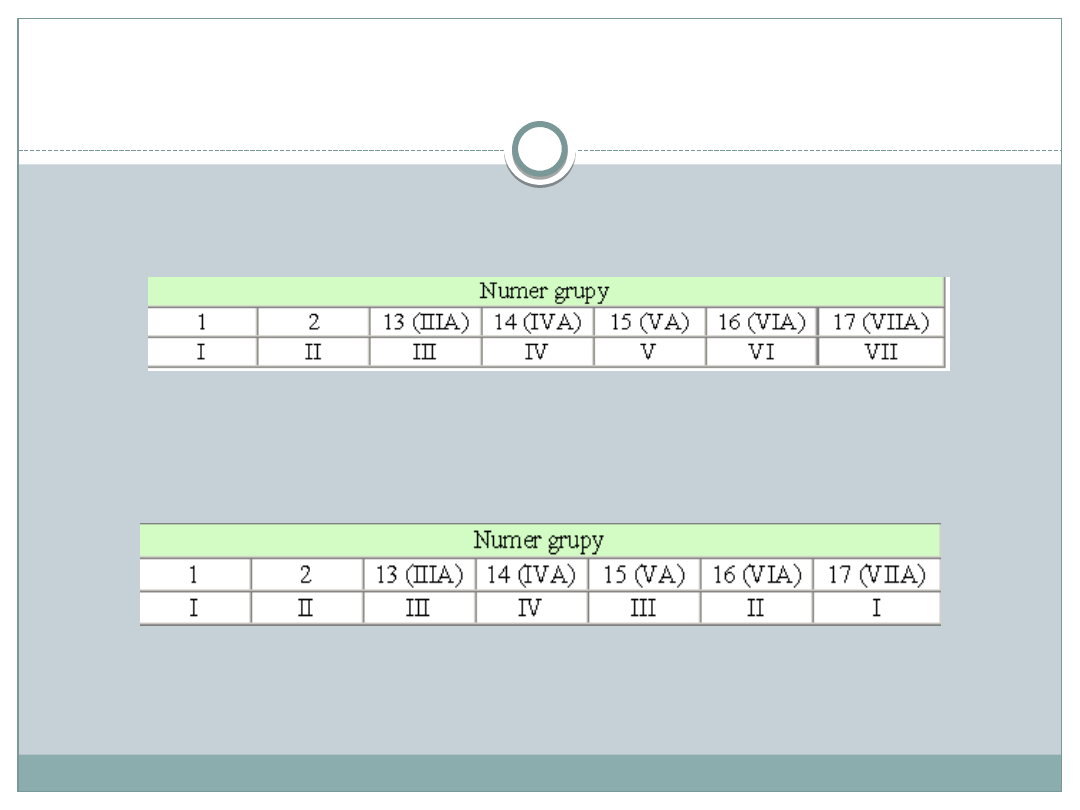
Wartościowość pierwiastków
Maksymalna wartościowość (nazywaną maksymalną
wartościowością względem tlenu) dla pierwiastków z grup
głównych równa jest cyfrze jedności w numerze grupy.
Wartościowość względem wodoru i metali (nazywana również
wartościowością normalną) powiązana jest z położeniem pierwiastka
w układzie okresowym w następujący sposób:
Pierwiastki o stałej wartościowości – 1. , 2. i 13 grupa oraz tlen(II),
cynk(II), fluor(I).

Tlenki - nazewnictwo
Tlenki
to
dwuskładnikowe związki tlenu z innymi pierwiastkami z
wyjątkiem fluoru (OF
2
– fluorek tlenu)
ogólny wzór
:
E
n
O
m
Nazwy systematyczne
w systemie Stocka: jeżeli dany pierwiastek
występuje w tlenkach na różnych wartościowościach (stopniach
utlenienia), to w nazwie należy podać wartościowość – stopień
utlenienia:
Na
2
O
–
tlenek
sodu
,
N
2
O
–
tlenek
azotu(I)
Ca
O
–
tlenek
wapnia
,
N
O
–
tlenek
azotu(II)
Al
2
O
3
–
tlenek
glinu ,
N
2
O
3
–
tlenek
azotu(III)
•
Nazewnictwo tlenków
mieszanych
(pierwiastki w cząsteczce występują
na różnych stopniach utlenienia (w różnych wartościowościach)
-
Fe
3
O
4
[inaczej
Fe
O
Fe
2
O
3
] –
tlenek
żelaza(II)
dwu
żelaza(III)
-
Pb
3
O
4
[inaczej (
Pb
O
)
2
Pb
O
2
] –
tlenek
dwu
ołowiu(II) ołowiu(IV)
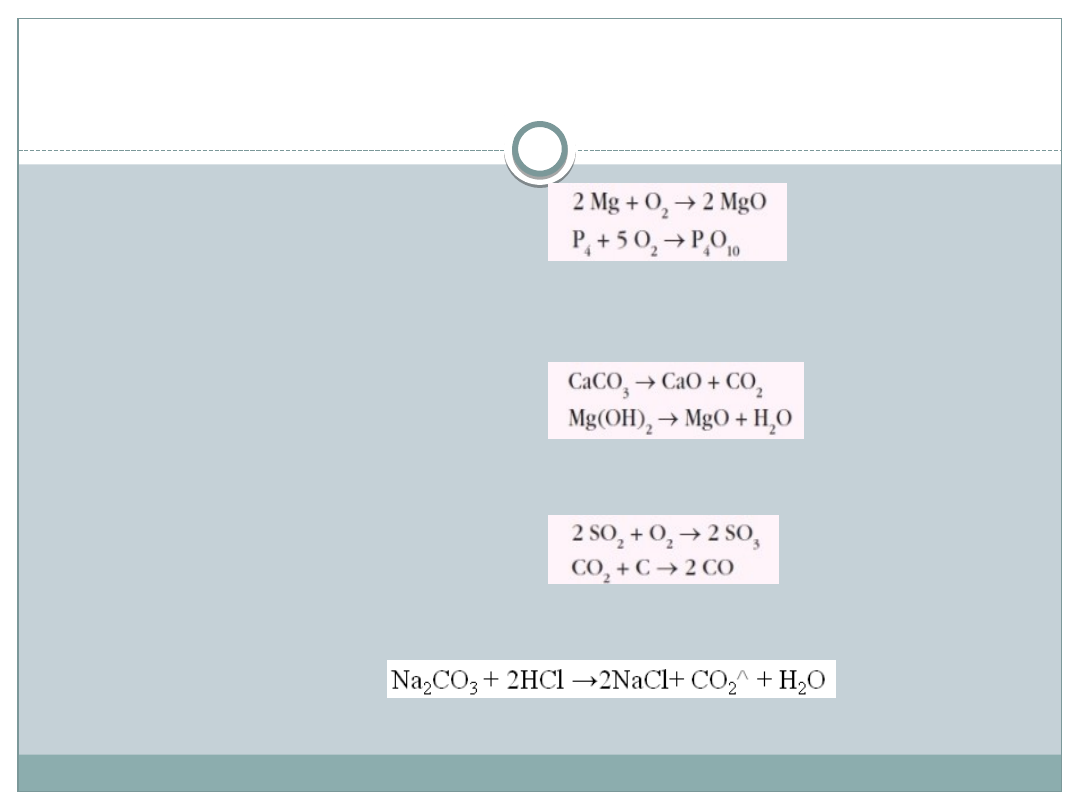
Metody otrzymywania tlenków:
Bezpośrednia synteza z pierwiastków:
Termiczny rozkład niektórych soli kwasów tlenowych (węglanów i
siarczanów IV) lub wodorotlenków (nierozpuszczalnych w wodzie):
Utlenianie lub redukcja tlenków (dla pierwiastków, które tworzą
tlenki na różnych stopniach utlenienia) w określonych warunkach,
np. w obecności katalizatora :
Reduktorami mogą być: C, H
2
, CO lub metale (Mg, Al.)
Reakcja soli nietrwałych kwasów tlenowych z mocnymi
kwasami:
Podział tlenków
ze względu na skład:
ze względu na zachowanie wobec wody:
tlenki metali
tlenki niemetali
Na
2
O tlenek sodu
SO
2
tlenek siarki(IV)
CaO tlenek wapnia
SO
3
tlenek siarki(VI)
Fe
2
O
3
tlenek żelaza(III)
N
2
O
5
tlenek azotu(V)
FeO tlenek żelaza(II)
P
4
O
10
tlenek fosforu(V)
reagujące z wodą
niereagujące z wodą
Na
2
O, MgO, CaO,
tworzące zasady w reakcji z wodą;
BeO, SiO
2
, Al
2
O
3
, Fe
2
O
3
, CO, NO
CO
2
, N
2
O
5
, SO
2
, SO
3
, P
4
O
10
,
tworzące kwasy w reakcji z wodą
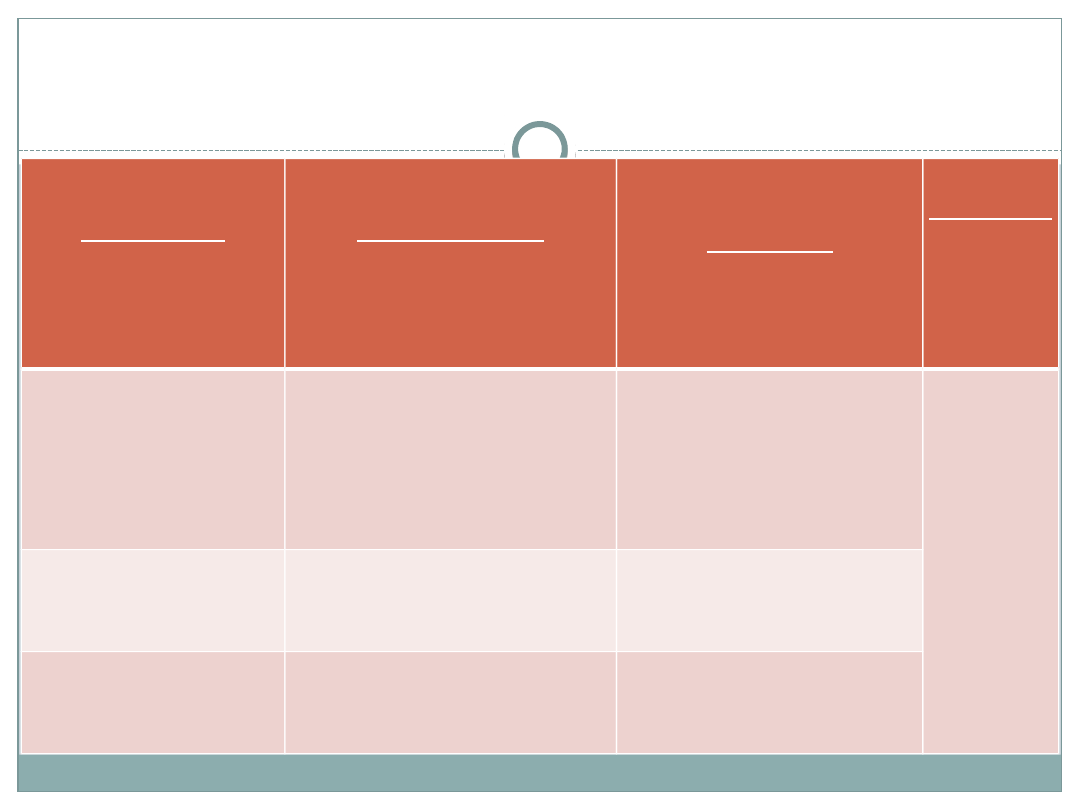
Podział tlenków ze względu na charakter chemiczny
Zasadowe
(reagujące z kwasami,
niereagujące z zasadami)
Amfoteryczne
(reagujące z kwasami i mocnymi
zasadami)
nie reagują z wodą
Kwasowe
(reagujące z zasadami, a
niereagujące z kwasami)
Obojętne
(niereagujące
z wodą,
kwasami,
zasadami)
tlenki te tworzą
metale z grup 1, 2 (bez berylu)
oraz np. Tl
2
O
3
, SnO
najniższe tlenki Cr, Mn
CrO, MnO
tlenki te tworzą
metale po przekątnej układu
np. Al
2
O
3
, ZnO, PbO, BeO, Ga
2
O
3
,
tlenki Cr, Mn na średnim stopniu
utlenienia
MnO
2
, Cr
2
O
3
tlenki te tworzą niemetale z grup
14, 15, 16, 17 oraz np. B
2
O
3
,
najwyższe tlenki Cr, Mn
CrO
3,
Mn
2
O
7
,
np. CO, N
2
O,
NO, SiO
Na
2
O + H
2
SO
4
→ Na
2
SO
4
+
H
2
O
Al
2
O
3
+ 6 HCl→ 2 AlCl
3
+ 3 H
2
O
SO
3
+ 2 NaOH → Na
2
SO
4
+ H
2
O
MgO + 2 HCl → MgCl
2
+
H
2
O
Al
2
O
3
+ 2 NaOH + 3 H
2
O → 2
Na[Al(OH)
4
]
P
4
O
10
+ 12 NaOH → 4 Na
3
PO
4
+ 6
H
2
O

Właściwości fizyczne tlenków
Tlenki metali:
substancje stałe o budowie krystalicznej,
większość tlenków jest związkami jonowymi, sieć krystaliczną tworzą
kationy metali i aniony tlenowe O
2-
,
w wodzie rozpuszczają się tylko tlenki litowców i berylowców z wyjątkiem
tlenku berylu,
w stanie stałym nie przewodzą prądu elektrycznego, w stanie stopionym są
przewodnikami prądu,
tlenki metali ciężkich są barwne, np.
Fe
2
O
3
– brunatny
,
HgO –
czerwony
,
Cr
2
O
3
– zielony,
CuO – czarny, a
TiO
2
, ZnO, MgO – białe
.
Tlenki niemetali :
•
związki o wiązaniach kowalencyjnych lub kowalencyjnych spolaryzowanych
z reguły substancje gazowe, rzadziej ciała stałe (SO
3
, P
4
O
10
, SiO
2
, N
2
O
5)
lub
ciecze (H
2
O, N
2
O
3
), w temp. poniżej temp. topnienia tworzą kryształy
cząsteczkowe o niskiej temp. topnienia.
Wodorki
Wodorki to związki dwuskładnikowe wodoru z metalem lub niemetalem
Wzór ogólny :
E
H
x
dla wodorków pierwiastka mniej elektroujemnego – metalu lub niemetalu z gr.
14, 15.
H
x
E
dla wodorków pierwiastka bardziej elektroujemnego – niemetalu z gr. 16 i 17.
Nazewnictwo:
Wodorki metali nazywa się zwykle według nomenklatury Stocka,
np. NaH – wodorek sodu,
Wodorki niemetali noszą nazwy, pochodzące od danego niemetalu, z
końcówką - wodór, np. HBr – bromowodór,
Wyjątki – woda H
2
O, amoniak –NH
3
, metan-CH
4
Otrzymywanie:
Najczęściej otrzymuje się je w wyniku bezpośredniej syntezy pierwiastków, np.
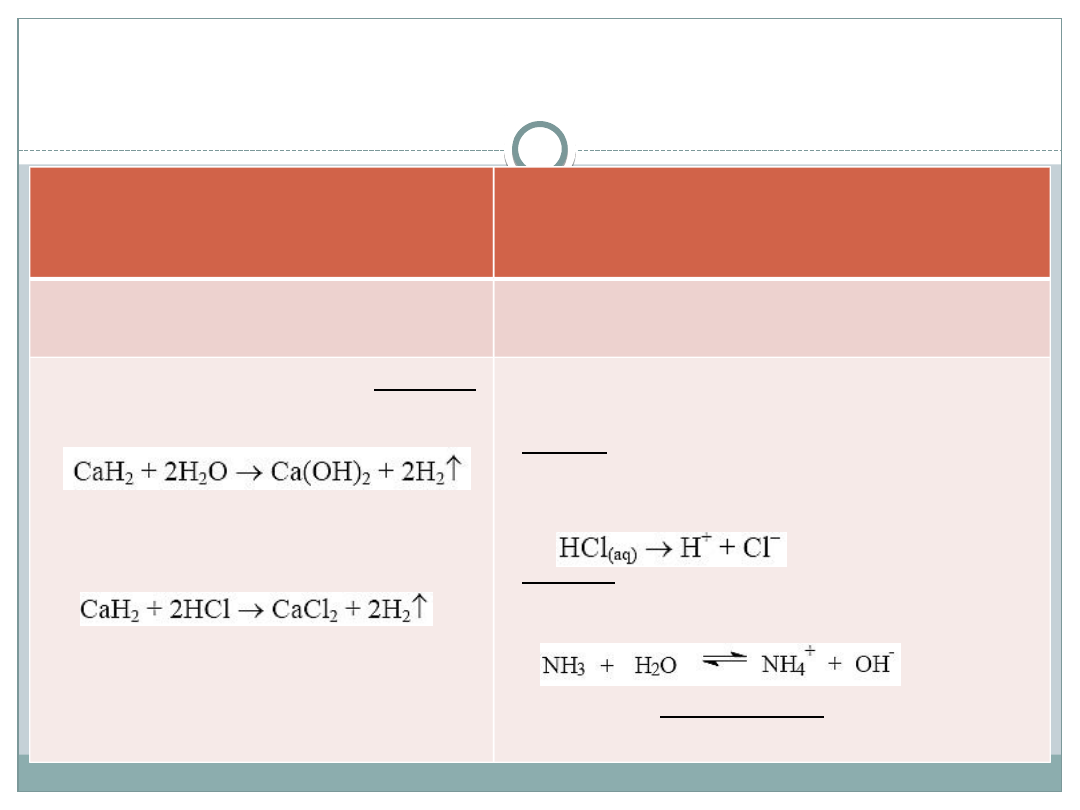
Właściwości chemiczne wodorków
METALI
(wodór na -I stopniu
utlenienia)
NIEMETALI
(wodór na I stopniu utlenienia)
posiadają charakter zasadowy i
redukujący
posiadają różnorodny charakter
reagując z wodą tworzą zasady:
reagują z kwasami, np.
reagując z wodą tworzą :
- kwasy –wodorki tlenowców i
fluorowców , np. HCl, H
2
S,
- zasady – amoniak np. NH
3
aq
- pozostałe nie reagują z wodą ,
np.CH
4
Wodorotlenki
Wodorotlenki to związki chemiczne, w skład których wchodzi kation
metalu i jon wodorotlenkowy OH
–
.
Wzór ogólny :
M
n
(OH)
n
Sieć krystaliczna wodorotlenków posiada budowę jonową, w której
przemiennie rozmieszczone są kationy metalu i aniony OH
—
, w
stosunku ilościowym odpowiadającym wzorowi sumarycznym
wodorotlenku.
Nazewnictwo
Nazwy wodorotlenków tworzy się stosując system Stocka, np.:
Fe(OH)
2
- wodorotlenek żelaza(II),
Fe(OH)
3
- wodorotlenek żelaza (III),
KOH - wodorotlenek potasu.
Zasady to rozpuszczalne wodorotlenki.
Moc zasad:
• w
grupie
moc zasad
rośnie
ze wzrostem liczby atomowej metalu
• w
okresie
moc zasad
maleje
ze wzrostem liczby atomowej metalu

Otrzymywanie wodorotlenków
metal + woda wodorotlenek + wodór
(z 1.lub 2.grupy (oprócz Be i Mg)
2 Na + 2 H
2
O 2 NaOH + H
2
tlenek metalu + woda wodorotlenek
(z 1.lub 2.grupy (oprócz BeO)
MgO + H
2
O Mg(OH)
2
wodorek metalu + woda wodorotlenek +
wodór
(
z 1.lub 2.grupy (oprócz Be)
CaH
2
+ 2H
2
O Ca(OH)
2
+ H
2
wodorotlenek
I
+ sól
I
wodorotlenek
II
+ sól
II
(rozpuszczalne)
NiCl
2
+ 2 NaOH Ni(OH)
2
+ 2 NaCl

Podział wodorotlenków
ze względu na charakter chemiczny
Zasadowe
Amfoteryczne
wodorotlenki metali 1 i 2 grupy
układu okresowego bez berylu
oraz np. Mn(OH)
2,
Cr(OH)
2
Be(OH)
2
; Cu(OH)
2
; Fe(OH)
2
; Pb(OH)
2
;
Al(OH)
3
; Cr(OH)
3
, Fe(OH)
3
; Sn(OH)
2
;
Mn(OH)
4
większość to wodorotlenki, które
po rozpuszczeniu w wodzie
tworzą zasady
zazwyczaj nierozpuszczalne w wodzie
reagują z kwasami i tlenkami
kwasowymi, nie reagują z
zasadami
reagują zarówno z mocnymi kwasami
jak i mocnymi zasadami
Ca(OH)
2
+ N
2
O
5
Ca(NO
3
)
2
+
H
2
O
Mg(OH)
2
+ 2 HCl MgCl
2
+
H
2
O
Al(OH)
3
+3HCl AlCl
3
+3H
2
O
Al(OH)
3
+NaOH Na[Al(OH)
4
]
tetrahydroksoglinian sodu
przy dużym nadmiarze zasady –
Na
3
[Al(OH)
6
]

Właściwości wodorotlenków
Niektóre właściwości
ciała stałe, krystaliczne o działaniu żrącym (soda żrąca –NaOH):
barwy – bezbarwne, np. NaOH, KOH, barwne, np.:
niebieski Cu(OH)
2
,
zielony Cr(OH)
3
,
rdzawy Fe(OH)
3
,
brunatnobrązowy Mn(OH)
4
,
białe AgOH, Pb(OH)
2
, Al(OH)
3
,
Zn(OH)
2
rozpuszczone w wodzie lub stopione przewodzą prąd elektryczny
(dot. wodorotlenków litowców i berylowców)
wodorotlenki pozostałych metali są substancjami słabo
rozpuszczalnymi w wodzie, są bardzo słabymi elektrolitami.
termicznemu rozkładowi ulegają wodorotlenki metalu ciężkiego, np.
Cu(OH)
2
CuO + H
2
O

Kwasy - s
posoby klasyfikacji kwasów
Kwasy to związki, które – zgodnie z teorią Arrheniusa – w roztworze wodnym
dysocjują na kationy wodoru i aniony reszt kwasowych
. Wzór ogólny:
H
I
x
R
x
Podział ze względu na obecność tlenu
- tlenowe, np. HNO
2
(kwas azotowy(III)), HNO
3
(kwas azotowy(V)), H
3
PO
4
(kwas fosforowy(V))
- beztlenowe, np. HCl (kwas chlorowodorowy), (H
2
S kwas siarkowodorowy)
Podział ze względu na liczbę atomów wodoru
- jednoprotonowe, np. HNO
3,
HNO
2
- wieloprotonowe, np. H
2
SO
4,
H
3
PO
4
Podział ze względu na zdolność utleniania
- silnie utleniające, np. HNO
3
, stężony H
2
SO
4
- słabo utleniające, (utleniaczem są atomy H
I
), np. HCl
Podział ze względu na trwałość
- trwałe, np. H
2
SO
4
, HNO
3
, H
3
PO
4
- nietrwałe, np. H
2
CO
3
, H
2
SO
3
Podział ze względu na moc
- elektrolity mocne, np. HCl, HBr, HI, H
2
SO
4
, HNO
3
, HClO
4
- elektrolity słabe, np. H
2
S, HF, HClO, HNO
2
, H
2
SO
3

Metody otrzymywania kwasów:
w reakcji tlenków kwasowych z wodą, np.
Tlenek krzemu nie tworzy z wodą kwasu
w reakcji soli słabego, lotnego, nietrwałego kwasu z mocnym kwasem,
np.
w reakcji bezpośredniej syntezy z pierwiastków (dla kwasów
beztlenowych), np.
Kwasy reagują z zasadami, tlenkami zasadowymi i amfoterycznymi,
solami kwasów słabszych i bardziej lotnych oraz z metalami (więcej
przy temacie soli)

Reakcje metali z kwasami
reakcja kwasu nieutleniającego np. rozcieńczonego kwasu siarkowego
(VI) lub chlorowodorowego z metalami bardziej aktywnymi niż wodór:
Ca + H
2
SO
4
CaSO
4
+ H
2
Mg + 2 HCl MgCl
2
+ H
2
reakcja stężonego kwasu azotowego (V) z metalami mniej aktywnymi
niż wodór (nie mogącymi wyprzeć wodoru z cząsteczki kwasu):
Ag + 2HNO
3
AgNO
3
+
NO
2
+ H
2
O
reakcja rozcieńczonego kwasu azotowego (V) z metalami mniej
aktywnymi niż wodór:
3 Ag + 4 HNO
3
3 AgNO
3
+
NO
+ 2 H
2
O
reakcja stężonego kwasu siarkowego (VI) z metalami, mniej
aktywnymi niż wodór:
Cu + 2 H
2
SO
4
CuSO
4
+
SO
2
+ 2 H
2
O
pasywacja niektórych metali pod wpływem kwasów utleniających (Al, Cr,
Fe)
2 Al+ 6 HNO
3
Al
2
O
3
+ 6
NO
2
+ 3H
2
O
(tlenek glinu
blokuje dalszą reakcję)

Moc kwasu
Jak zmienia się moc kwasu?
• ze wzrostem liczby atomowej niemetalu moc kwasów tlenowych (niemetal na
najwyższym stopniu utlenienia) w okresie rośnie
• ze wzrostem liczby atomowej niemetalu moc kwasów beztlenowych w okresie
rośnie
• w grupie moc kwasów tlenowych (niemetal na najwyższym stopniu utlenienia)
maleje ze wzrostem liczby atomowej niemetalu
• w grupie moc kwasów beztlenowych rośnie ze wzrostem liczby atomowej
niemetalu
• ze wzrostem liczby atomów tlenu w cząsteczce kwasu rośnie moc (dla kwasów
tlenowych niemetali, które mogą występować na różnych stopniach utlenienia)
HClO < HClO
2
< HClO
3
<
HClO
4
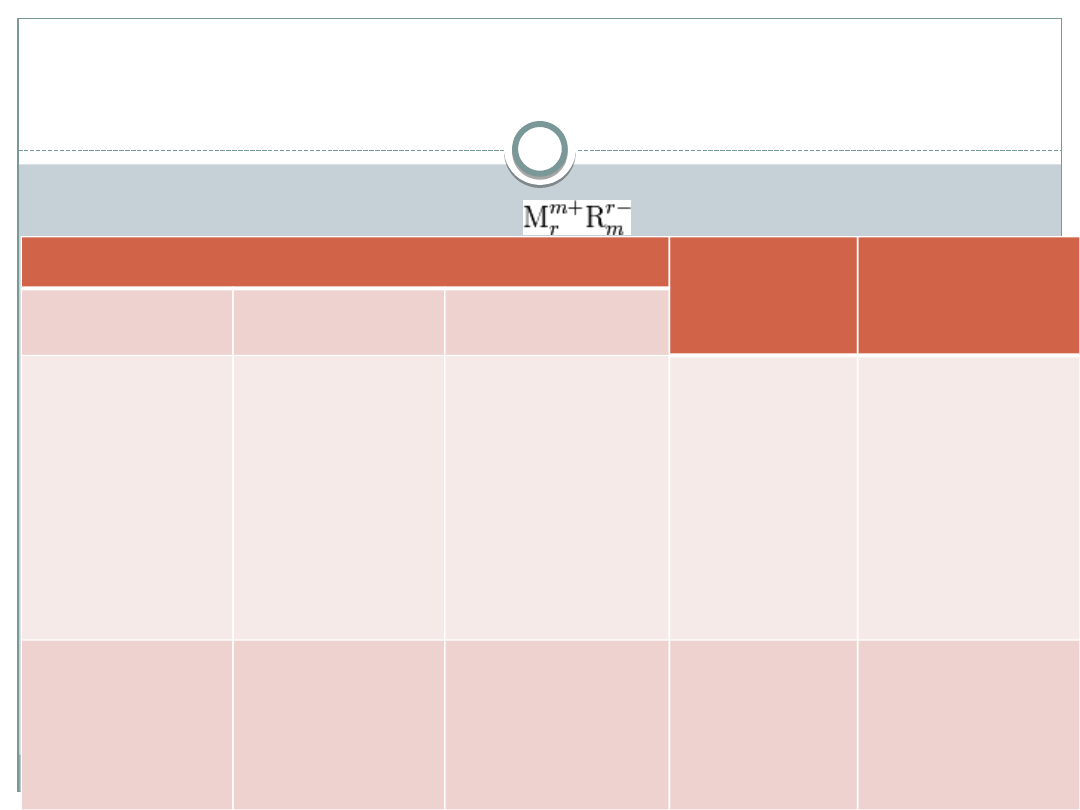
Rodzaje soli
Sole obojętne
Wodorosole Hydroksosole
Sole proste
Sole
podwójne
Hydraty
Zawierają
jeden rodzaj
kationów
i jeden rodzaj
anionów
Zawierają
dwa
rodzaje
kationów
i
jeden rodzaj
anionów
lub
jeden rodzaj
kationu
i
dwa rodzaje
anionów
Sole
uwodnione
(wodziany)
zawierają w
kryształach
soli
wbudowane są
cząsteczki
wody
Zawierają
przynajmnie
j jeden
wymienialn
y
kation
wodoru
związany z
resztą
kwasową
Zawierają
przynajmniej
jeden
anion
wodorotlenow
y
związany
z kationem
metalu w soli
Na
2
SO
4
Ca
(
NO
3
)
2
K
Br
Mg
Al
2
(
SO
4
)
4
Pb
2
Cl
2
CO
3
CaSO
4
.
2H
2
O
siarczan(VI)
wapnia-
woda(1/2)
CuSO
4
.
5H
2
O
K
H
F
2
Na
H
CO
3
Ca(
H
2
PO
4
)
2
Cu
OH
Cl
chlorek
wodorotlenek
miedzi(II)
Cr
OH
SO
4
Sole to związki, które w stanie stałym zbudowane są z kationów metali
(wyjątek – jon NH
4
+
) i anionów reszt kwasowych.
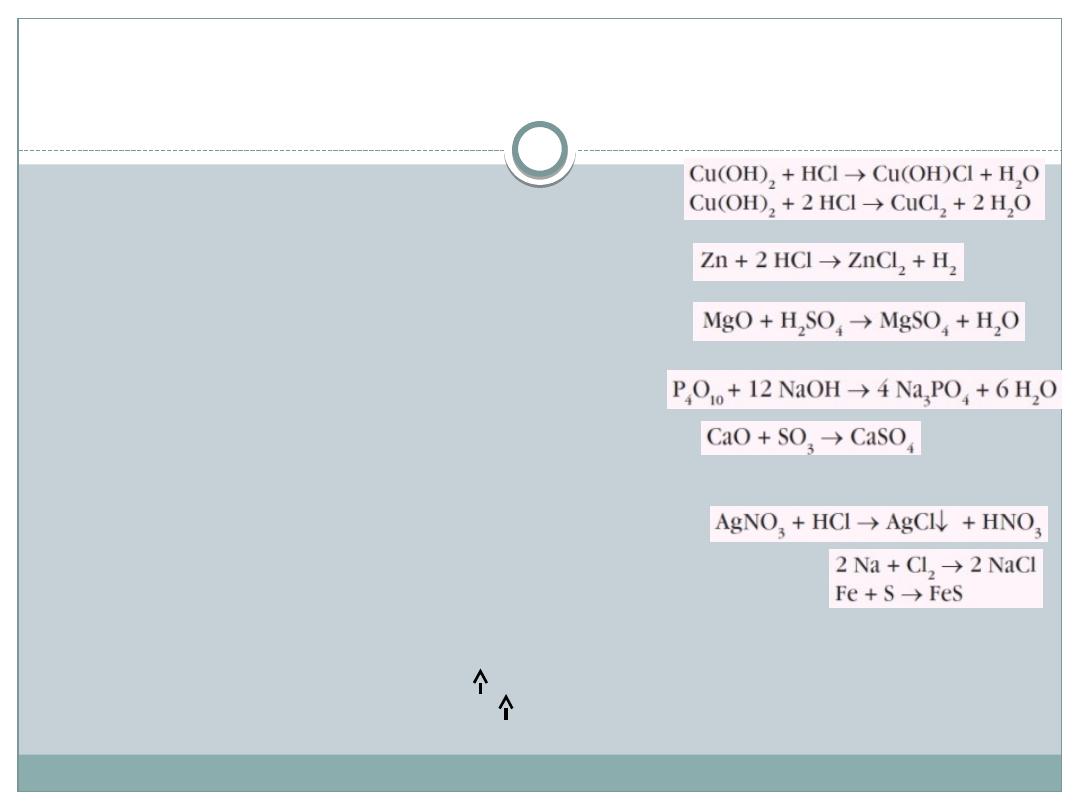
Sposoby otrzymywania soli
w reakcji kwasu z wodorotlenkiem, np.
ZOBOJĘTNIANIE
w reakcji metalu z kwasem (dla soli metali aktywnych), np.
w reakcji tlenku zasadowego z kwasem, np.
w reakcji tlenku kwasowego z zasadą, np.
w reakcji tlenku zasadowego z tlenkiem kwasowym, np.
wytrącanie trudno rozpuszczalnych soli z roztworu soli rozpuszczalnych, np.
bezpośrednia synteza z pierwiastków (sole kwasów beztlenowych), np.
wypieranie przez mocniejszy kwas słabszego, bardziej lotnego lub nietrwałego
kwasu z jego soli lub przez mocniejszą zasadę słabszej z jej soli.
NaOH + NH
4
Cl → NaCl + NH
3
+ H
2
O
2HClO
4
+ FeS → Fe(ClO
4
)
2
+ H
2
S

Właściwości soli
W stanie stałym sole tworzą sieć krystaliczną zbudowaną z jonów dodatnich i ujemnych .
W roztworze wodnym tworzą solwatowane, osobne jony. W stanie stopionym tworzą ciecz
składającą się z jonów.
Cechy charakterystyczne dla praktycznie wszystkich soli to:
Wysoka temperatura topnienia i bardzo wysoka temperatura wrzenia,
Praktycznie całkowita dysocjacja na jony w roztworach wodnych,
Krystaliczne ciała stałe.
Rozpuszczalność w wodzie jest różna i zależy zarówno od anionu, jak i od kationu.
Z pewnymi wyjątkami azotany , chlorki oraz sole amonu, potasu i sodu to sole dobrze
rozpuszczalne w wodzie.
Do soli wytrącających się z roztworów wodnych należą głównie sole srebra, ołowiu i rtęci.
Barwa soli zależy od kationu oraz od anionu- najczęściej jednak sole są substancjami o kolorze
białym.
Przykładowe kolorowe sole:
CuSO
4.
5H
2
O
-
– niebieska, chociaż
CuSO
4-
biała
KMnO
4
– fioletowa
Ag
2
S – czarna
FePO
4
– żółta
PbJ
2
– żółta
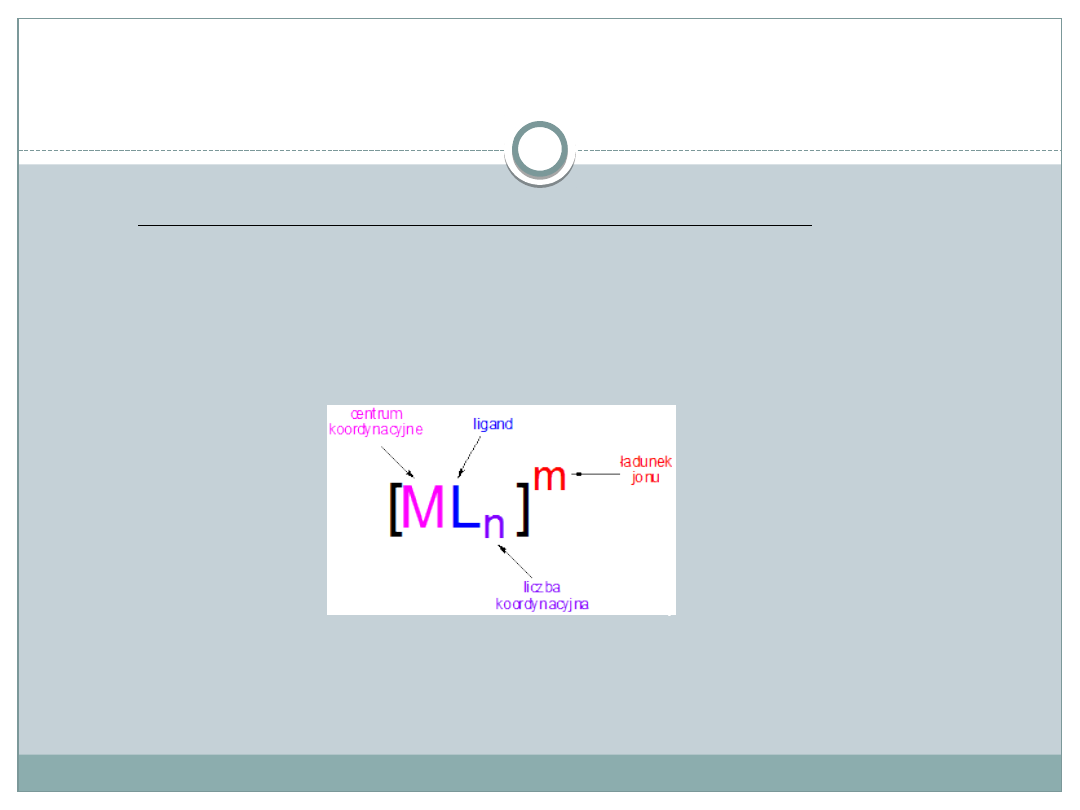
Związki kompleksowe (koordynacyjne)
W skład związków koordynacyjnych wchodzi:
• jon/atom centralny
, np. Al
3+
, Cu
2+
, Co
2+
, Cr
3+
, Fe
3+
, Ni
2+
, Zn
2+
• ligandy
, którymi mogą być:
obojętne cząsteczki, np.
H
2
O
(akwa),
NH
3
(amina),
CO
(karbonyl),
NO
(nitrozyl),
jony, np.
OH
-
(hydrokso),
Cl
–
(chloro),
F
–
(fluoro),
SCN
–
(tiocyjaniano),
CN
–
(cyjano)
Ligandy (donory pary elektronowej) łączą się z jonem centralnym
(akceptor pary elektronowej) za pomocą wiązań koordynacyjnych.
Liczba ligandów bezpośrednio połączonych z atomem centralnym to liczba
koordynacyjna (najczęściej 2, 4, 6). Liczba ta decyduje o określonej
strukturze przestrzennej związku.

Wzory i nazwy związków
kompleksowych
We wzorze jonu kompleksowego obowiązuje następująca kolejność:
[
atom centralny
,
ligandy naładowane
,
ligandy obojętne
]
ładunek jonu
W nazwie natomiast obowiązuje kolejność alfabetyczna wszystkich ligandów
(niezależnie od ich rodzaju)
[Al(H
2
O)
6
]Cl
3
chlorek heksa
akwa
glinu
[Ag(NH
3
)
2
]OH wodorotlenek di
amina
srebra (I)
K
3
[Fe(SCN)
6
] heksa
tiocyjaniano
żelazian(III)
potasu
[Ag(NH
3
)
2
]OH wodorotlenek di
amina
srebra(I)
Na
2
[Fe(CN)
5
NO] penta
cyjano
nitrozyl
żelazian(III)
sodu
Nazwy niektórych ważniejszych ligandów:
H
2
O (akwa),
S
2
O
32-
(tiosiarczano(VI)),
NH
3
(amina), CN
-
(cyjano), OH
-
(hydrokso)
CO (karbonyl), F
-
(fluoro), SO
42-
(siarczano(VI)),
Document Outline
- Slide 1
- Wartościowość pierwiastków
- Tlenki - nazewnictwo
- Metody otrzymywania tlenków:
- Podział tlenków
- Podział tlenków ze względu na charakter chemiczny
- Właściwości fizyczne tlenków
- Wodorki
- Właściwości chemiczne wodorków
- Wodorotlenki
- Otrzymywanie wodorotlenków
- Slide 12
- Właściwości wodorotlenków
- Kwasy - sposoby klasyfikacji kwasów
- Metody otrzymywania kwasów:
- Reakcje metali z kwasami
- Moc kwasu
- Rodzaje soli
- Sposoby otrzymywania soli
- Właściwości soli
- Związki kompleksowe (koordynacyjne)
- Wzory i nazwy związków kompleksowych
Wyszukiwarka
Podobne podstrony:
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Chemia, Chemia - Systematyka związków nieorganicznych, OTRZYMYWANIE TLENKÓW:w drodze bezpośredniej s
Związki nieorganiczne węgla i ich właściwości 1, Chemia(2)
Związki nieorganiczne - zadania, Matura, Chemia, Zadania
SYSTEMATYKA ZWIAZKOW NIEORGANICZNYCH 5.11 (8.11), Budownictwo PK, Chemia, Chemia nieorganiczna od Ma
Związki nieorganiczne węgla i ich właściwości, Chemia(2)
TEST Systematyka związków nieorganicznych (wersja II), Chemia
systematyka związków nieorganicznych, chemia
Systematyka związków nieorganicznych, Chemia
TEST Systematyka związków nieorganicznych (wersja I), Chemia
Klasyfikacja związków nieorganicznych, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
CHEMIA- SYSTEMATYKA ZWIĄZKÓW NIEORGANICZNYCH, Chemia
Typy reakcji związków chemicznych, Studia, Chemia organiczna i nieorganiczna
Właściwości związków nieorganicznych, Studia, Chemia, chemia7
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
zwiazki nieorg 1 cz2
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Identyfikacja roztworów związków nieorganicznych
więcej podobnych podstron