
Stan gazowy
Gazy i środki lotne

Opis stanów materii
• Termin „stan” ma w chemii
fizycznej kilka różnych znaczeń
• Pierwsze znaczenie odnosi się do
form w jakich może występować
materia:
• Stan gazowy, ciekły i stały

STAN
• Stan będzie wyrażać opis pewnej
wybranej części materii
określający charakteryzujące
wartości objętości, ciśnienia,
temperatury, i ilości substancji.
• Dwie próbki tej samej substancji
są w tym samym stanie jedynie
wówczas, gdy mają taką samą
masę, objętość, ciśnienie i
temperaturę.

Objętość, temperatura
• Objętość
próbki V jest miarą
przestrzeni, jaka próbka zajmuje.
• Temperatura
ciała jest wielkością, która
określa kierunek przepływu energii,
gdy ciało znajduje się w kontakcie z
innym: energia przepływa od ciała o
temperaturze wyższej do ciała o
temperaturze niższej.
• Gdy dwa ciała maja tę samą
temperaturę, nie zachodzi miedzy nimi
przepływ ciepła i mówimy wówczas, że
znajdują się w
równowadze termicznej.

Jednostki ciśnienia
• W praktyce wielorakość.
• W układzie SI:
• 1 Pa = 1 N/m
2
• W równaniach należy stosować
jednostki Pa
• Inne jednostki:
• 1 bar = 10
5
Pa
• 1 mm Hg = 1 torr = 133.32 Pa

Jednostki ciśnienia
• 1 atm = 1,013 x 10
5
Pa
• 1 psi = 6894,76 Pa
• Ciśnienie w manometrach
pokazuje ciśnienie mierzone
względem ciśnienia
atmosferycznego:
• Psia = psig+14,7 (psi)
• Atmosfera standardowa = 760 mm
Hg = 760 torr = 1,013 bar =
1,013 x 10
5
Pa

Równanie stanu
• Stan dowolnej próbki danej
substancji możemy określić
podając wartości:
• V – objętość, jaką zajmuje próbka,
• P – ciśnienie, pod jakim się
znajduje,
• T – jej temperaturę
• N – ilość substancji, jaką zawiera
• Z doświadczenia wiemy, że te
cztery wielkości nie są od siebie
niezależne

Równanie stanu
• Co to oznacza?
• Np.. W 5,55 moli wody o objętości
100 cm
3
w temp. 500 K panujące
ciśnienie wynosiło by 100 kPa.
Doświadczalnie stwierdza się, że
taki stan nie istnieje.
• Jeżeli dobierzemy: n, V, T, to w
układzie ustali się ciśnienie p
niezależne od naszej woli.

Równanie stanu
• Prawidłowość ta odnosi się do
wszystkich substancji.
• Inaczej mówiąc stwierdza się, że
substancja spełnia określone
równanie stanu.
• Dla większości nie jest znane. W
szczególności znane jest równanie
stanu dla gazów pod niewielkim
ciśnieniem.

Równanie stanu gazu
doskonałego
• Równanie stanu gazów było
jednym z pierwszych praw chemii
fizycznej.
• Równanie Boyle’a Mariott’a
• Stanowi idealizację równań stanu
spełnianych w rzeczywistości
przez gazy.
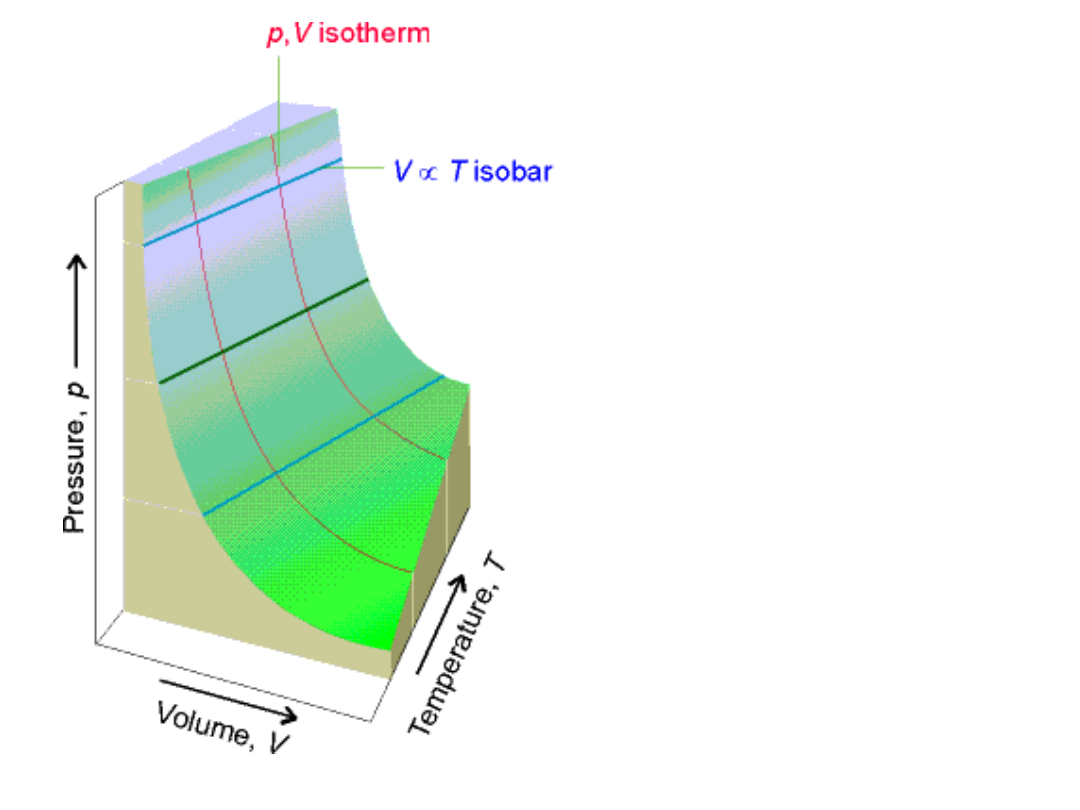

Gazy idealne i gazy
rzeczywiste
• Równanie
• P·V = n · R · T
• P – Pa
• V – m
3
• n – liczba moli gazu
• T – temperatura w K
• R – stała gazowa [ 8,314 J mol
-1
K
-1
]

Wartości stałej gazowej w
różnych jednostkach
• R = 8,31451• J • K
-1
• mol
-1
– 8,31451 • kPa • l • K
-1
• mol-1
– 8,20578 • 10
-2
• l • atm • K
-1
• mol-1
– 62,364 • l • Tr • K
-1
• mol
-1
– 1, 98722 • cal • K
-1
• mol
-1

Równania gazu
doskonałego
• Podstawą kinetyczna teoria gazu
– Doskonałe elastyczne kule
– Objętość kuli do pominięcia
– Brak występowania oddziaływań:
• przyciągających
• odpychających
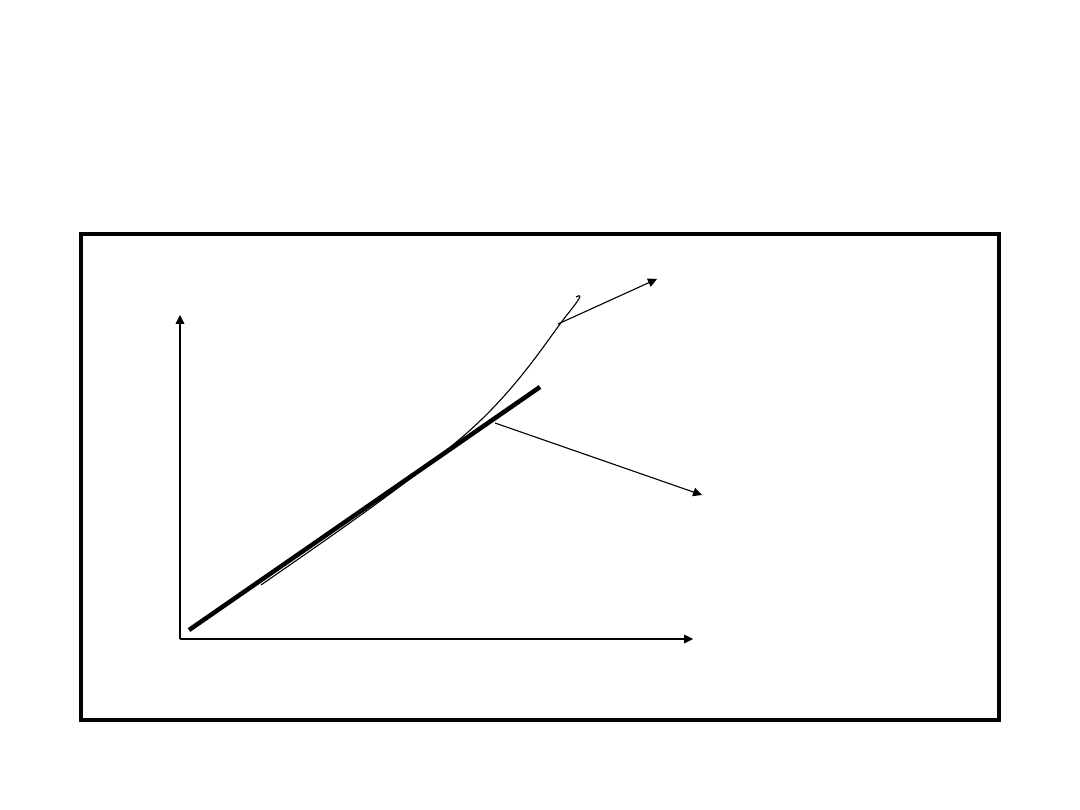
Prawo Boyle’a p versus
1/V
• P vs 1/V
p
1/objętość, 1/V
Ciśnienie
gazu
doskonałego
Ciśnienie
obserwowana
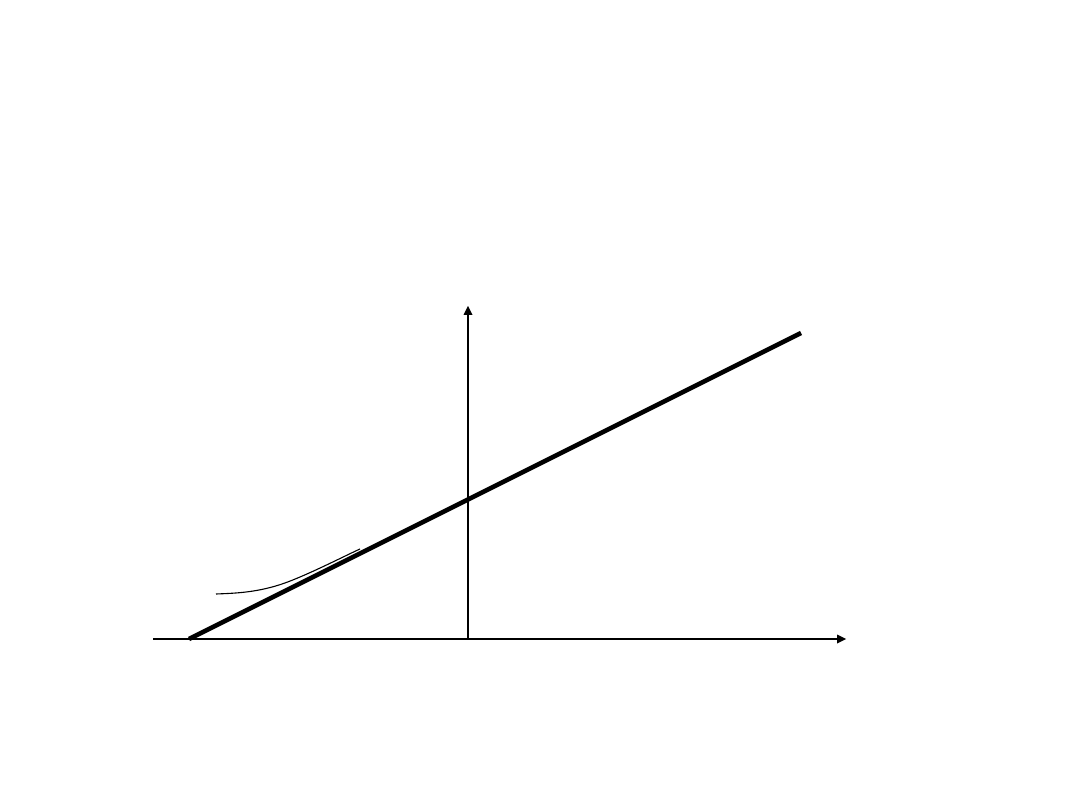
Prawo Charlesa V versus
t/°C
• V vs t/C
-273
0
Temperatura /°C

Objętość molowa
• Objętość molowa,
V
m
, dowolnej
substancji przedstawia objętość
zajmowaną przez mol cząsteczek
tworzących substancję:
• V
m
= V/n
• Z zasady Avogadra wynika, że
objętości molowe wszystkich
gazów w tych samych warunkach
p i T są jednakowe

Warunki standardowe
• Temperatura 25°C dokładnie (298,
15 K)
• Ciśnienie 100 kPa (tj. 1 bar)
• Ciśnienie standardowe p = p
= 1
bar
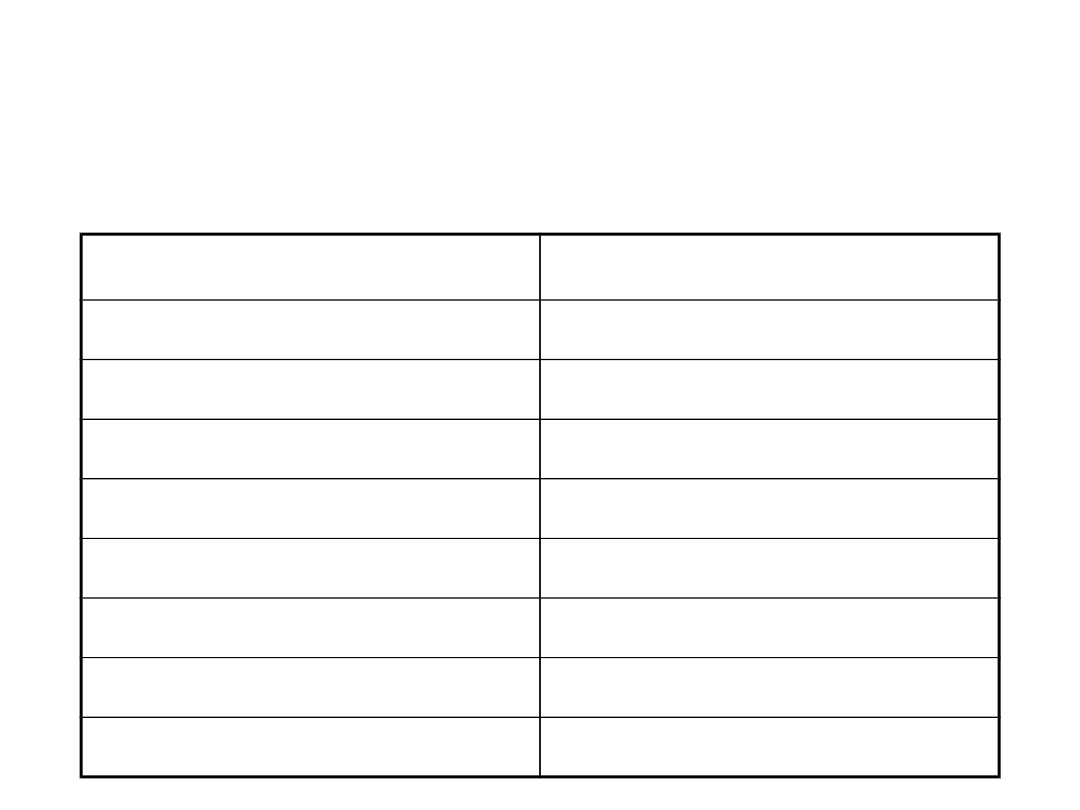
Objętości molowe gazów w
temperaturze 25 °C i pod
ciśnieniem 1 bar
Gaz
V
m
/l· mol
-1
Gaz doskonały
24,79
Amoniak
24,4
Argon
24,8
Dwutlenek węgla
24,6
Azot
24,8
Tlen
24,8
Wodór
24,8
Hel
24,8

Areozole
• W niektórych typach areozoli
• Gaz pod ciśnieniem
wykorzystywany jest do wydalenia
produktu jako strumienia ciała
stałego, mgły, lub piany.
• Ciśnienie gazu w areozolach
można obliczyć wykorzystując
prawo B

Obliczenie ciśnienia z
wykorzystaniem prawa B
• Oblicz ciśnienie gazu w pojemniku
zawierającym areozol, jeżeli
temperatura wynosi 25 °C,
objętość pojemnika V = 250 cm
3
,
objętość cieczy V
C
= 160 cm
3
. Do
pojemnika wprowadzono 0,04
mola azotu.

Rozwiązanie
• PV = n R T P = n R T / V
• P = ?
• V
g
=V – V
c
= 250 cm
3
-160 cm
3
= 90 cm
3
• 90 cm
3
x [1 m
3
/10
6
cm
3
]
• n = 0,04
• T = t °C + 273,15 K = 25 + 273,15 =
298,15
• P = (0,04 mol x 8,314 J/[mol K] x
298,15 K)/(90 cm
3
1 m
3
x 10
-6
cm
-3
) =
1,01 x 10
6
N m
-2
(lub Pa)

Równanie stanu gazów
rzeczywistych
• Napiszmy równanie stanu dla 1
mola gazu podzielmy stronami
przez n RT:
1
RT
1
pV
nRT
pV
m
m

Współczynnik ściśliwości
• Poprzednie równanie sugeruje wartość
jeden dla wszystkich gazów.
• Prawa strona wyrażenia oznaczana jest
jako z
• Zmiana ciśnienia nie powinna wpływać
na wartość tego wyrażenia.
• W rzeczywistości wartość ta różni się
od jedności i zależy od ciśnienia.
• Odchylenia są wywołane
oddziaływaniami
międzycząsteczkowymi.
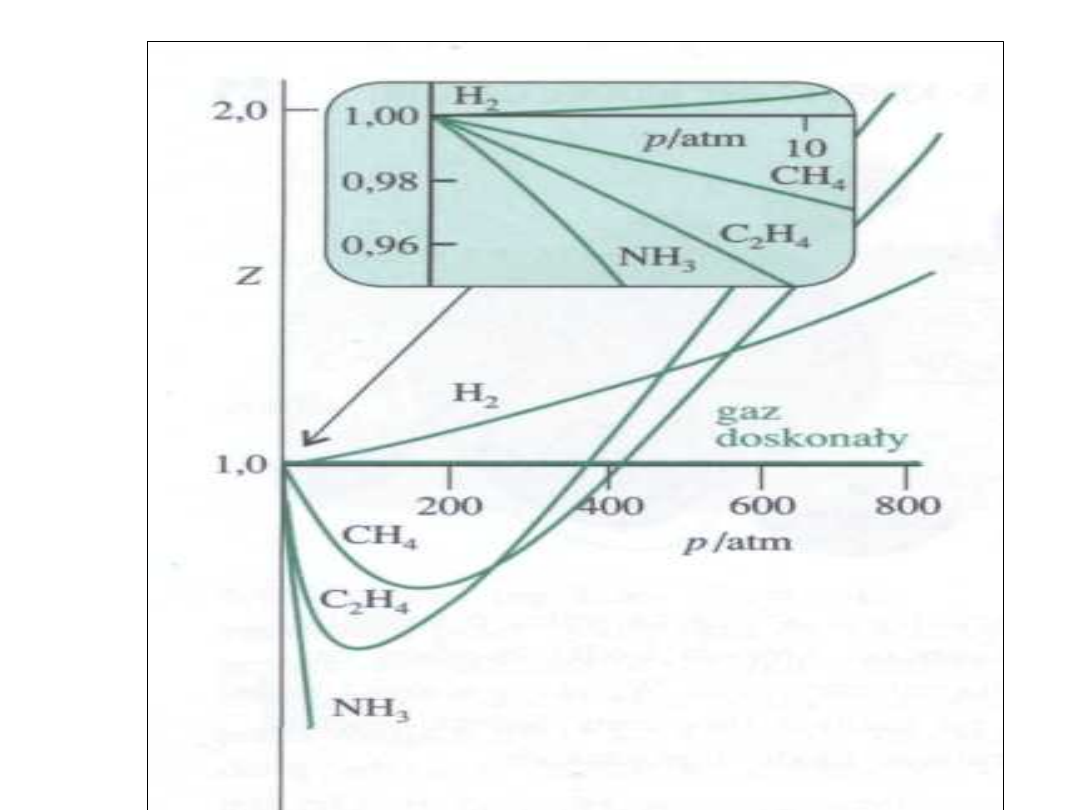


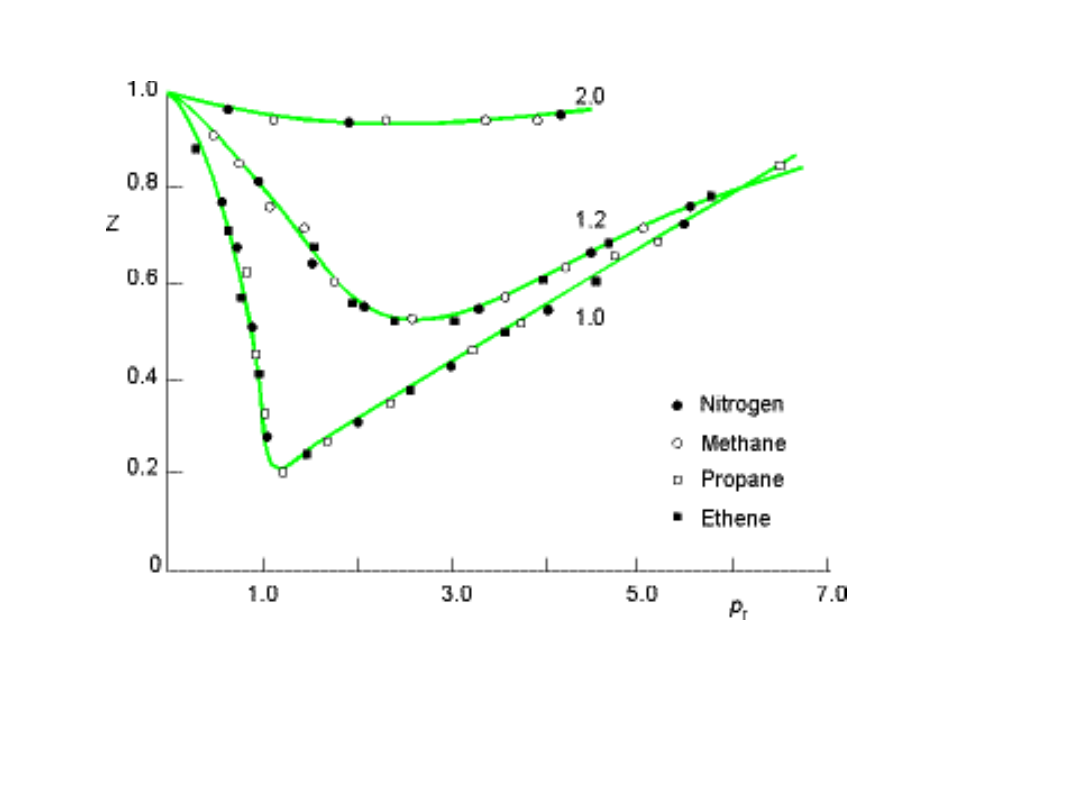
Z- odstępstwa od 1
• Wykres przedstawia z = f(p) dla
temperatury 0 °C.
• Wodór wykazuje z >1 zawsze
• Pozostałe gazy
• z < 1 w początkowej fazie
• z > 1 przy wysokich ciśnieniach
• z > 1 oznacza V
m
> od wartości
oczekiwanej (siły odpychania)
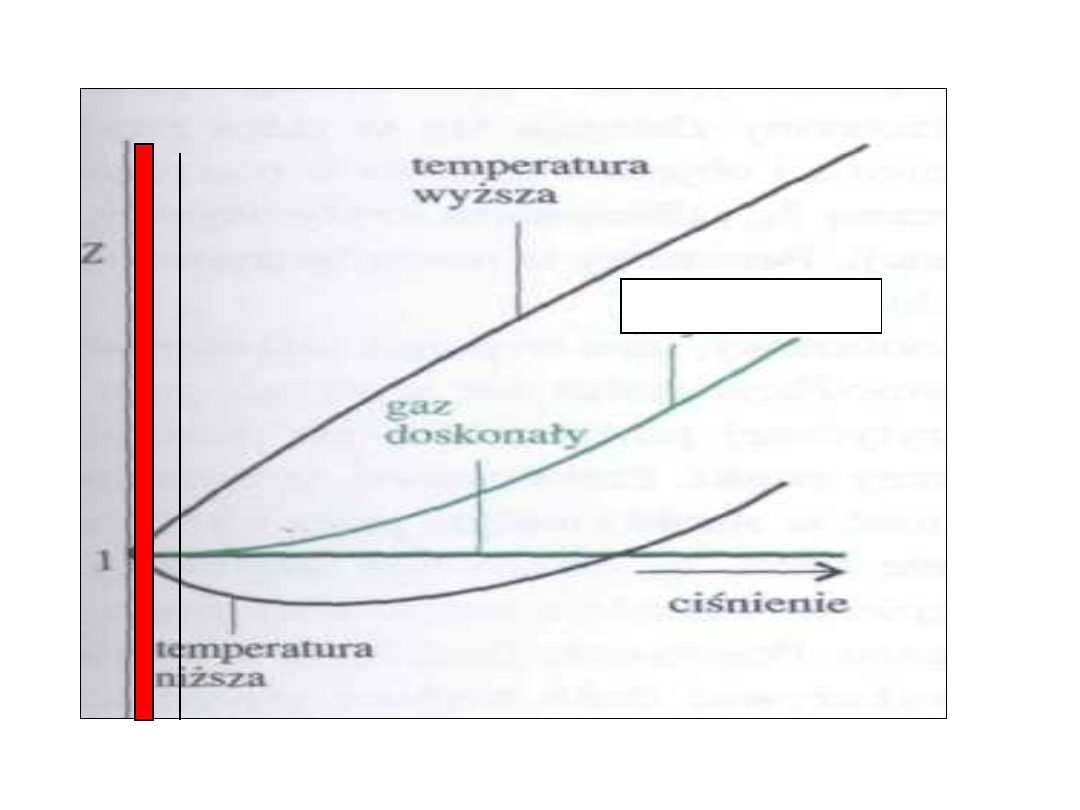

Systemy spotykane w
medycynie
• Obszar zaznaczony na czerwono
obejmuje zakres ciśnień z jakim
spotykamy się w medycynie, zatem
zastosowanie praw odnoszący się
do gazów idealnych jest słuszne

Gazy rzeczywiste
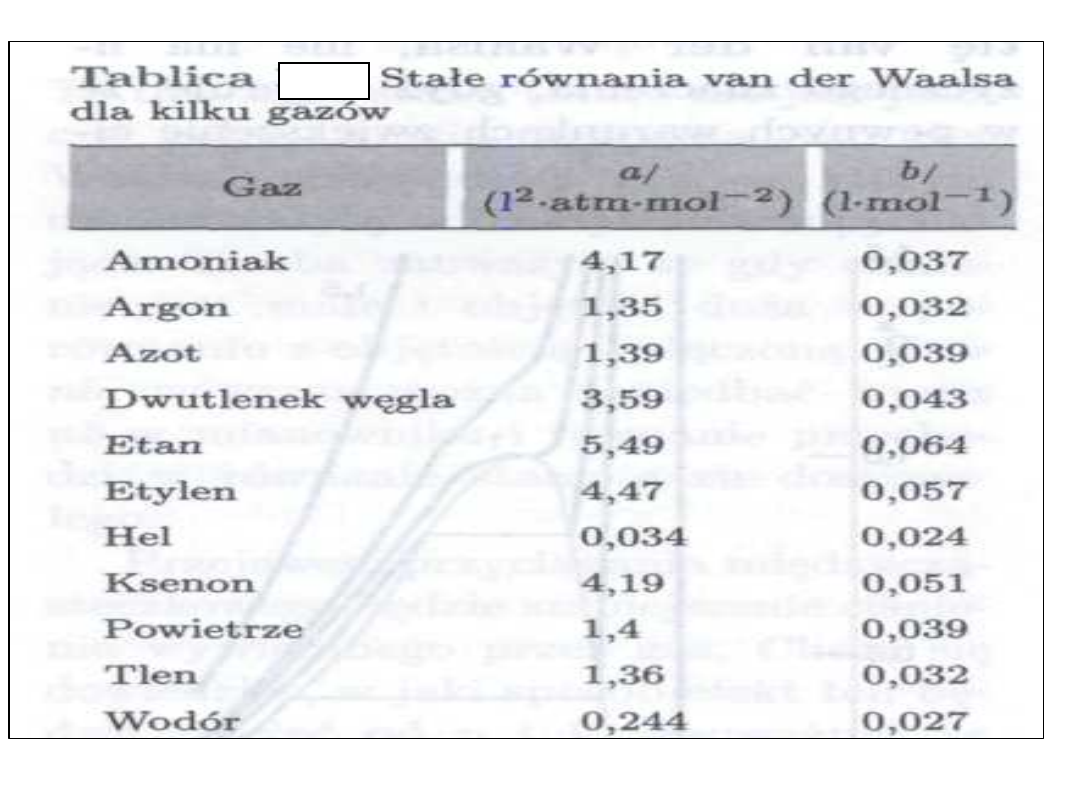
• Van der Waals wprowadził
poprawki do gazowego równania
stanu gazowego uwzględniające
wzajemne oddziaływanie
cząsteczek i objętość własną
cząsteczek.
• Dla 1 mola gazu rzeczywistego
równanie van der Waalsa ma
postać
• (p + a/V
2
)(V-b) = RT

Gazy rzeczywiste
• gdzie: V - oznacza objętość gazu
rzeczywistego,
• p - ciśnienie,
• R - stała gazowa,
• T - temperatura w Kelvinach,
• a i b - stałe charakterystyczne dla
danego gazu rzeczywistego

Gazy rzeczywiste
• Wartość a jest stałą wynikająca z
istnienia sił przyciągania
międzycząsteczkowego, natomiast
b jest poprawką związaną z
objętością własną cząsteczek gazu.

Gazy rzeczywiste
• Poprawka a/V
2
nosi nazwę
ciśnienia wewnętrznego gazu.
Dodaje się ją do ciśnienia
zewnętrznego p dlatego, że
ciśnienia te mają zgodny kierunek
działania.

Gazy rzeczywiste
• Poprawka b zależy od wielkości i
kształtu cząsteczki gazu rzeczywistego,
oznacza tzw sferę działania
cząsteczek.
• b jest równe w przybliżeniu poczwórnej
objętości własnej cząsteczek.
• Poprawkę b wynikającą z istnienia
objętości własnej cząsteczek odejmuje
się od całkowitej objętości v zajmowanej
przez gaz.

Porównanie zachowania
się gazów
• 0,193 mola eteru wypełnia
zbiornik o pojemności 7,35 litra w
temp. 295 K.
• Oblicz ciśnienie p stosując
równanie gazu idealnego i
rzeczywistego.
• Poprawka dla eteru a = 17,38 L
2
atm mol
-2
• Poprawka b = 0,1344 L mol
-1
.

Rozwiązanie
• P • V = n • R • T
• (P+a • n
2
/V
2
) •(V-b) = R • T
• P = R • T/(V-b)-a • n
2
/V
2
• P = (0,193 • mol • 0,0821 • l •
atm • deg • mol • 295 deg)/7,35 l
=
0,636 atm
• P= (0,193 • 0,0821 • 295)/[7,35-
(0,193 • 0,1344)]-17,38 • 0,193
2
=
0,626 atm

Gaz idealne i rzeczywiste
• Obliczyć ciśnienie 0,5 mola dwutlenku
węgla w gaśnicy o pojemności 1 litra w
temperaturze 27°C. Poprawki równania
van der Waalsa wyliczyć na podstawie
temperatury i ciśnienia krytycznego:
• Poprawka a = 27 R
2
T
2
c
/64 P
c
• Poprawka b = RT
c
/8P
c
• Temperatura krytyczna T
c
= 31,0 C
• Ciśnienie krytyczne P
C
= 72,9 atm

Rozwiązanie
• P = n • R • T/V=0,5 • 0,0821 •
300,15/1 = 12, 32 atm
• A = 27 • (0,0821)
2
(304.15)
2
/(64
72.9) = 3,608
• B = (0,0821 • 304,15)/(8 • 72,9) =
0,0428
• P = n • R • T/(V-n • b)-a •
n
2
/V
2
=(0,5 • 0,0821) • 300,15/(1-
(0,5 • 0,0428)-(3,608 • (0,5)
2
)/1
2
=
11, 69 atm

Mieszaniny gazów i
ciśnienia cząstkowe
• Mieszaniny gazów
• Skład atmosfery – meteorologia
• Wydychane powietrze – medycyna
• Synteza amoniaku – przemysł
chemiczny
• Jaki jest wkład każdego ze
składników mieszaniny do
całkowitego ciśnienia?

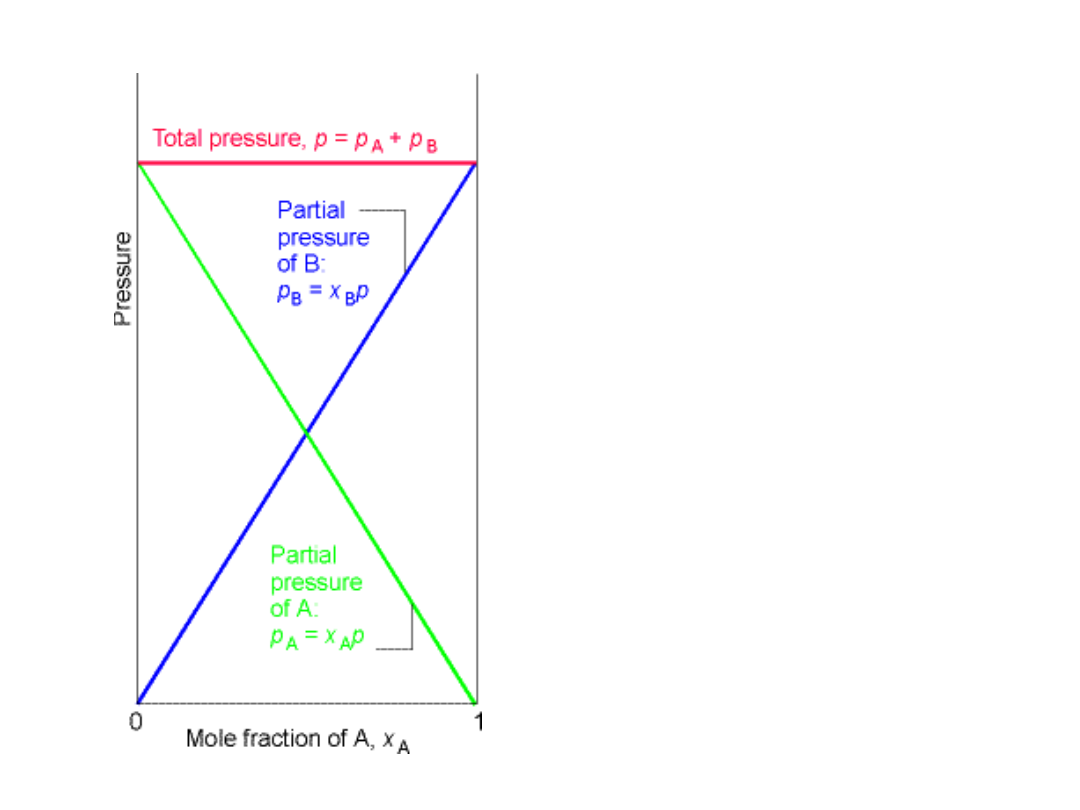
Prawo Daltona
• Ciśnienie wywierane przez
mieszaninę gazów doskonałych
jest sumą ciśnień, jakie
wywierałby każdy z gazów z
osobna.

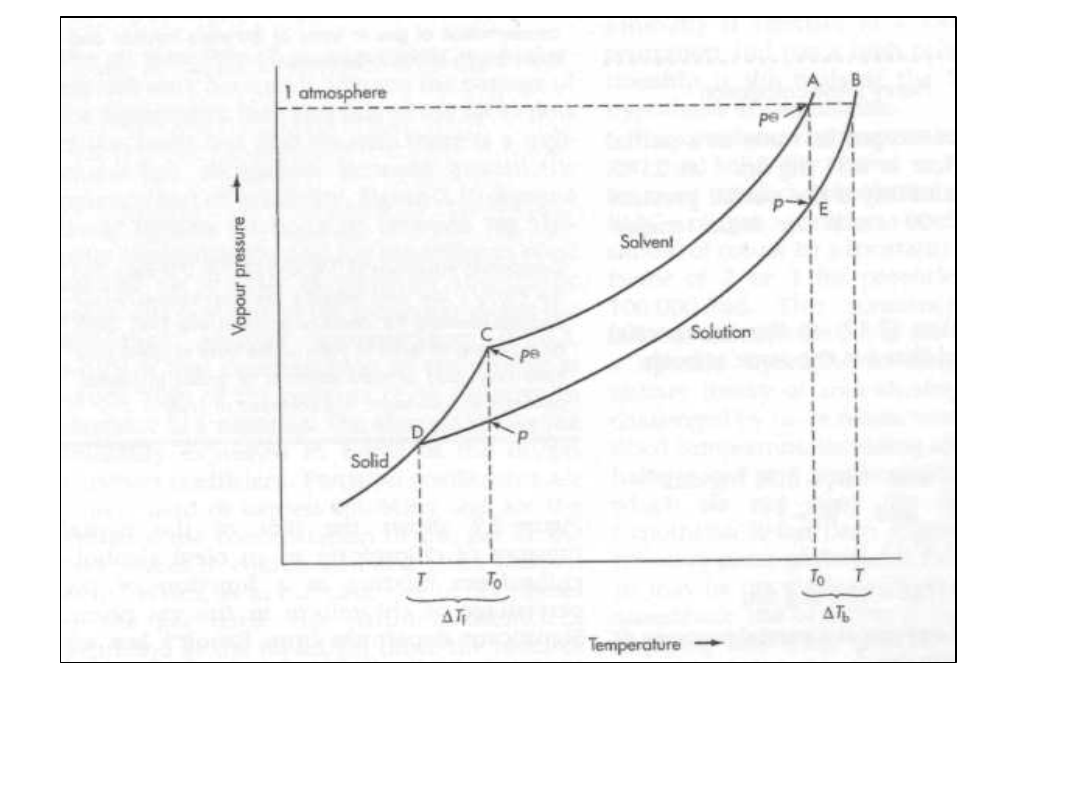
Ciśnienie par nad
roztworem
• Dla roztworu idealnego ciśnienie
par opisuje równanie Raoult’a”
i
0
i
i
x
p
p

Prawo Rault’a
• Znaczenie polega na możliwości
obliczenia
• prężności par ze znajomości
składu roztworu.
• Ze względu na ochronę
środowiska w 1989 wprowadzono
zmiany w cieczach używanych do
wypełniania urządzeń,
chłodniczych, inhalatorów itp..

Dziura ozonowa
• Pochodne chlorofluoroalkanowe
(CFC) na pochodne
hydrofluoroalkanowe znacząca
różnica we właściwościach
fizycznych i chemicznych.
• Właściwości najczęściej
stosowanych wypełniaczy
przedstawia następne przezrocze:
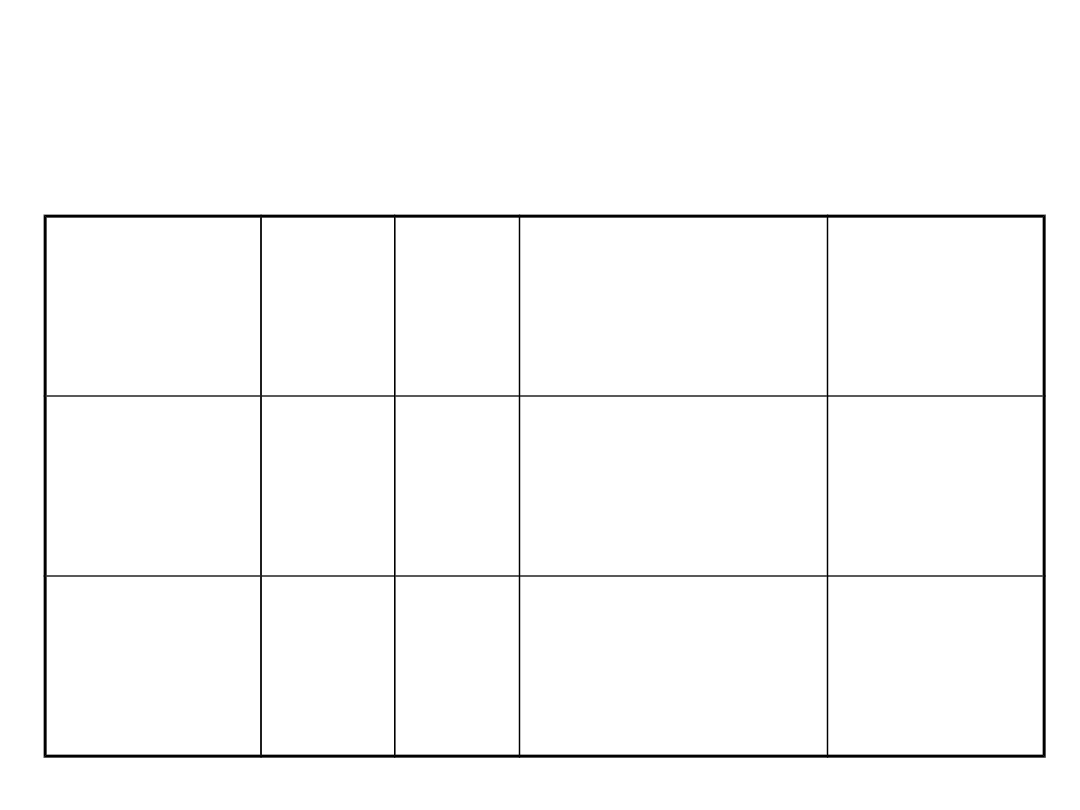
Właściwości pochodnych
fluorowcowych alkanów
Wypełniac
z
Wzór
M
T
wrz
(°C )
przy p = 1 atm
P (psig),
w 20 °C
HFA 134a C
2
H
2
F
4
102,0
-26,5
68,4
HFA
C
3
HF
7
170,0
-17,3
56,0

Dozowniki - inhalatory
• Ciśnienie w inhalatorach określa
wielkość kropli i wpływa na
skuteczność ich osadzania się w
płucach.
• Rozpatrzmy następujący przykład
w którym w zależności od rodzaju
wypełniacza istnieje równowaga
pomiędzy cieczą a parami.

Obliczenie ciśnienia par w
mieszaninie fluorowęglowodorów
• Mieszanina zawiera 30% w/w HFA
(składnik 1) 134a i 70% w/w HFA
227(składnik 2). Zakładamy
idealne zachowanie się
mieszaniny. Korzystamy z danych
w tabeli:
1
0
1
1
x
p
p

cd. zadania
• Dla drugiego składnika:
• Obliczmy ułamki molowe składników
mieszaniny:
• n
1
= 30/102 = 0,2941 mola
• n
2
= 70/170 = 0,4118 mola
• Suma = 0,2941 + 0,4118 = 0,7059 moli
2
0
2
2
x
p
p

Prawo Daltona
• X
1
= 0,2941/0,7059 = 0,4166
• X
2
= 0,4118/0,7059 = 0,5834
• Prawo Daltona – ciśnienie całkowite
• P = ciśnień cząstkowych (zakładając
idealne zachowanie się gazów)
• P = (68,4 x 0,4166) + (56,0 x 0,5834) =
61,17 psig
• Przeliczając jednostki otrzymamy:
• Psia=psig+14,7 i 1psia = 6894,76 Pa P
= 5,23 x 10
5
Pa

Pompa infuzyjna
• Wykorzystanie stałego ciśnienia
nad roztworem
fluoroweglowodorów.
• Pompy infuzyjne:
• Wprowadzenie pod skórę brzucha
• Dostarczają płyn z stałą
szybkością:
• Np.., 1 cm
3
/dzień do żyły lub
tętnicy
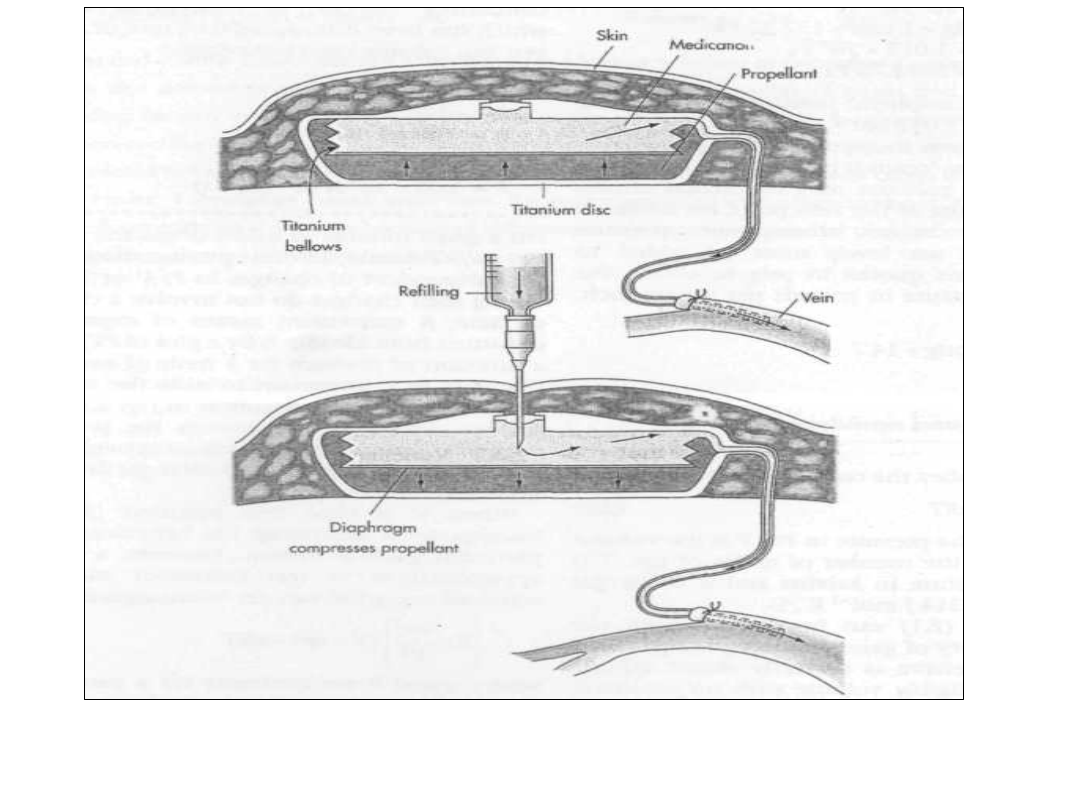

Zasada działania pompy
infuzyjnej
• Pierwsza podawana była heparyna
• Obecnie wiele leków
• Wymiar dysku 9 x 2,5 cm (tytan)
• Dwa zbiorniki przedzielone
nieprzepuszczalną membraną w
kształcie miechu.
• Zewnętrzny zawiera wypełniacz -
Freon

Zasada działania pompy
dyfuzyjnej
• Wewnętrzny zbiornik zawiera płyn
infuzyjny, który za pomocą cewnika
dostarczany jest do żyły(tętnicy),
poprzez filtry i oporniki regulujące
przepływ.
• Ponieważ ciśnienie par wypełniacza
pozostaje stałe (mała wrażliwość)-
temperatura ciała zmienia się w
niewielkim stopniu – stąd stałe
ciśnienie wywierane na brzuch, a w
konsekwencji stała szybkość
dostarczania płynu do krwi.
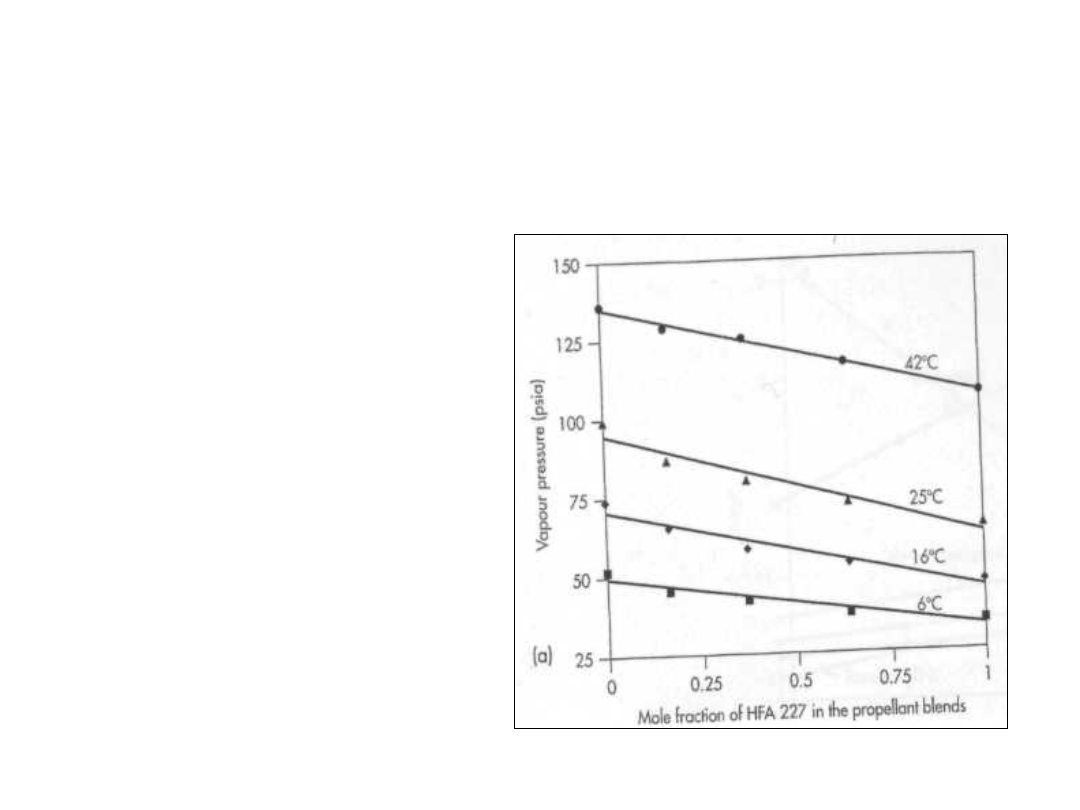
Wpływ temperatury
• Wykres obok
przedstawia
wpływ
temperatury na
zachowanie się
mieszaniny:
• Liniowość w
całym zakresie –
gaz idealny
• Tylko 2 psia w
zakresie 1 stopnia
czyli około 0,2
atm

Dodatek trzeciego
składnika
• Czasami należy poprawić właściwości
wypełniaczy przez dodatek
rozpuszczalnika.
• Poniższy diagram ilustruje zachowanie
się mieszaniny w sytuacji dodawania
etanolu.
• Należy rozpatrzyć oddziaływania –
pomiędzy samymi cząsteczkami CFC a
pomiędzy cząsteczką CFC a cząsteczka
alkoholu.
• CFC jest silnie niepolarną
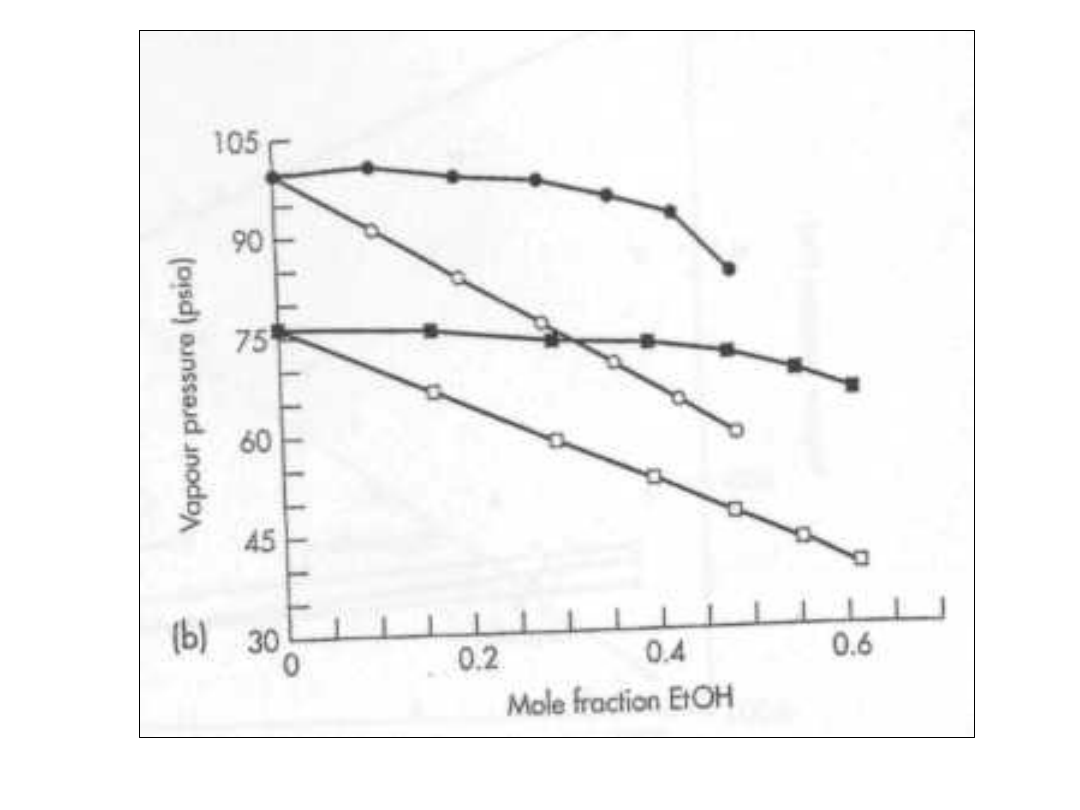

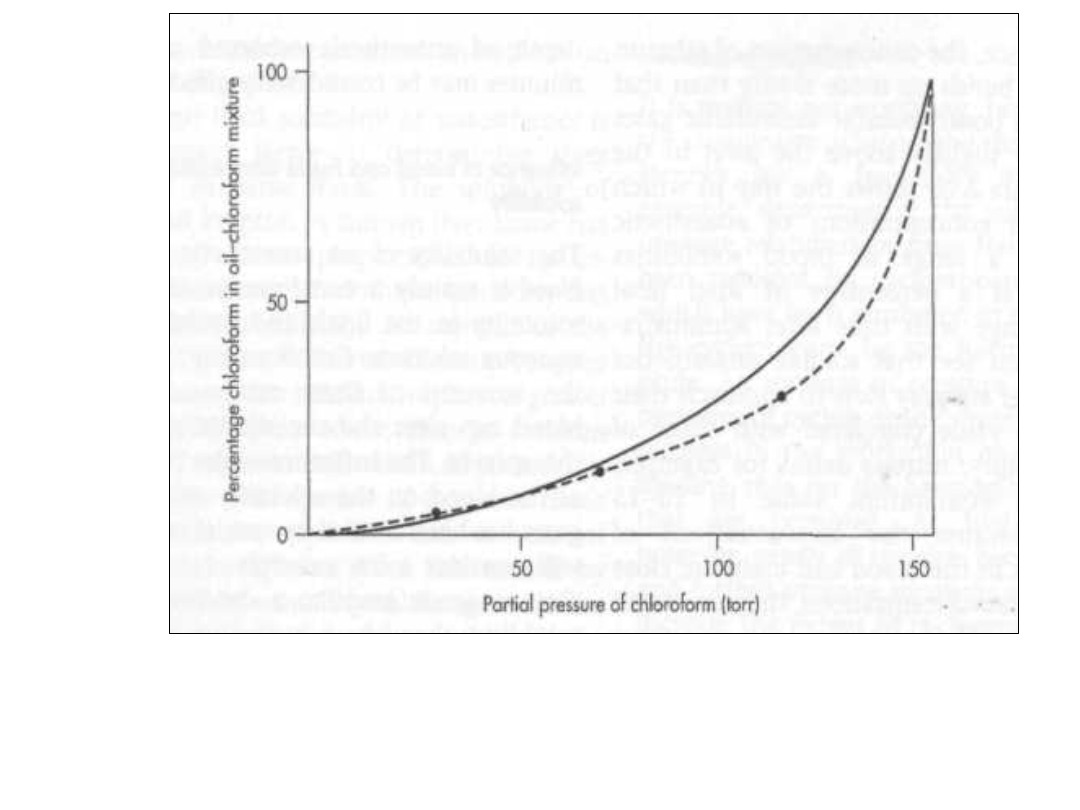
Dodatnie odchylenia od
prawa Rauolt’a
• Korzyści z dodatniego odchylenia
polegają na wzroście całkowitej
prężności a tym samym
właściwości nie ulęgają
pogorszeniu
• Wykres fazowy dla pary środków
znieczulających przedstawiony jest
poniżej:
• Enflurane – halothane
• Enflurane – znaczne odchylenie
• Laothane – niewielkie odchylenie
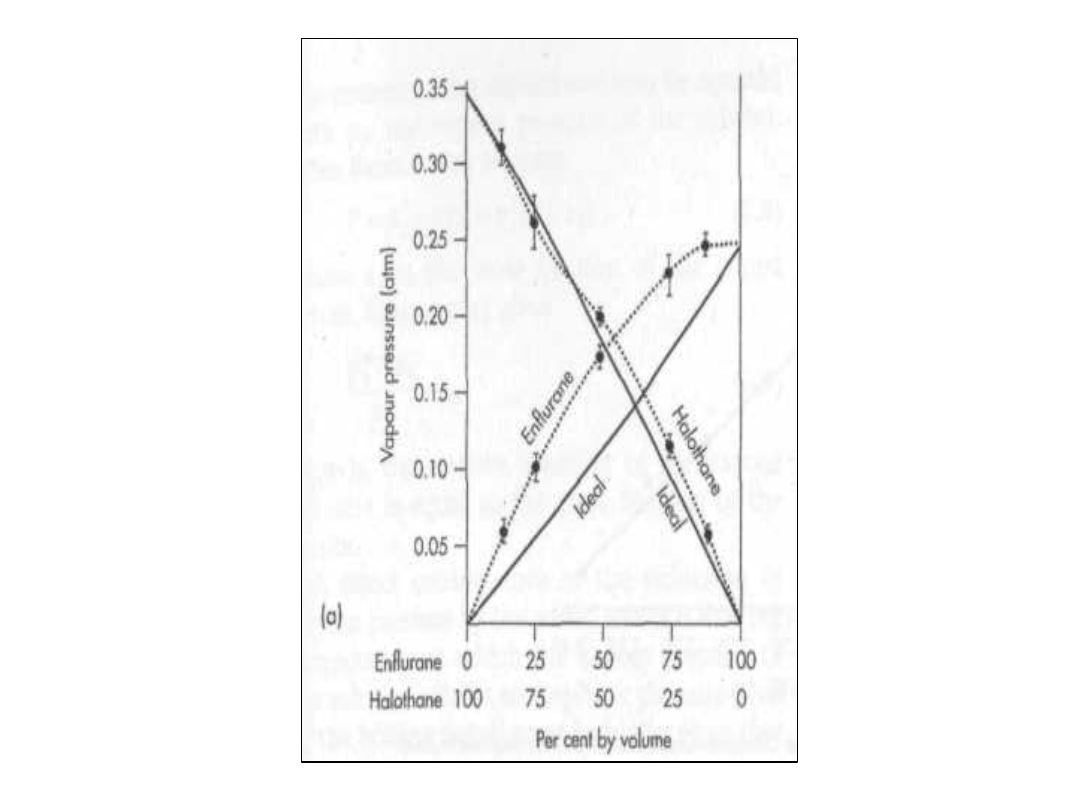
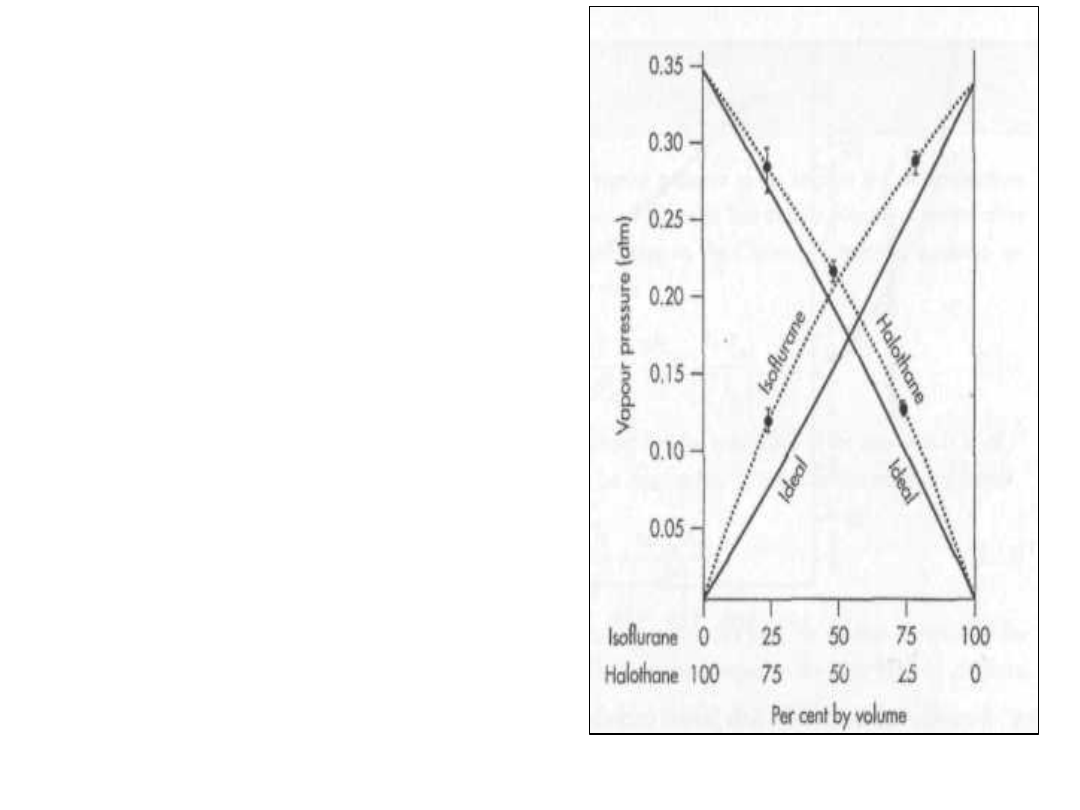

Asocjacja składnika
• Duże odchylenia są spowodowane
asocjacją jednego ze składników
• Gdzie wykorzystuje się praktycznie
takie diagramy fazowe:
• Środki znieczulające są podawane
poprzez wykorzystanie mieszanin ich z
gazem obojętnym.
• Jeżeli składniki są pomylone to wtedy
do organizmu są wprowadzone większe
ilości co może spowodować przykre
konsekwencje. Skład ten sam lecz
prężności par inne i inny skład w
mieszaninie.

Wpływ temperatury na ciśnienie p
• Temperatura powoduje wzrost
energii kinetycznej cząsteczek co
zwiększa tendencje do
opuszczenia powierzchni cieczy i
przechodzenia do fazy gazowej.
• Zmianę ciśnienia z temperaturą
określa równanie Claperon’a

Równanie Clausius -
Clapeyron
• Równanie różniczkowe:
V
T
H
dT
dP
par

Opis równania
• V – różnica objętości molowej w
stanie pary i stanie cieczy
• Ponieważ V
par
>>V
c
• Można różnice zastąpić przez V
par
• Zakładając idealne zachowanie się
pary można obliczyć V = n R T/p

Rózniczkowa postać
równania
• Równanie można całkować
2
par
2
par
T
dT
R
H
P
dP
lub
T
R
H
P
dT
dP

Całkowanie
• Log p vs 1/T
• Wykres linii prostej – nachylenie
s
RT
303
,
2
H
P
log
par

Wykorzystanie równanie
CC
• Równanie to można
wykorzystywać
• Do obliczenia entalpii parowania
• W przejściach fazowych

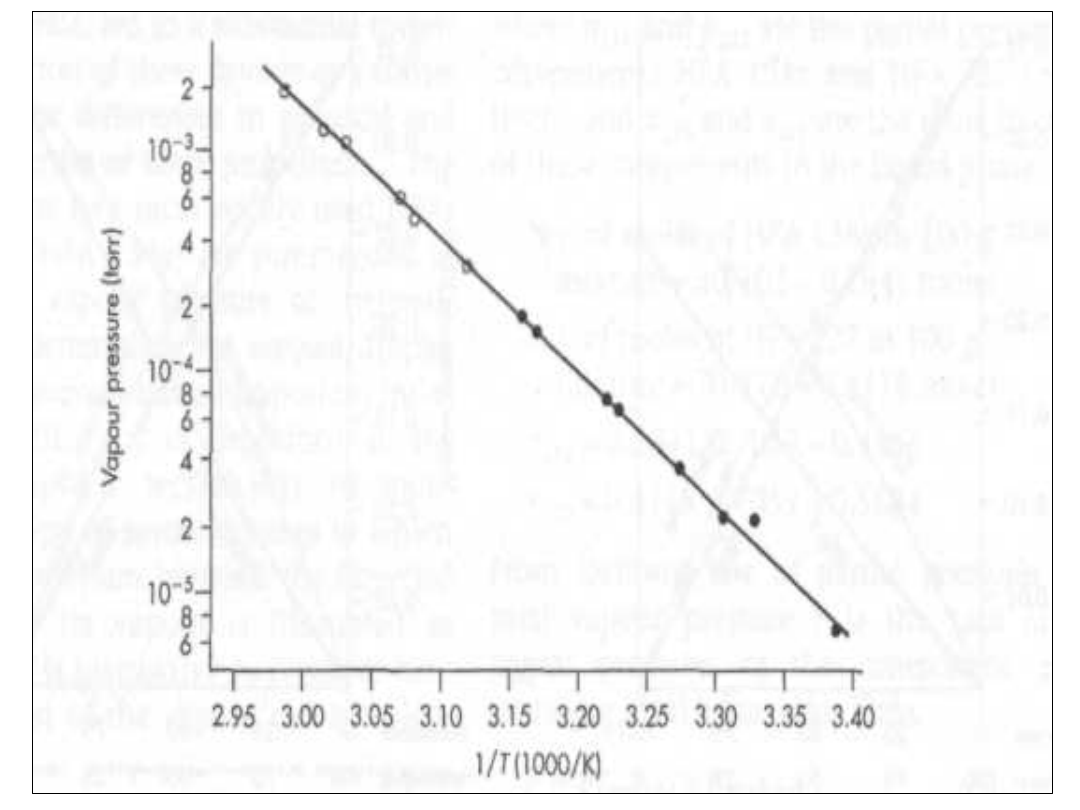
Sublimacja ibuprofenu
• Można porównać
prężność w
zakresie 23-64 C
przy entalpii
parowania 121 kJ
mol
-1
• W temp 23 jest
bardzo niska
rzędu 9 x 10
-6
ale
szybko rośnie o
kilka rzędów

Sublimacja
• Zmiana prężności powoduje, że w
temp. 55 C ubywa 4,15 mg w
ciągu dnia.

Ocena ryzyka
zawodowego
• Leki o działaniu cytostatycznym w
chemoterapii
• Zanieczyszczenia są wykrywane
bowiem ma miejsce rozlewanie,
• Wdychanie cieczy w postaci
areosolu (wyciąganie igieł)
• Bezpośredni kontakt z lekami -
rękawiczki

Parowanie
• Środki cytotoksyczne parują, i
tworzą pary
• Stwarzają ryzyko wdychania ich
przez personel
• Czynniki wpływające na szybkość
parowania

Szybkość parowania leku
• Ciśnienie par
• Wielkość cząsteczek (lek
sproszkowany)
• Camustine w temp. 40 C prężność
0,530 Pa oraz szybkość
wyparowania:
• d = 1 m 12 s
• d = 100 m 1,2 x 10
5
s [dodac
wykres]

Inne środki
antyneoplastyczne?
• Wykres p vs 1/T
• Im bardziej stromy wykres tym
większa entalpia a zatem
trudności w parowaniu tym
bezpieczniejszy środek dla
personelu go stosującego
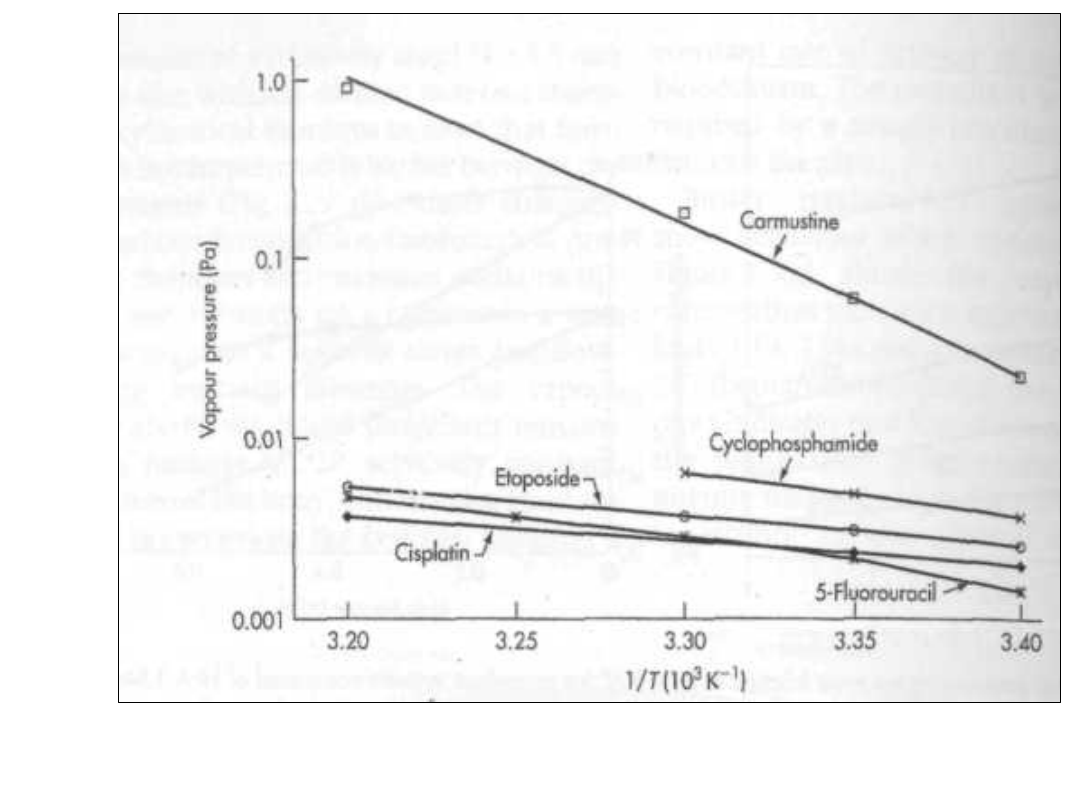

Obliczenie molowej entalpii
parowania
• Nachylenie wykresu p vs 1/T
wynosi:
• -2,727 x 10
3
K
• Obliczyć entalpię parowania:
• Nachylenie = -H
par
/(2,303 RT)=-
2.727 x 10
3
K
• H
pa
= -2,727 x 10
3
x 2,303x8,314=-
52,2 x 10
3
J mol
-1

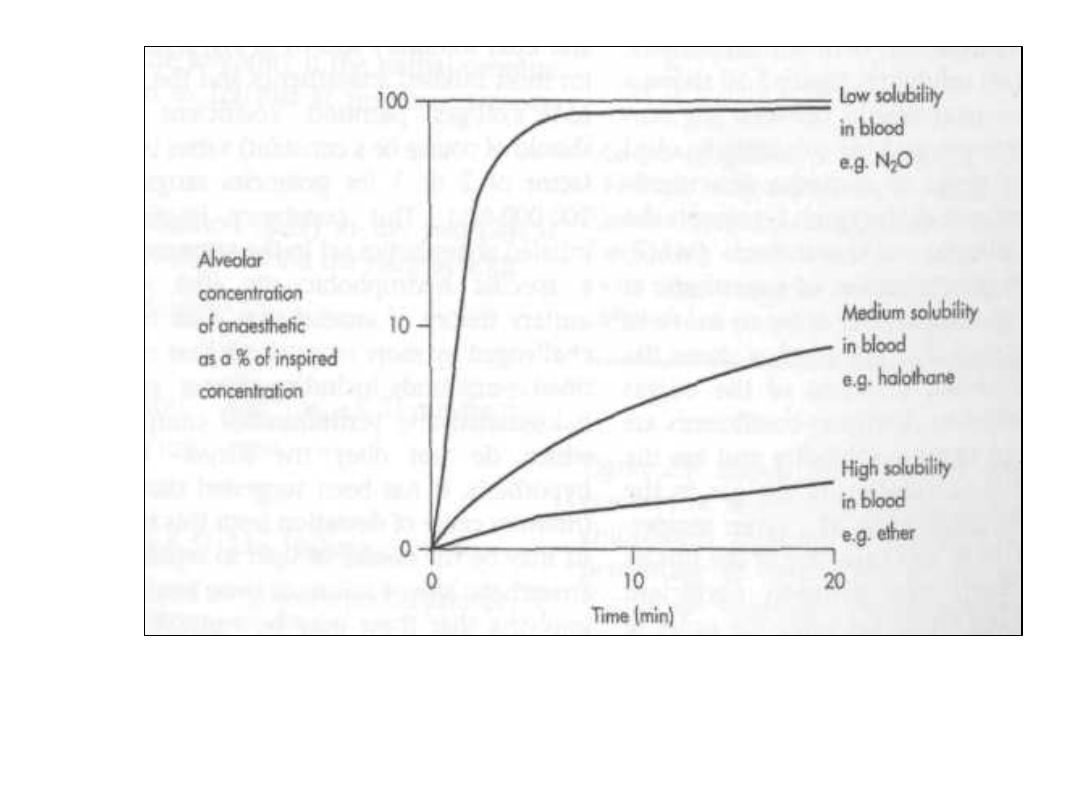
Gazowe znieczulanie
• Istnieje równowaga pomiędzy
gazem znieczulającym a gazem w
przestrzeni gdzie on działa:
biofazą. Prężność pary powinna
być opisywana równaniem C C.
• Dla celów porównawczych należy
równanie zmodyfikować tak aby
można było je zastosować do
każdego gazu

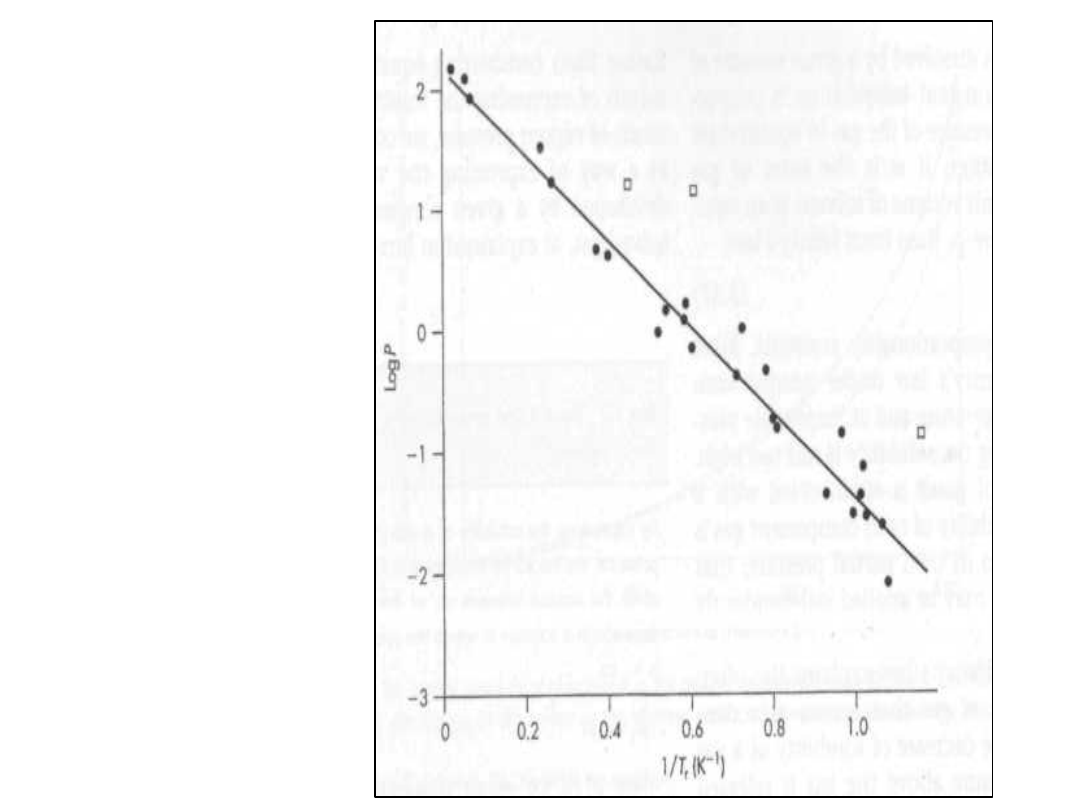
Wielkości zredukowane
• Należy wprowadzić wielkości
termodynamiczne-zredukowane
• Zredukowaną temperaturę
fizjologiczną T
f
• Można otrzymać dzieląc
temperaturę fizjologiczną (temp.,
ciała) prze temp. Wrzenia gazu

Wielkości zredukowane
• Powinno się otrzymać jedna linię
s
RT
303
,
2
H
P
log
r
par

Ciśnienie znieczulające
• Log vs 1/T
r

PODSUMOWANIE
• Barometr, manometr, jednostki
ciśnienia
• Prawa gazowe –równanie Clasiusa –
Clapeyrona
• Warunki standardowe STP
• Stała gazowa i stała Boltzmana
• Ułamek molowy
• Prawo Daltona i ciśnienia cząstkowe
• Prawo Grahama efuzji

Przykładowe zadania
• Zad 1.
• Przelicz 1,26 atm na Torr.
• Zad.2 Zakładając, że
skonstruowano barometr stosując
ciecz o gęstości 1,22 g/mL, Jaki
będzie poziom cieczy w
barometrze, jeżeli ciśnienie
atmosferyczne wynosiło 755 Torr.
Gęstość rtęci 13,6 g/mL

Zadania
• Wzór h
B
=h
A
x d
A
/d
B
• Zad.3
• Oblicz wartość stałej gazowej w
następujących jednostkach mL x Torr x
mol
-1
x K
-1
• Zad. 4
• Jaki jest skład procentowy powietrza
wewnątrz płuc jeżeli ciśnienie
cząstkowe wynoszą:
• N
2
= 570 Torr, O
2
= 103 Torr, CO
2
=
Torr

Zadania
• Zad. 5
• Gęstość CO
2
wynosi 1,96 gL
-1
i
gęstość N
2
1,25 gL
-1
. Który z
gazów wypływa szybciej? Jaki
będzie stosunek szybkości efuzji
azotu do ditlenku węgla.
•
A
B
A
B
B
A
M
M
d
d
v
v

Document Outline
- Slide 1
- Opis stanów materii
- STAN
- Objętość, temperatura
- Jednostki ciśnienia
- Jednostki ciśnienia
- Równanie stanu
- Równanie stanu
- Równanie stanu
- Równanie stanu gazu doskonałego
- Slide 11
- Gazy idealne i gazy rzeczywiste
- Wartości stałej gazowej w różnych jednostkach
- Równania gazu doskonałego
- Prawo Boyle’a p versus 1/V
- Prawo Charlesa V versus t/°C
- Objętość molowa
- Warunki standardowe
- Slide 19
- Areozole
- Obliczenie ciśnienia z wykorzystaniem prawa B
- Rozwiązanie
- Równanie stanu gazów rzeczywistych
- Współczynnik ściśliwości
- Slide 25
- Slide 26
- Slide 27
- Z- odstępstwa od 1
- Slide 29
- Systemy spotykane w medycynie
- Gazy rzeczywiste
- Gazy rzeczywiste
- Gazy rzeczywiste
- Gazy rzeczywiste
- Gazy rzeczywiste
- Slide 36
- Porównanie zachowania się gazów
- Rozwiązanie
- Gaz idealne i rzeczywiste
- Slide 40
- Rozwiązanie
- Mieszaniny gazów i ciśnienia cząstkowe
- Prawo Daltona
- Ciśnienie par nad roztworem
- Slide 45
- Prawo Rault’a
- Dziura ozonowa
- Właściwości pochodnych fluorowcowych alkanów
- Dozowniki - inhalatory
- Obliczenie ciśnienia par w mieszaninie fluorowęglowodorów
- cd. zadania
- Prawo Daltona
- Pompa infuzyjna
- Slide 54
- Zasada działania pompy infuzyjnej
- Zasada działania pompy dyfuzyjnej
- Wpływ temperatury
- Dodatek trzeciego składnika
- Slide 59
- Dodatnie odchylenia od prawa Rauolt’a
- Slide 61
- Slide 62
- Asocjacja składnika
- Wpływ temperatury na ciśnienie p
- Równanie Clausius - Clapeyron
- Opis równania
- Rózniczkowa postać równania
- Całkowanie
- Slide 69
- Wykorzystanie równanie CC
- Sublimacja ibuprofenu
- Sublimacja
- Ocena ryzyka zawodowego
- Parowanie
- Szybkość parowania leku
- Inne środki antyneoplastyczne?
- Slide 77
- Obliczenie molowej entalpii parowania
- Gazowe znieczulanie
- Wielkości zredukowane
- Wielkości zredukowane
- Ciśnienie znieczulające
- Slide 83
- PODSUMOWANIE
- Przykładowe zadania
- Zadania
- Zadania
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
Wyszukiwarka
Podobne podstrony:
Stan gazowy charakteryzuje się tym
STAN GAZOWY 2
2008 1 Stan Gazowy, inżynieria ochrony środowiska kalisz
Szkol Stan spawacz gazowy
Tematyka egzaminu dla stan DOZORU w zakresie gazowym
regul praw stan wyjątk 05
Stan zapalny
aparaty cyfrowe praktyczny przewodnik r 14 trudne zdjecia stan sitwe helion 56GBUFHXJXG6NRFSKVYCN
F 2 Złącze p n stan równowagi
monter instalacji gazowych 713[07] z2 03 u
7 Stan sinusoidalny 3
Kodeks drogowy stan prawny na styczeń 2011
STAN WYŻSZEJ KONIECZNOŚCI, prawo karne
Stan rozwoju mowy dzieci - charakterystyka, logopedia
Tab-wart stan, SWPS, Systemy motywacyjne w firmie
Seminarium dyplomowe Stan zaawansowania pracy inżynierskiej
Slavoj Žižek, Permanentny stan wyjątkowy
więcej podobnych podstron