
Charakterystyka najważniejszych
peptydów czynnych biologicznie
Katarzyna Wiech, gr. II

Wiele peptydów wykazuje
aktywność fizjologiczną
Komórki zwierząt, roślin i bakterii
zawierają różnorodne
małocząsteczkowe polipeptydy
(3- 100 reszt aminokwasowych) o
istotnej aktywności fizjologicznej.
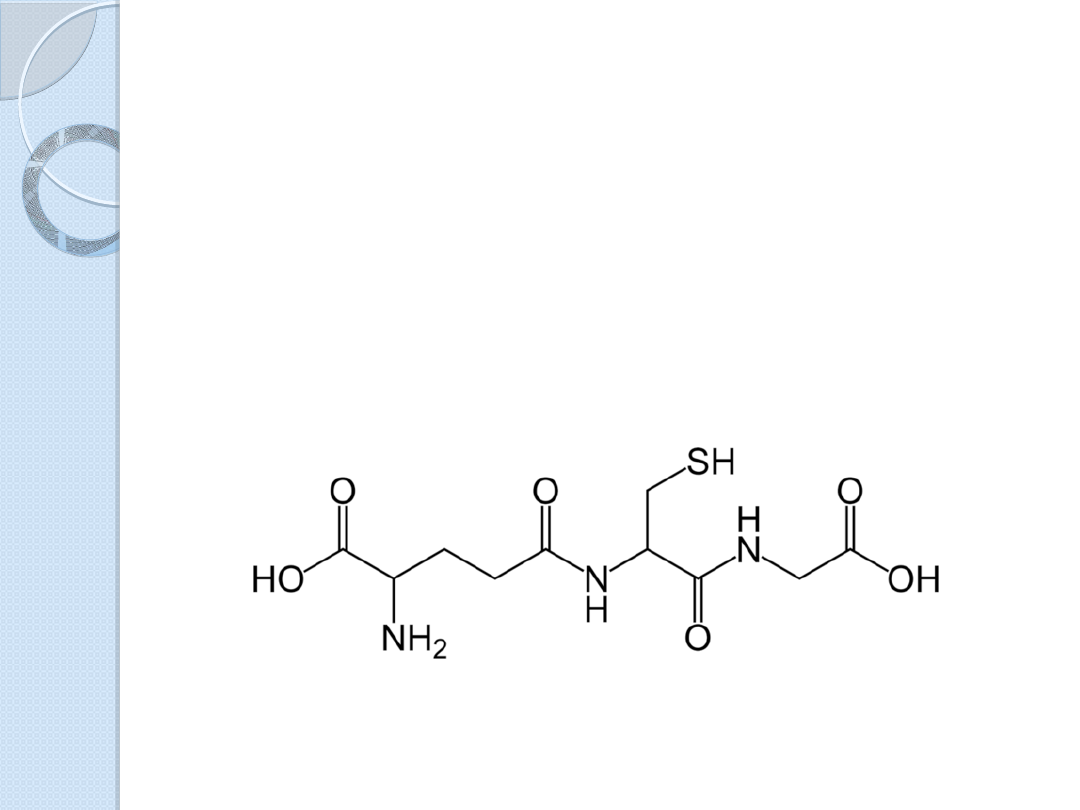
Glutation (GSH)
Jest tripeptydem o nietypowej
strukturze, składa się z 3 reszt
aminokwasowych: glutaminianu,
cysteiny i glicyny.
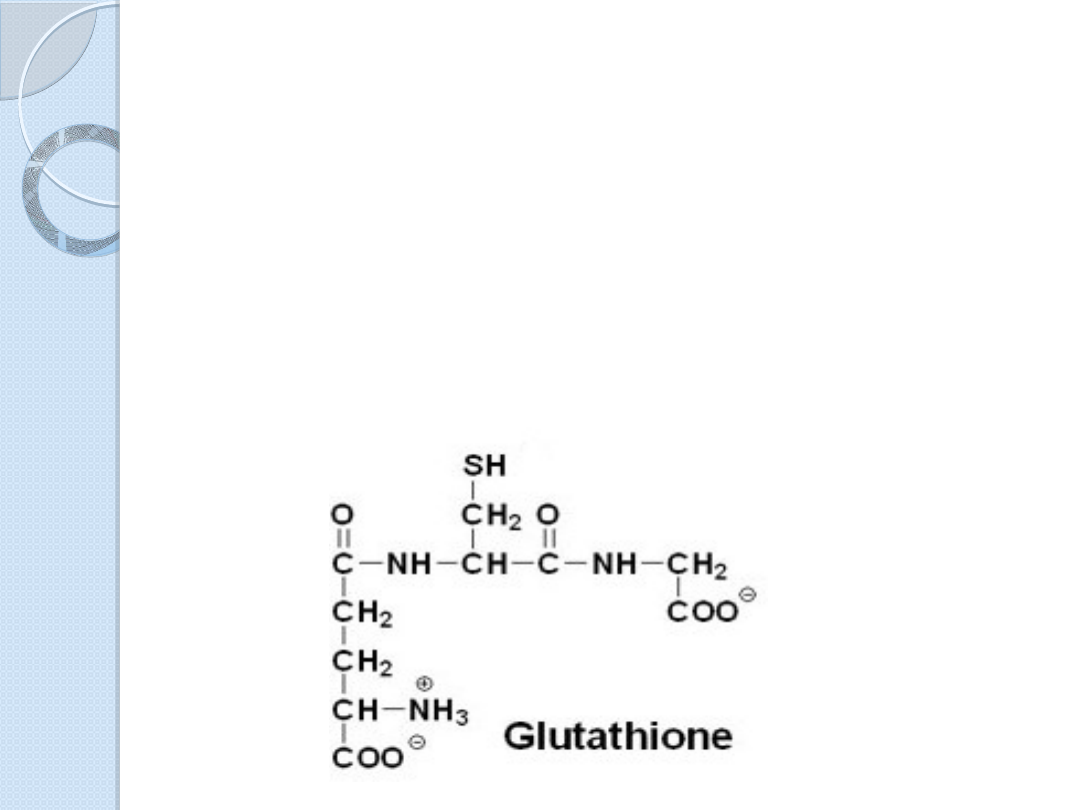
Glutation-
-glutamylo-
cysteinylo- glicyna
Budowa glutationu jest nietypowa dla
pepydów ze względu na sposób
połączenia glutaminianu (N- końca) z
cysteiną. W wiązaniu tym nie
uczestniczy grupa -karboksylowa
glutaminianu, tylko jego grupa -
karboksylowa.
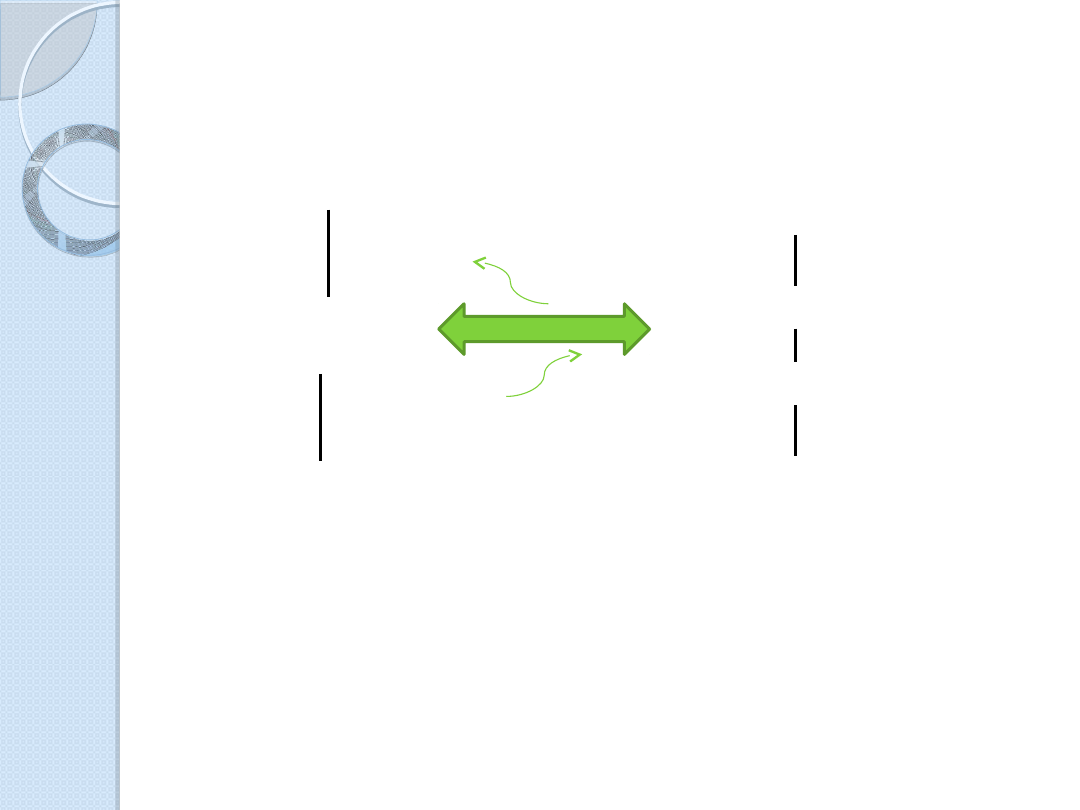
Dwie formy glutationu
-Glu – Cys - Gly
S
H
-Glu – Cys – Gly
S
H
+2H
-2H
-Glu – Cys -
Gly
S
-Glu – Cys -
Gly
S
Forma zredukowana
Forma utleniona

Funkcje glutationu
Usuwa szkodliwe nadtlenki (m.in.
nadtlenek wodoru i nadtlenki
organiczne),
Jest aktywatorem wielu enzymów,
Działa w ustroju jako układ oksydo-
redukcyjny (reakcje redoks) chroniący
grupy –SH białek przed utlenieniem,
Jest koenzymem m.in. hydrolazy
acyloglutationowej, dehydrogenazy
formaldehydowej, tautomerazy
indolilopirogronowej i wielu innych.

Wazopresyna
Zwana jest również adiuteryną,
jest oligopeptydem złożonym z 9
reszt aminokwasowych. Podobnie
jak oksytocyna wytwarzany jest
przez tylny płat przysadki
mózgowej. Hormon ten pobudza
resorpcję moczu pierwotnego w
kanalikach nerkowych, chroni
organizm przed nadmierną utratą
wody i elektrolitów.

Regulacja wydzielania
Wydzielanie wazopresyny jest
pobudzane przez wzrost ciśnienia
osmotycznego, osocza krwi i
płynu mózgowo- rdzeniowego,
hipowolemię lub angiotensynę II.
Jej zwiększone wydzielanie
następuje także podczas snu.
Spadek osmolarności osocza lub
hiperwolemia hamują jej
wydzielanie.

Choroby związane z ADH
Niedobór
Niedobór hormonu antydiuretycznego lub brak
jego działania powoduje moczówkę prostą.
Jeśli dotyczy ona zaburzenia wydzielania na
poziomie podwzgórza lub przysadki jest to
moczówka prosta ośrodkowa. Jeżeli
występuje niewrażliwość cewek nerkowych
na działanie hormonu antydiuretycznego -
jest to moczówka prosta nerkowa.
Nadmiar
Nadmiar wazopresyny wywołuje Zespół
Schwartza-Barttera.

Oksytocyna
Jest cyklicznym nonapeptydem. W obrębie
pierścienia zawiera wiązanie disiarczkowe
pomiędzy resztami cystynowymi w pozycji
1 i 6 cząsteczki. Strukturalnie przypomina
wazopresynę z tą róznicą, że zawiera
izoleucynę zamiast fenyloalaniny w pozycji
3 i leucynę zamiast argininy w pozycji 8.
Również wytwarzna w tylnym płacie
przysadki mózgowej.
Pobudza czynność skurczową macicy w
czasie porodu.

Endorfiny
Wszystkie endorfiny powstają ze
wspólnego prekursora. Jest nim
polipeptyd zwany
lipotropiną
,
zawierający 91 reszt aminokwasowych. W
wyniku jego rozkładu powstają endorfiny.
-endorfiny składają się z C-końcowej
sekwencji 31 aminokwasów - lipopro-
teiny. Endorfina i są pochodnymi
endorfiny , od której zostało
odszczepionych 15 lub 14 aminokwasów
od fragmentu C- końcowego.

Endorfiny- c.d.
Peptydy te występują w przysadce
mózgowej, gdzie ulegają acetylacji i
przez to inaktywacji biologicznej. Z
kolei np. w neuronach nie ulegają
biochemicznej modyfikacji i dlatego
spełniają rolę neuroprzkaźników lub
neuromodulatorów. W OUN endorfiny
wiążą się z tymi samymi receptorami
co opity morfinowe, dzięki czemu
uczestniczą w percepcji bólu.

Enkefaliny
Są to pentapeptydy, występujące
w mózgu, zaliczne (podobnie jak
endorfiny) do endogennych
peptydów opioidowych. Peptydy
opioidowe zawieraja wspólną
sekwencję N -końcową TYR-GLY-
GLY-PHE. Enkefaliny dzielimy na
Leu-Enkefalinę i Met-Enkefalinę.
Różnią się jedynie aminokwasem
C-końcowym. Jest nim,
odpowiednio, metionina lub
leucyna.

Enkefaliny
Stymulują one receptory opioidowe
wywołując różne reakcje . Enkefaliny są
charakterystyczne dla receptora
opioidowego sigma , dynorfiny dla
receptora kappa, natomiast beta
endorfina dla sigma i mi. Dzięki
stymulacji receptorów dochodzi do
reakcji fizjologicznych takich jak
działanie przeciwbólowe, skurcz
zwieraczy i hamowanie perystaltyki
jelit .

Angiotensyna I
H
2
N-Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-
Leu-COOH
(inaczej
katalizuje przemianę białkowego
angiotensynogenu w dekapeptyd
angiotensynę I zachodzącą w
wątrobie. Sama angiotensyna I nie
wykazuje aktywności biologicznej i jest
prekursorem angiotensyny II.
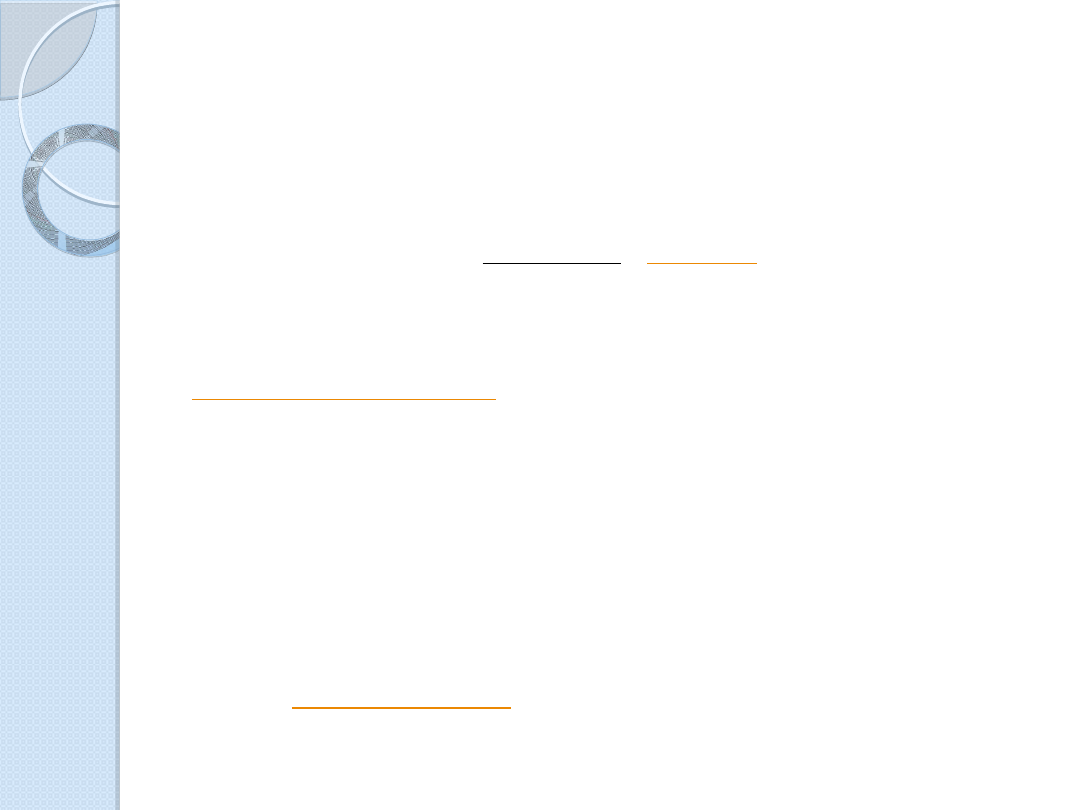
Angiotensyna II
H
2
N-Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-COOH
Poprzez usunięcie histydyny i
, znajdujących się
na końcu łańcucha peptydowego angiotensyny I powstaje
oktapeptyd angiotensyna II. Angiotensyna II wykazuje
najsilniejsze działanie kurczące błonę mięśniową
Angiotensyna II jest jednym z najbardziej efektywnych
regulatorów ciśnienia krwi; wywołuje silny skurcz
mięśniówki drobnych naczyń krwionośnych i znacząco
podnosi ciśnienie tętnicze krwi, tym samym zwiększając
częstotliwość pracy serca. Angiotensyna II reguluje również
homeostazę wodno-elektrolitową organizmu, pobudzenie
współczulnego układu nerwowego oraz biosyntezę i
wydzielanie niektórych hormonów kory nadnerczy (tak
zwane
).

Bibliografia
„Biochemia” E. Bańkowski,
„Biochemia Harpera”,
„Postępy Biochemii” (3) 2006.

Dziękuję za
uwagę
Document Outline
- Slide 1
- Wiele peptydów wykazuje aktywność fizjologiczną
- Glutation (GSH)
- Glutation- -glutamylo-cysteinylo- glicyna
- Dwie formy glutationu
- Funkcje glutationu
- Wazopresyna
- Regulacja wydzielania
- Choroby związane z ADH
- Oksytocyna
- Endorfiny
- Endorfiny- c.d.
- Enkefaliny
- Enkefaliny
- Angiotensyna I
- Angiotensyna II
- Bibliografia
- Slide 18
Wyszukiwarka
Podobne podstrony:
CHARAKTERYSTYKA NAJWAŻNIEJSZYCH ORGANÓW UNII EUROPEJSKIEJ”, nauka - szkola, hasło integracja, rok I
Charakterystyka najważniejszych instytucji niebankowych obsługujących sektor?nkowy (2)
138 Charakterystyka mikrofal i ich dzialania biologicznego
peptydy i bialka, Biologia-liceum
11. Charakterystyka mitochondrialnego DNA-ok, Biologia II, Biologia molekularna
Charakterystyka srodowiska wodnego i ladowego, Biologia maturalna
Charakterystyka najważniejszych olejków, Technik usług kosmetycznych
I grupa układu pierwiastkow i charakterystyka najważniejszych pierwiasków
4. Bakteriofagi charakterystyka i cykle rozwojowe-ok, Biologia II, Biologia molekularna
I grupa układu pierwiastkow i charakterystyka najważniejszych pierwiasków
4 Charakterystyka najważniejszych księstw
więcej podobnych podstron