
I grupa
układu
okresowego
pierwiastków
i
charakterysty
ka
najważniejszy
ch
pierwiastków.
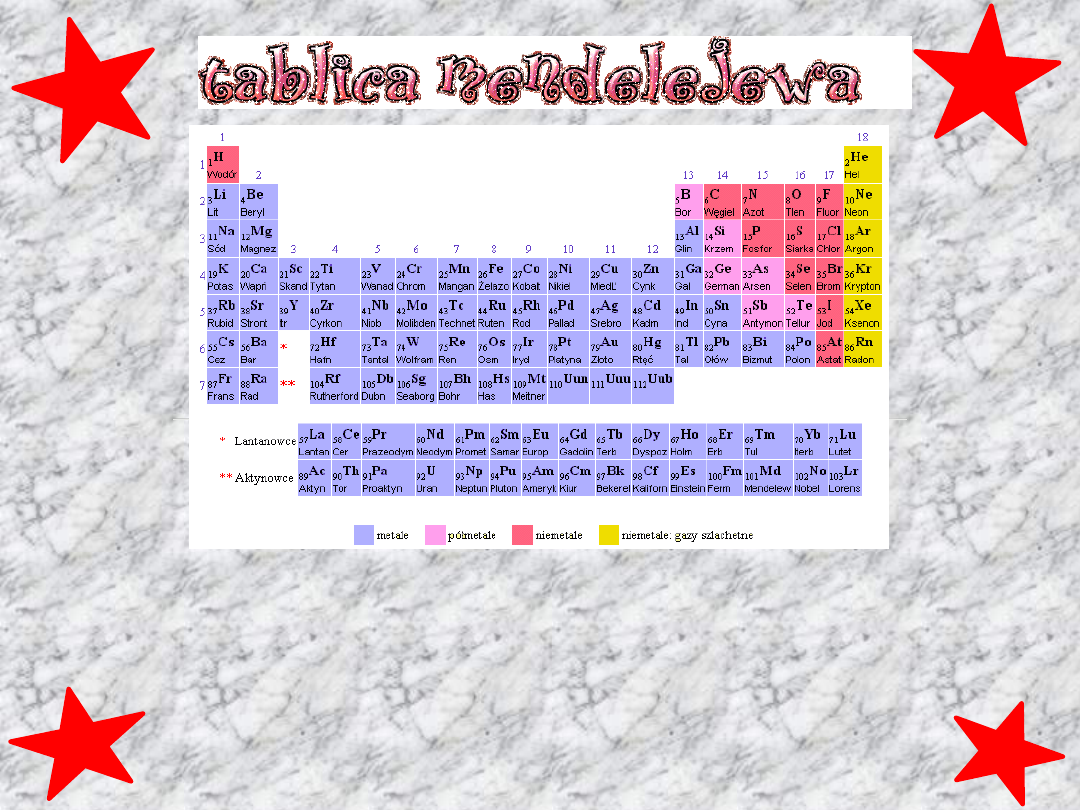
Jest to zestawienie wszystkich pierwiastków chemicznych
w postaci rozbudowanej tabeli, uporządkowane według ich
rosnącej liczby atomowej, grupujące pierwiastki według
ich cyklicznie powtarzających się podobieństw
właściwości, zgodnie z prawem okresowości Dmitrija
Mendelejewa.

I GRUPA UKŁADU OKRESOWEGO PIERWIASTKÓW.
Składa się z Wodoru i Litowców
(Lit, Sód, Potas, Rubid, Cez, Frans).
Litowce
(metale alkaliczne) grupa
pierwiastków I grupy ukŁadu
okresowego
(bez wodoru)
o silnych wŁasnoŚciach
metalicznych, tworzĄcych z wodĄ
silnie zasadowe (alkaliczne)
wodorotlenki.

Wodó
r
Jest to
najprostszy
możliwy
pierwiastek o
liczbie atomowej
1, składający się
z jednego
protonu i
jednego
elektronu.
IZOTOPY:
1
H (prot)
2
H (deuter,
D)
3
H (tryt, T).
WYSTĘPOWANIE
:
W stanie wolnym
występuje w postaci
gazowych cząsteczek
dwuatomowych H
2
,
tworząc wodór
cząsteczkowy.
Na Ziemi występuje w
górnej warstwie
atmosfery.
W postaci związanej
wchodzi w skład wielu
związków
nieorganicznych
(np.: wody, kwasów,
zasad, wodorotlenków)
oraz związków
organicznych
(węglowodory i ich
pochodne).
ZASTOSOWAN
IE:
Dawniej wodór był
używany do
napełniania
sterowców.
Skroplony wodór jest
używany jako paliwo
w silnikach
rakietowych, ponad
to używa się go w
elektrowniach do
chłodzenia
generatorów o dużej
mocy
Mimo iż
wodór jest
niemetalem,
w warunkach
wysokiego
ciśnienia
przechodzi do
stanu
metalicznego.

Me
ta
l n
ale
żą
cy do
gru
py l
itow
có
w w
ukł
adz
ie
okre
so
wym.
Je
st n
ajl
żejs
zym
ciałe
m st
ały
m.
Występowanie:
W górnych warstwach Ziemi
występuje w ilości 0,0018%, w
postaci izotopu 7Li z dodatkiem
3,75%-7,5% 6Li. W warunkach
naturalnych pierwiastek ten
występuje tylko w postaci
związanej. Wchodzi w skład
minerałów: ambligonitu,
lepidolitu, tryfilinu i
spodumenu.
ZASTOSOWANIE:
Lit jest stosowany do produkcji
akumulatorów. Mydło litowe
stosuje się w produkcji smarów.
W stopach (np z glinem)
stosowany w lotnictwie. Ciekły
lit jest stosowany jako
chłodziwo w reaktorach
jądrowych. Deuterek litu jest
istotnym składnikiem broni
termonuklearnej.
L
I
T

SÓD
Pierwiastek z grupy
metali alkalicznych w
układzie okresowym.
Czysty sód jest
srebrzystym, miękkim,
kowalnym metalem.
Sód jest bardzo
reaktywny.
Występowanie:
Nie występuje w
przyrodzie w wolnej
postaci. W oceanach
występuje głównie
jako składnik soli
kuchennej NaCl, w
skorupie ziemskiej jako
węglan i siarczan
sodu.
Zastosowanie:
Tlenki i wodorotlenek
sodu są stosowane w
łodziach podwodnych i
statkach kosmicznych
jako środki
pochłaniające
dwutlenek węgla z
powietrza. Chlorek
sodu pod nazwą sól
kuchenna jest
powszechnie
używanym dodatkiem
do potraw,
wykorzystywany jest
też do topienia śniegu
na drogach; natomiast
zmieszany z lodem
tworzy mieszaninę
oziębiającą.

POTA
S
POTA
S
Jest bardzo lekkim, miękkim
metalem i może być krojony
nożem. Świeżo przekrojony ma
srebrzystobiałą barwę i jasny
połysk, który bardzo szybko
zanika na skutek reakcji z tlenem
atmosferycznym. Jest bardzo
reaktywnym pierwiastkiem,
błyskawicznie utlenia się na
powietrzu, burzliwie reaguje z
wodą wydzielając wodór, który
zapala się od ciepła reakcji. Jest
ważnym składnikiem tkanek
roślin i zwierząt.
Jest bardzo lekkim, miękkim
metalem i może być krojony
nożem. Świeżo przekrojony ma
srebrzystobiałą barwę i jasny
połysk, który bardzo szybko
zanika na skutek reakcji z tlenem
atmosferycznym. Jest bardzo
reaktywnym pierwiastkiem,
błyskawicznie utlenia się na
powietrzu, burzliwie reaguje z
wodą wydzielając wodór, który
zapala się od ciepła reakcji. Jest
ważnym składnikiem tkanek
roślin i zwierząt.
Występowanie:
Występuje w
przyrodzie w dość
dużych ilościach,
głównie w wodzie
morskiej w
małych ilościach
w skorupie
ziemskiej.
Występowanie:
Występuje w
przyrodzie w dość
dużych ilościach,
głównie w wodzie
morskiej w
małych ilościach
w skorupie
ziemskiej.
Zastosowanie:
Stosowany jako ciecz chłodząca w
reaktorach jądrowych.
Związki potasu znajdują zastosowanie
jako nawozy sztuczne.
Używany do wytwarzania jodyny (jodek)a
także do produkcji szkła (węglan)
i mydła (wodorotlenek) oraz jako
pochłaniacz CO2 (wodorotlenek) i
utleniacz (chloran).
Zastosowanie:
Stosowany jako ciecz chłodząca w
reaktorach jądrowych.
Związki potasu znajdują zastosowanie
jako nawozy sztuczne.
Używany do wytwarzania jodyny (jodek)a
także do produkcji szkła (węglan)
i mydła (wodorotlenek) oraz jako
pochłaniacz CO2 (wodorotlenek) i
utleniacz (chloran).

W postaci czystej rubid jest metalem o srebrzysto-szarym
połysku. Jego własności chemiczne są zbliżone do potasu, tyle
że jest jeszcze bardziej reaktywny. Na powietrzu zapala się, z
wodą reaguje wybuchowo. Występuje w skorupie ziemskiej w
postaci minerałów lepidolitu i karmalitu. Rubid posiada aż 30
różnych izotopów.
W postaci czystej rubid jest metalem o srebrzysto-szarym
połysku. Jego własności chemiczne są zbliżone do potasu, tyle
że jest jeszcze bardziej reaktywny. Na powietrzu zapala się, z
wodą reaguje wybuchowo. Występuje w skorupie ziemskiej w
postaci minerałów lepidolitu i karmalitu. Rubid posiada aż 30
różnych izotopów.
Jest jednym z najbardziej reaktywnych pierwiastków, na
powietrzu bardzo szybko pokrywa się ciemnym nalotem tlenku
cezu, z wodą i kwasami reaguje wybuchowo. Minerałem w
którym Cez często występuje jest pollucyt lub inaczej Polluks.
Izotop cezu 137Cs jest często wykorzystywany w przemyśle
oraz w badaniach geofizycznych.
Jest jednym z najbardziej reaktywnych pierwiastków, na
powietrzu bardzo szybko pokrywa się ciemnym nalotem tlenku
cezu, z wodą i kwasami reaguje wybuchowo. Minerałem w
którym Cez często występuje jest pollucyt lub inaczej Polluks.
Izotop cezu 137Cs jest często wykorzystywany w przemyśle
oraz w badaniach geofizycznych.
Jest najaktywniejszym metalem alkalicznym. Nazwa pochodzi od
Francji gdzie w 1939 roku został odkryty przez Marguerite Perey.
Frans reaguje gwałtownie z wodą i kwasami. Łącznie na kuli
ziemskiej występuje naturalnie nie więcej niż kilkadziesiąt
gramów fransu. Frans nie ma stabilnych izotopów. Standardowa
masa atomowa nie może być podana, dlatego wymienia się
masę atomową najtrwalszego izotopu.
Jest najaktywniejszym metalem alkalicznym. Nazwa pochodzi od
Francji gdzie w 1939 roku został odkryty przez Marguerite Perey.
Frans reaguje gwałtownie z wodą i kwasami. Łącznie na kuli
ziemskiej występuje naturalnie nie więcej niż kilkadziesiąt
gramów fransu. Frans nie ma stabilnych izotopów. Standardowa
masa atomowa nie może być podana, dlatego wymienia się
masę atomową najtrwalszego izotopu.
Pozostałe pierwiastki z grupy
litowców:
Document Outline
Wyszukiwarka
Podobne podstrony:
I grupa układu pierwiastkow i charakterystyka najważniejszych pierwiasków
CHARAKTERYSTYKA NAJWAŻNIEJSZYCH ORGANÓW UNII EUROPEJSKIEJ”, nauka - szkola, hasło integracja, rok I
Charakterystyka najważniejszych instytucji niebankowych obsługujących sektor?nkowy (2)
Charakterystyka najważniejszych olejków, Technik usług kosmetycznych
Geografia 1, Budowa układu słonecznego-charakterystyka planet
Analizowanie struktury układu regulacji i charakterystyk regulatorów
Analizowanie struktury układu regulacji i charakterystyk regulatorów
Charakterystyka najważniejszych peptydów czynnych biologicznie
4 Charakterystyka najważniejszych księstw
Budowa Układu Okresowego Pierwiastków
charakterystyka pierwiastkow pyt
Charakterystyki pierwiastków bloku p i d
06 OGÓLNA CHARAKTERYSTYKA PIERWIASTKÓW
Grupy główne i podgrupy układu okresowego pierwiastków, Chemia Fizyczna, chemia fizyczna- laborki ro
Chemia, Chemia - Budowa atomu i wiązania chemiczne, LICZBA ATOMOWA(liczba porządkowa):wielkość chara
więcej podobnych podstron