
Tworzenie
wiązania
peptydowego
Anna Pabian
Chemia 2012/2013
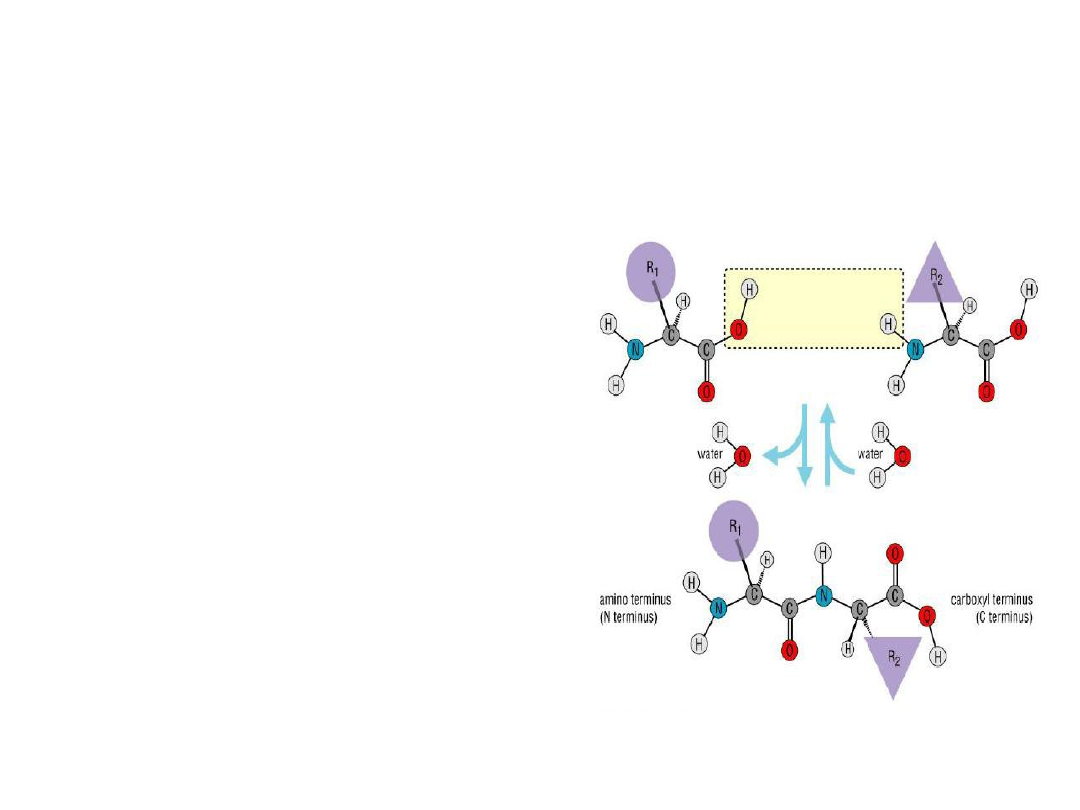
Wiązanie peptydowe
Wiązanie kowalencyjne
tworzone pomiędzy
kwasem karboksylowym i
grupą aminową dwóch α-
aminokwasów z
uwolnieniem jednej
cząsteczki wody.
Wiązania amidowe są
bardzo stabilne w
środowisku wodnym przy
pH≈7. W komórce
tworzenie i hydroliza
wiązań peptydowych
kontrolowane jest
enzymatycznie.
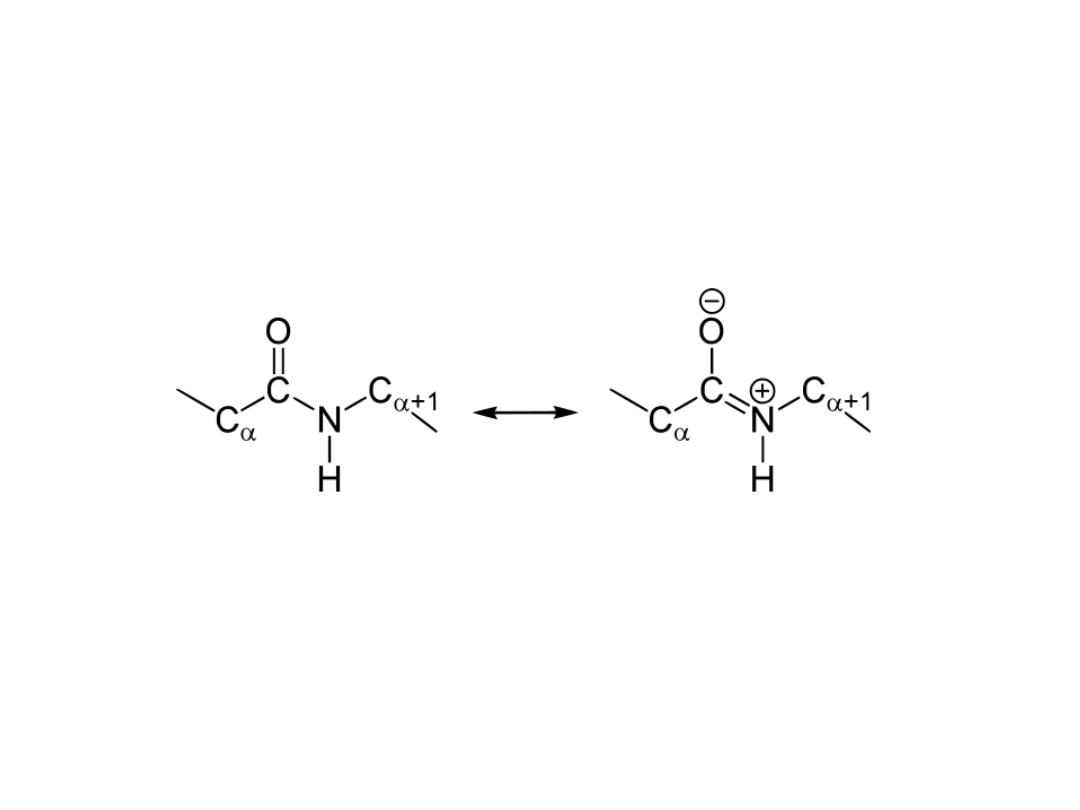
Występuje ono w dwóch formach izomerycznych: cis
i trans. W wiązaniu peptydowym wyróżnić można
dwie formy mezomeryczne, nadające wiązaniu
węgiel-azot częściowy charakter wiązania
podwójnego.
Efekt ten wzmacnia siłę wiązania oraz silnie hamuje
rotację wokół wiązania C-N, dzięki czemu wiązanie
jest płaskie. Możliwa natomiast jest rotacja wokół
wiązań z grupami bocznymi.

Sąsiednie wiązanie C-C i C-N są rzeczywistymi wiązaniami
pojedynczymi, co zapewnia możliwość rotacji, a tym
samym umożliwia fałdowanie się białek.
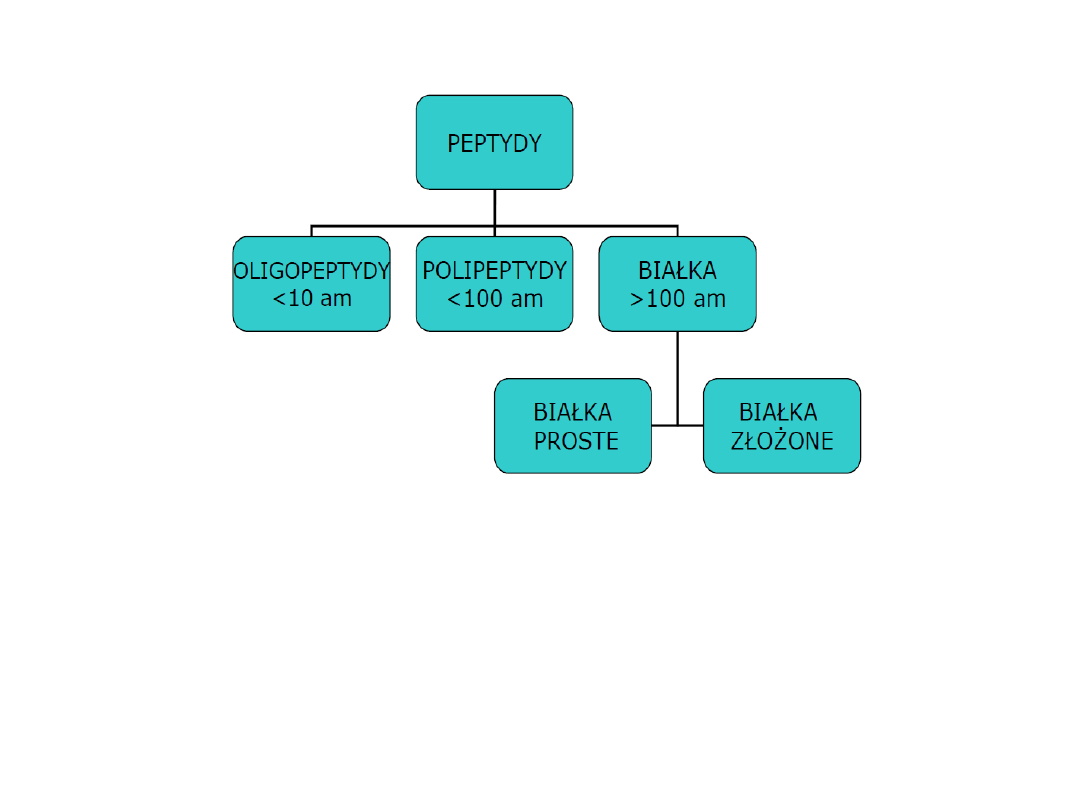
Najczęściej obiema cząsteczkami są α
aminokwasy naturalne. Wiązania peptydowe występują też
w polimerach syntetycznych zwanych poliamidami, w tym
przypadku jednak identyczne chemicznie wiązania są
nazywane wiązaniami amidowymi.
Wiązanie peptydowe tworzą też często łańcuchy
boczne aminokwasów w białkach, takich jak lizyna, z
cząsteczkami przyłączonymi do białka (koenzymami).

Synteza peptydów
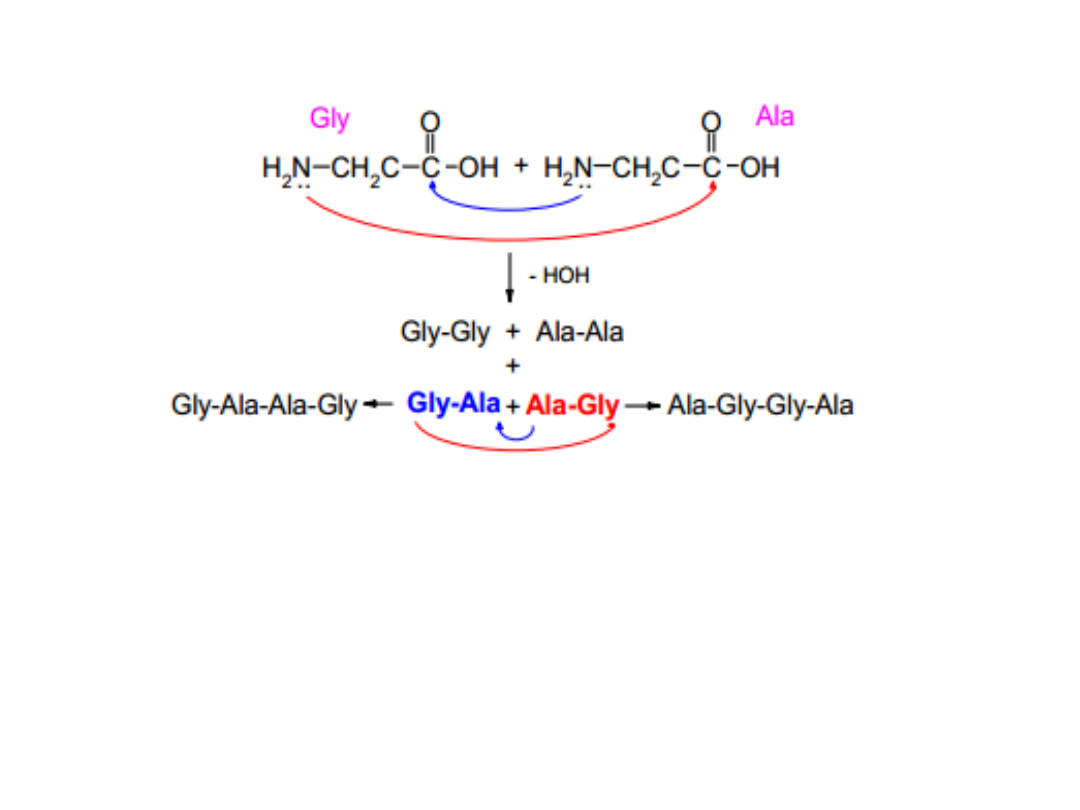
Pierwszą udaną syntezę peptydu -
glicyloglicyny przeprowadzili w 1901 r.
E. Fisher i E. Fourneau.
Reakcja ta przez długi czas sprawiała
chemikom poważne trudności, których
przyczyną była obecność w każdym
aminokwasie aktywnych grup
aminowych i karboksylowych.
Tworzące się peptydy wchodziły w
dalsze reakcje i w ten sposób w
środowisku reakcji tworzyły się
mieszaniny wielu produktów, z których
trudno było wydobyć poszczególne
składniki.
Problem ten rozwiązano z pomocą czasowego
osłaniania funkcji aminowej aminokwasu
arylującego i karboksylowej aminokwasu
arylowanego. Osłony grup funkcyjnych dobiera się w
taki sposób, aby umożliwić ich selektywne lub
równoczesne usunięcie.

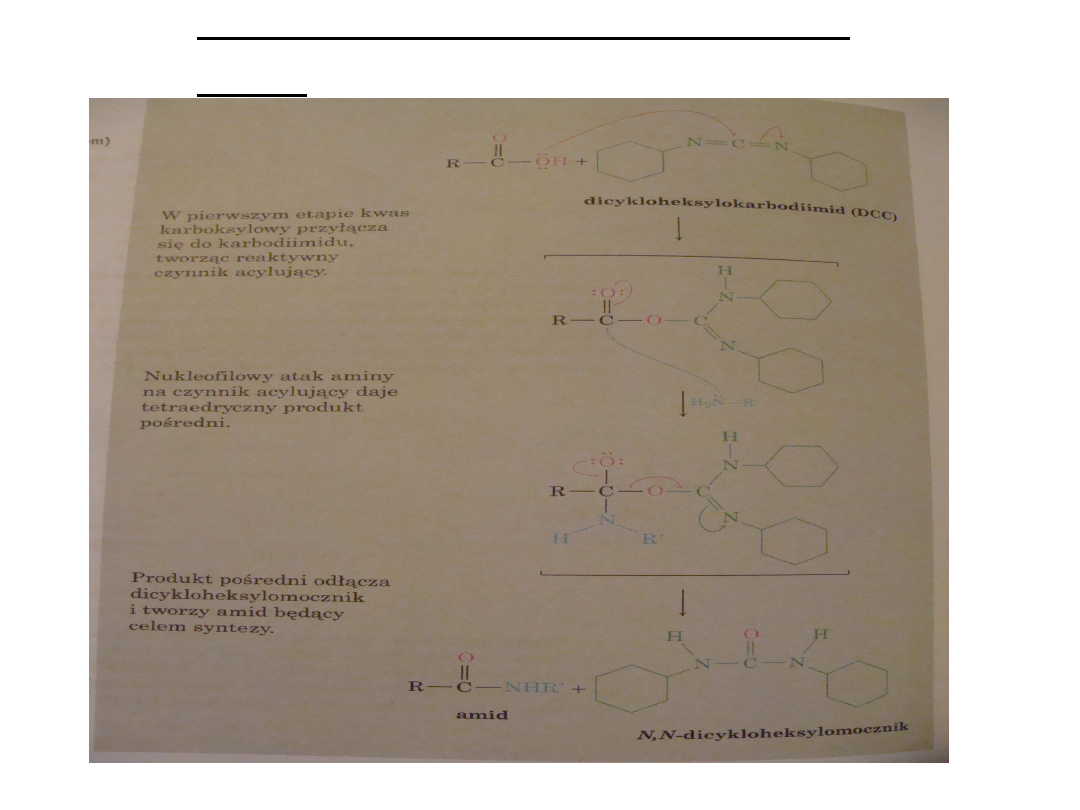
1.Metoda karbodiimidowa
DCC
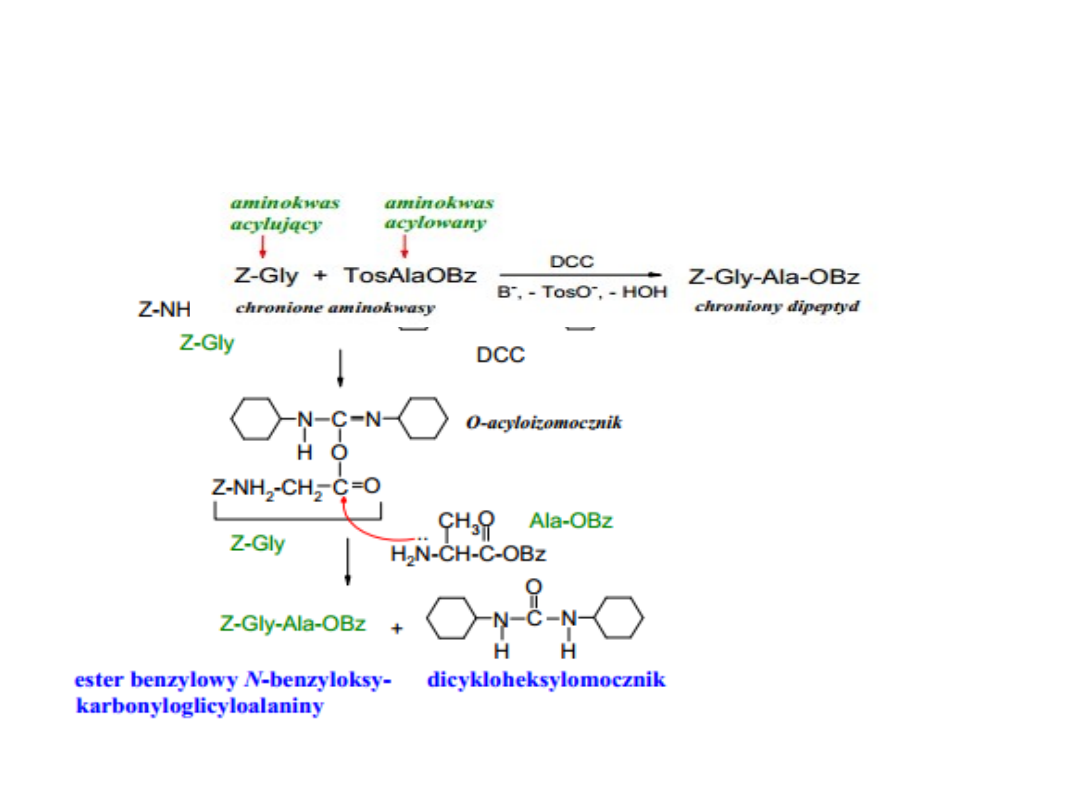
Metody tworzenia wiązania
peptydowego
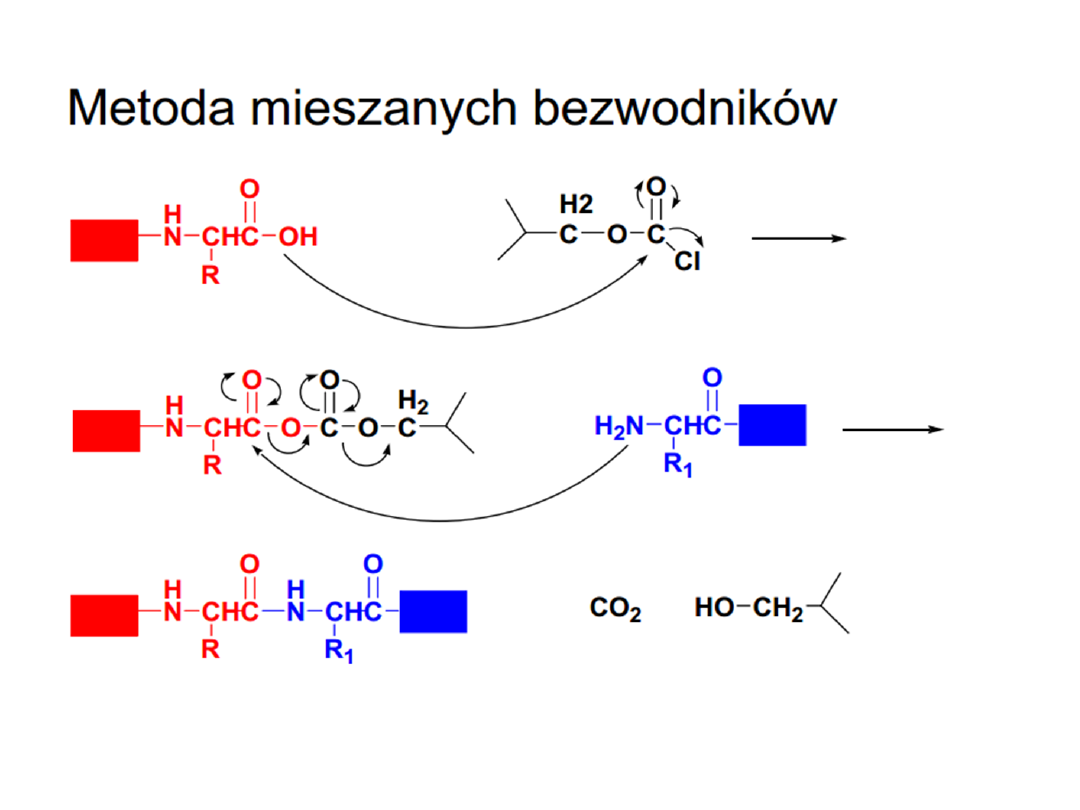
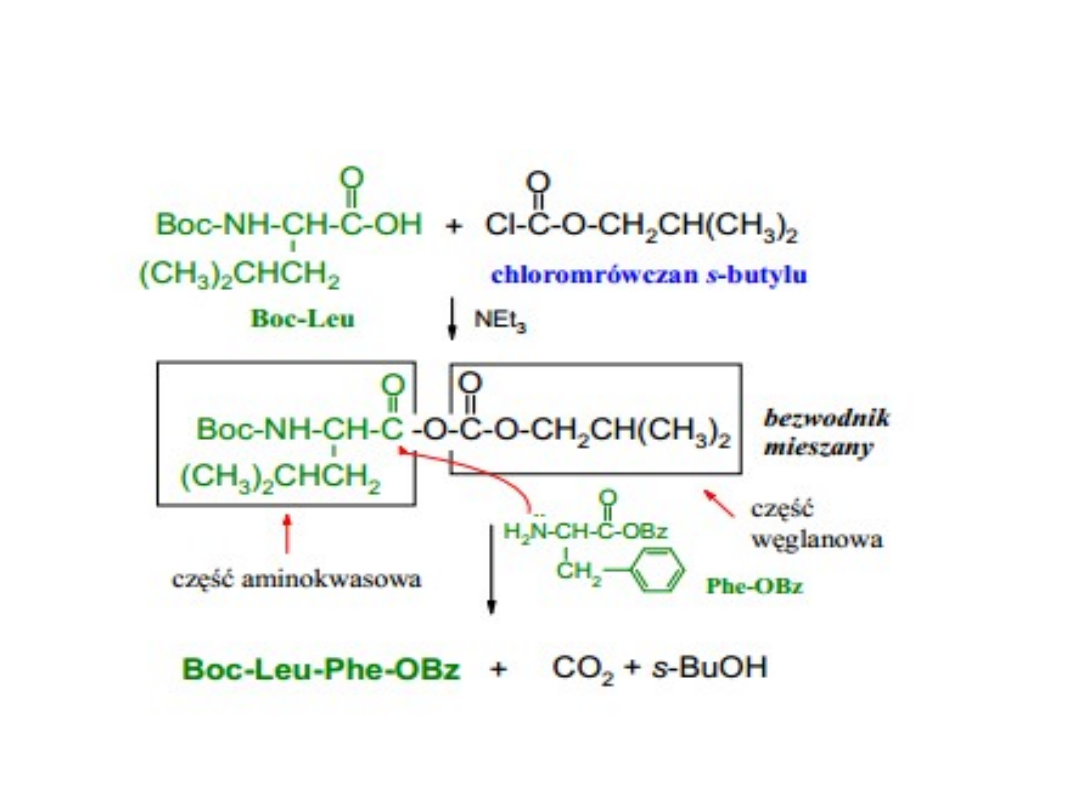
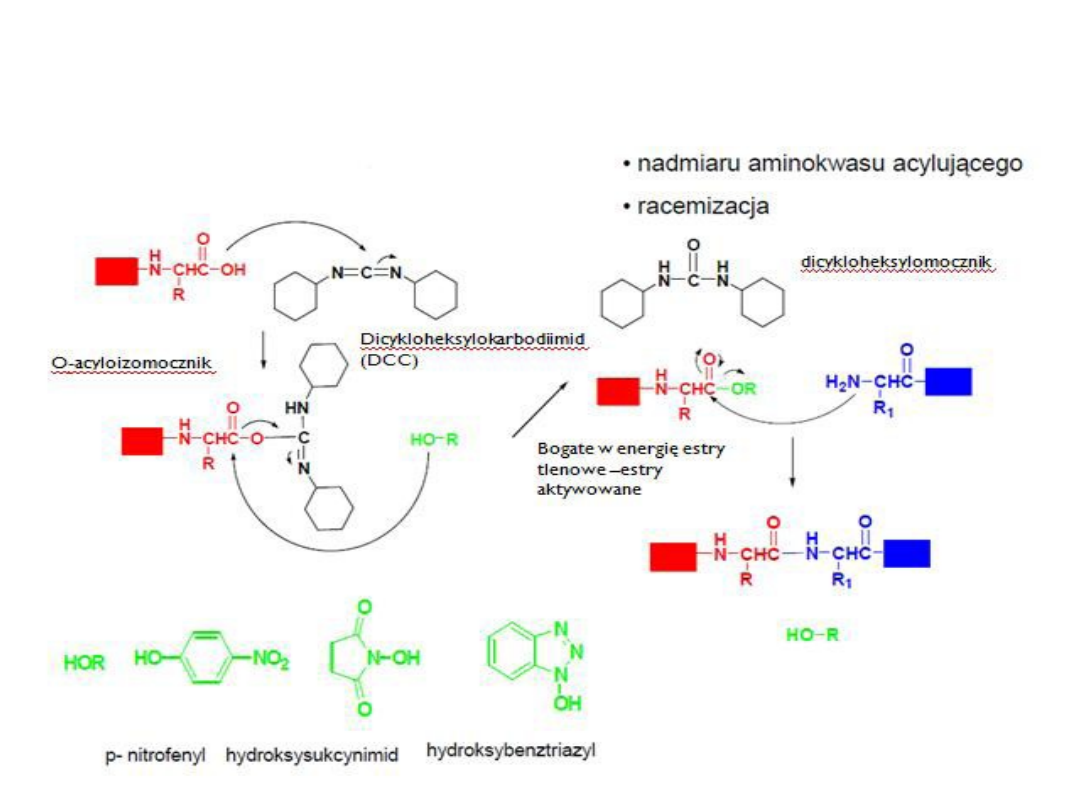
3. Metoda estrów aktywnych

Niektóre estry aktywne popularnych N-
chronionych aminokwasów są odczynnikami
łatwodostępnymi. Inne przyrządza się przez
rozpuszczenie się N-chronionego aminokwasu w
odpowiednim rozpuszczalniku, dodaje się substratu,
z którego ma powstać ester i DCC. Po 2-3
godzinach aktywny ester jest gotowy do użycia.
Bez wyodrębniania miesza się go z aminoestrem i
pozostawia do utworzenia peptydu.
O
H
NO
2
O
H
NO
2
Boc-Val +
DCC
Boc-Val-ONp
Gln-ONBz
p-nitrofenol
ester p-nitrofenylowy Boc-Val
Boc-Val-Gln-ONBz
-
ester p-nitrofenylowy t-butyloksy-
karbonylowaliloglutaminy

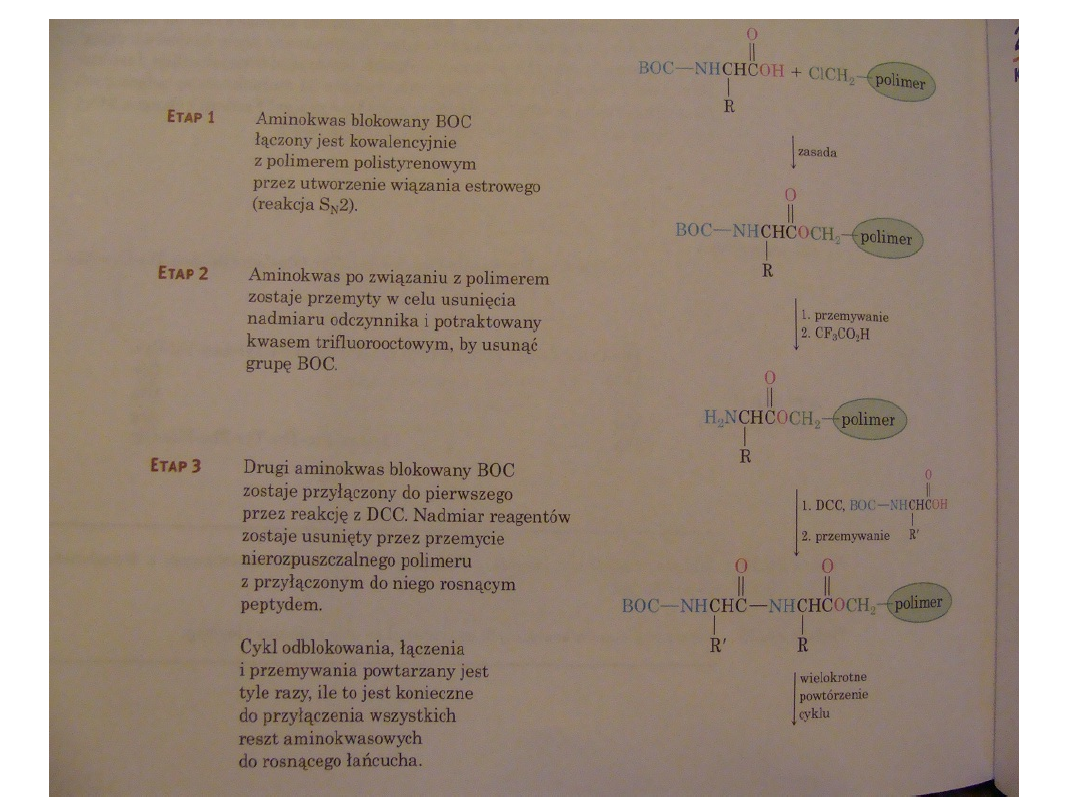
4. Metoda na nośniku
stałym
W 1962 roku Merrefield
opracował nową strategię
syntezy chemicznej
peptydów i białek (Nagroda
Nobla 1984r.). Metoda ta
polega na tym, że pierwszy
aminokwas wiąże się
kowalencyjnie swą grupą
karboksylową z
nierozpuszczalnym
polimerem, a następnie
syntezuje się cały łańcuch
peptydowy krok po kroku od
C-końca.

Polimery używane w SPS
Najczęściej stosowanym nośnikiem stałym jest
kopolimer styrenu i diwinylobenzenu.
Diwinylobenzen zapewnia usieciowanie
polimeru, czyli mostki między łańcuchami.
Stopień usieciowania można kontrolować
poprzez zmianę ilości diwinylobenzenu
biorącego udział w procesie polimeryzacji. Do
syntezy peptydów stosuje się polimer luźno
usieciowany (1-2%), tak aby rozpuszczalniki i
substraty mogły swobodnie wnikać do wnętrza
perełek wykonanych z takiego materiału.


Zalety syntezy na nośniku
stałym:
• skrócony całkowity czas syntezy
• łatwość izolacji produktu (filtracja)
• możliwość automatyzacji
• wysoka efektywność syntezy
Znaczną wadę w początkowym etapie rozwoju
syntezy na nośniku stanowił problem otrzymywania
czystych peptydów. Wynikało to z braku ilościowego
przebiegu reakcji przyłączania i odblokowywania
aminokwasów na poszczególnych etapach syntezy.

Bibliografia
Shawn Doonan, Białka i peptydy, wyd. naukowe
PWN , Warszawa 2008
H. D. Jakubke, H. Jeschkeit, Aminokwasy ,peptydy
,białka, wyd. naukowe PWN, Warszawa 1982
http://en.wikipedia.org/wiki/Peptide_synthesis
J. McMurry Chemia Organiczna 4, wyd. PWN
DZIĘKUJĘ ZA UWAGĘ !!!!
Document Outline
- Slide 1
- Wiązanie peptydowe
- Slide 3
- Slide 4
- Slide 5
- Synteza peptydów
- Slide 7
- Slide 8
- Metoda karbodiimidowa DCC
- Metody tworzenia wiązania peptydowego
- Slide 11
- Slide 12
- 3. Metoda estrów aktywnych
- Slide 14
- 4. Metoda na nośniku stałym
- Polimery używane w SPS
- Slide 17
- Slide 18
- Zalety syntezy na nośniku stałym:
- Bibliografia
Wyszukiwarka
Podobne podstrony:
8d Tworzenie wiązania peptydowego
1 wiazanie peptydowe 2struktura, biochemia(4)
notatek pl wiazanie peptydowe i jego cechy wyklad
Wiązanie peptydowe
wiazanie peptydowe
notatek pl wiazanie peptydowe
bialka, Wykrywanie wiazania peptydowego- reakcja biuretowa 2suche Pr wsypac po ok
Wiązanie peptydowe
MIDI w praktyce cz 8 Tworzenie wiązanki midi
Proces tworzenia oprogramowania
1 Tworzenie bazy danychid 10005 ppt
Wyklad 1 Wiazania
więcej podobnych podstron