
Tworzenie wiązania peptydowego w roztworze oraz
synteza na fazie stałej
Agnieszka Kwapisiewicz
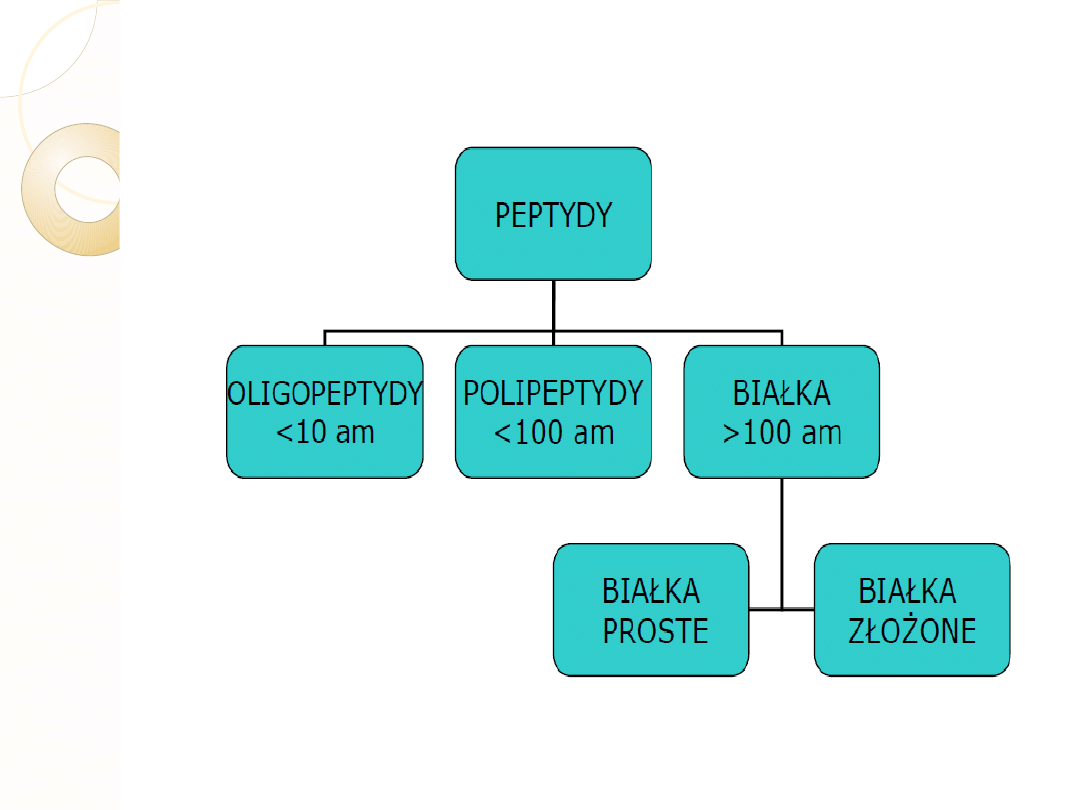
AMINOKWASY
PEPTYDY
BIAŁKA
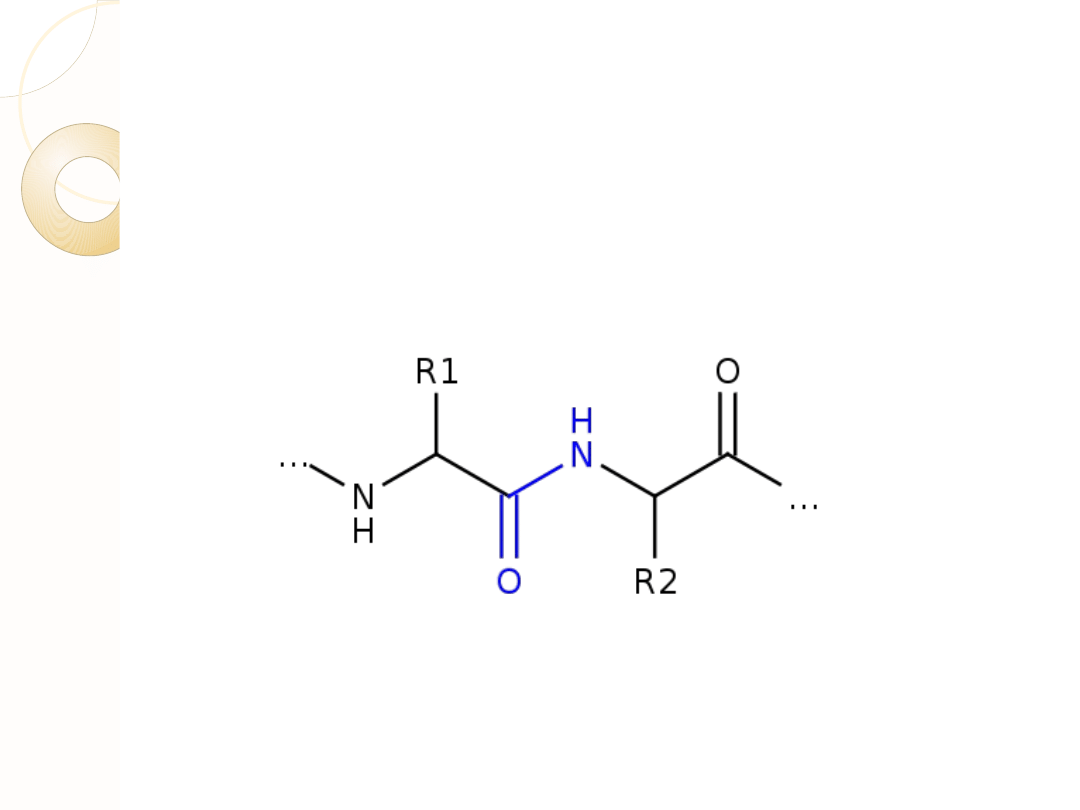
Tworzenie wiązania peptydowego
METODY TWORZENIA WIĄZANIA PEPTYDOWEGO:
ü
Metoda karbodiimidowa (DCC)
§
Metoda azydkowa
ü
Metoda bezwodnikowa
ü
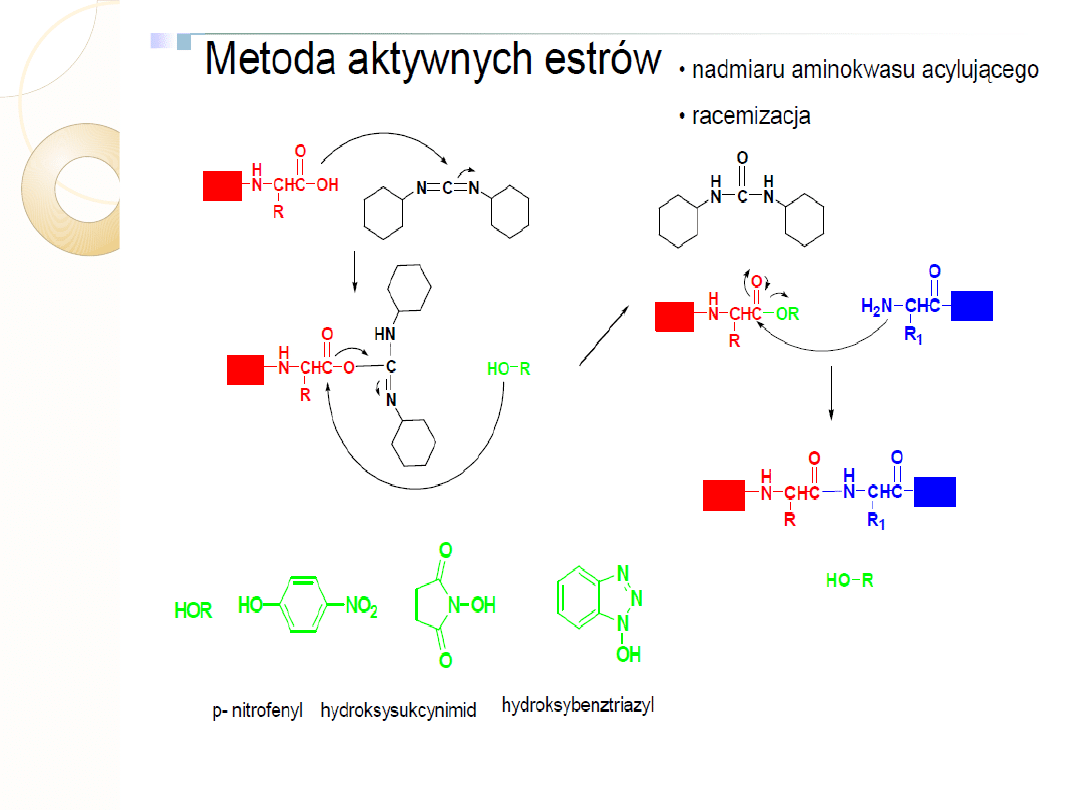
Metoda aktywnego estru
§
Metoda aktywnego amidu
§
Metoda izocyjanianowa
§
Metoda fosfoazowa
§
Metoda ynaminowa
§
Metoda chlorku kwasowego
§
Wbudowanie grupy aminoacylowej
§
Synteza peptydów poprzez N- karboksybezwodniki (NCA)
§
Sprzęganie w reakcji redoks
ü
Synteza na fazie stałej
WIĄZANIE
PEPTYDOWE
Już w 1902 r. Emil Fisher zauważył, że białka zawierają stosunkowo mało wolnych grup
aminowych i karboksylowych. Na tej podstawie zasugerował, że łączenie się aminokwasów
to reakcja kondensacji z udziałem grupy karboksylowej jednego z nich oraz grupy aminowej
kolejnego; w rezultacie powstaje wiązanie amidowe. Nazwane jest ono wiązaniem
peptydowym.
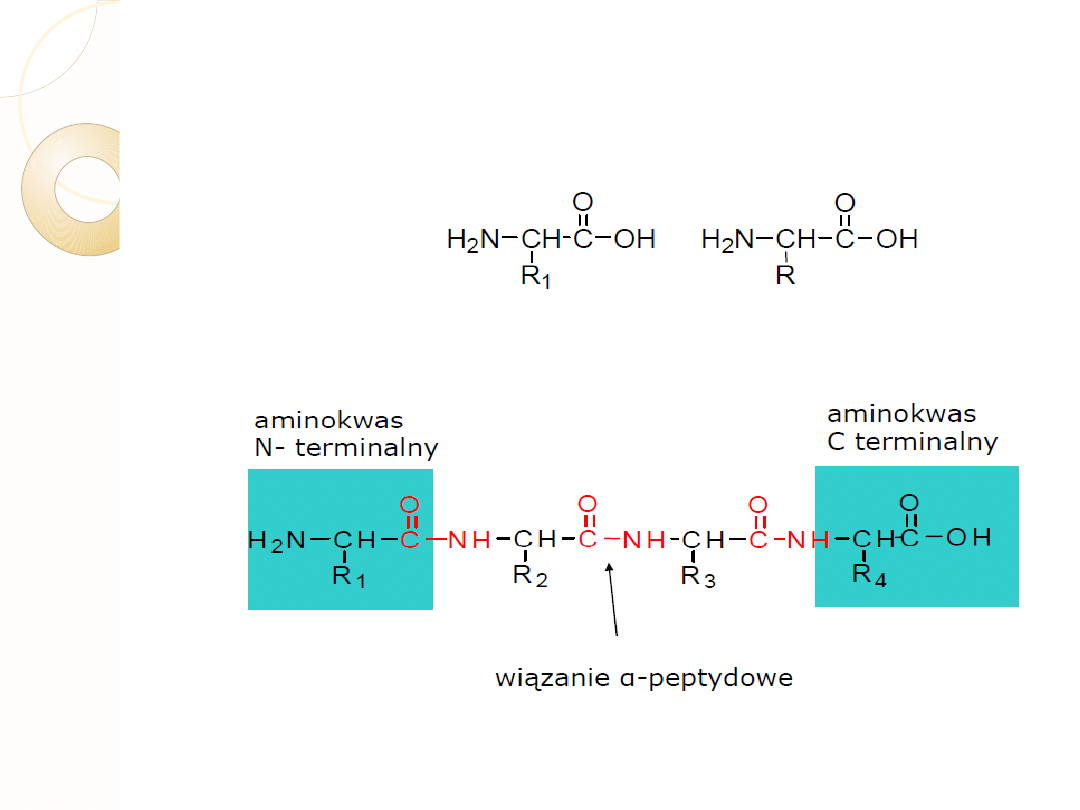
WIĄZANIE PEPTYDOWE
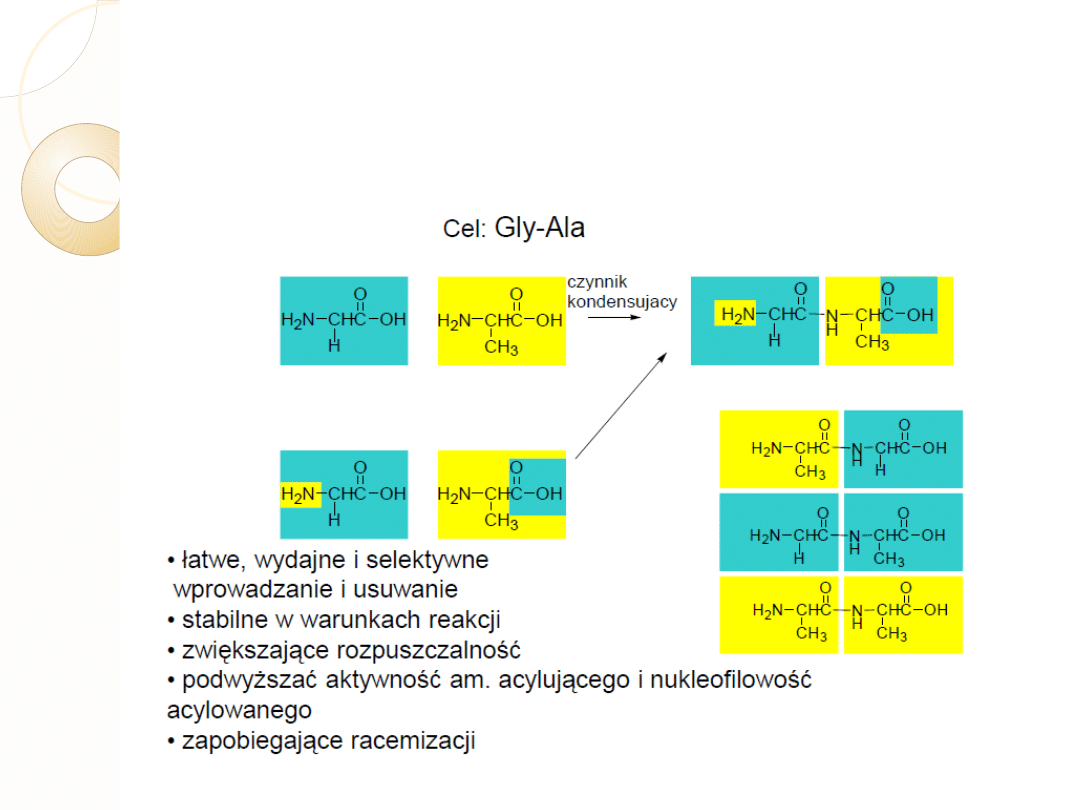
SYNTEZA PEPTYDÓW
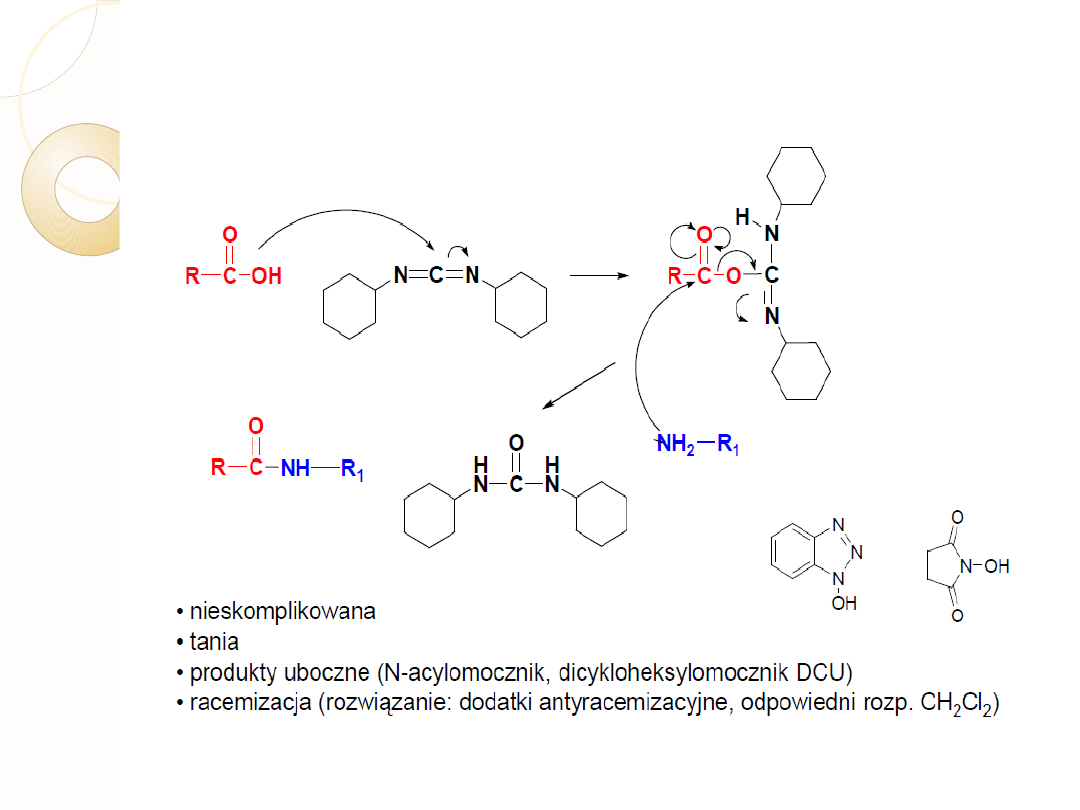
METODA KARBODIIMIDOWA DCC
Dicykloheksylokarbodiimid (DCC)
O-acyloizomocznik
dicykloheksylomoczn
ik
1-hydroksybenzotriazol
(HOBT)
N -
hydroksysukcynoimid
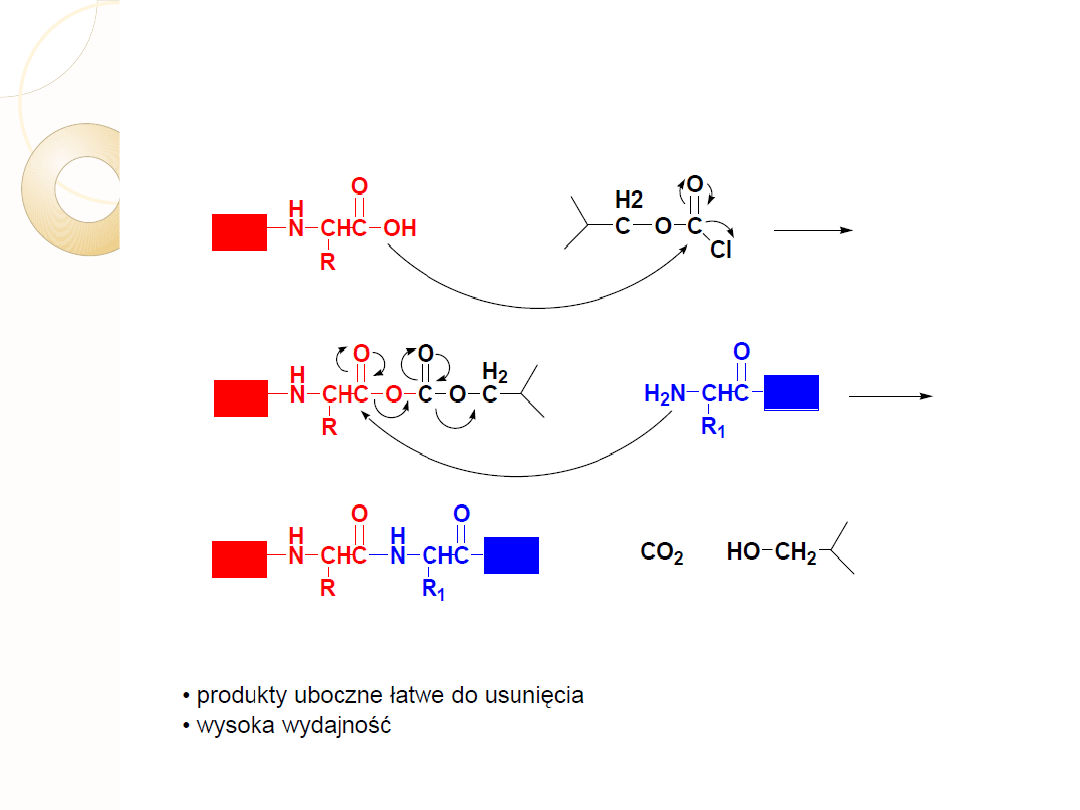
METODA MIESZANYCH BEZWODNIKÓW
chloromrówczan izobutylu
THF
-5 do -15 C
BEZWODNIK
Dicykloheksylokarbodiimi
d (DCC)
dicykloheksylomoczn
ik
Bogate w energię estry
tlenowe –estry
aktywowane
O-acyloizomocznik

METODA NA NOŚNIKU STAŁYM
W metodzie tej blokuje się grupę α-aminową aminokwasu, który ma
znaleźć się na końcu C docelowego peptydu, a grupę α-
karboksylową tego aminokwasu łączy się z nierozpuszczalnym
nośnikiem polimerowym; zwykle w tej roli stosowany jest
polistyren, czyli poli (fenyloeten)
Całkowicie nowe podejście syntezy peptydów
opracował Merrifield w 1960r. Chodzi o syntezę
na nośniku stałym (SPPS- ang. solid-phase peptide
synthesis).Za to osiągnięcie Merrifieldowi
przyznano w 1984 r. Nagrodę Nobla z chemii.
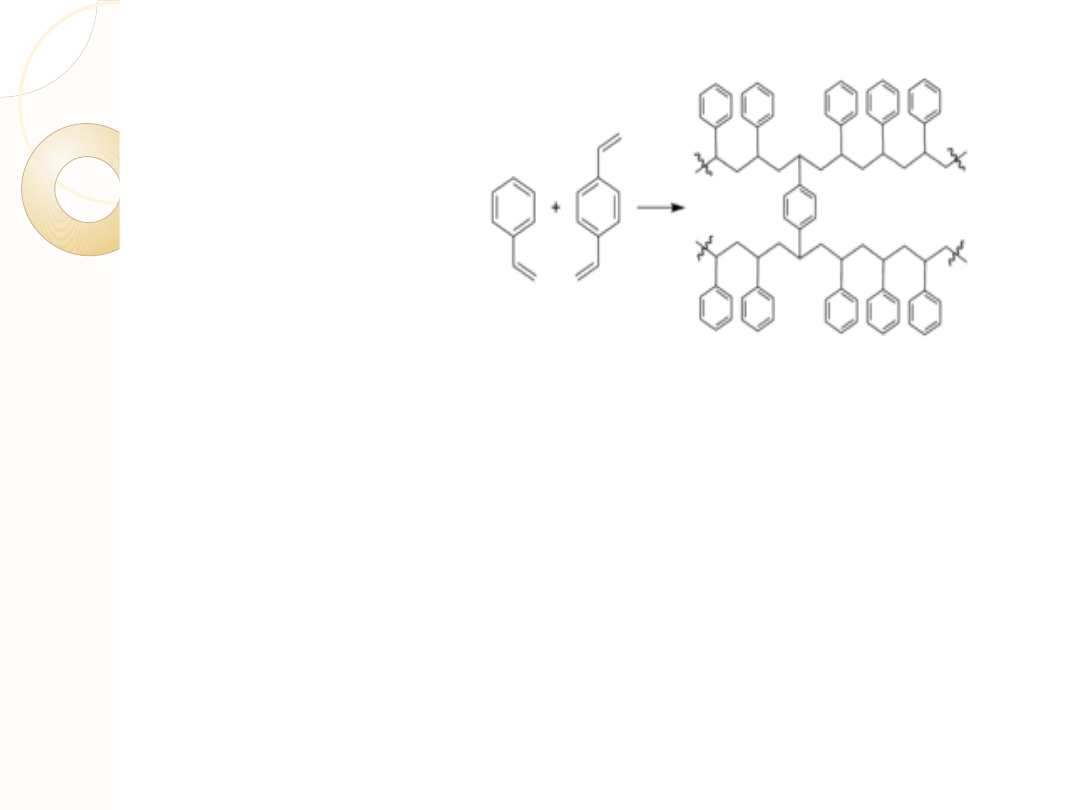
POLISTYREN
Najczęściej stosowanym nośnikiem stałym jest kopolimer styrenu i
diwinylobenzenu. Diwinylobenzen zapewnia usieciowanie polimeru,
czyli mostki między łańcuchami. Stopień usieciowania można
kontrolować poprzez zmianę ilości diwinylobenzenu biorącego udział
w procesie polimeryzacji. Do syntezy peptydów stosuje się
polimer luźno usieciowany (1-2%), tak aby rozpuszczalniki i substraty
mogły swobodnie wnikać do wnętrza perełek wykonanych z takiego
materiału. Rozpuszczalnik stanowi około 90% objętości spęczniałych
perełek, a zatem synteza zachodzi praktycznie w
roztworze, mimo, że łańcuch peptydowy jest przez cały czas połączony z
nośnikiem.
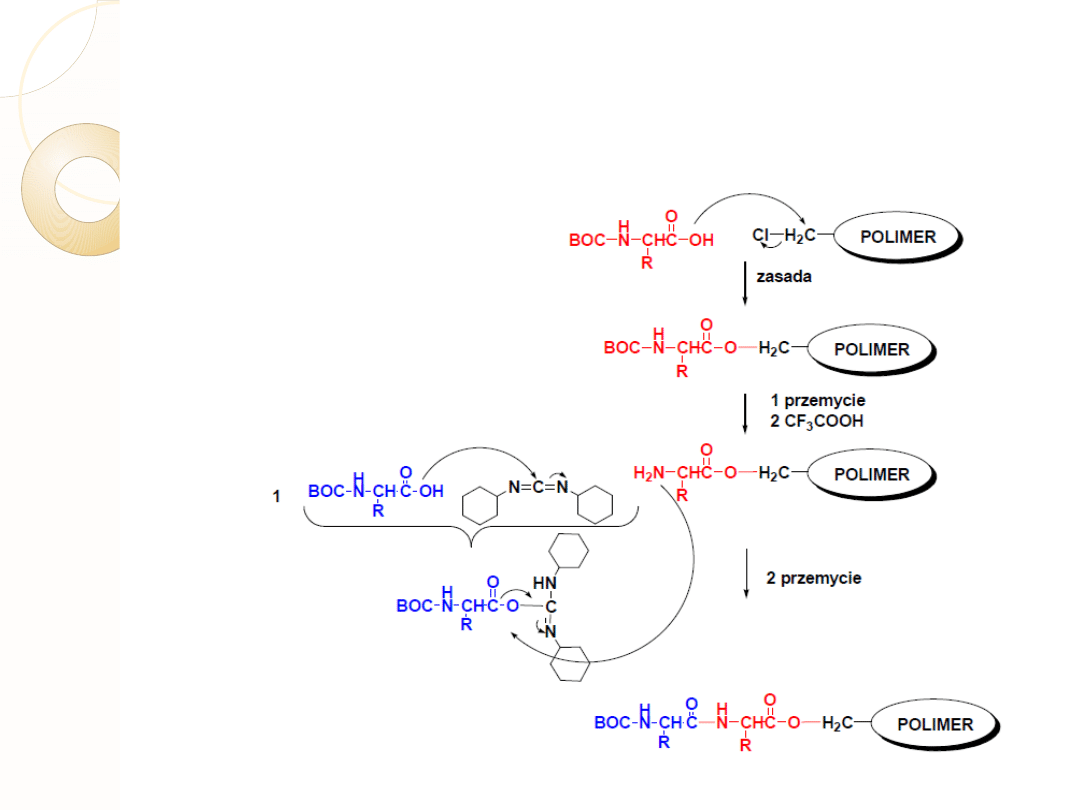
METODA NA NOŚNIKU STAŁYM SPPS
DCC
O-acyloizomocznik

Jednym z najszerzej
stosowanych linkerów jest
alkohol 4-
alkoksybenzylowy,
połączona z nim żywica
tzw.”ŻywicaWanga”

ZALETY SYNTEZY PEPTYDÓW NA
NOŚNIKU STAŁYM
Ø
Łatwość pozbycia się wszystkich produktów ubocznych kolejnych reakcji – przez
proste przemywanie żywicy polistyrenowej na sączku
Ø
Rosnący łańcuch jest przez cały czas przyczepiony do stałego nośnika i nie trzeba
go wyodrębniać
Ø
W metodzie tej nie pojawia się problem słabej rozpuszczalności peptydów, często
utrudniający syntezę w roztworze; peptyd jest przecież przyczepiony do nośnika
Ø
SPPS jest procesem stosunkowo prostym. Procedura została w pełni
zautomatyzowana i obecnie można po prostu kupić urządzenie, które wykonuje całą tę
pracę.

Zdjęcie przedstawia zestaw do prowadzenia syntezy peptydów na nośniku stałym


WADY SYNTEZY PEPTYDÓW NA NOŚNIKU
STAŁYM SPPS
Rosnący łańcuch peptydowy przez cały czas pozostaje połączony
ze stałym nośnikiem. Oznacza to, że jeśli z jakiegoś powodu
reakcja sprzęgania nie zachodzi do końca na pewnym etapie, to
w produkcie końcowym obecna jest pewna populacja
cząsteczek z brakującą resztą aminokwasową.
Pozbycie się takich produktów delecji może nastręczać wielu
trudności. Dlatego też powszechną praktyką jest
sprawdzanie na
każdym etapie kompletności reakcji sprzęgania
, tak aby w razie
potrzeby można ją było powtórzyć. W tym celu niewielką ilość
żywicy poddaje się testowi na obecność pozostałych wolnych grup
aminowych (reakcji ninhydrynowej).Jeśli także i powtórne
sprzęganie nie przebiega do końca, ułomny peptyd można na
trwałe zablokować, by zapobiec jego dalszemu wydłużaniu.
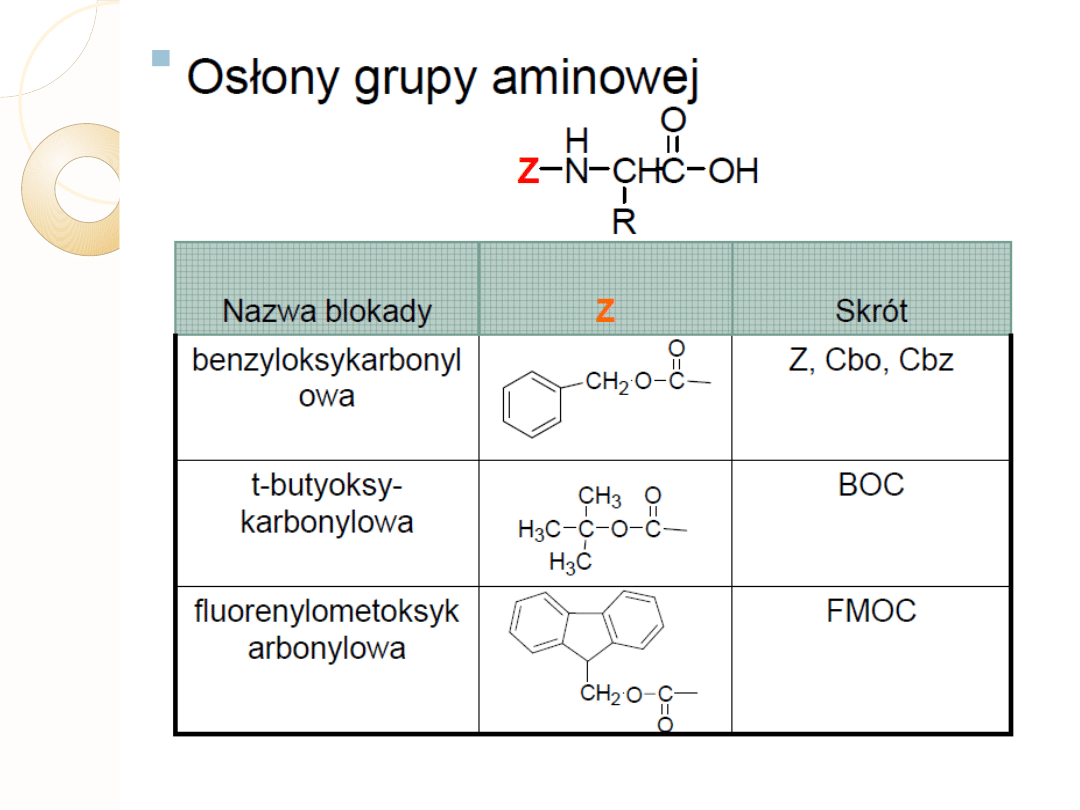
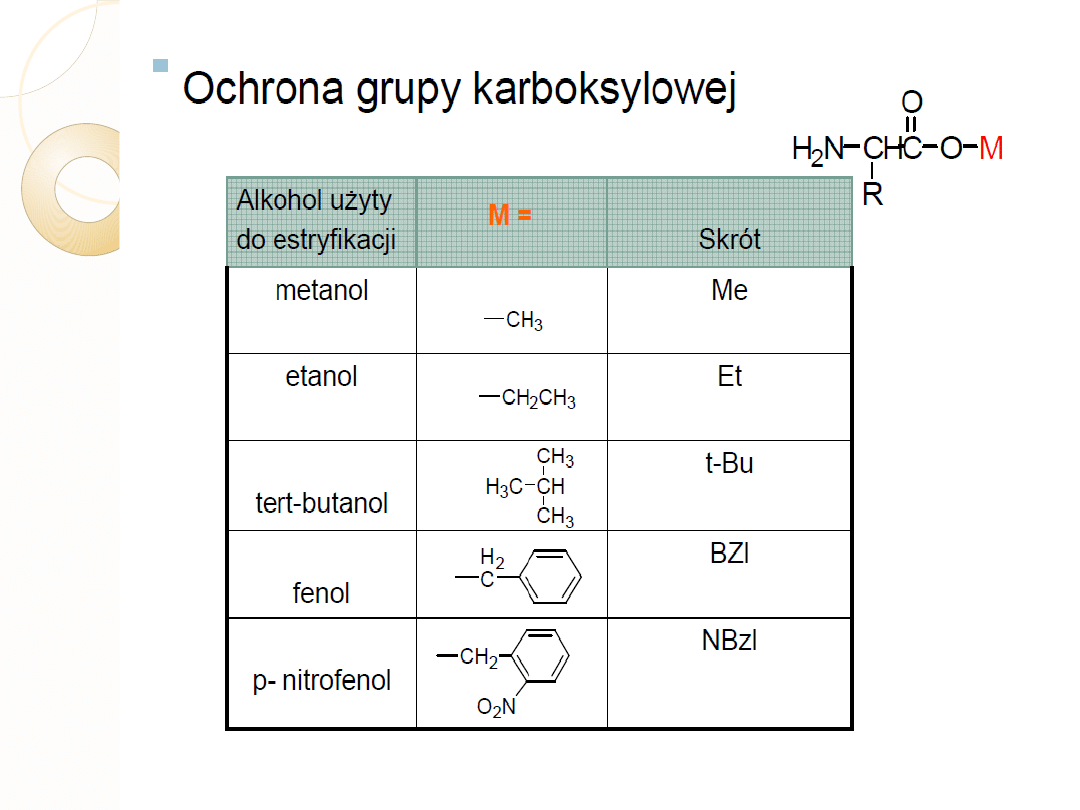
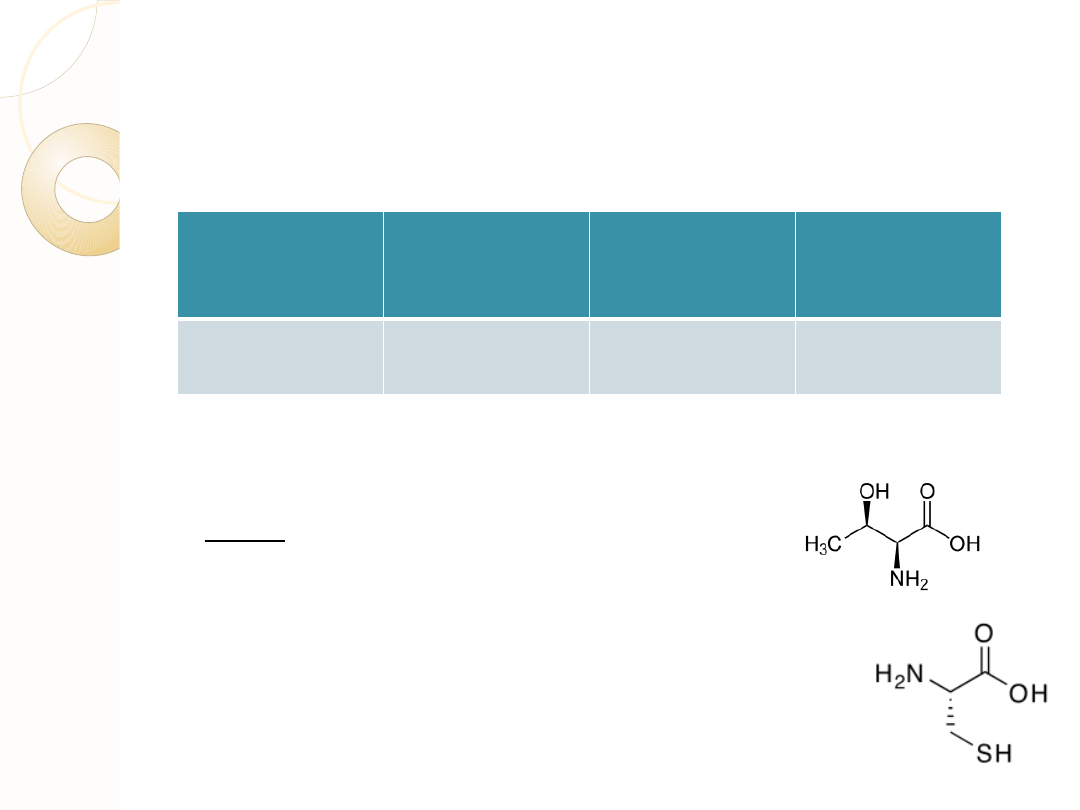
ZABEZPIECZANIE ŁAŃCUCHÓW
BOCZNYCH
Blokowanie
N α
Odblokowanie
Nα
Blokowanie
łańcucha
bocznego
Odblokowanie
łańcucha
bocznego
T –BOC
F moc
TFA
piperydyna
pochodne Bz
pochodne t-BU
HF
TFA
Tab.
Dwie główne strategie ochrony łańcuchów bocznych w metodzie SPPS
Skróty:
T-BOC – grupa t-butoksykarbonylowa
F moc- grupa fluorenylometoksykarboksylowa
TFA- kwas trifluorooctowy
Bz –ugrupowanie benzylowe; np.eter benzylowy w przypadku Thr
T-Bu - t-butanol np. sulfid dibutylowy w przypadku Cys
HF- ciekły fluorowodór
Treonina
Cysteina
Zasadniczą sprawą jest to, aby ochrona łańcucha bocznego przetrwała reakcje odblokowania
N- terminalnego aminokwasu
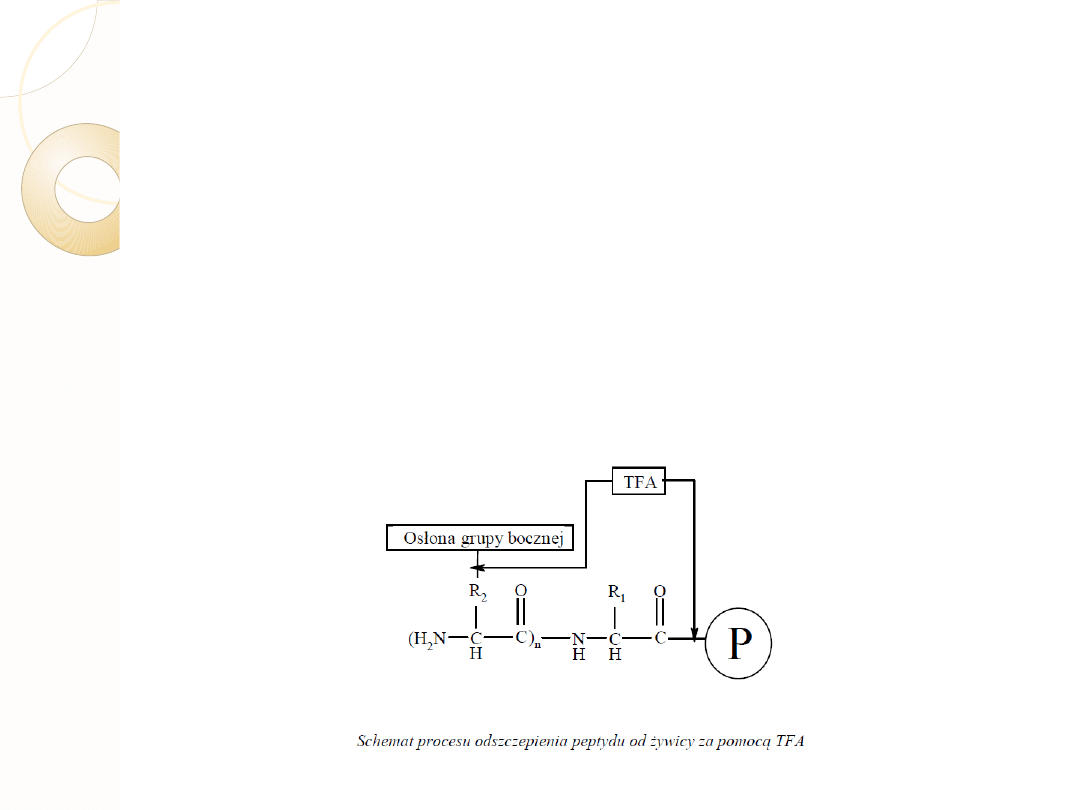
Odszczepienie, oczyszczenie i charakteryzowanie
produktu-peptydu
Odszczepianie peptydów od żywicy prowadzone jest zwykle z jednoczesnym usunięciem
osłon z grup funkcyjnych łańcuchów bocznych aminokwasów, np. z zastosowaniem
mieszaniny TFA/Fenol/H2O/TIPS (88:5:5:2). Reakcja, z zastosowaniem powyższej
mieszaniny, prowadzona jest przez 120 min w temperaturze pokojowej w atmosferze gazu
obojętnego (argonu). Po tym czasie żywica jest odsączana i przemywana dwukrotnie
niewielkimi ilościami TFA, a następnie z przesączu wytrącany jest peptyd za pomocą
zimnego Et2O. Wytrącony peptydy jest odsączany i po rozpuszczeniu w wodzie lub 20%
AcOH liofilizowany. Najczęściej używanym sposobem oczyszczania peptydu jest
preparatywna chromatografia HPLC w odwróconym układzie faz.

LITERATURA :
§
Shawn Doonan, Białka i peptydy, wyd. naukowe PWN , Warszawa 2008
§
H. D. Jakubke, H. Jeschkeit, Aminokwasy ,peptydy ,białka, wyd. naukowe
PWN, Warszawa 1982
§
J. McMurry, Chemia Organiczna, cz.4, wyd. naukowe PWN, Warszawa 2005
§
http://ewelina.adamska.w.interia.pl/3.pdf
§
http://www.ppc.univ.gda.pl/instrukcje/chembiol_cw1.pdf
§
http://en.wikipedia.org/wiki/Peptide_synthesis
Dziękuję za uwagę
Document Outline
- Slajd 1
- Slajd 2
- WIĄZANIE PEPTYDOWE
- WIĄZANIE PEPTYDOWE
- Slajd 5
- SYNTEZA PEPTYDÓW
- METODA KARBODIIMIDOWA DCC
- METODA MIESZANYCH BEZWODNIKÓW
- Slajd 9
- METODA NA NOŚNIKU STAŁYM
- POLISTYREN
- METODA NA NOŚNIKU STAŁYM SPPS
- Slajd 13
- ZALETY SYNTEZY PEPTYDÓW NA NOŚNIKU STAŁYM
- Slajd 15
- Slajd 16
- WADY SYNTEZY PEPTYDÓW NA NOŚNIKU STAŁYM SPPS
- Slajd 18
- Slajd 19
- ZABEZPIECZANIE ŁAŃCUCHÓW BOCZNYCH
- Slajd 21
- Slajd 22
Wyszukiwarka
Podobne podstrony:
8d Tworzenie wiązania peptydowego
1 wiazanie peptydowe 2struktura, biochemia(4)
notatek pl wiazanie peptydowe i jego cechy wyklad
Wiązanie peptydowe
wiazanie peptydowe
notatek pl wiazanie peptydowe
bialka, Wykrywanie wiazania peptydowego- reakcja biuretowa 2suche Pr wsypac po ok
Wiązanie peptydowe
MIDI w praktyce cz 8 Tworzenie wiązanki midi
Proces tworzenia oprogramowania
1 Tworzenie bazy danychid 10005 ppt
Wyklad 1 Wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wiązania chemiczne (II)
Tworzenie Łańcucha Wartości Dodanej
więcej podobnych podstron