
Wiązanie
peptydowe
tworzenie
struktura
właściwości

Powstaje wskutek związania azotu grupy α-
aminowej jednego aminokwasu z węglem
grupy α-karboksylowej aminokwasu drugiego
Tworzeniu towarzyszy utrata fragmentu -OH z
grupy karboksylowej i -H z grupy aminowej,
które odłączają się w postaci wody

Wiązanie amidowe (kowalencyjne)
Wykazuje częściowo charakter
wiązania podwójnego (brak swobodnej
rotacji wokół wiązania łączącego
węgiel i azot), na skutek występowania
dwóch jego form mezomerycznych
Równowaga powstawania przesunięta
w kierunku hydrolizy, a co za tym idzie
powstawanie wiązania wymaga
dostarczenia energii
Wiązanie to nie posiada ładunku w
żadnym istotnym fizjologicznie pH
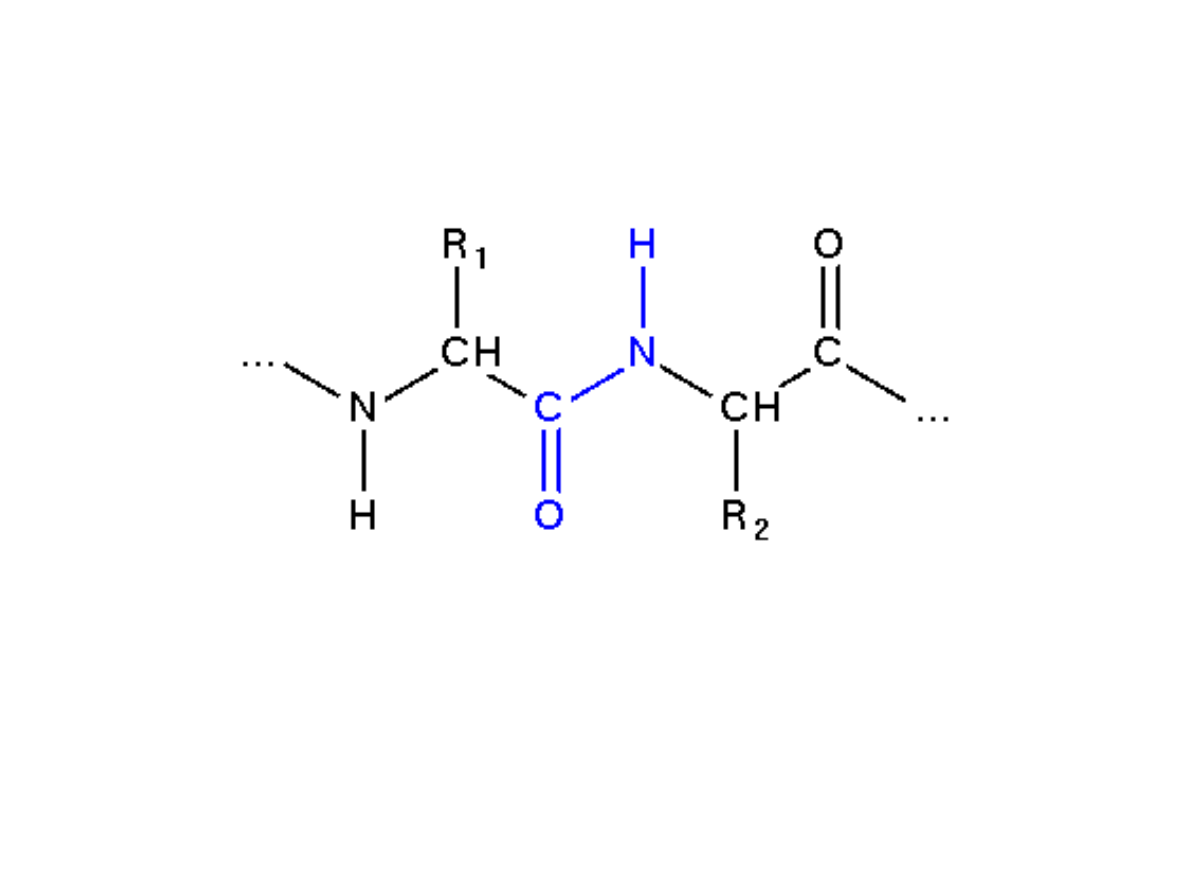
Wiązanie wykazuje koplanarność- 4
atomy (C, O, N, H {zaznaczone na
niebiesko} leżą w jednej płaszczyźnie)
Wiązania peptydowe występujące w
białkach mają najczęściej
konfigurację trans (atom wodoru z
grupy -NH i atom tlenu z grupy -CO
leżą naprzeciw siebie)

W wyniku połączenia wiązaniem peptydowym co
najmniej dwóch aminokwasów powstaje peptyd. W
zależności od liczby aminokwasów wchodzących w
jego skład wyróżniami di-; oligo- i polipeptydy,
podział ten jest umowny i nie posiada powszechnie
obowiązujących granic
Jednostkę aminokwasu wbudowaną w łańcuch
polipeptydowy nazywamy resztą aminokwasową, a
powstały łańcuch polipeptydowy wykazuje
polarność, spowodowaną występowaniem na
jednym jego końcu grupy α-aminowej, na drugim zaś
α-karboksylowej oraz kwaśnych lub zasadowych
grup R
Grupa karboksylowa aminokwasu C-końcowego
może wejść z reakcję z grupą aminową aminokwasu
N-końcowego, powodując powstanie peptydu
cyklicznego

Ważniejsze fizjologicznie
peptydy
Glutation
Karnozyna
Anseryna
Oksytocyna
Wazopresyna
Glukagon
Kalcytonina
Gramicydyny
Kininy
Enkefaliny
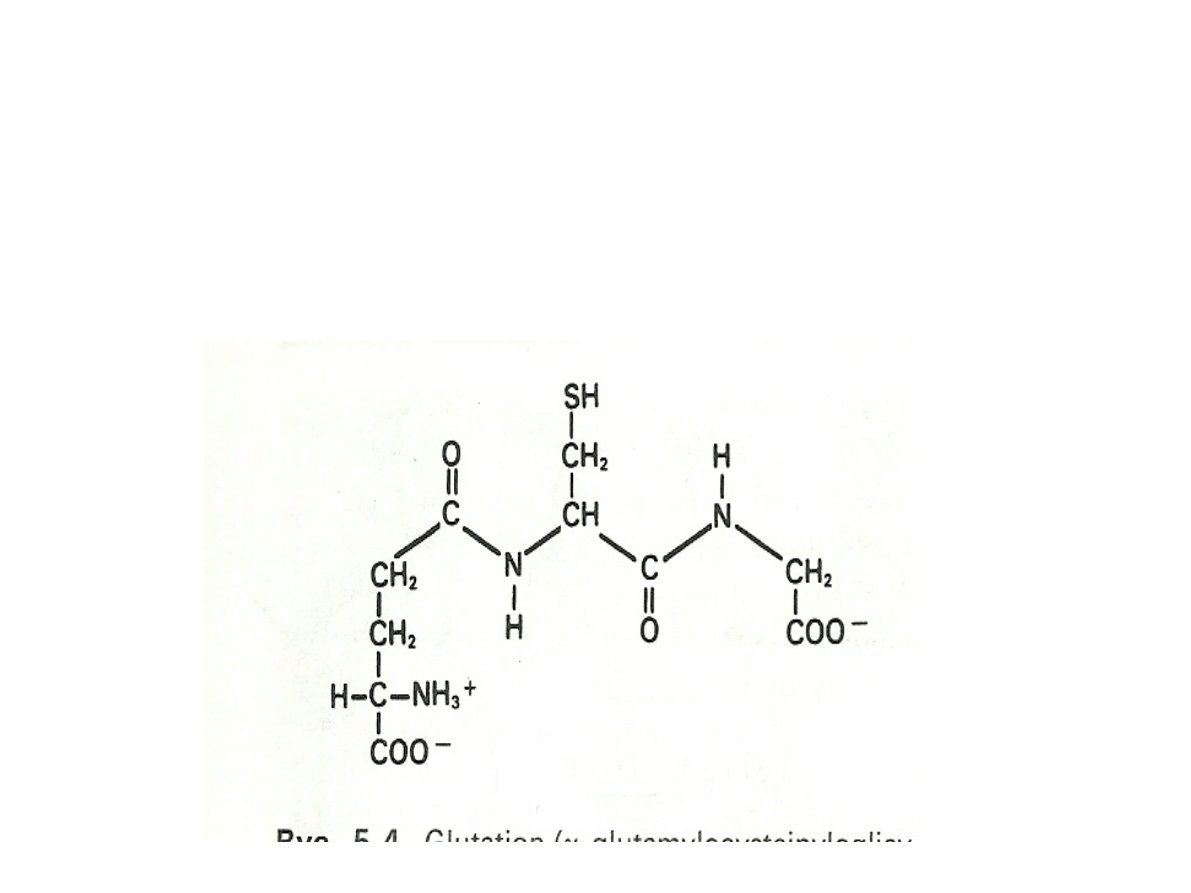
Glutation
γ-glutamylocysteinyloglicyna

Występuje nietypowy dla białek sposób
połączenia glutaminianu z cysteiną. W
wiązaniu tym bierze udział grupa γ- a nie
α-karboksylowa glutaminianu
Niezwykle ważny w procesach
oksydacyjno-redukcyjnych, dzięki
zdolności do przechodzenia w stan
utleniony i zredukowany
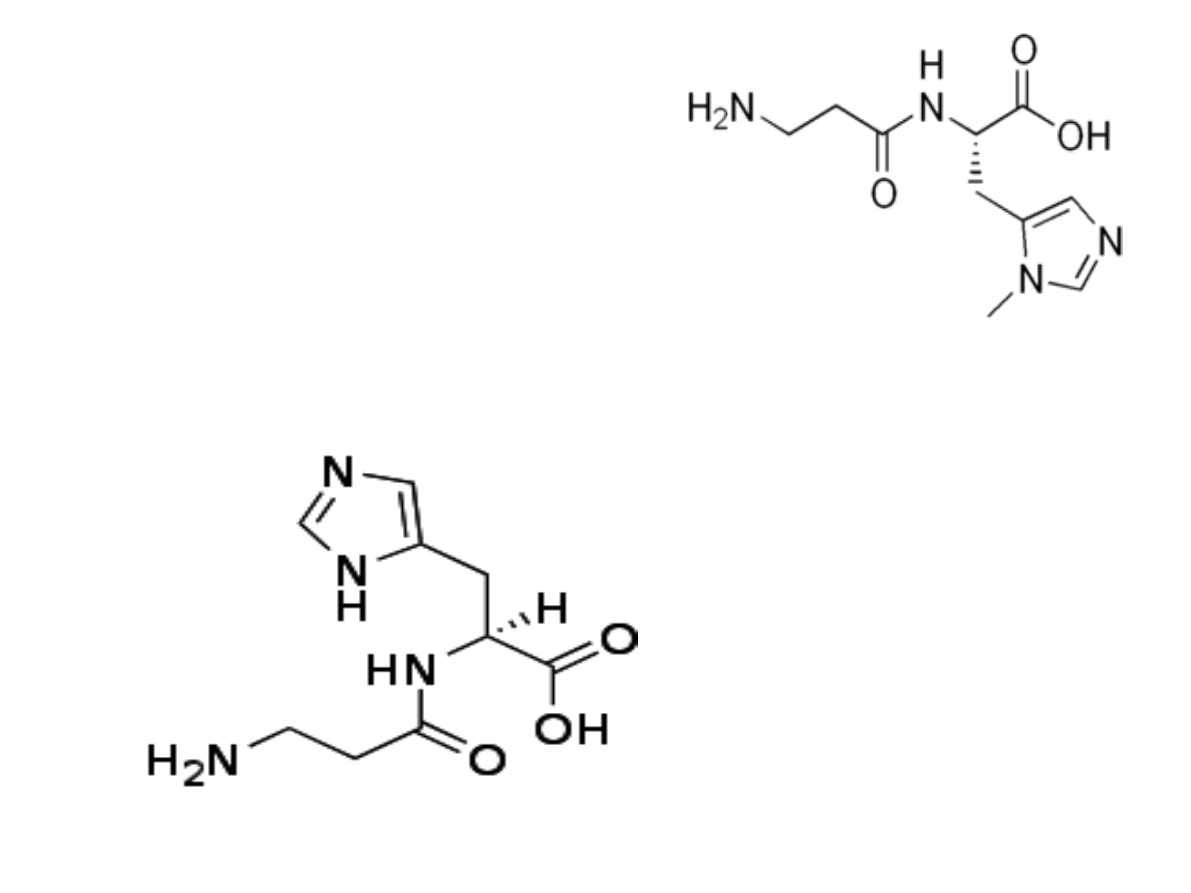
Anseryna
β-alanilo-N-metylohistydyna
Występuje w mięśniach i mózgu
Ma działanie antyoksydacyjne
Karnozyna
β-
alanilohistydyna
Składnik mięśni
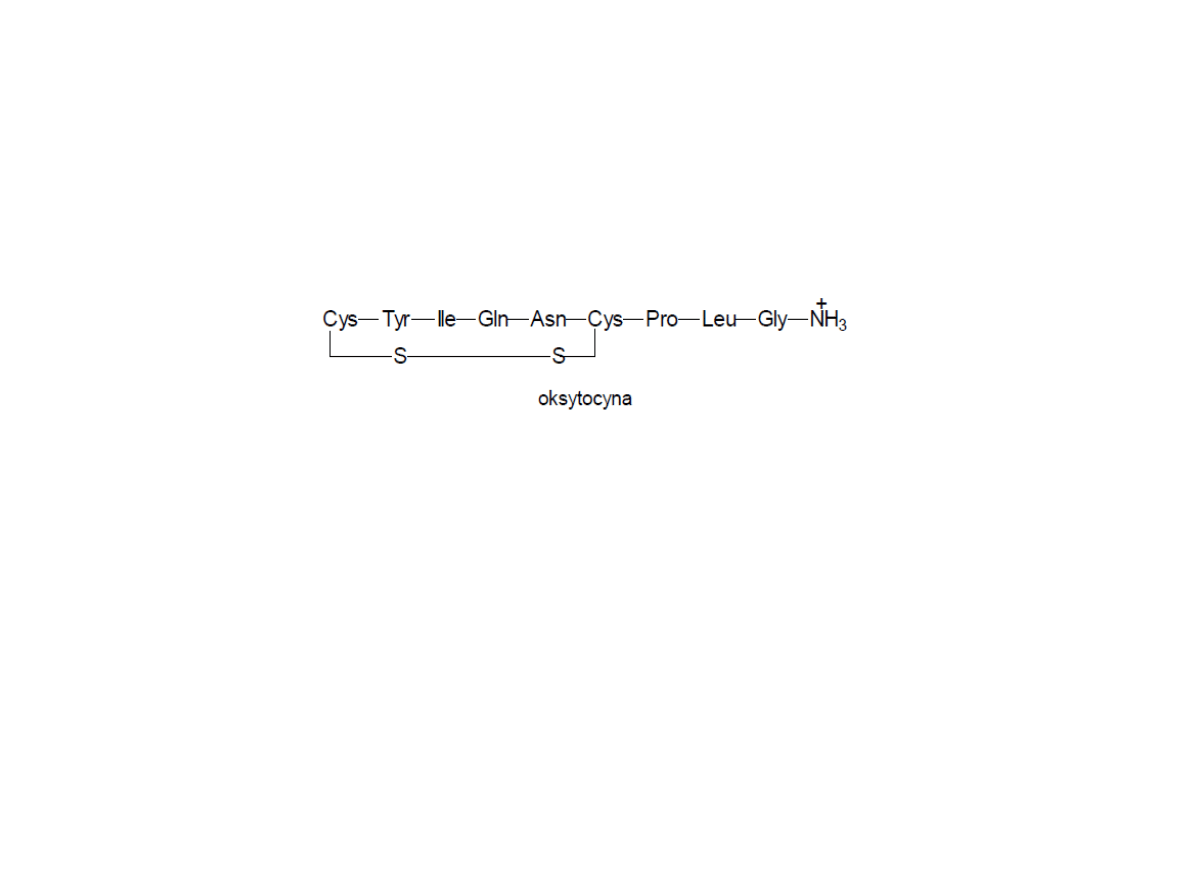
Oksytocyna
Cykliczny hormon peptydowy zbudowany z 9 aminokwasów
Uwalniany okresowo neuroprzekaźnik
Funkcje:
Powoduje skurcze macicy w czasie porodu
Ułatwia zapłodnienie
Wspomaga wydzielanie mleka
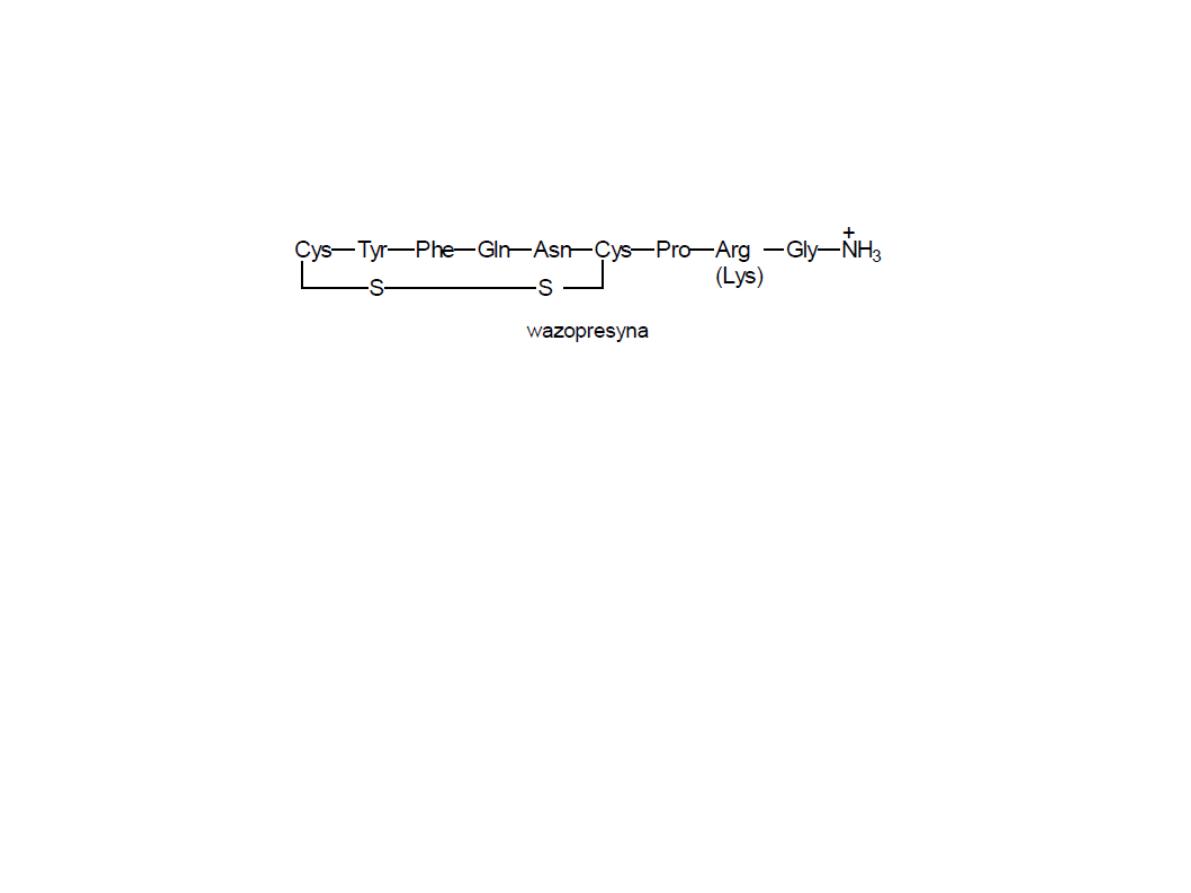
Wazopresyna
Cykliczny hormon peptydowy zbudowany z 9 aminokwasów
wytwarzany jest przez podwzgórze w postaci
preprowazopresynoneurofizyny i wydzielany w ostatecznej
postaci przez tylny płat przysadki mózgowej
Nazywany hormonem antydiuretycznym
Funkcje:
Zwiększa resorpcję wody
Podnosi ciśnienie krwi
Jego brak jest przyczyną moczówki prostej

Glukagon
Hormon peptydowy składający się z 29 reszt aminokwasowych
Jest syntetyzowany w postaci wielkocząsteczkowego prekursora, z którego na drodze
reakcji proteolitycznych uwalniany jest glukagon
Antagonista insuliny
Funkcje:
Powoduje wzrost stężenia glukozy we krwi
Wzmaga procesy glikogenolizy i glukoneogenezy oraz utlenianie kwasów tłuszczowych

Kalcytonina
Polipeptyd zudowany z 32 reszt aminokwasowych
U człowieka występuje w postaci mono- lub dimeru
Powstaje z polipeptydowego prohormonu
Antagonista parathormonu
Funkcje:
Zmniejsza stężenie jonów wapnia i fosforanów w
płynach pozakomórkowych
Sprzyja wapnieniu tkanki kostnej

Gramicydyny
Peptydowe antybiotyki jonoforowe
Otwartołańcuchowe oligopeptydy zbudowane z 15
aminokwasów o naprzemiennej konfiguracji D i L
Wyróżniamy 3 pary gramicydyn A, B, C, różniące się
aminokwasem występującym w pozycji 11.,
odpowiednio: tryptofan, fenyloalanina, tyrozyna, oraz
w pozycji 1.: walina i izoleucyna
W wyniku połączenia 6 wyżej opisanych podjednostek
powstaje cząsteczka gramicydyny D
Stosowane miejscowo ze względu na wysoką
toksyczność, nie może być stosowana wewnętrznie
Działają na większość bakterii Gram-dodatnich i
wybrane Gram-ujemne
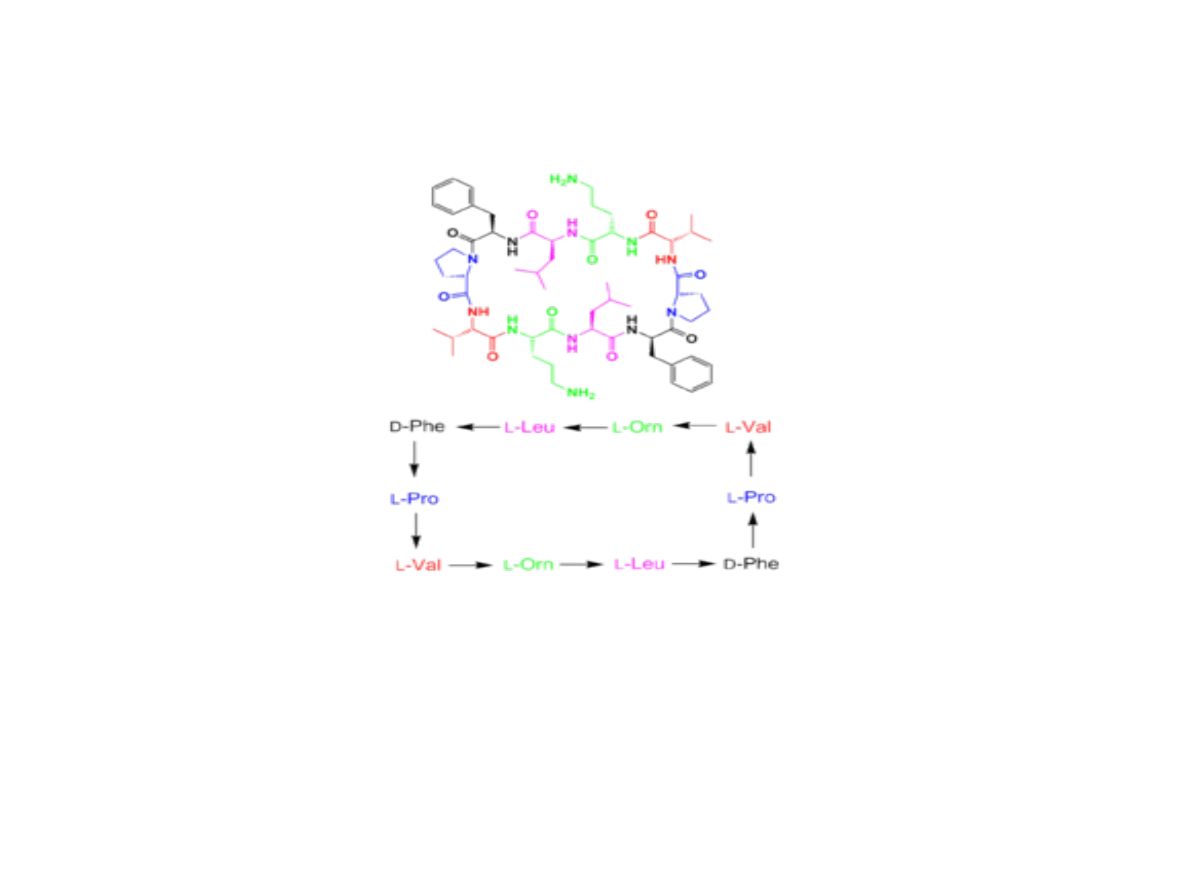
Gramicydyna S
Cykliczny peptyd zbudowany z 5 reszt aminokwasowych
powtarzających się dwukrotnie, tworzących hydrofobowy
pierścień
Antybiotyk jonoforowy
Ma charakter zasadowy, w lecznictwie jest więc stosowana
w postaci chemicznie trwalszych chlorowodorków

Kininy
BRADYKININA
nanopeptyd; Arg-Pro-Pro-Gly-Phe-Ser-Pro-
Phe-Arg
-roszerzają naczynia krwionośne,
-kurczą mięśnie gładkie przewodu
pokarmowego
ANGIOTENSYNA I
dekapeptyd; Asp-Arg-Val-Tyr-Ile-His-Pro-
Phe-His-Leu
ANGIOTENSYNA II
oktapeptyd; Asp-Arg-Val-Tyr-Ile-His-Pro-
Phe
-zwiększają ciśnienie tętnicze krwi, siłę
skurczu mięśnia sercowego
-regulacja biosyntezy hormonów

Enkefaliny
Pentapeptydy występujące w mózgu, np.
enkefalina metioninowa Tyr- Gly-Gly-Phe-
Met, leucynowa Tyr- Gly-Gly-Phe-Leu
odszczepiają się od β-lipotropiny, gdzie
zajmują 61-65 pozycję oraz z ENDORFIN α,
β, ɣ zbud z 16, 17 i 31 aminokwasów
Działają modyfikująco na neurony,
obniżając ich wrażliwość na acetylocholinę
DZIAŁANIE PRZECIWBÓLOWE
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
1 wiazanie peptydowe 2struktura, biochemia(4)
notatek pl wiazanie peptydowe i jego cechy wyklad
Wiązanie peptydowe
8d Tworzenie wiązania peptydowego
notatek pl wiazanie peptydowe
bialka, Wykrywanie wiazania peptydowego- reakcja biuretowa 2suche Pr wsypac po ok
Wiązanie peptydowe
8d Tworzenie wiązania peptydowego
Wyklad 1 Wiazania
Wyklad 4 Wiazania chemiczne w cialach stalych
Wiązania chemiczne (II)
6 wykad WiĄzania chemiczne[F]
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Wykład 1, budowa atomu, wiązania chemiczne
Enzymatyczna redukcja związków karbonylowych i zawierających wiązania C=C
Pecznienie to zdolnosc odwodnionych koloidow do wiazania wody
2 Atom i cząstka Wiązania chemiczne klucz
więcej podobnych podstron