
Aminy i
aminokwasy
CHARAKTERYSTYKA
ZWIĄZKÓW
ORGANICZNYCH
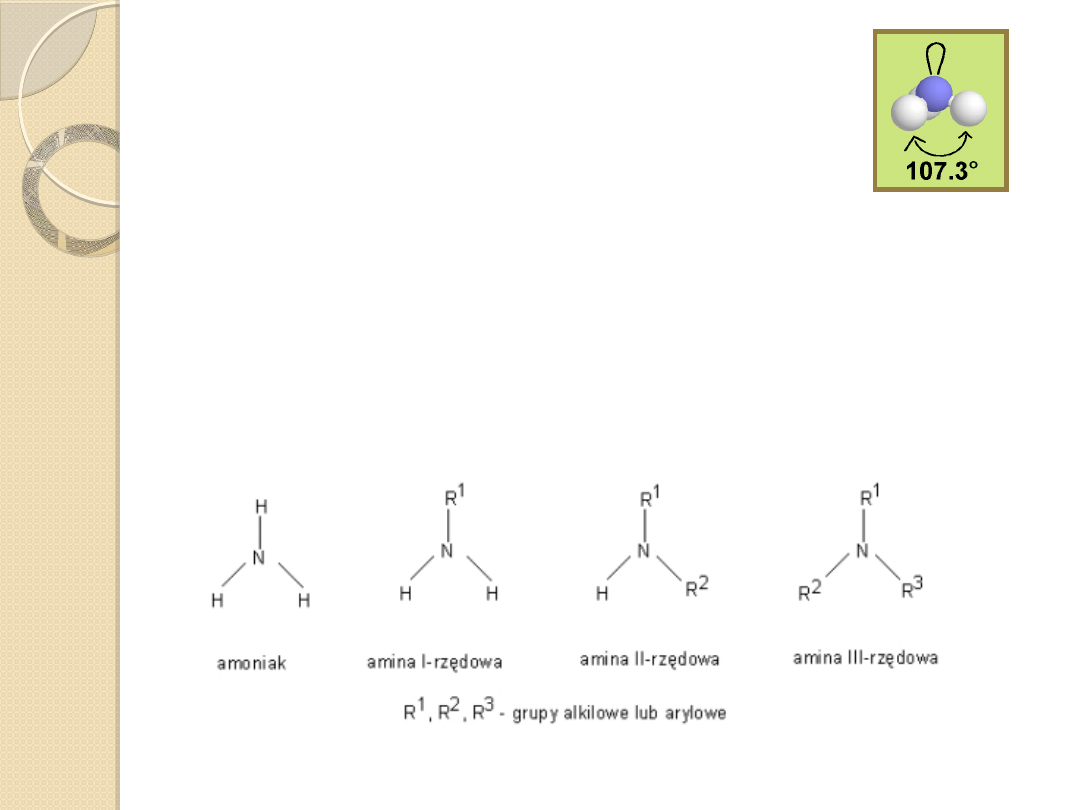
Aminy
Aminy są organicznymi pochodnymi
amoniaku, w których co najmniej jeden atom
węgla został podstawiony resztą alifatyczną
lub aromatyczną
Liczba podstawionych atomów wodoru
określa rzędowość aminy
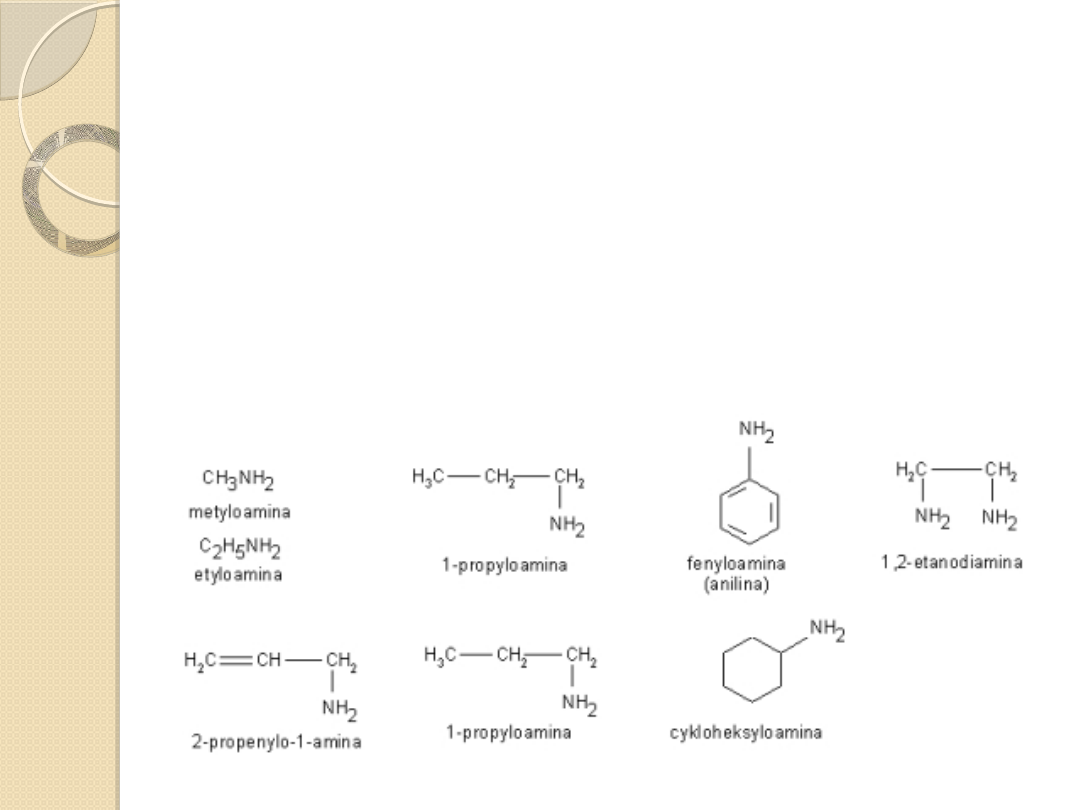
Aminy I-rzędowe
Wśród amin wyróżniamy pochodne
wszystkich grup węglowodorów:
alifatycznych alkanów i alkenów,
cykloalkanów, arenów
Aminy mogą zawierać więcej niż jedną grupę
aminową
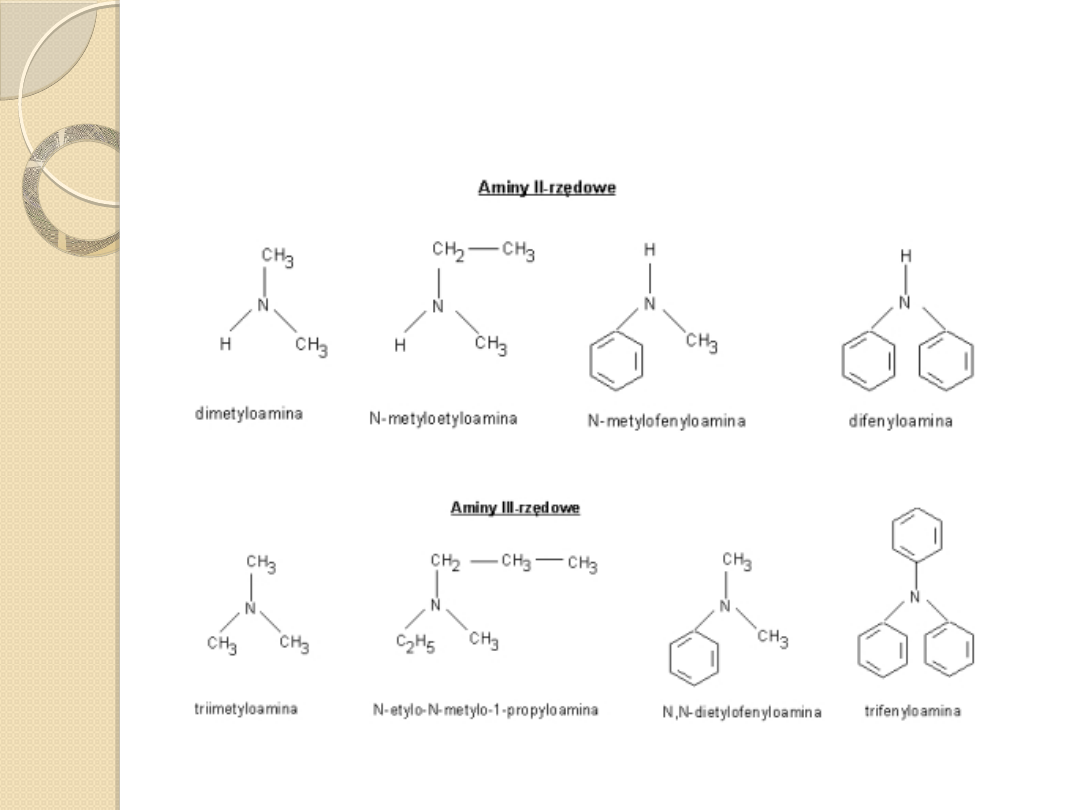
Aminy II i III-rzędowe
Rzędowość amin
W nazwie amin rzędowość określa liczba podstawników:
metyloamina – I-rz, metylo-etyloamina, dimetyloamina – II-rz,
metylo-etylo-propylo-amina, etylo-dimetyloamina,
trietyloamina – III-rz.
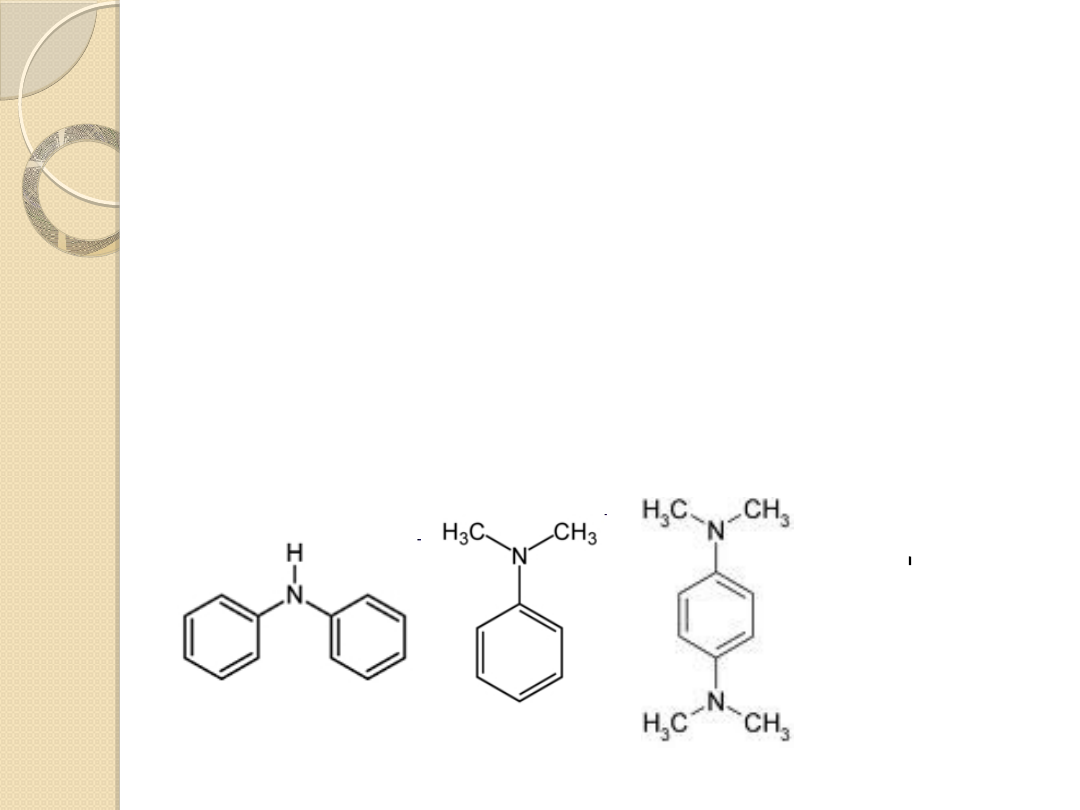
Nazwy amin aromatycznych wywodzimy od aniliny
(fenyloaminy)
Jeżeli w cząsteczce znajdują się inne grupy funkcyjne, grupę
aminową traktuje się jako podstawnik (np. kwas aminooctowy)
difenyloamina dimetylofenyloamina fenylodimetylodiamina
COOH
H
3
C−NH
2
kwas aminooctowy
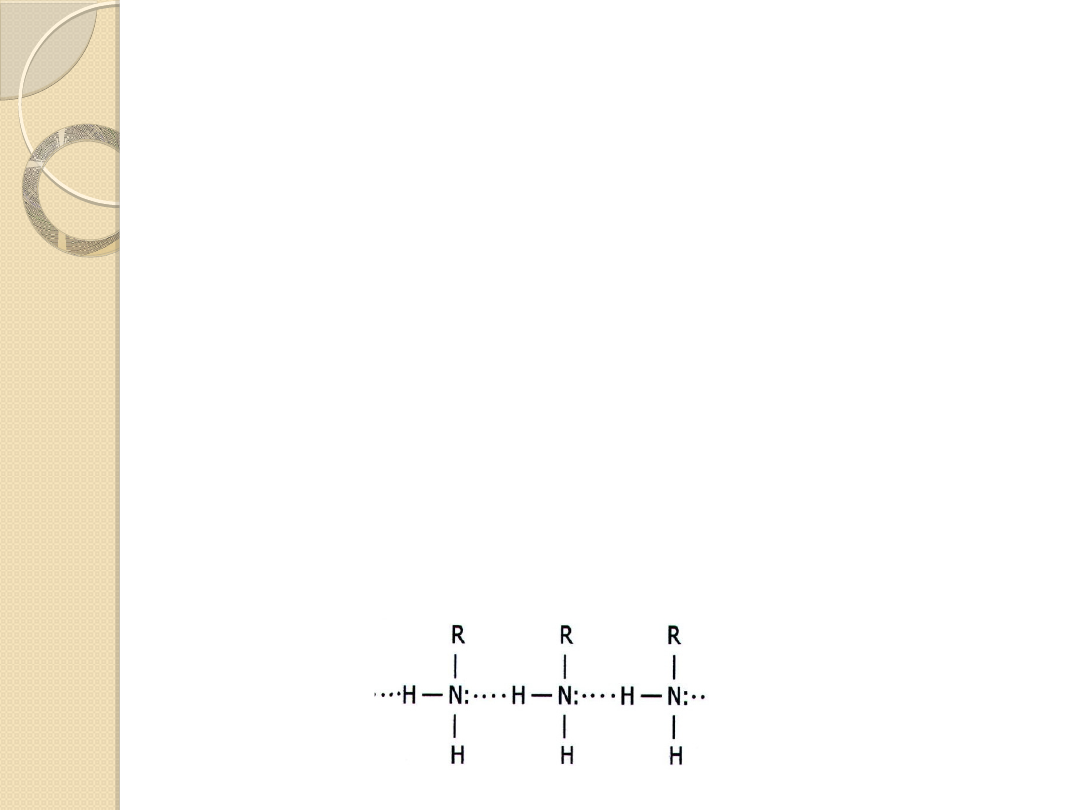
Właściwości fizyczne
Aminy alifatyczne I- i II-go rzędowe to zazwyczaj
ciecze o ostrej, rybiej lub amoniakalnej woni
metyloamina, dimetyloamina, trimetyloamina i
etyloamina są gazami
Dobrze rozpuszczają się w wodzie, źle w
rozpuszczalnikach organicznych. Są wyraźnie
zasadowe.
Aminy o większych grupach alifatycznych są cieczami
lub ciałami stałymi; długość łańcucha obniża
rozpuszczalność w wodzie
Aminy aromatyczne to ciecze lub ciała stałe o
wysokich temperaturach wrzenia i ostrej woni
Są słabo rozpuszczalne w wodzie, a ich odczyn jest
słabo zasadowy.
między cząsteczkami amin
i z cząsteczkami wody
tworzą się wiązania wodorowe
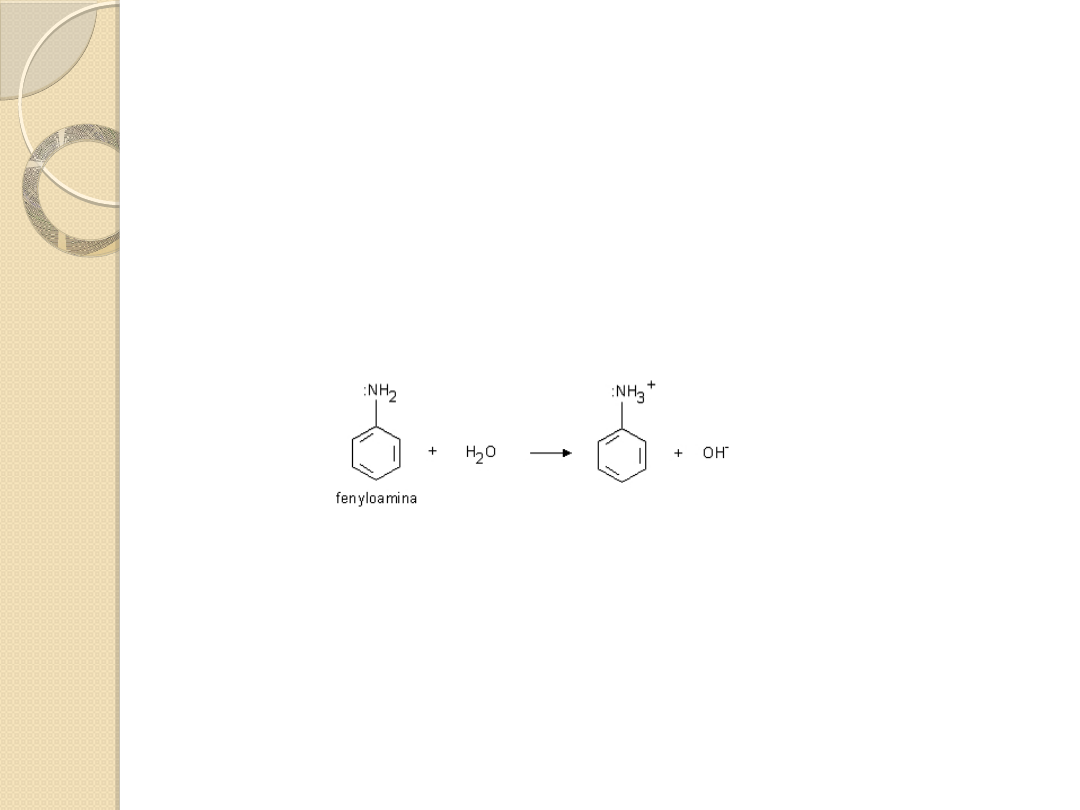
Właściwości zasadowe
amin
Aminy mają silne własności zasadowe, reagują z kwasami
nieorganicznymi oraz organicznymi, a w roztworach
wodnych posiadają odczyn zasadowy:
R-NH
2
+ H
2
O RNH
3+
+ OH
−
Dla amin alifatycznych im wyższa rzędowość tym większa
zasadowość; wykazują silniejsze właściwości zasadowe
niż amoniak.
Własności zasadowe amin aromatycznych są słabsze i
spadają w miarę wzrostu rzędowości. Wynika to z
oddziaływania wolnej pary elektronowej w grupie
aminowej z elektronami pierścienia aromatycznego.

Właściwości chemiczne
Aminy alifatyczne I,II i III-rzędowe oraz aminy
aromatyczne I-rzędowe dają z kwasami sole.
(CH
3
)
3
N + HCl [(CH
3
)
4
N]
+
Cl
−
Aminy I-rzędowe reagują z kwasem azotawym z
wydzieleniem azotu
CH
3
−CH
2
−NH
2
+ HNO
2
CH
3
−CH
2
−OH + N
2
+ H
2
O
Aminy II-rzędowe reagują z kwasem azotawym z
wytworzeniem nitrozoamin (aminy trzeciorzędowe zostają
przekształcone w aminy drugorzędowe oraz aldehyd)
CH
3
CH
3
CH
3
−NH + HNO
2
CH
3
−N−NO + H
2
O
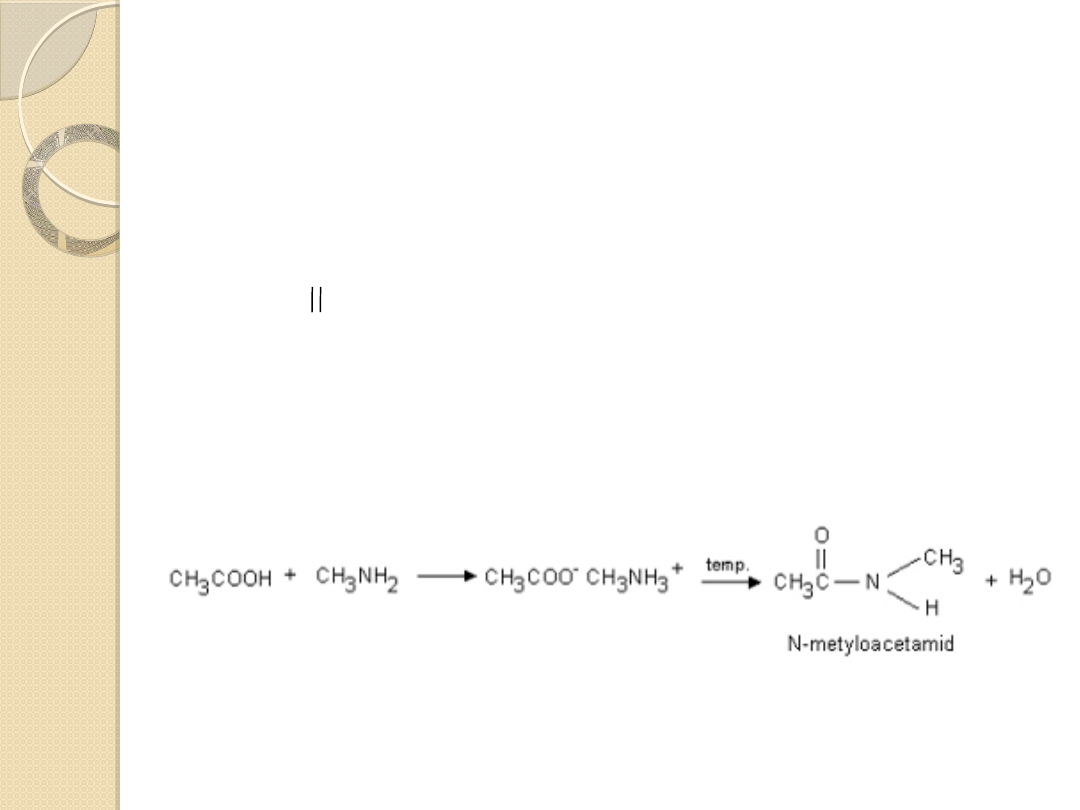
Właściwości chemiczne
c.d.
Działanie aldehydami na aminy I-rzędowe prowadzi
do powstania zasad Schiffa.
O
CH
3
−C−H + H
2
N−CH
3
CH
3
−CHN−CH
3
+
H
2
O
Wszystkie aminy I i II-rzędowe ulegają acylacji do
amidów w reakcji z estrami, chlorkami oraz
bezwodnikami kwasów karboksylowych
imina

aminokwas
y

Aminokwasy
Aminokwasy są związkami, które posiadają
grupę aminową oraz grupę kwasową
Grupa aminowa najczęściej jest I-rzędowa,
a grupą kwasową jest grupa karboksylowa
W aminokwasach białkowych obie grupy
funkcyjne lokują się przy tym samym
węglu (C )
Związki zawierające grupę iminową (aminy
II-rzędowe) lub grupę kwasową inną niż
karboksylowa także są aminokwasami
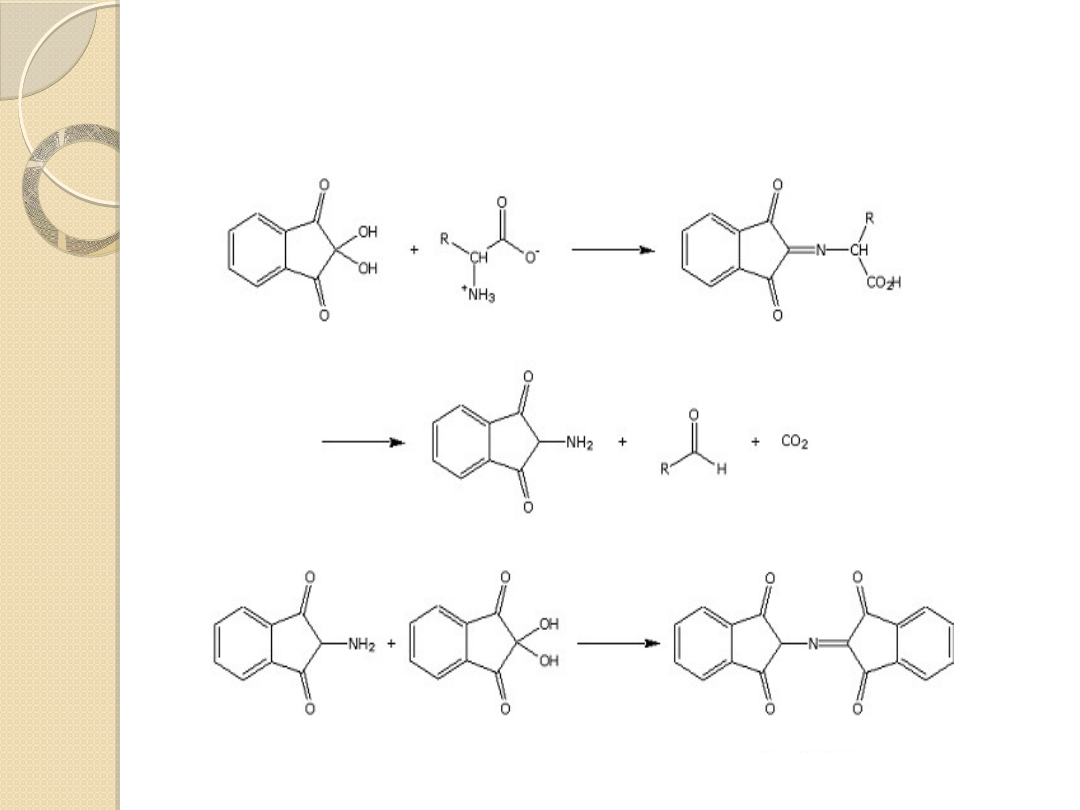
Reakcja ninhydrynowa

Aminokwasy budujące
białka
Białka buduje 20 podstawowych aminokwasów
Wszystkie aminokwasy białkowe oprócz glicyny
zawierają asymetryczny atom węgla, a zatem są
optycznie czynne: występują w postaci
enancjomerów
W białkach występują wyłącznie aminokwasy
wywodzące się od aldehydu L-glicerolowego: ich
konfigurację określamy jako L
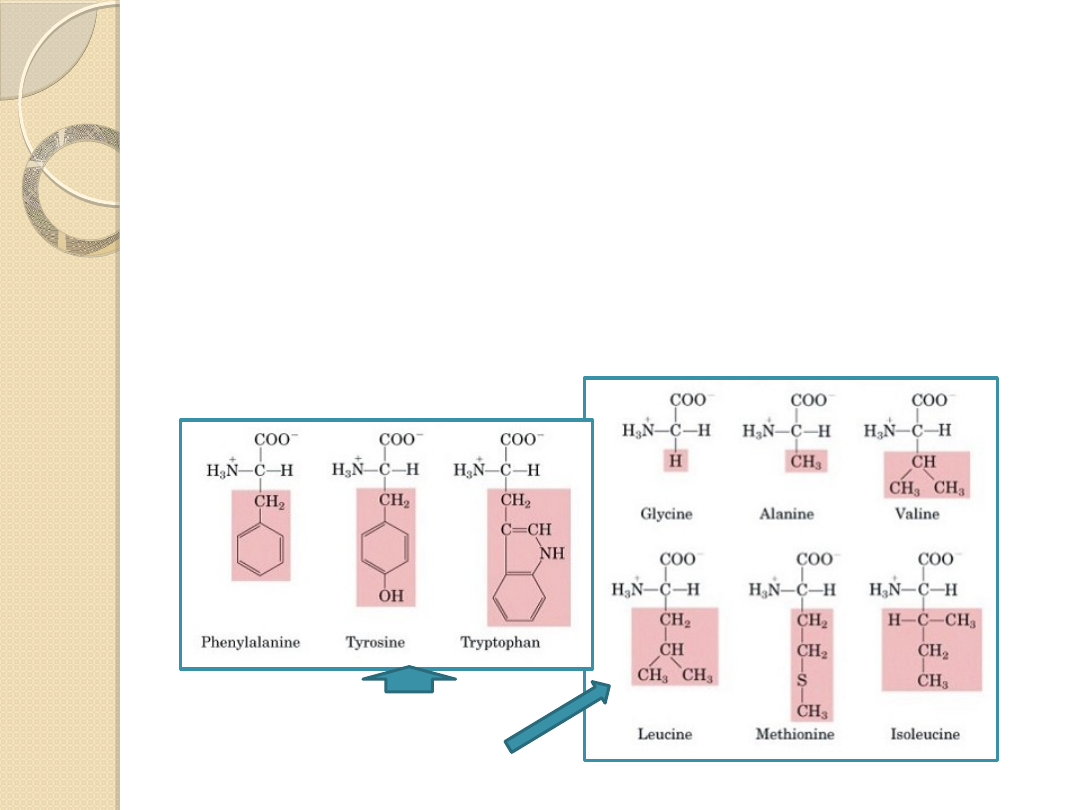
Aminokwasy niepolarne
Niepolarne (hydrofobowe) łańcuchy boczne
nie zawierają silnie elektroujemnych
pierwiastków
Reszty alkilowe rozgałęzione lub nie, reszty
arylowe (także tyrozyny i tryptofanu), reszta
z ugrupowaniem tioeterowym
aromatyczne
alifatyczne
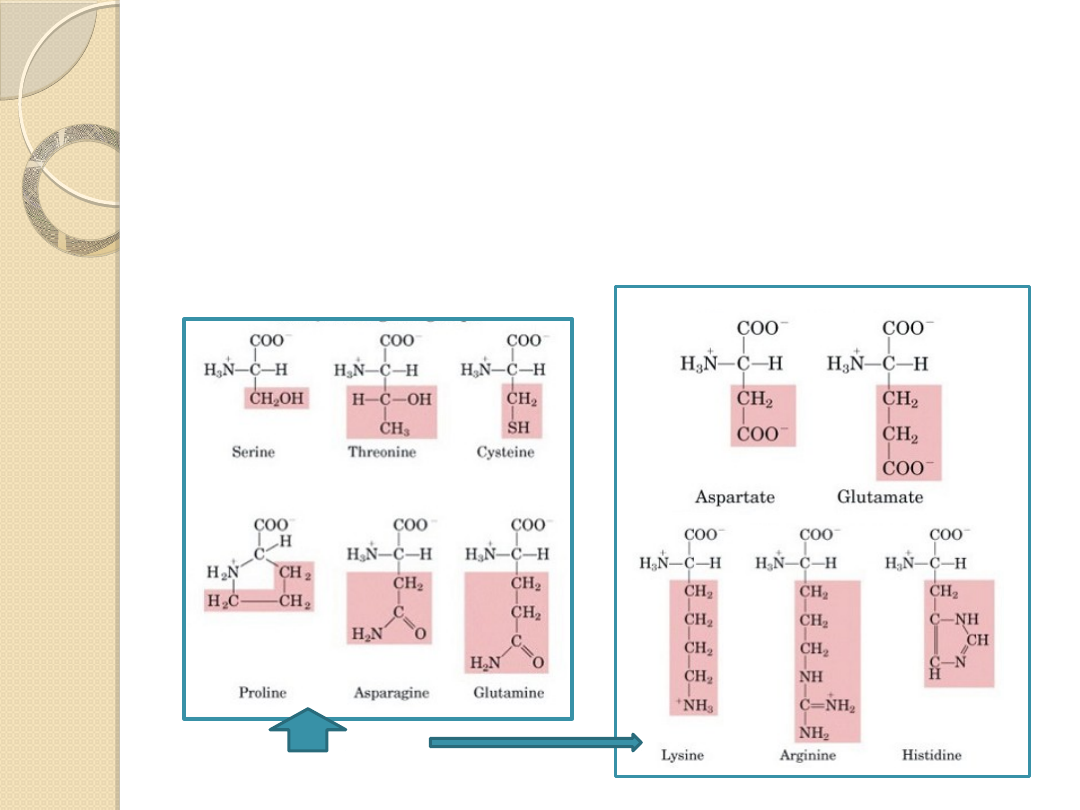
Aminokwasy polarne
Reszty polarne wykazują właściwości hydrofilowe
Mogą być naładowane dodatnio, ujemnie, lub nie
niosą ładunku, a polarność wynika z obecności grup
hydroksylowej, tiolowej lub amidowej
bez ładunku
z dodatkowym ładunkiem
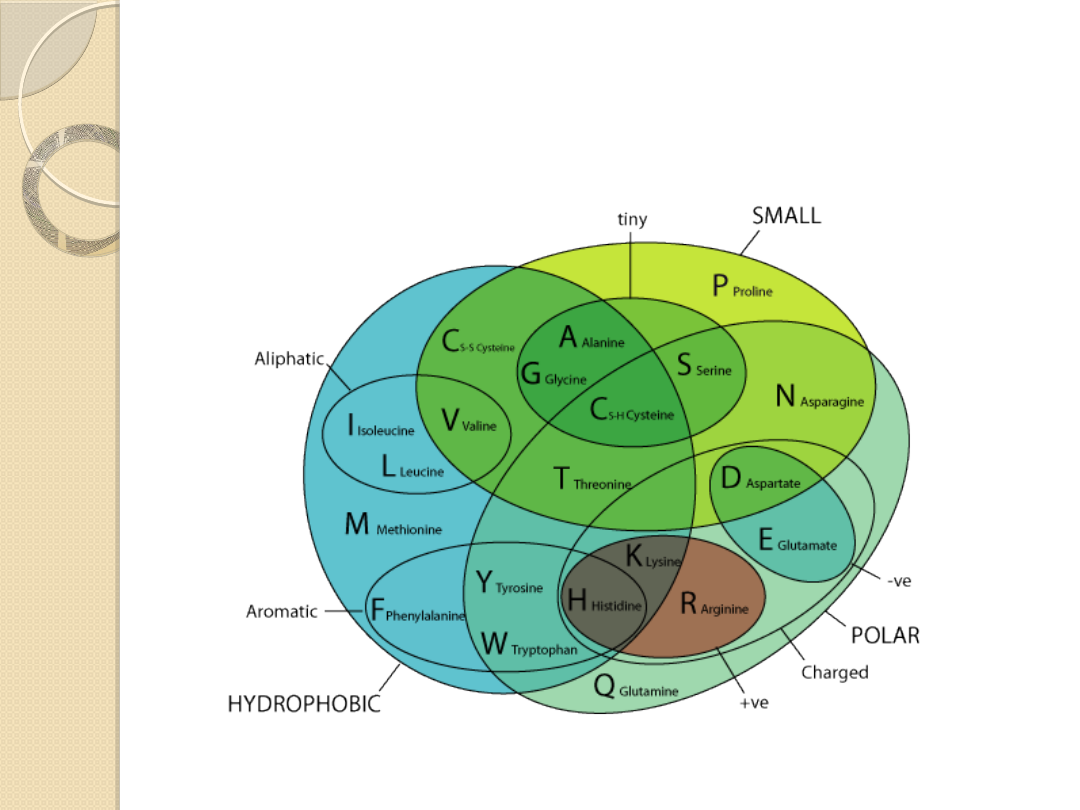
Aminokwasy - porównanie
właściwości
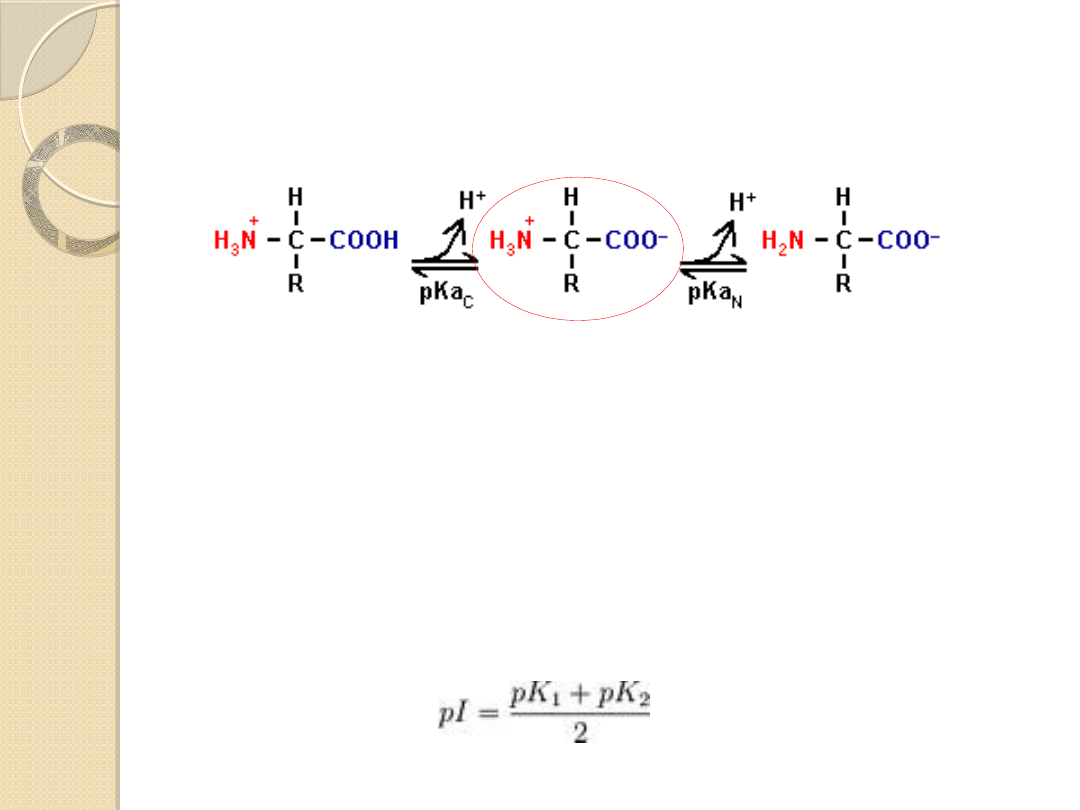
Właściwości amfoteryczne
aminokwasów
W środowisku bogatym w protony grupy funkcyjne
aminokwasów przyłączają je buforując roztwór, aminokwas
przyjmuje formę kationu
W środowisku zasadowym grupy funkcyjne aminokwasu
oddają protony do środowiska, a aminokwas przyjmuje formę
anionu
W pH równym średniej z wartości stałych dysocjacji grup
funkcyjnych liczba zdysocjowanych grup karboksylowych jest
równa liczbie grup aminowych w formie zjonizowanej −NH
3+
pI
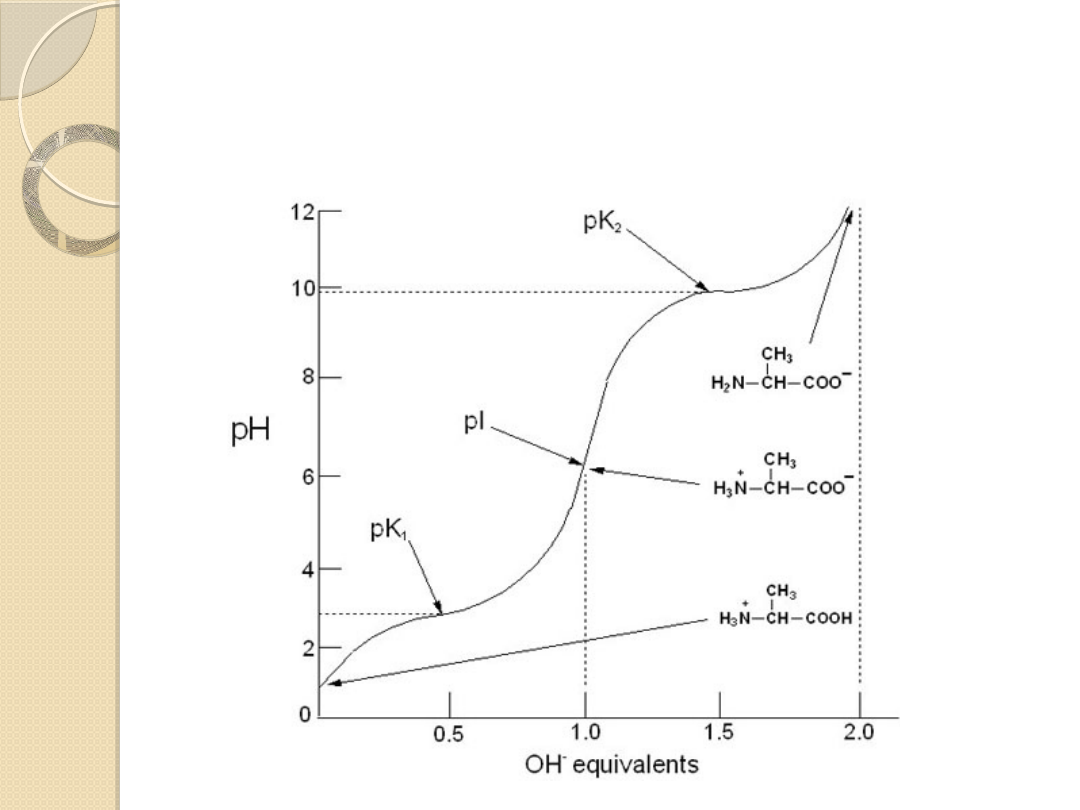
Właściwości buforujące alaniny
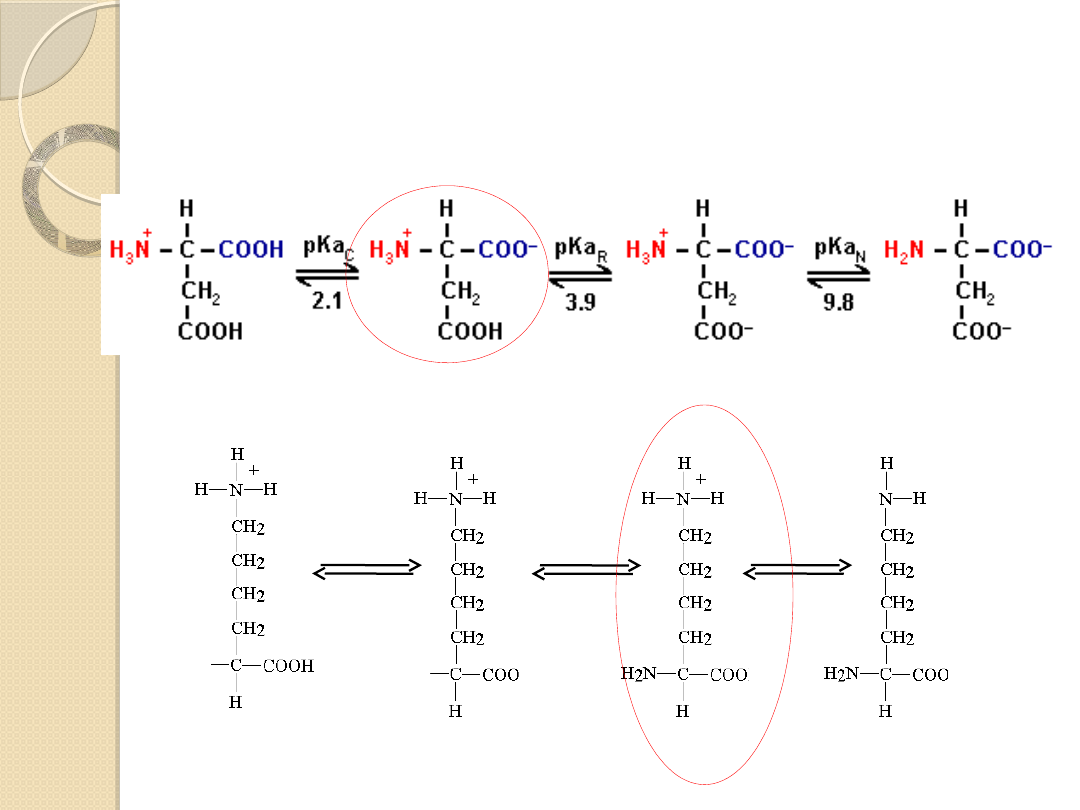
Formy jonowe aminokwasów
kwaśnych i zasadowych
+
H
3
N
+
H
3
N
−
−
−
pI=3
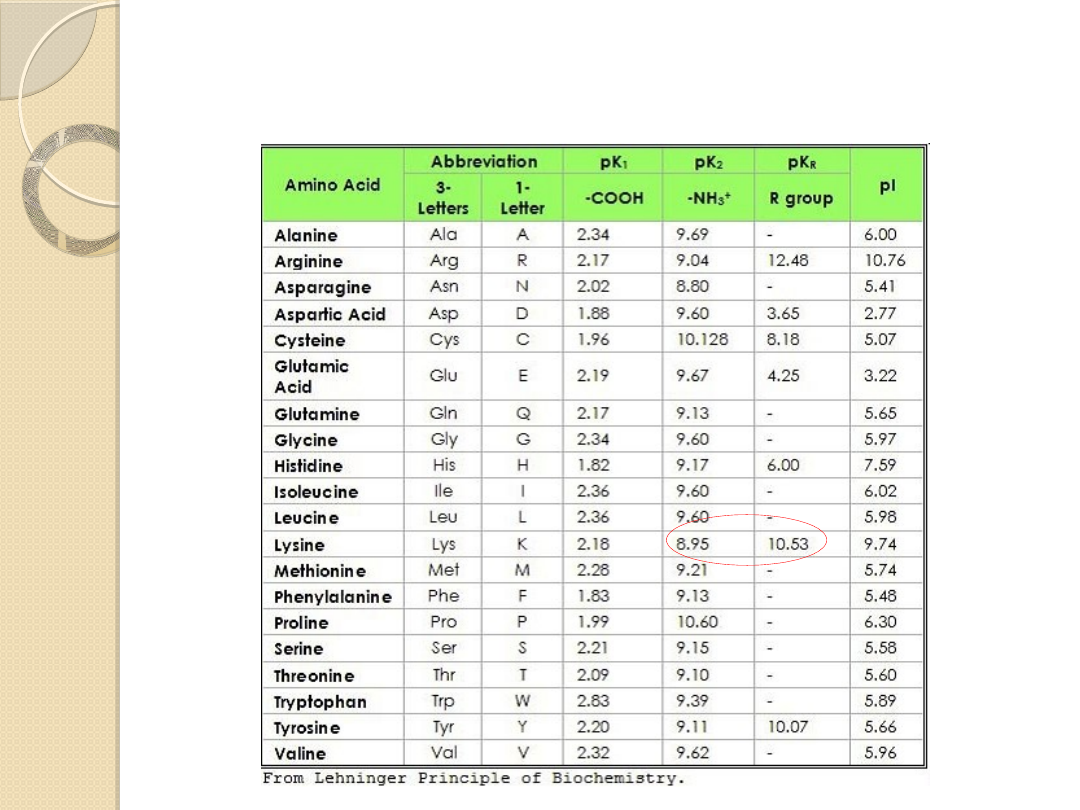
Punkt izoelektryczny

Aminokwasy egzogenne
i endogenne dla człowieka
Aminokwasy egzogenne
:
lizyna, metionina, leucyna, izoleucyna,
fenyloalanina, treonina, tryptofan,
walina, w okresie rozwoju histydyna
Aminokwasy endogenne
:
alanina, glicyna, aparagina,
glutamina, seryna, cysteina, prolina,
hydroksyprolina, arginina, tyrozyna

aminokwasy
niebiałkowe

Kwas -aminomasłowy
Inhibitor plazminy – przeciwdziała
fibrynolizie (stabilizuje skrzep krwi)
Neuroprzekaźnik, powoduje zmniejszenie pobudliwości,
rozluźnienie mięśni, niedobór: konwulsje, nawet śmierć
Kwas -aminokapronowy
H
2
N−CH
2
−CH
2
−CH
2
−CH
2
−CH
2
−COOH
H
2
N−CH
2
−CH
2
−CH
2
−COOH
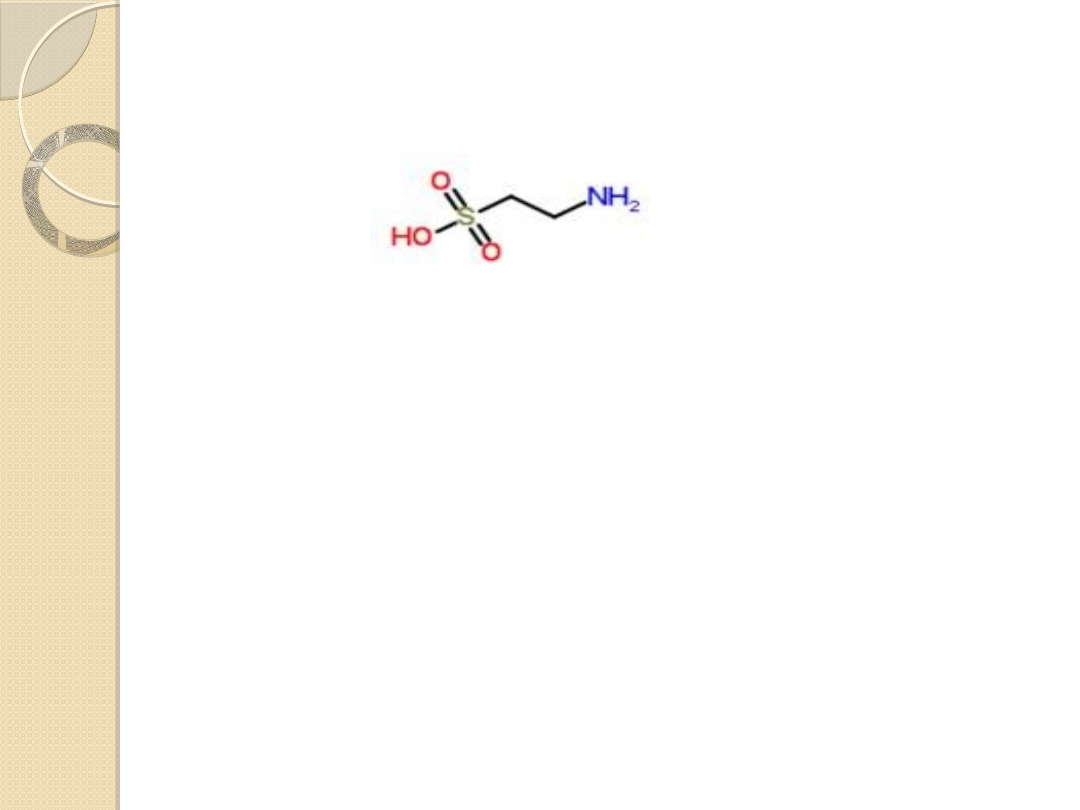
Tauryna
Tauryna jest produktem degradacji cysteiny
Funkcje w organizmie:
Sprzęganie kwasów żółciowych (tworzy się kwas taurocholowy)
zwiększa ich rozpuszczalność i zdolności emulgujące
Wspomaga transport kreatyny do mięśni, co poprawia
efektywność jej wykorzystania
Przyspiesza regenerację mięśni po wysiłku
Przypisuje się jej funkcje neuroprzekaźnika (wspomaga funkcje
poznawcze??)
Składnik napojów energetyzujących
Dla kotów jest aminokwasem egzogennym
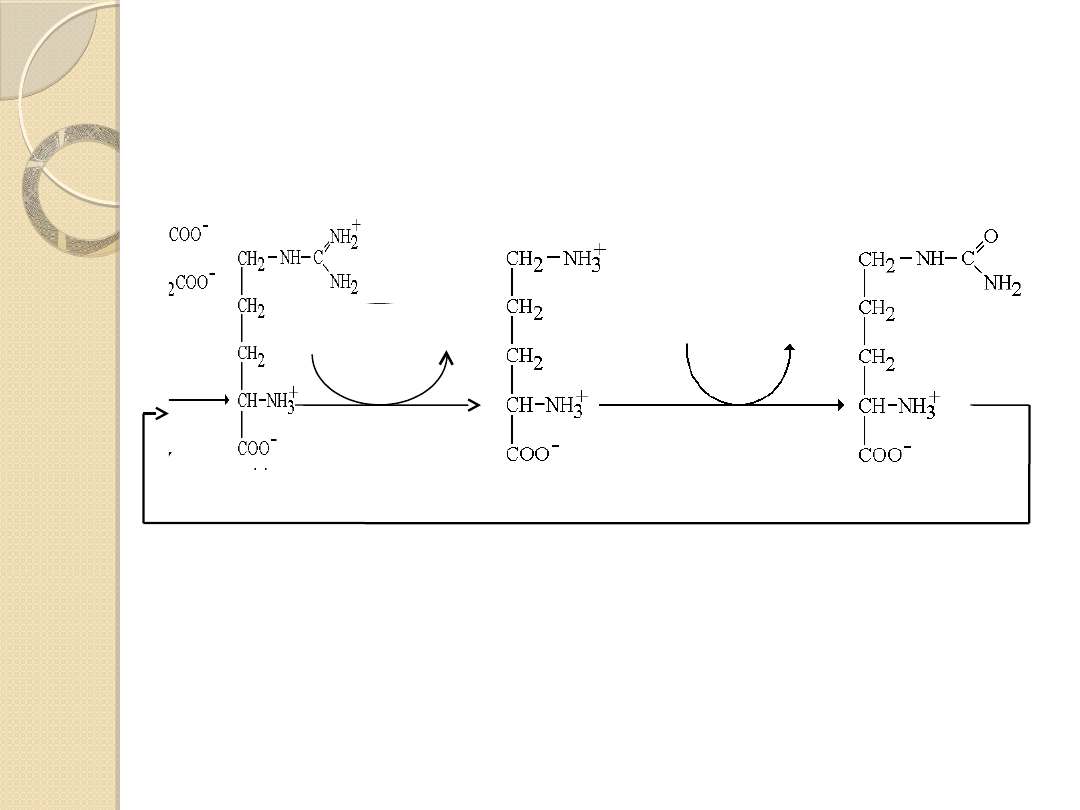
Cytrulina i ornityna: cykl
mocznikowy
Cytrulina jest homologiem lizyny
Cykl mocznikowy umożliwia usunięcie nadmiaru
związków azotowych w postaci mocznika
arginina cytrulina ornityna
H
2
O
OC(NH
2
)
2
CO
2
NH
2

aminy
biogenne
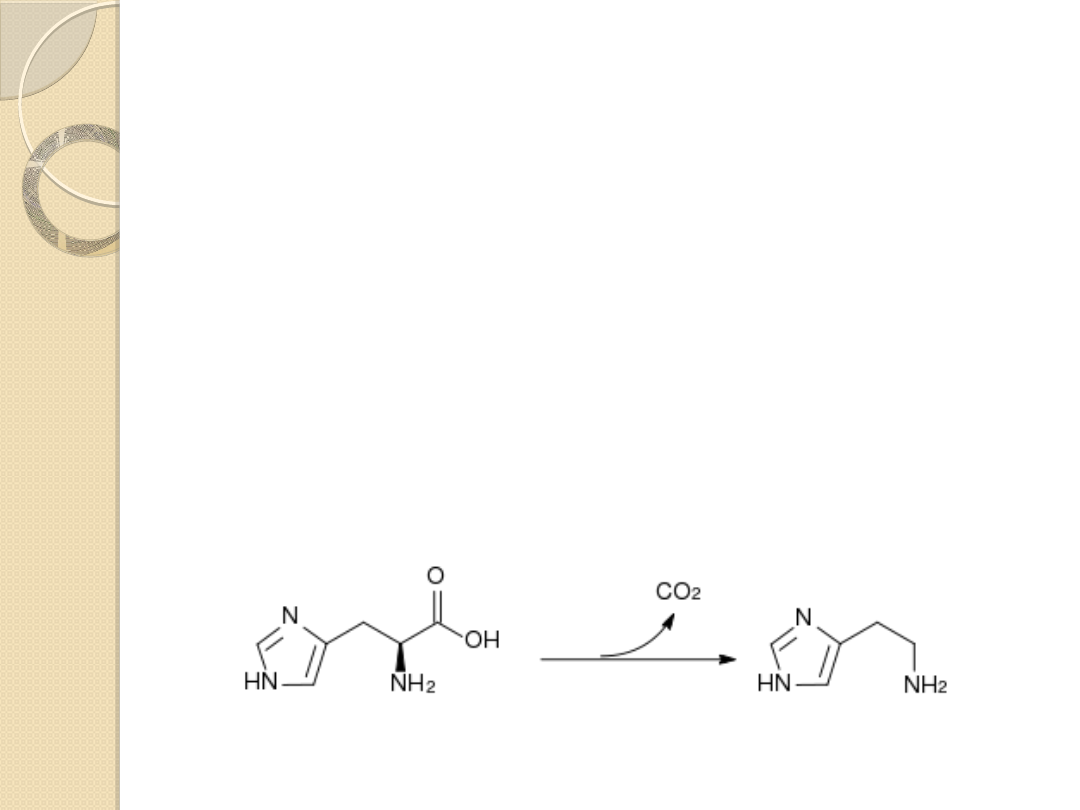
Aminy biogenne:
histamina
Aminy biogenne powstają w organizmie w wyniku
dekarboksylacji aminokwasów
Często pełnią funkcję neuroprzekaźników lub
hormonów
Histamina
jest magazynowana w ziarnistościach
granulocytów obojętnochłonnych i komórek tucznych i
uwalniana w reakcji zapalnej
Powoduje rozszerzenie naczyń krwionośnych, wzrost
ich przepuszczalności, skurcz mięśni gładkich oskrzeli
(astma), przewodu pokarmowego, macicy (zagrożenie
poronieniem u ciężarnych)
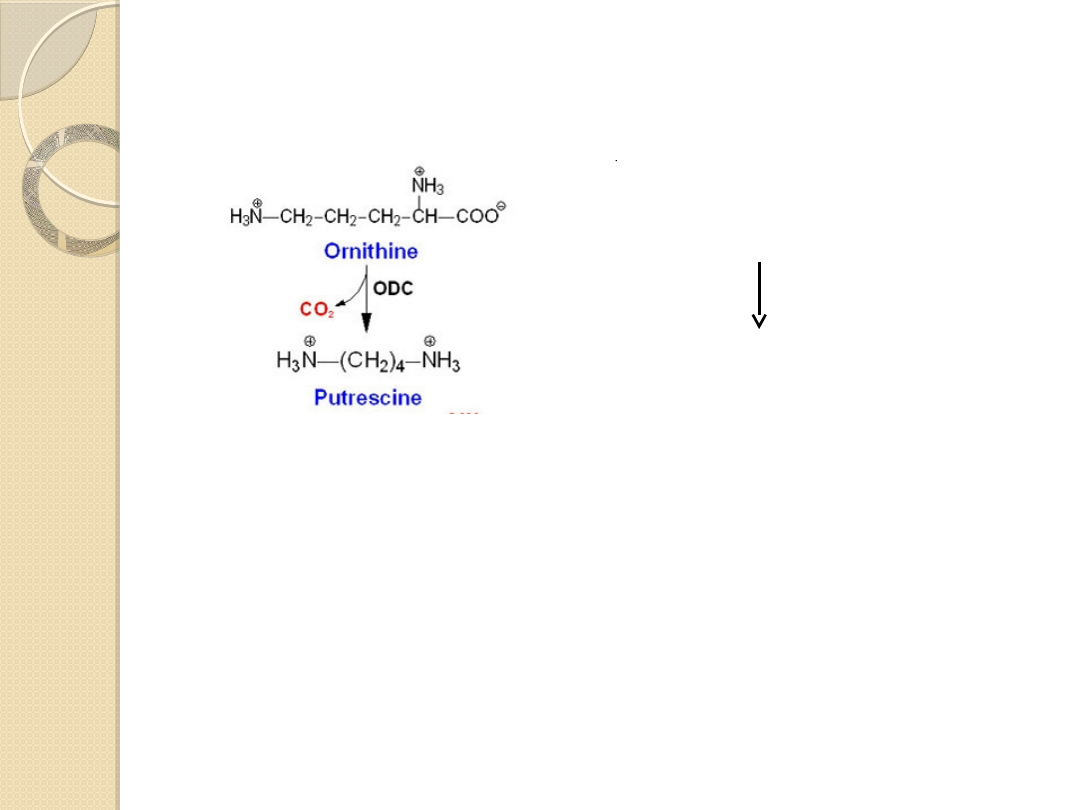
Putrescyna i kadaweryna
Należą do „jadów trupich”, powstają w
wyniku beztlenowego rozkładu białek pod
wpływem bakterii gnilnych
Putrescyna dimeryzuje do spermidyny i
polimeryzuje do sperminy, te poliaminy mają
znaczenie jako rezerwuary grup aminowych
lizyna
kadaweryna
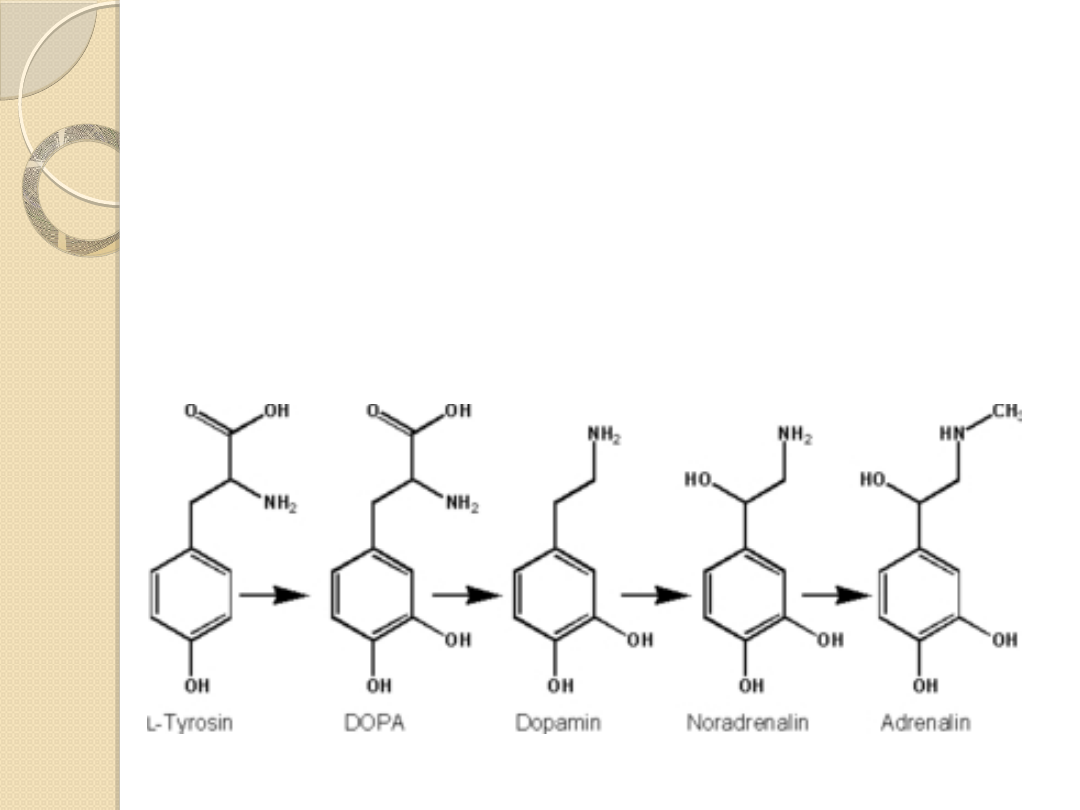
Katecholaminy: pochodne
tyrozyny
Neuroprzekaźniki, „hormony stresu”, wyzwalają
reakcję „uciekaj lub walcz”
Wzrost stężenia glukozy, ciśnienia krwi,
przyspieszenie akcji serca
Adrenalina – centralny układ nerwowy, noradrenalina
na obwodzie
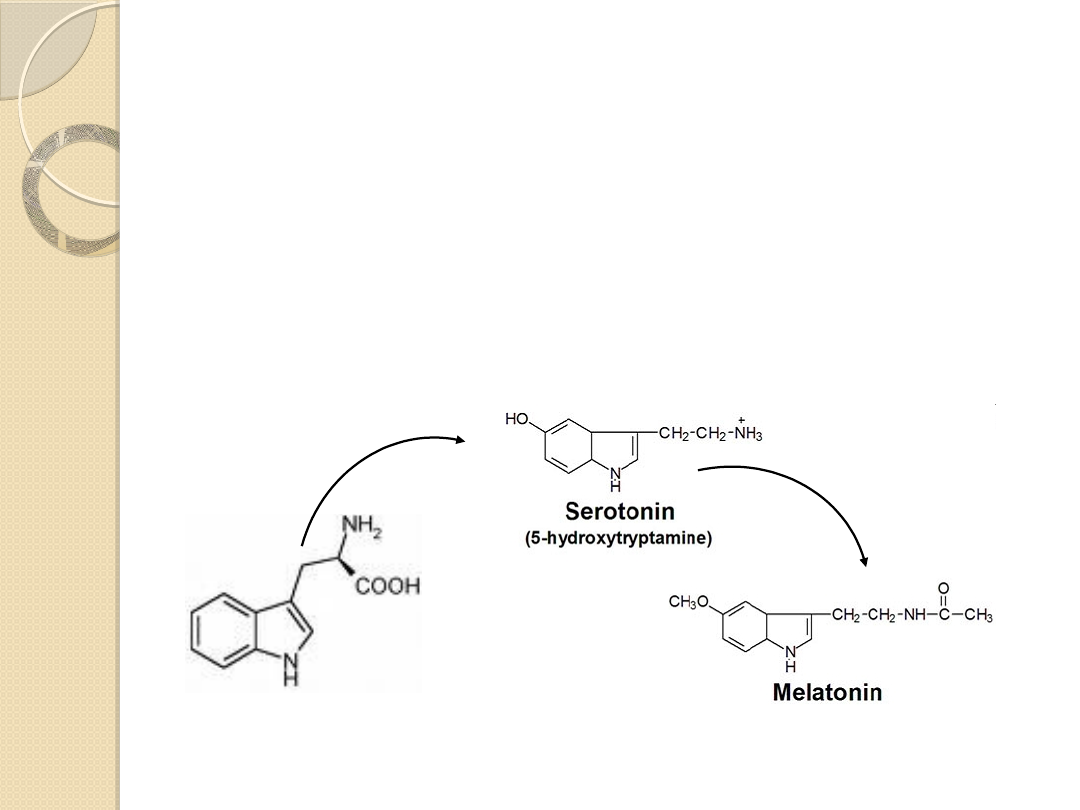
Tryptaminy
„hormony przyjemności”, związki psychoaktywne
Regulują sen, aktywność seksualną, apetyt
Stosowane jako antydepresanty; do tej grupy
związków należą niektóre narkotyki (LSD)
+ −OH
− CO
2
tryptofan

pepty
dy
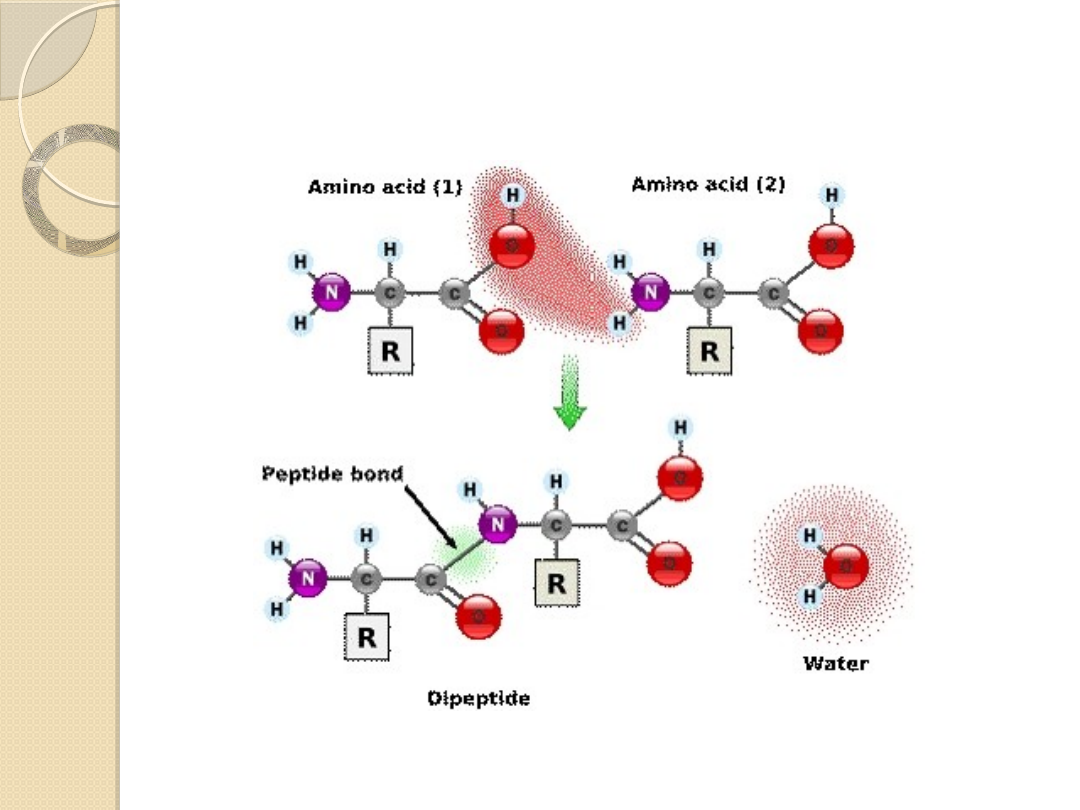
Wiązanie peptydowe
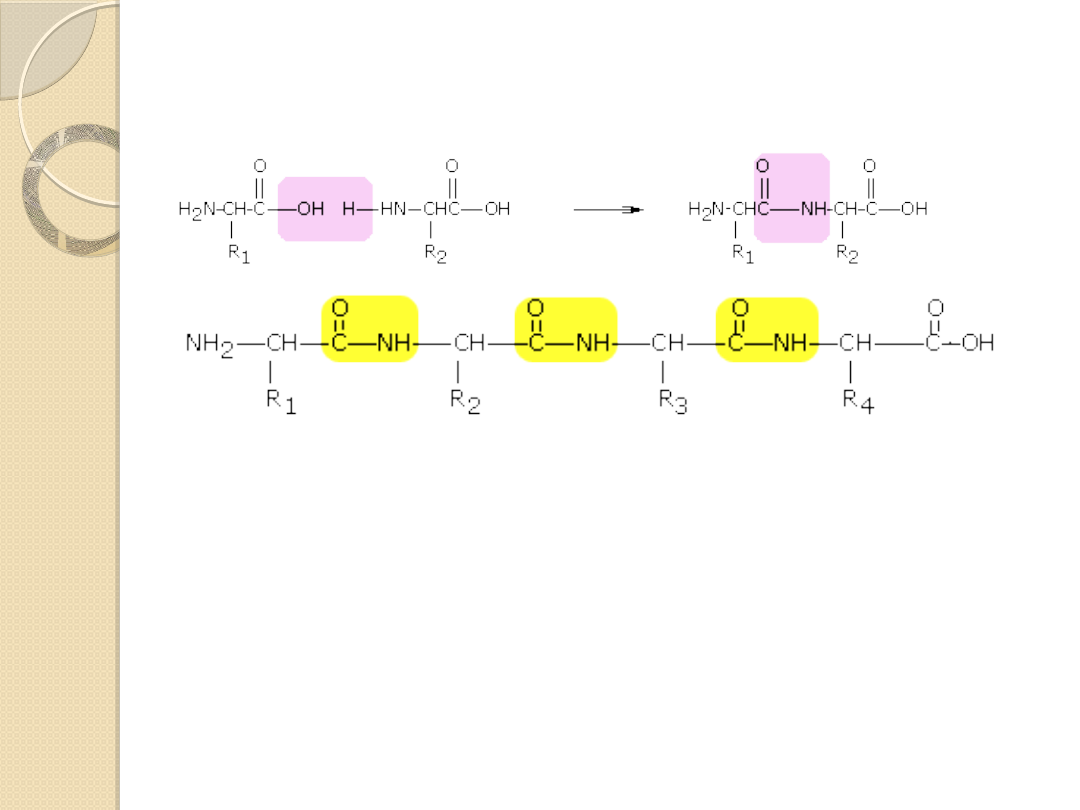
Peptydy
Wiązanie peptydowe powstaje między grupą karboksylową
jednego a aminową drugiego aminokwasu, ma charakter
wiązania amidowego
Reakcja nie zachodzi spontanicznie
Ukierunkowana synteza peptydu wymaga zablokowania jednej
z grup funkcyjnych
W praktyce syntezę prowadzi się immobilizując początkowy
aminokwas na nośniku, co jednocześnie blokuje późniejszą
grupę N-końcową
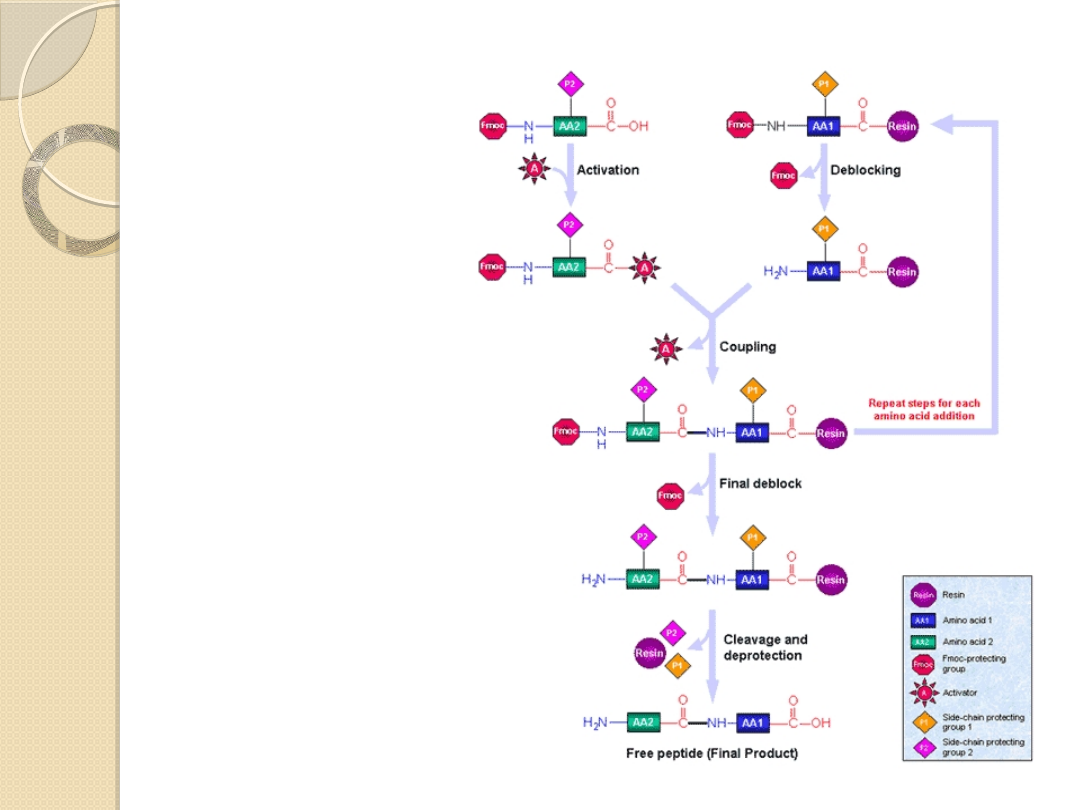
Synteza
peptydó
w
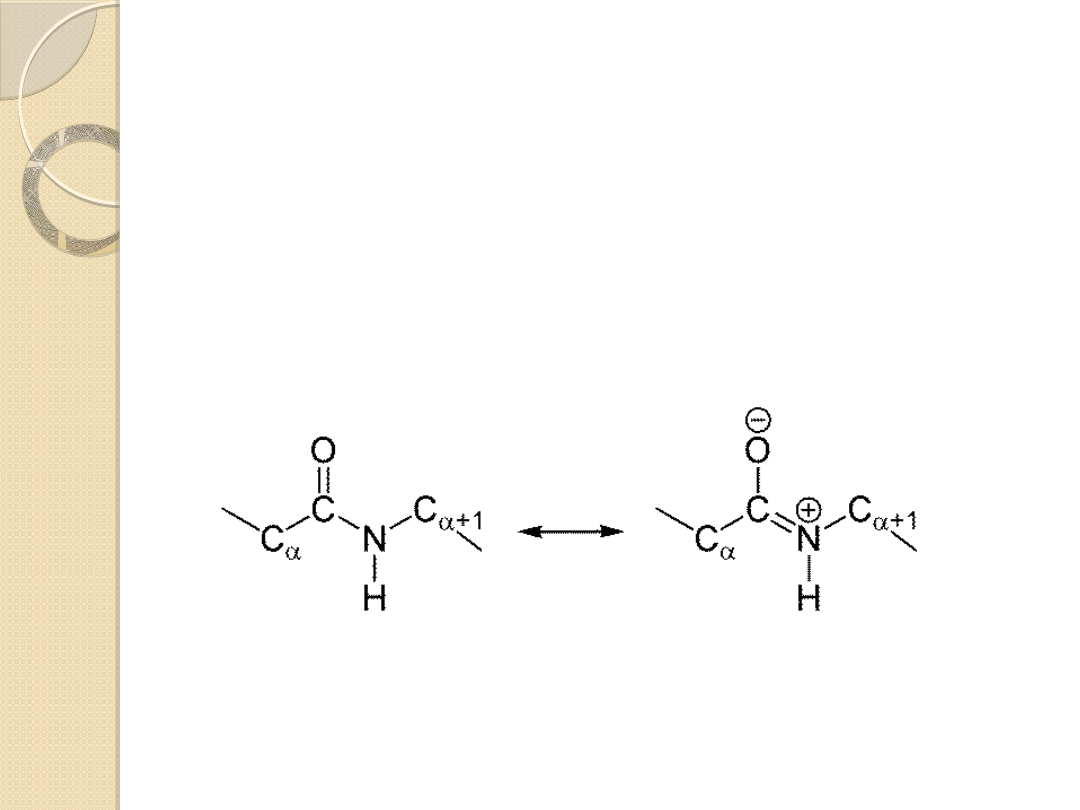
Wiązanie peptydowe
Cztery atomy ugrupowania peptydowego
leżą w jednej płaszczyźnie
Swoboda rotacji wokół wiązania −C−C− jest
ograniczona ze względu na istnienie struktur
mezomerycznych

Przykłady peptydów biologicznie
czynnych
Glutation
Glu-Cys-Gly
kontrola statusu redoks, antyutleniacz
Tyreoliberyna
tripeptyd, reguluje czynność tarczycy
Oksytocyna
Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH
2
wywołuje skurcze mięśni gładkich
Wazopresyna
Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly-NH
2

Peptydy opioidowe
Enkefaliny
Tyr-Gly-Gly-Phe-Leu Tyr-Gly-Gly-Phe-Met
Działanie przeciwbólowe i narkotyczne
Endorfiny
- endogenne morfiny
Zawierają około 30 aminokwasów, różnią się
między sobą długością łańcucha i
nieznacznie składem aminokwasowym
Document Outline
- Slide 1
- Aminy
- Aminy I-rzędowe
- Aminy II i III-rzędowe
- Rzędowość amin
- Właściwości fizyczne
- Właściwości zasadowe amin
- Właściwości chemiczne
- Właściwości chemiczne c.d.
- Slide 10
- Aminokwasy
- Reakcja ninhydrynowa
- Aminokwasy budujące białka
- Aminokwasy niepolarne
- Aminokwasy polarne
- Aminokwasy - porównanie właściwości
- Właściwości amfoteryczne aminokwasów
- Właściwości buforujące alaniny
- Formy jonowe aminokwasów kwaśnych i zasadowych
- Punkt izoelektryczny
- Aminokwasy egzogenne i endogenne dla człowieka
- Slide 22
- Kwas -aminomasłowy
- Tauryna
- Cytrulina i ornityna: cykl mocznikowy
- Slide 26
- Aminy biogenne: histamina
- Putrescyna i kadaweryna
- Katecholaminy: pochodne tyrozyny
- Tryptaminy
- Slide 31
- Wiązanie peptydowe
- Peptydy
- Synteza peptydów
- Wiązanie peptydowe
- Przykłady peptydów biologicznie czynnych
- Peptydy opioidowe
Wyszukiwarka
Podobne podstrony:
Aminy i aminokwasy, chemia, GIMNAZJUM
Aminy i aminokwasy
Chemia Aminy i Aminokwasy mini
AMINY I AMINOKWASY
8 aminy,aminokwasy
chemia ściąga aminy, aminokwasy
VIII Aminy i aminokwasy
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
Aminokwasy Aminy Kwasy nukelinowe Białka
2 14 Organiczne związki z azotem(aminy, amidy, aminokwasy, biaka)
Klucz do testu Aminy, amidy, aminokwasy, białka i sacharydy(1)
2 14 Organiczne związki z azotem(aminy, amidy, aminokwasy, biaka)
aminokwasy
AMINOKWASY 7
Aminy analityka
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
8a Syntezy prostych aminokwasów
więcej podobnych podstron