
Mechanizm reakcji enzymatycznej. Regulacja
aktywności enzymu przez sprzężenie zwrotne i
jej przykłady w organizmie człowieka

Mechanizm działania
enzymów
• Enzymy pełnią rolę biokatalizatorów
w reakcjach chemicznych. Są one
zdolne do przyspieszania reakcji,
którym towarzyszy spadek energii
swobodnej (reakcje samorzutne).
-ΔG=ΔH-TΔS

Mechanizm działania
enzymów
• Enzym (E) tworzy przejściowy
kompleks (ES) z substratem (S) i
obniża energię aktywacji reakcji
chemicznej. Dzięki temu wytwarzanie
produktów zachodzi znacznie szybciej.
E+S
↔
ES
E+P
• Enzym nie zużywa się podczas reakcji,
tylko łączy się z kolejnymi
cząsteczkami substratu.
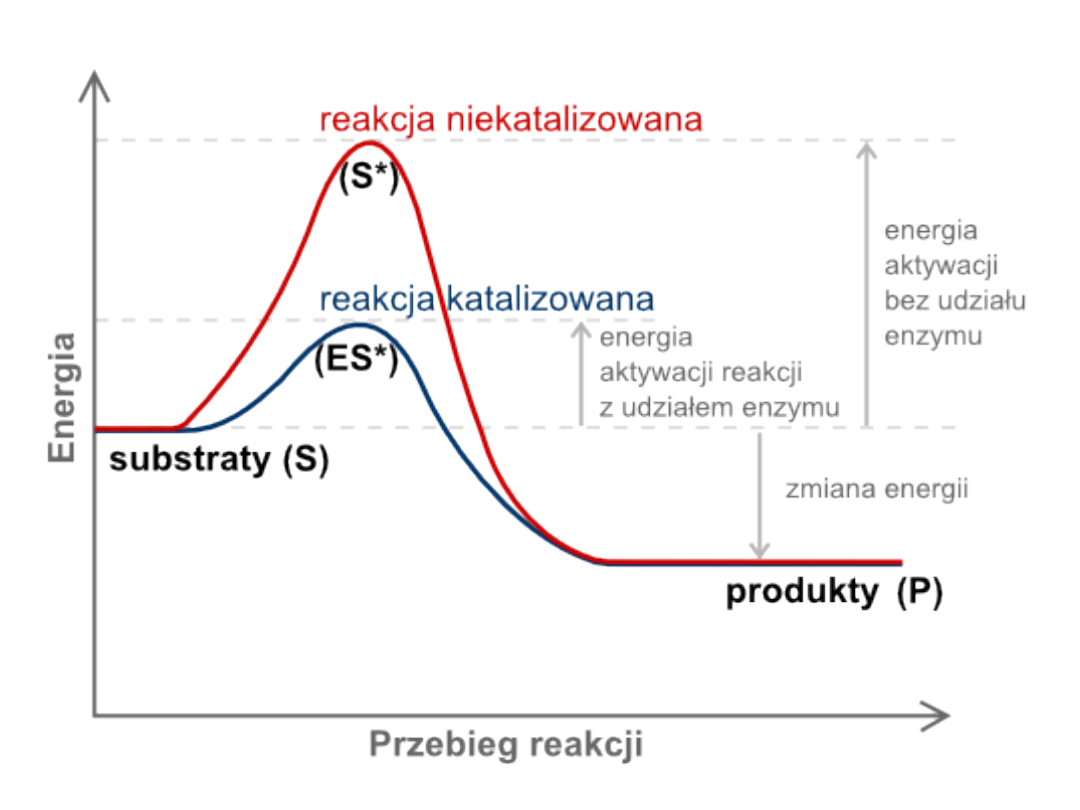

Mechanizm reakcji enzymatycznej
na przykładzie chymotrypsyny
• Chymotrypsyna jest enzymem proteolitycznym,
który hydrolizuje wiązania peptydowe położone w
głębi łańcucha białkowego, co prowadzi do
fragmentacji substratu na peptydy o różnej
długości.
• Jej reakcja z octanem p-nitrofenylu pozwala na
badanie mechanizmu działania enzymów.
Fenol H20 Ac-
CT+PNPA CT-PNPA ↑ CT-Ac ↓→↑→ CT
• Centrum aktywne chymotrypsyny: seryna 195,
histydyna 57 i asparaginian 102.

• Podczas reakcji Ser 195 ulega
acylacji. Zbliżeniu anionu
octanowego do grupy –OH seryny
wyzwala reakcję przeniesienia
protonu z seryny poprzez His 57 na
Asp 102. Zwiększa to reaktywność
tlenu seryny.
• Podczas decylacji produktu
pośredniego acylo-Ser 195 protony
przekazywane są w kierunku
przeciwnym.

Mechanizm kwasowo-
zasadowy
• Łańcuchy boczne (obdarzone ładunkiem elektrycznym
reszt) aminokwasowych w pobliżu miejsca wiązania
substratu przez enzym mogą działać na zasadzie
katalizatorów kwasowych lub zasadowych.
• Są dwa rodzaje katalizy enzymatycznej kwasowo-
zasadowej: swoista i ogólna.
• Swoista – szybkość zmienia się wraz ze zmianą
stężenie H
3
O
+
;jest niezależna od stężenia innych
kwasów lub zasad w roztworze.
• Ogólna – szybkość jest uzależniona od wszystkich
kwasów i zasad w roztworze.
S+H
3
O
+
↔ SH
+
+H
2
O
SH
+
+H
2
OP+H
3
O
+

Regulacja aktywności enzymów
przez sprzężenie zwrotne
• Jeśli enzym produkuje jedną
substancję ponad potrzeby komórki,
to ta substancja może stać się
inhibitorem dla tego enzymu, co
zmniejsza lub całkowicie hamuje
aktywność enzymu, co z kolei
zmniejsza stężenie produktu. Taka
regulacja jest formą ujemnego
sprzężenia zwrotnego.
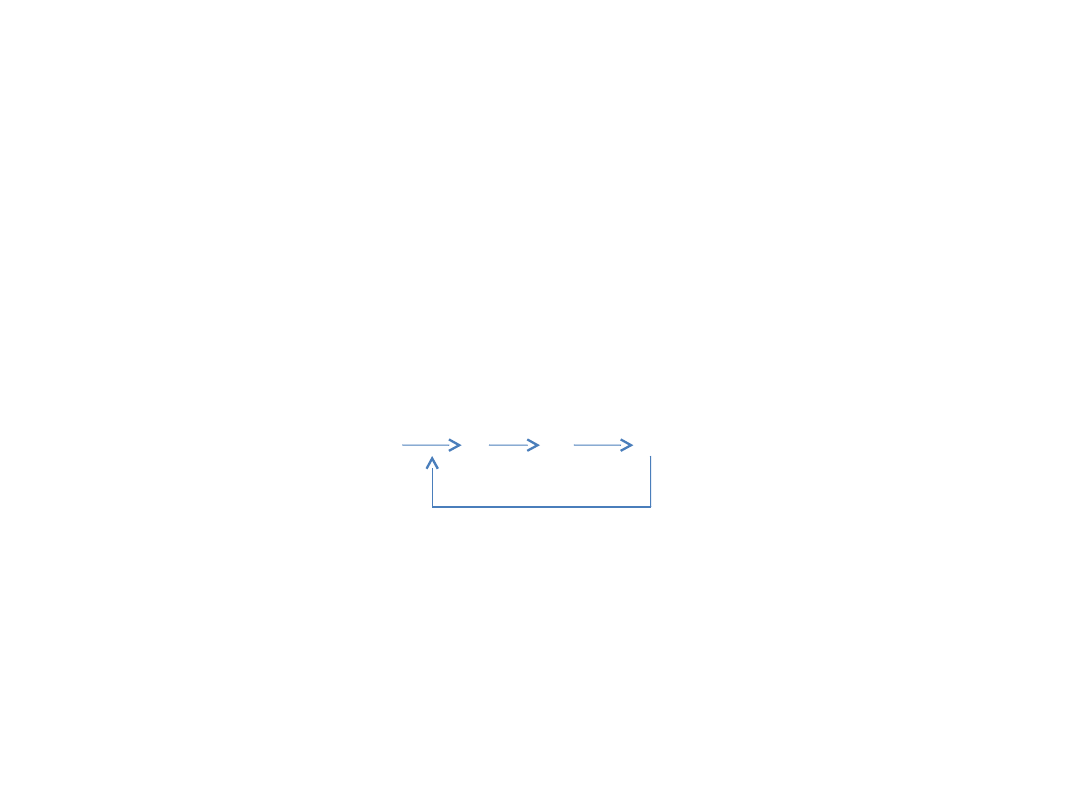
Hamowanie przez sprzężenie
zwrotne
• Enzym działający w pierwszym etapie
szlaku biosyntetycznego zazwyczaj jest
hamowany przez produkt końcowy tego
szlaku.
enz1 enz2 enz3
A B C D
Związek D działa jako ujemny efektor allosteryczny lub inhibitor
zwrotny Enz1, dzięki czemu regulowane jest stężenie związku
D. Związek D łączy się zwykle z miejscem allosterycznym,
różnym od miejsca katalitycznego enzymu.
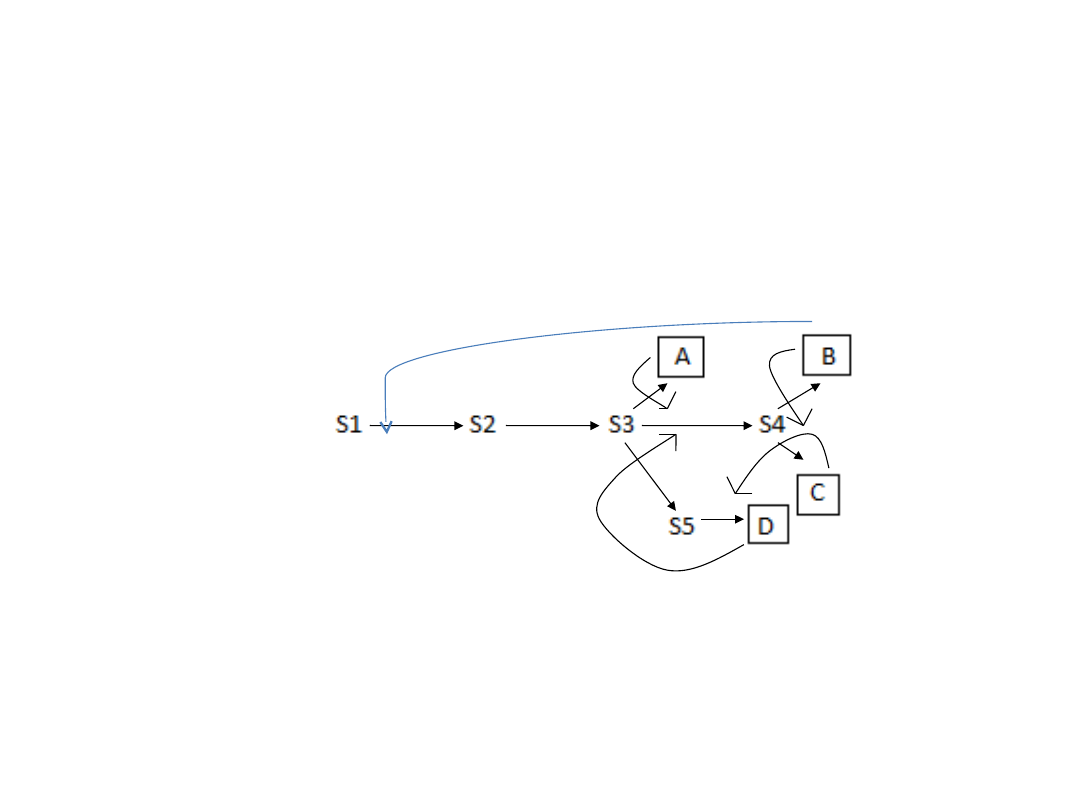
Hamowanie w szlaku rozgałęzionym
• W szlakach rozgałęzionych początkowe produkty
są wykorzystywane do wytworzenia dwóch lub
więcej nowych związków.
Przykładowo, jeśli związek B hamuje część szlaku
odpowiedzialną nie tylko za swoją biosyntezę, lecz
wspólną z innymi produktami to cały szlak może
zostać zahamowany.

Temu niechcianemu efektowi zapobiegają następujące
mechanizmy:
• Kumulatywne hamowanie przez sprzężenie zwrotne -
hamujący wpływ dwóch lub więcej produktów
końcowych na jeden enzym regulujący jest sumą
skutków wywoływanych przez każdy z tych produktów
niezależnie.
• Zgodne (wielowartościowe) hamowanie przez
sprzężenie zwrotne – całkowite zahamowanie szlaku
następuje jedynie wtedy, gdy jednocześnie dwa lub
więcej produktów jest obecnych w nadmiarze.
• Kooperatywne hamowanie przez sprzężenie zwrotne -
jeden końcowy produkt występujący w nadmiarze
hamuje enzym regulacyjny. Jednak w obecności dwóch
lub więcej produktów końcowych stopień hamowania
znacznie przewyższa sumaryczny efekt
kumulatywnego hamowania przez sprzężenie zwrotne.

Przykłady:
• Podczas syntezy cholesterolu: następuje
na początku szlaku biosyntezy, na etapie
reduktazy HMG-CoA. Jest ona hamowana
przez mawelonian, który jest
bezpośrednim produktem reakcji syntezy
HMG-CoA, oraz przez cholesterol. Uważa
się, że działa on represyjnie na
transkrypcję genu reduktazy HMG-CoA
• Podczas syntezy nukleotydów
pirymidynowych.
Document Outline
- Slide 1
- Mechanizm działania enzymów
- Mechanizm działania enzymów
- Slide 4
- Mechanizm reakcji enzymatycznej na przykładzie chymotrypsyny
- Slide 6
- Mechanizm kwasowo-zasadowy
- Regulacja aktywności enzymów przez sprzężenie zwrotne
- Hamowanie przez sprzężenie zwrotne
- Hamowanie w szlaku rozgałęzionym
- Slide 11
- Przykłady:
Wyszukiwarka
Podobne podstrony:
Mechanizm reakcji enzymatycznej
Mechanizmy i stereochemia reakcji enzymatycznej
06 Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych I
Wyznaczanie parametrów kinetyki reakcji enzymatycznej za pomocą metod polarymetrycznych 5x
biol-cykl mocznikowy, Cykl mocznikowy jest sekwencją reakcji enzymatycznych w toku których grupy ami
KINETYKA REAKCJI ENZYMATYCZNYCH
Wpływ aktywatorów i inhibitorów na szybkość reakcji enzymatycznej
Mechanizm katalizy enzymatycznej
Reakcje enzymatyczne
Kinetyka reakcji enzymatycznej m poteraj
Enzymy 3 Wprowadzenie do reakcji enzymatycznych
12 MECHANIZM KATALIZY ENZYMATYCZNEJ
Typy i mechanizmy reakcji związków organicznych
Kinetyka reakcji enzymatycznych Nieznany
więcej podobnych podstron