
Enzymologia-5
Określanie mechanizmów reakcji enzymatycznych

Najważniejsze metody badania mechanizmów reakcji
1. Określanie struktury enzymu
2. Modyfikacja chemiczna enzymu
3. Ukierunkowana mutageneza genu kodującego enzym
4. Detekcja intermediatów reakcji enzymatycznej
5. Badanie kinetyki reakcji enzymatycznej
Zastosowanie badań strukturalnych do określania
mechanizmów reakcji
Metody: niskotemperaturowa rentgenografia strukturalna, NMR
Szczególne znaczenie – określanie struktury kompleksu enzymu
z analogiem substratu lub analogiem stanu przejściowego
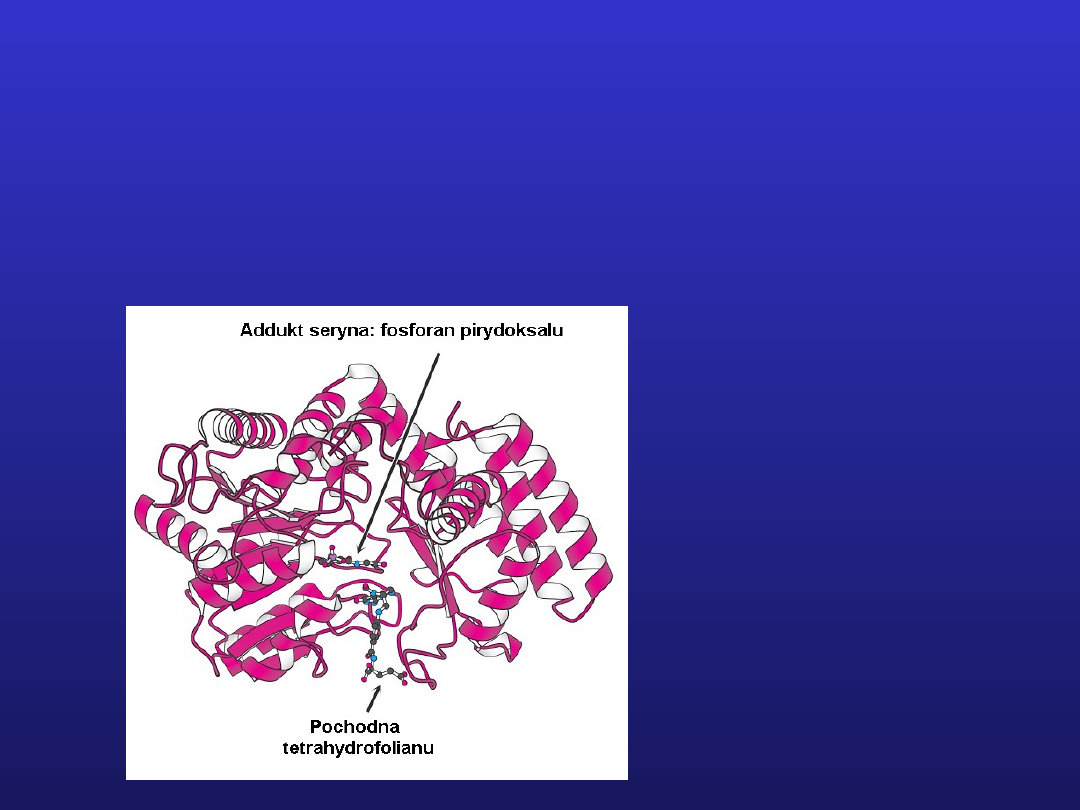
Struktura kompleksu
hydroksymetylotransferazy
serynowej z adduktem
substratu z koenzymem
oraz analogiem drugiego
substratu

Reakcja katalizowana
przez karbamoilotransferazę
asparaginianową
Analog stanu przejściowego
C
O
O
_
_
N
CH
CH
2
C
O
O
P
O
O
O
O
C
NH
2
O
-
_
H
N-fosfonoacetylo-L-asparaginian (PALA)
L-asparaginian
Karbamylofosforan
C
O
O
_
_
H
2
N
CH
CH
2
C
O
O
P
O
O
O
O
C
O
NH
2
_
P
O
C
O
O
C
O
N
CH
CH
2
C
O
O
C
O
O
H
2
H
_
_
_
Stan przejściowy
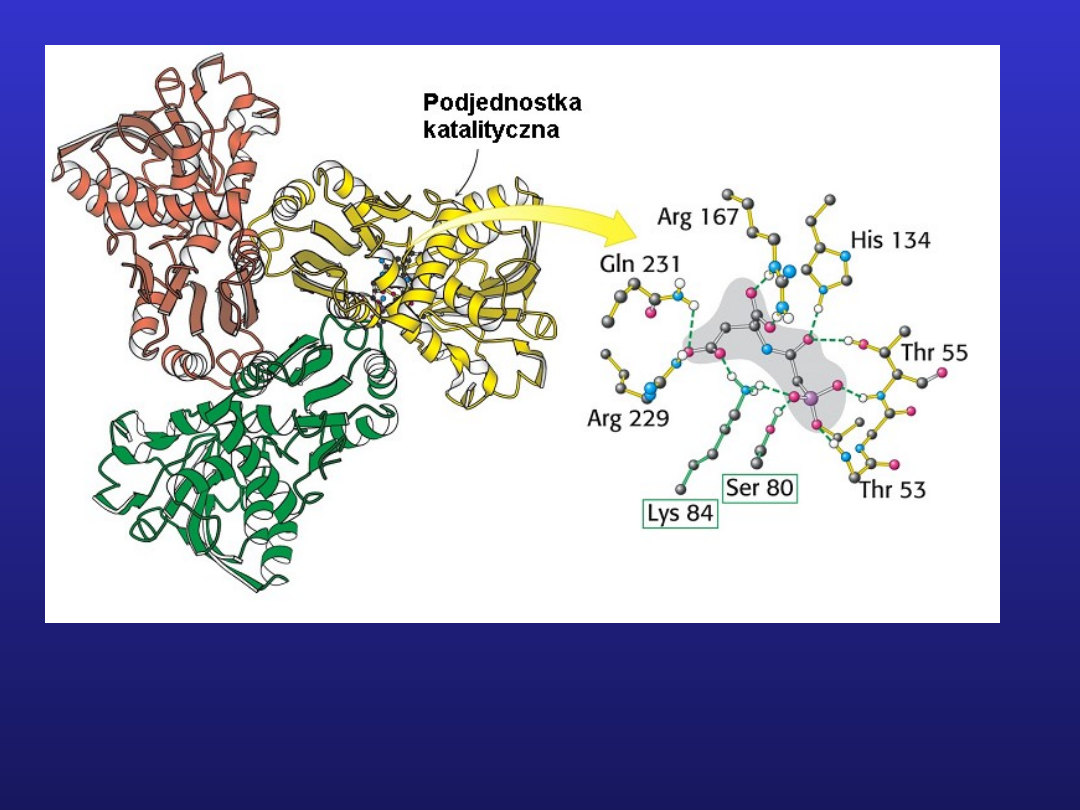
Struktura kompleksu karbamoilotransferazy asparaginianowej z PALA

MODYFIKACJE CHEMICZNE ENZYMU
Działanie na enzym związkiem chemicznym powodującym inaktywację
Dwa podejścia:
- odczynniki specyficzne wobec grup funkcyjnych określonych reszt
aminokwasowych;
- analogi substratu lub stanu przejściowego reakcji enzymatycznej
zawierające reaktywne ugrupowania chemiczne (ang. affinity labeling)
Cechy odczynnika modyfikującego:
• selektywne zablokowanie określonej grupy funkcyjnej
• charakter lokalny zmiany
• ograniczenie zawady przestrzennej

MODYFIKACJE CHEMICZNE ENZYMU
Pojęcie reszty istotnej dla aktywności enzymu
- modyfikacja chemiczna reszty powoduje całkowitą utratę aktywności przez
enzym;
- stechiometria inaktywacji 1 : 1;
- substrat lub inhibitor kompetytywny chronią enzym przed inaktywacją
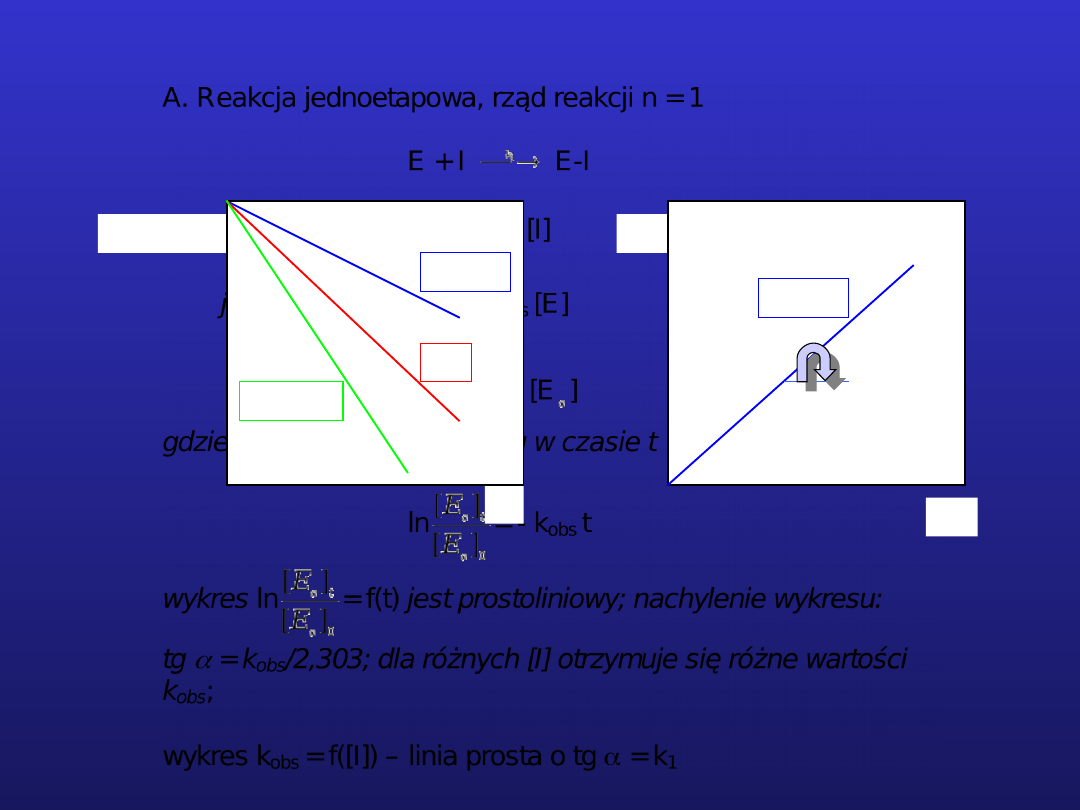
Kinetyka inaktywacji enzymu
ln[E
a
]
t
/
[E
a
]
o
t
[I
o
]
[I] >
[I
o
]
[I] <
[I
o
]
k
obs
[I]
tg =
k
1

B. Reakcja jednoetapowa, rząd reakcji n 1
E + n I
1
k
E-nI
k
obs
= k
1
[I]
n
wykres k
obs
= f([I]) nie jest linią prostą; wyznaczanie rzędowości
reakcji z wykresu:
log k
obs
= n log [I] + log k
1
k
obs
[I
]

C . R e a k c j a d w u e t a p o w a
v = k
2
[ E I ] ; K
i n a k t
=
1
1
k
k
w s t a n i e r ó w n o w a g i , g d y k
2
k
- 1
, t o :
k
o b s
=
1
1
2
1
]
[
]
[
k
I
k
I
k
k
w y k r e s k
o b s
= f ( [ I ] ) j e s t h i p e r b o l ą .
N a t o m i a s t :
obs
k
1
=
]
[
1
I
2
k
K
inakt
+
2
1
k
,
c z y l i w y k r e s :
obs
k
1
= f (
]
[
1
I
) j e s t p r o s t o l i n i o w y .
A l t e r n a t y w n i e , w p r o w a d z a j ą c : = l n 2 / k
o b s
o r a z T = l n 2 / k
2
,
o t r z y m u j e m y :
=
]
[
1
I
T K
i n a k t
+ T ,
c z y l i w y k r e s = f (
]
[
1
I
) j e s t p r o s t o l i n i o w y .
Z p r o s t o l i n i o w y c h w y k r e s ó w m o ż n a w y z n a c z y ć w a r t o ś c i : K
i n a k t
,
k
2
o r a z T .
k
1
k
-1
E + I
E I
2
k
E - I
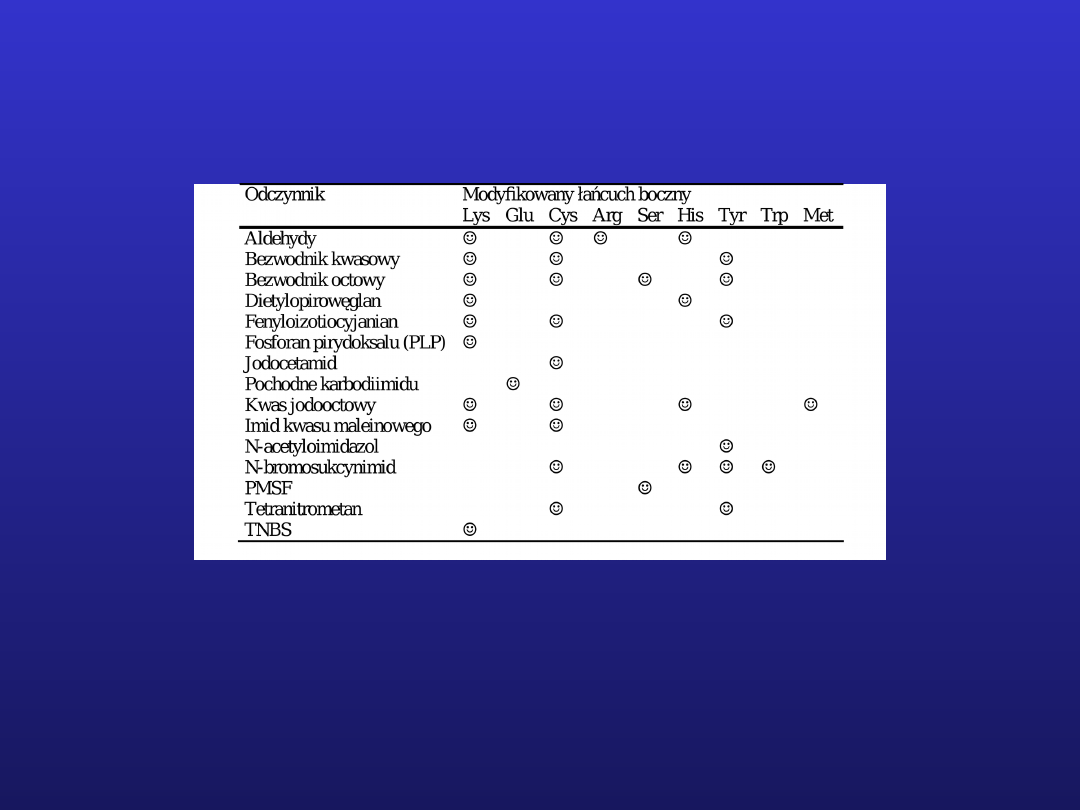
Odczynniki reagujące specyficznie z łańcuchami bocznymi niektórych
reszt aminokwasowych.

E
SH +
I CH
2
C
O
NH
2
CH
2
C
O
NH
2
S
E
E
SH +
N
O
O
CH
2
CH
3
E
S
N
O
O
CH
2
CH
3
MODYFIKACJE CHEMICZNE ENZYMU
Odczynniki ukierunkowane na reszty cysteinylowe
A. -halogenooctany i -halogenoacetamidy
Warunki: pH
7; labilne w roztworach wodnych; reaktywność I>Br>>Cl;
dla jodopochodnych rekcję należy prowadzić w ciemności
B. N-podstawione imidy kwasu maleinowego
Warunki: pH
7; możliwość śledzenia zaniku absorpcji przy = 302 nm;
dla NEM
= 620 M
-1
cm
-1

E
SH +
E
S
N
C
E
S
COO
S
NO
2
-
OOC
O
2
N
S C N
-
E
SH +
-
OOC
O
2
N
S
-
COO
NO
2
S
E
S
COO
S
NO
2
-
+
COO
S
NO
2
-
-
pH>7
C. Kwas 2-nitro-5-tiocyjanobenzoesowy
Warunki: pH = 8.0; niezbyt duże nadmiary molowe odczynnika (1,5
do 2 );
dla wytworzonej S-cyjanopochodnej
max
= 330 nm,
= 7500 M
-1
cm
-1
D. Odczynnik Ellmana – kwas 5,5’-ditiobis(5-nitrobenzoesowy)
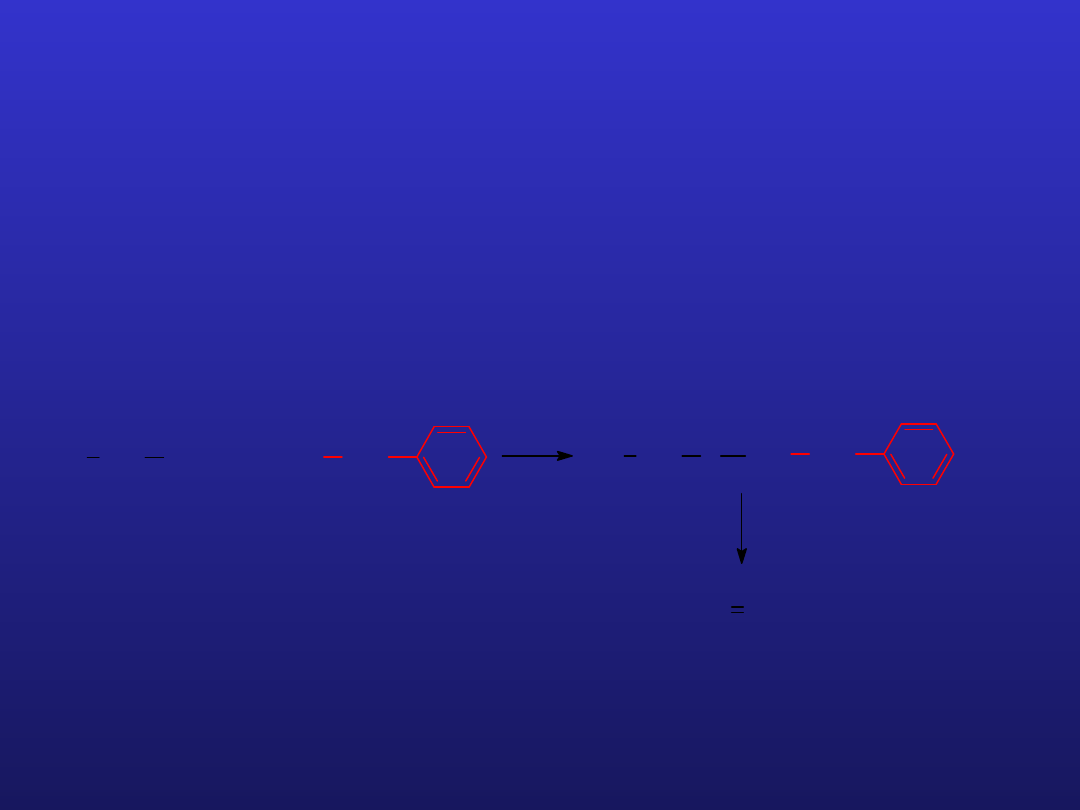
Używany do ilościowego oznaczania grup tiolowych.
E
CH
2
OH
+
CH
2
FSO
2
E
CH
2
O
CH
2
SO
2
OH
-
E
CH
2
MODYFIKACJE CHEMICZNE ENZYMU
Odczynnik ukierunkowany na reszty serylowe
Fluorek fenylometylosulfonylu (PMSF)

MODYFIKACJE CHEMICZNE ENZYMU
Odczynniki ukierunkowane na reszty lizylowe
A. Imidoestry
Warunki: długie czasy reakcji
B. Kwas 2,4,6-trinitrobenzenosulfonowy
Warunki: Barwny produkt podstawienia;
max
= 420 nm,
= 20 000 M
-1
cm
-1
E
(CH
2
)
4
NH
2
+
N
C
NH
2
+
OCH
3
E
(CH
2
)
4
NH
N
C
+
H
2
N
+
E
(CH
2
)
4
NH
2
O
2
N
SO
3
O
2
N
NO
2
2
-
E
(CH
2
)
4
NH
O
2
N
O
2
N
NO
2

C. Fosforan pirydoksalu
Warunki: najwyższa selektywność; wytworzenie trwałego wiązania dopiero
w wyniku redukcji zasady Schiffa; reakcję należy prowadzić w ciemności;
cyjanoborowodorek preferowany wobec borowodorku bo można prowadzić
reakcję w roztworze wodnym (uwaga: tylko w pH >7!)
+
E
(CH
2
)
4
NH
2
N
O
3
POCH
2
C
OH
CH
3
H O
2
-
E
(CH
2
)
4
N
N
O
3
POCH
2
C
OH
CH
3
H
+
H
E
(CH
2
)
4
N
N
O
3
POCH
2
C
OH
CH
3
H
H
NaBH
4
lub NaBH
3
CN
pH 7 - 8,5
2
2
-
-

MODYFIKACJE CHEMICZNE ENZYMU
Odczynniki ukierunkowane na reszty histydylowe
A. Dietylopirowęglan
Warunki: odczynnik specyficzny dla His w zakresie pH4,5 – 7; produkt modyfikacji
absorbuje w UV -
max
= 240 nm,
= 3200 M
-1
cm
-1
; odczynnik nietrwały w roztworach
wodnych; w pH 7 czas połowicznego rozpadu = 10 min; im niższe pH tym większa
trwałość odczynnika
E
CH
2
N
N
H
C
O
EtO
O
C
O
OEt
+
H
E
CH
2
N
N
C
O
EtO
+ CO
2
+ EtOH
H
2
N OH
H
E
CH
2
N
N
+
N C
OEt
O
HO
H

B. Róż Bengalski – odczynnik fotoutleniający
Warunki: ograniczona specyficzność (możliwe utlenienie Cys, Met i Trp);
reakcję prowadzi się w temp 0 - 4
C naświetlając promieniowaniem w zakresie VIS
O
I
HO
I
I
I
Cl
Cl
Cl
Cl
C
O
O
O
- Na
+
E
CH
2
OH +
N
N
C
CH
3
O
E
CH
2
O
O
C
CH
3
N
N
H
pH 7,5
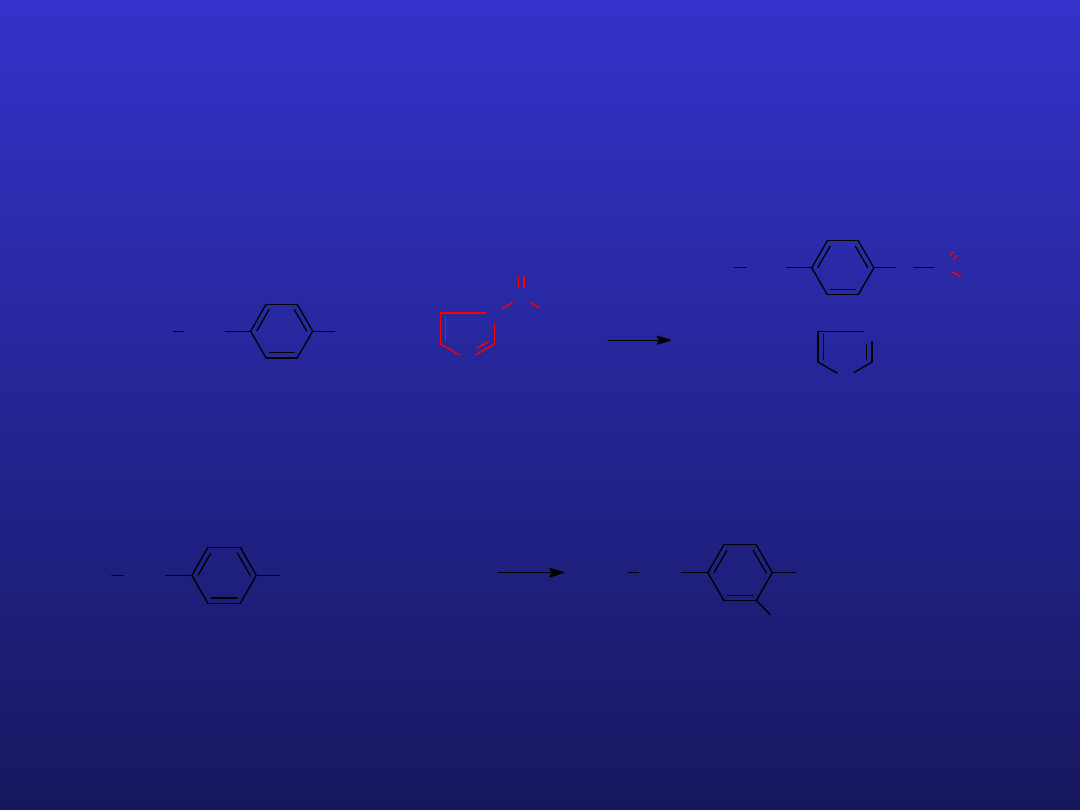
MODYFIKACJE CHEMICZNE ENZYMU
Odczynniki ukierunkowane na reszty tyrozylowe
A. N-acetyloimidazol
Warunki: duże nadmiary odczynnika. Unikać buforu Tris. Reakcja dość wolna
+
-
C(NO
2
)
3
E
CH
2
O
-
NO
2
pH 9
+
C(NO
2
)
4
E
CH
2
OH
B. Tetranitrometan
Warunki: można śledzić postęp reakcji przy
= 350 nm, = 14.400 M-1cm-1
(anion trinitrokarboniowy). Może zachodzić utlenienie cysteiny.
E CH
2
N
H
+
N
O
O
Br
E CH
2
N
O
H
pH 4 - 5
CH
2
Br
OH
O
2
N
CH
2
+
Br
-
OH
O
2
N
HO
NO
2
E
CH
2
N
E
CH
2
N
H
OH
O
2
N
S
+
Br
-
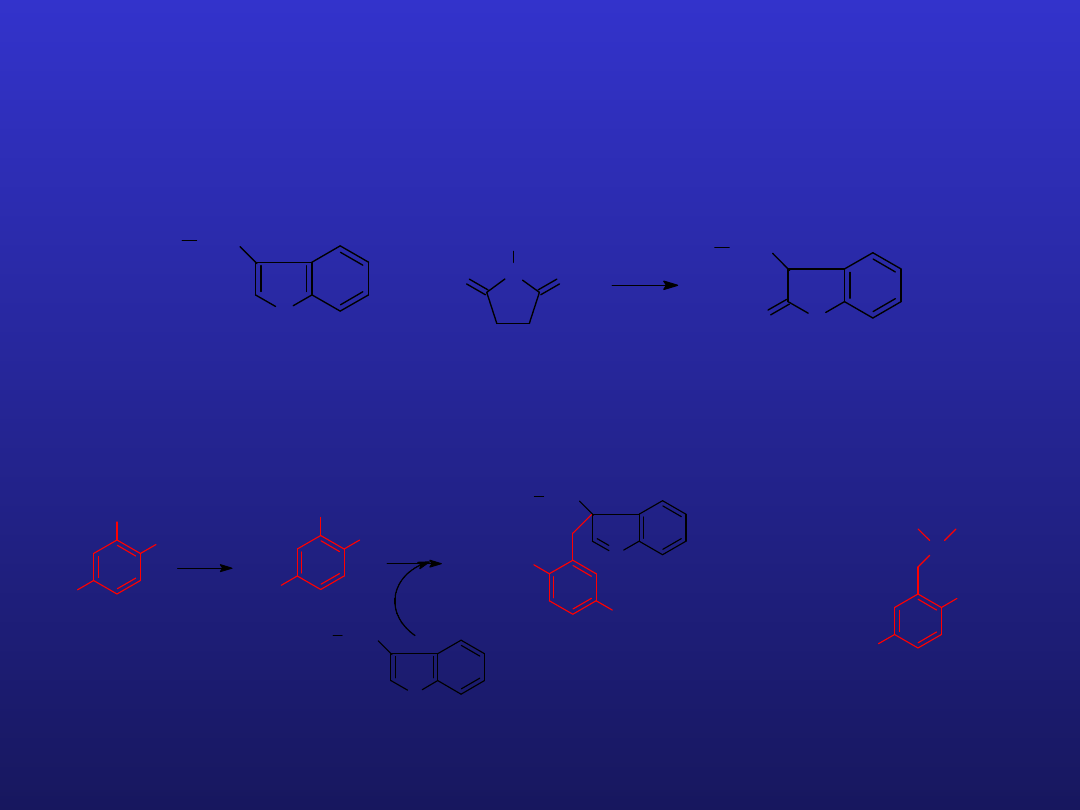
MODYFIKACJE CHEMICZNE ENZYMU
Odczynniki ukierunkowane na reszty tryptofanylowe
A. N-bromoimid kwasu bursztynowego
Warunki: reakcja w buforze octanowym; gwałtowny przebieg;
ograniczona specyficzność (ulegają też Tyr, Cys. Met)
B. Bromek 2-hydroksy-5-nitrobenzylu (BHNB)
Warunki: duże nadmiary odczynnika (nawet 100
);
reakcja w ciemności; odczynnik słabo rozpuszczalny
w wodzie
C. Sól dimetylosulfoniowa
BHNB
odczynnik rozpuszczalny
w wodzie

H
3
C CH
2
N C N CH
2
CH
2
CH
2
N
CH
3
CH
3
HCl
x
EDC
CMC
N
O
H
3
C
CH
2
CH
2
N C N
+
H
3
C
SO
3
2-
C
O
HN
NH
R
1
R
2
R
1
N C N
R
2
H
+
R
1
NH C N R
2
+
E
CO
2
R
2
R
1
NH C
N
E
O
C
O
H
2
O
CO
2
E
C
O
HN
NH
R
1
R
2
R
3
NH
2
HN
R
3
E
O
C
MODYFIKACJE CHEMICZNE ENZYMU
Odczynniki ukierunkowane na reszty Glu i Asp
A. Rozpuszczalne w wodzie pochodne karbodiimidu
Schemat przebiegu reakcji
Warunki: reakcja specyficzna
w pH 4 – 6; duże nadmiary
odczynnika; jako aminę stosuje
się najczęściej ester metylowy
glicyny;
w kwaśnym pH konkurencyjna
reakcja hydrolizy jest bardzo
wolna.
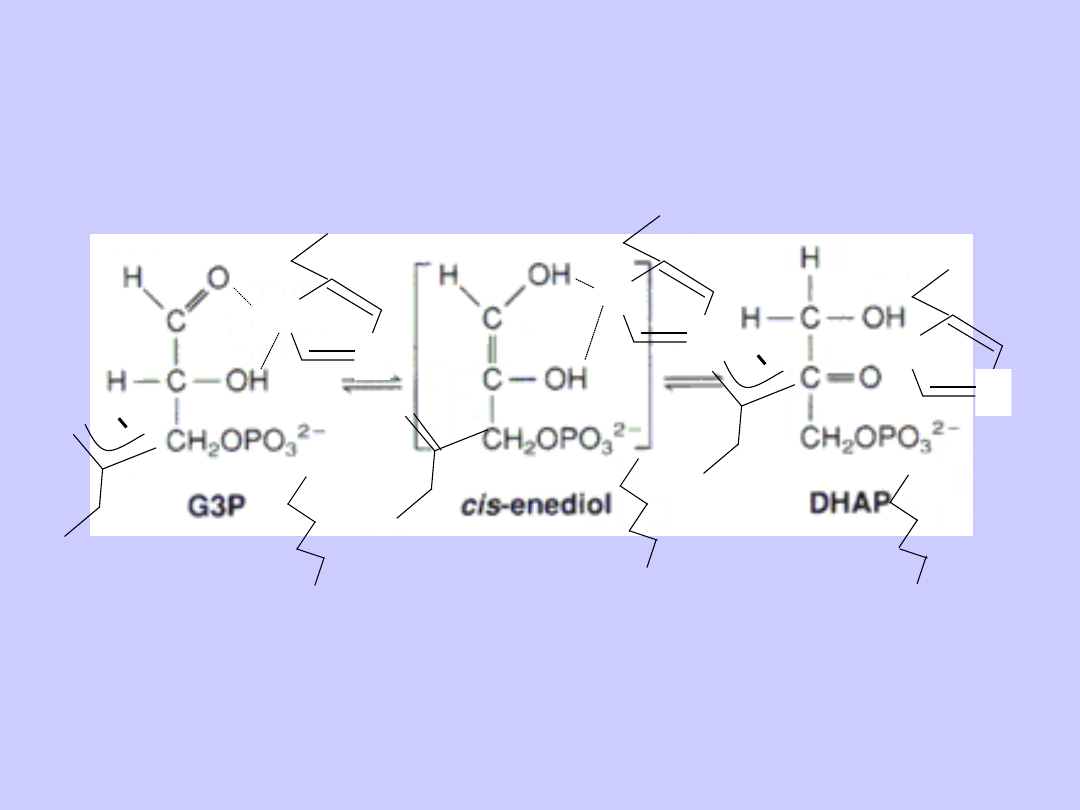
Izomeraza fosfotriozowa
HIS95
N
+
H-N
Lys12
NH
3
+
Glu165
HIS95
N
N
Lys12
NH
3
+
Glu165
O
O
H
HIS95
N
+
H-N
Lys12
NH
3
+
Glu165
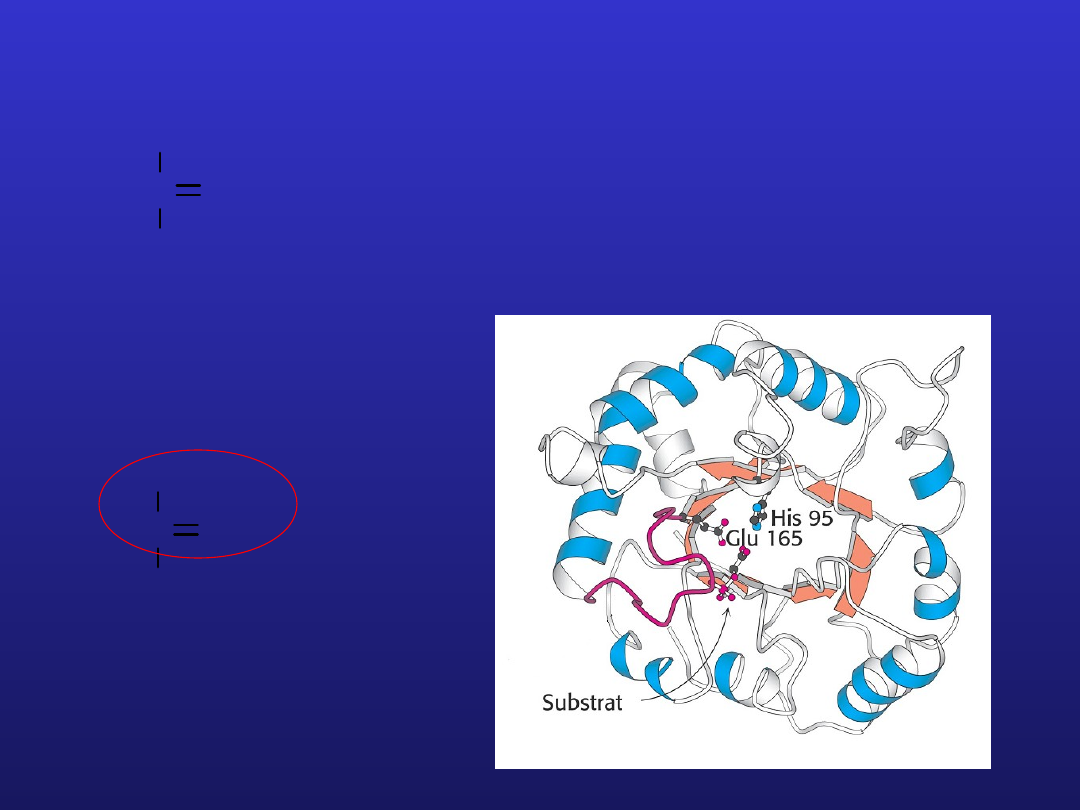
MODYFIKACJE CHEMICZNE ENZYMU
C
CH
2
OH
CH
2
OPO
3
O
2
-
Substrat
2
-
C
CH
2
Br
CH
2
OPO
3
O
Reaktywny
analog substratu
Izomeraza fosfotriozowa
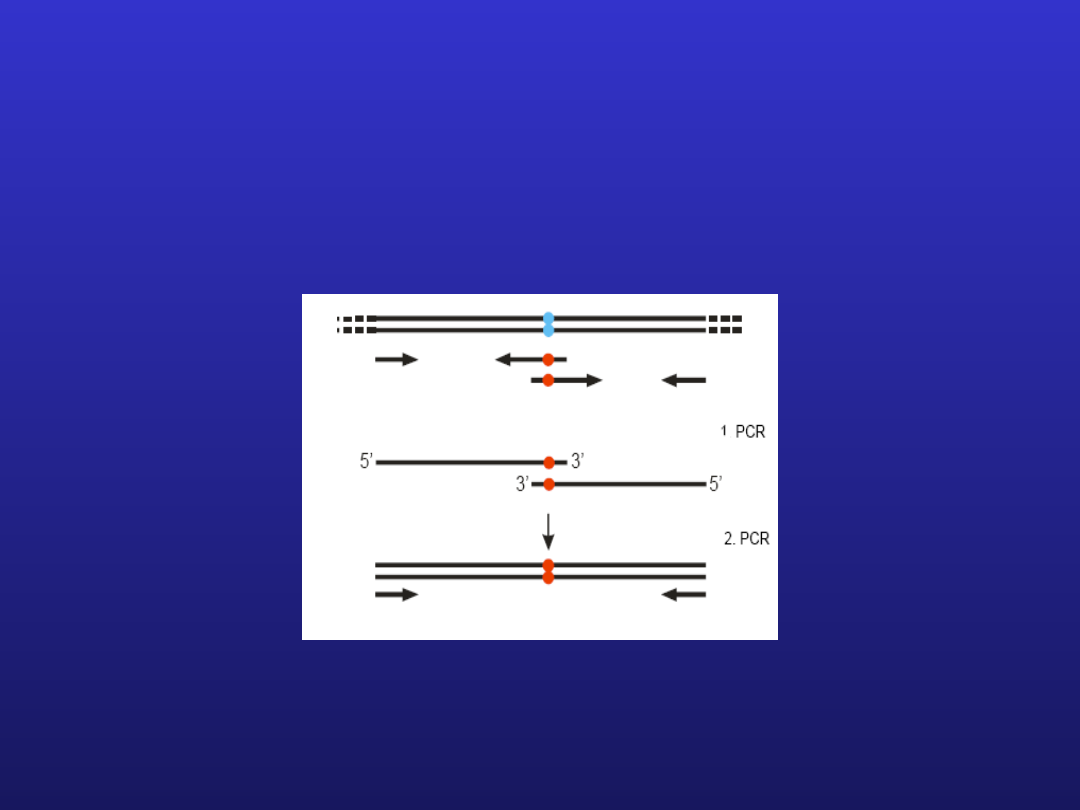
Mutageneza ukierunkowana
Mutageneza to proces prowadzący do powstania
mutacji, czyli dziedziczonej zmiany sekwencji
nukleotydowej DNA
Mutageneza
ukierunkowana
jest
techniką
umożliwiającą precyzyjne badanie białek:
• umożliwia zrozumienie, w jaki sposób białka
ulegają fałdowaniu
• jak rozpoznają inne cząsteczki, katalizują reakcje.
W przypadku ustalania aminokwasów biorących
udział w funkcji katalitycznej, czy regulacyjnej
enzymu jest to najlepsza metoda udowadniająca lub
obalająca udział konkretnych aminokwasów w
pełnieniu tych funkcji.
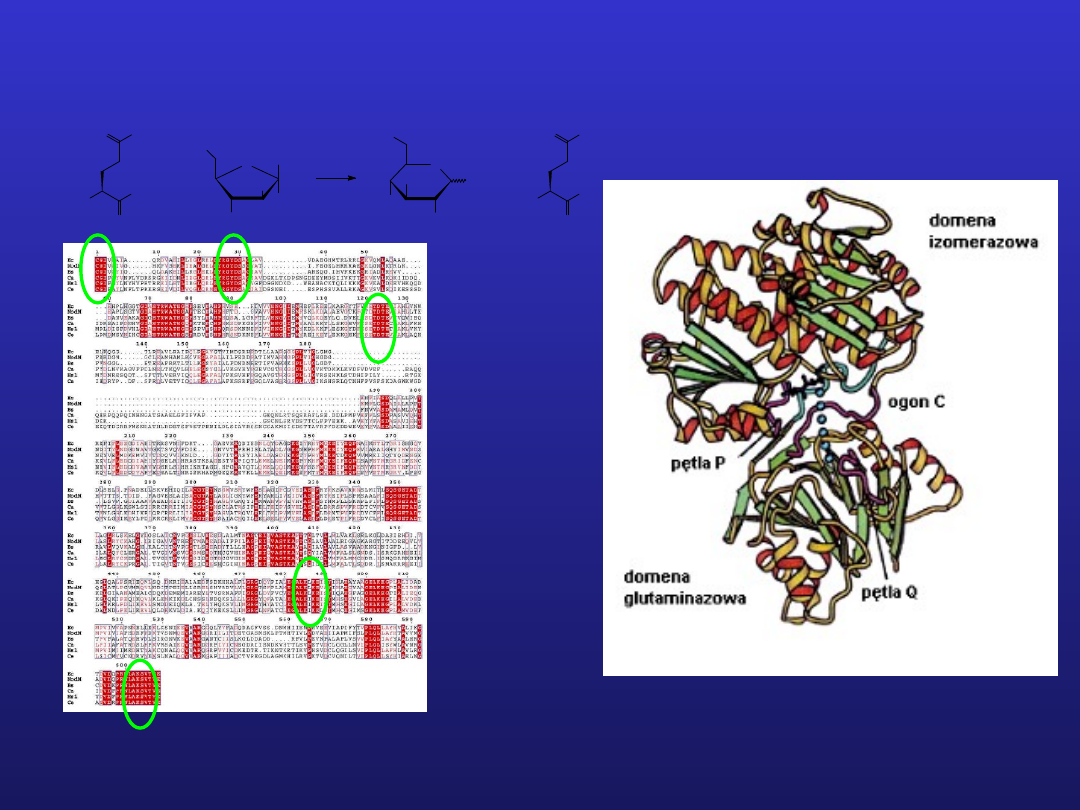
Zastosowanie ukierunkowanej mutagenezy do identyfikacji reszt
istotnych dla aktywności enzymu
Enzym syntaza GlcN-6-P
O
NH
3
OH
O
OH
O
3
PO
H
O
OH
CH
2
OH
O
OH
O
3
PO
H
+
+
H
3
N
O
O
-
O
NH
2
H
3
N
O
O
-
O
O
-
2-
2-
+
+
+
Struktura przestrzenna enzymu
Analiza porównawcza sekwencji syntazy GlcN-6-P z różnych źródeł
podstawą selekcji reszt do ukierunkowanej mutagenezy

Zastosowanie ukierunkowanej mutagenezy do identyfikacji reszt
istotnych dla aktywności enzymu
Enzym syntaza GlcN-6-P
Aktywność
glutaminazowa
Aktywność
izomerazowa
Aktywność syntazowa
Wersja
K
M (Gln)
(mM)
k
kat
(min
-1
) K
M (Fru-6-P)
(mM)
k
kat
(min
-1
)
K
M (Gln)
(mM)
K
M (Fru-6-P)
(mM)
k
kat
(min
-1
)
Natywna
C1A
D29N
D123N
K603R
K603L
H488F
0,43
-
8,7
0,58
0,38
0,40
0,45
12
0
11,8
8,9
12,3
12,1
11,4
1,40
1,38
1,48
2,1
5,1
14,2
1,57
89
95
88
65
72
32
1,2
0,43
-
8,2
0,60
0,39
0,42
0,42
1,41
1,54
1,42
2,4
6,8
13,1
1,54
930
0,05
850
720
780
420
10,5
Aktywność glutaminazowa: L-Gln + H
2
O L-Glu + NH
3
Aktywność izomerazowa: Fru-6-P Glu-6-P
Aktywność syntazowa: L-Gln + Fru-6-P L-Glu + GlcN-6-
P
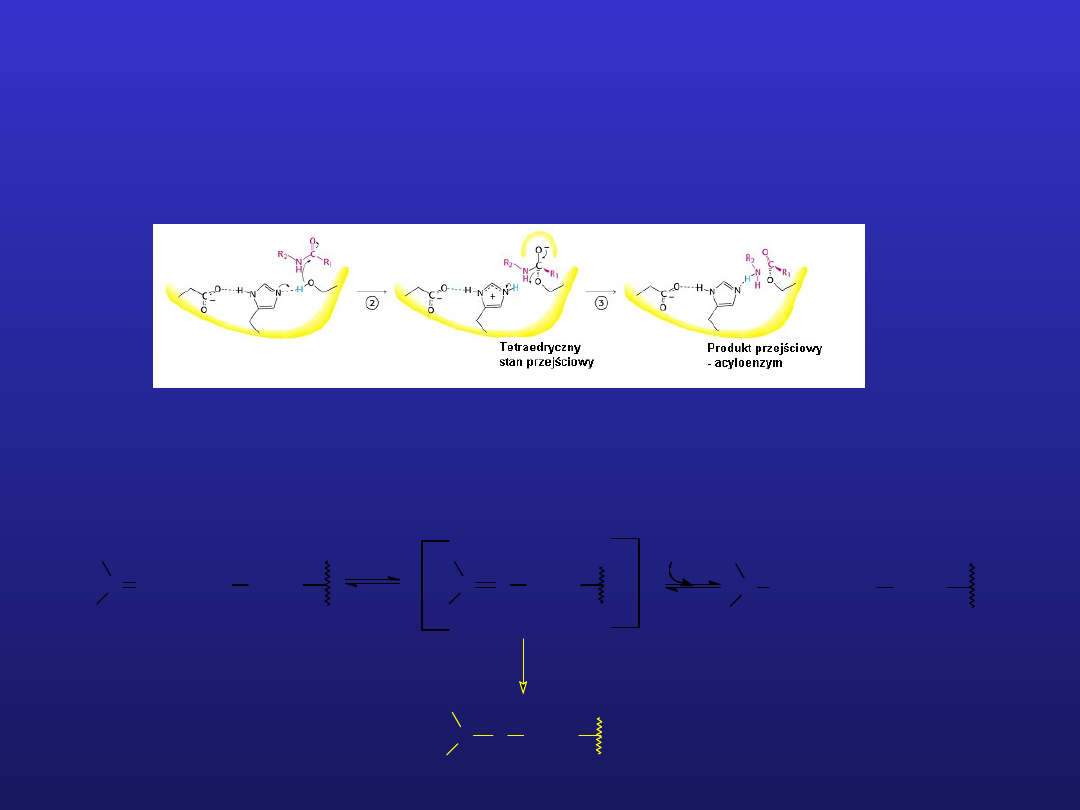
Detekcja intermediatów
Niektóre produkty przejściowe reakcji enzymatycznej są stosunkowo
stabilne (głębokie minimum energetyczne) – istnieje możliwość
detekcji metodami spektroskopowymi: spektrofluorymetria, NMR
niskotemperaturowy;
Początkowe etapy reakcji katalizowanej przez chymotrypsynę
C O + H
2
N (CH
2
)
4
C
N (CH
2
)
4
H
+
NH
3
H
2
N (CH
2
)
4
+
C NH
2
H
NaBH
4
lub NaBH
3
CN
+
H
N (CH
2
)
4
C
H
H
Redukcja produktu przejściowego
w postaci zasady Schiffa prowadzi
do powstania stabilnego adduktu
Wyłapywanie intermediatów za pomocą reakcji chemicznej

Informacje dotyczące mechanizmu działania enzymu,
które można uzyskać z pomiarów kinetycznych
Eksperyment
Możliwe informacje
Określanie zmian szybkości reakcji
w zależności od stężenia substratu
Określanie zależności parametrów
kinetycznych od struktury
substratu
Inhibicja odwracalna
Określanie zależności aktywności
od zmian pH
Badania kinetyki stanu
nieustalonego
Wyznaczanie parametrów kinetycznych;
rozróżnianie mechanizmów reakcji
dwusubstratowych
Rozpoznanie czynników strukturalnych
odpowiedzialnych za wiązanie substratu
Informacje pomocne dla określenia struktury
centrum
aktywnego
Określenie pK
a
reszt istotnych dla katalizy
Wyznaczenie stałych szybkości etapów
reakcji:
detekcja kompleksów enzymu z substratem
i/lub produktami przejściowymi
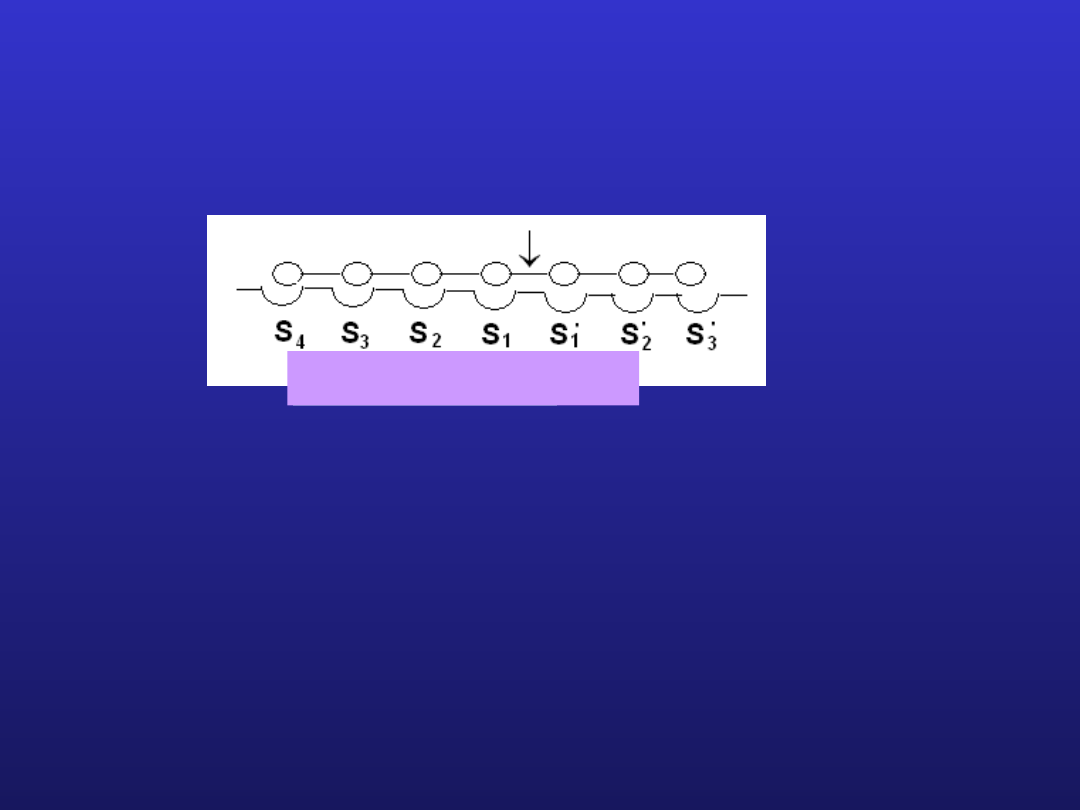
Zależność aktywności enzymu od zmian struktury substratu
Papaina – proteinaza cysteinylowa
Badania specyficzności substratowej papainy wobec syntetycznych
oligopeptydów wykazały istnienie w centrum wiążącym substrat obecność
7 „subcentrów”
S
2
– specyficzne wobec L-Phe
S
1
’ – stereospecyficzne dla L-aminokwasów, z preferencją dla L-Leu i L-Trp
Tripeptyd Ala-Phe-Arg jest inhibitorem kompetytywnym enzymu
Czy tetrapeptyd Ala-Phe-Arg-Leu jest także inhibitorem?
Ala-Phe-Arg
Ala-Phe-Arg-Leu
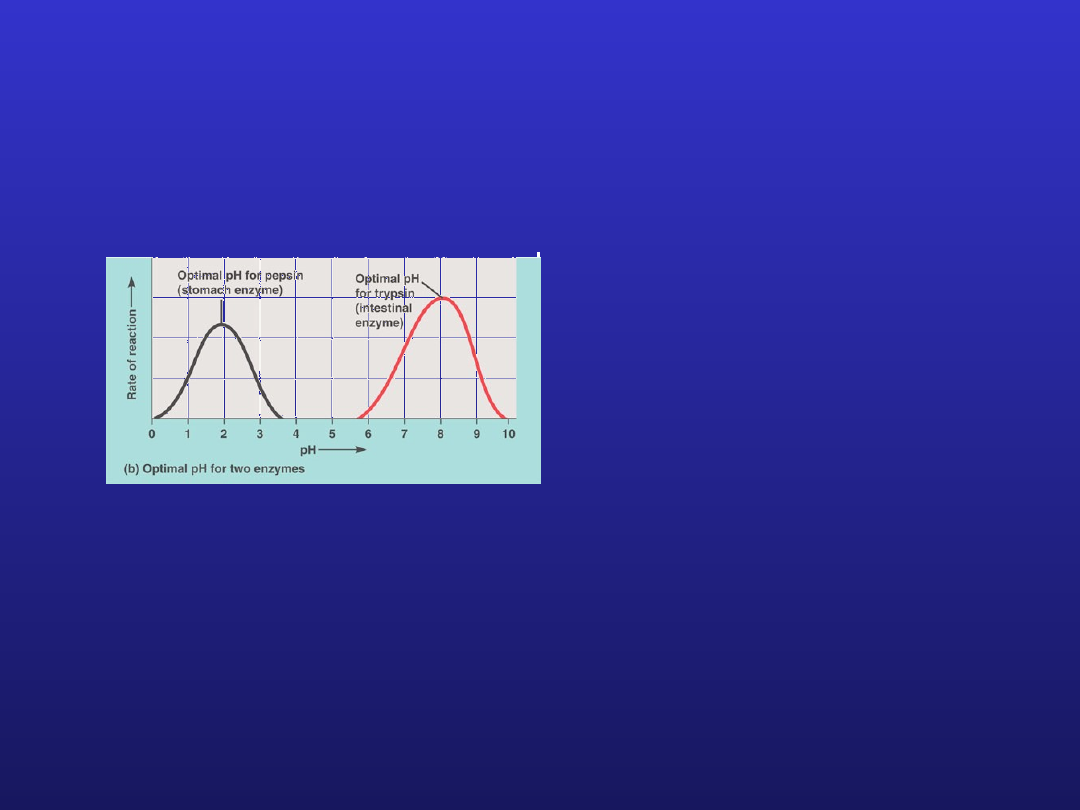
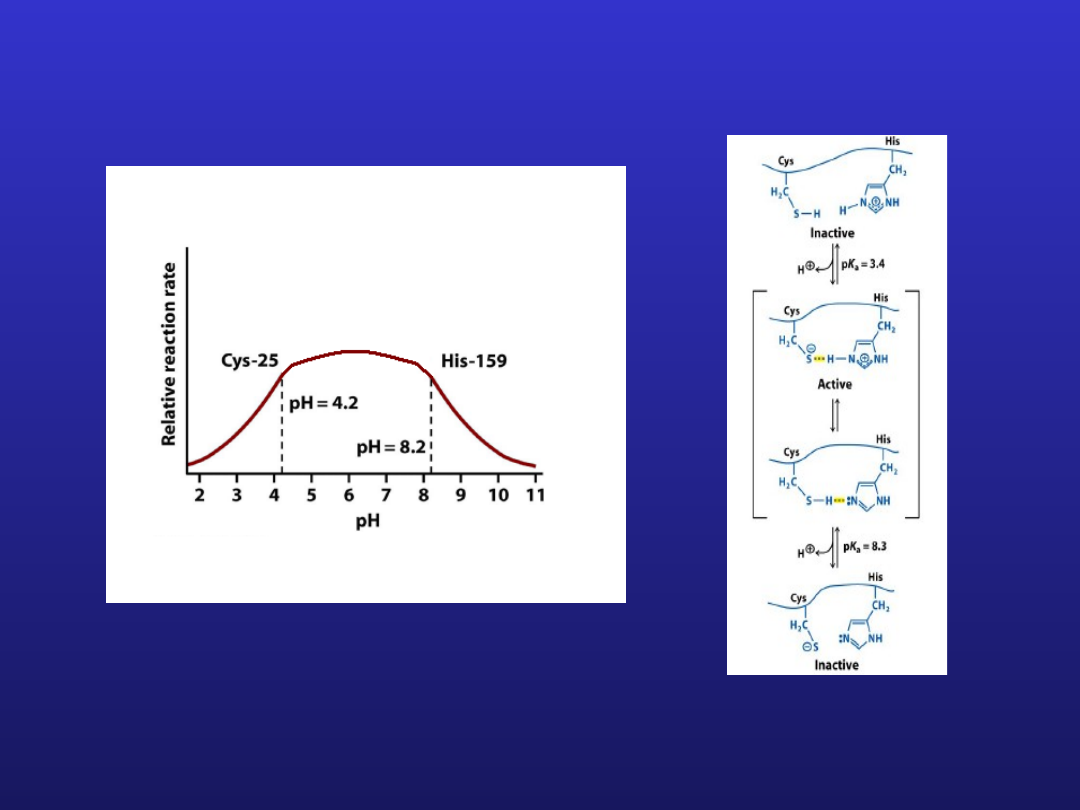
Zależność zmian aktywności enzymu od pH
Analiza kształtu zależności v = f(pH) daje możliwość wyznaczenia
pK
a
reszt ulegających jonizacji, które są istotne dla aktywności enzymu
Krzywa dzwonowa
pH optimum = pK
a
reszty katalitycznej

Analiza zależności pK
a
reszt jonizujących od polarności rozpuszczalnika
pozwala na określenie stanu jonizacji reszty
-CO
2
H
-COO
-
+ H
+
W tym przypadku obniżenie polarności rozpuszczalnika jest niekorzystne dla dysocjacji.
pK
a
rośnie przy obniżaniu polarności.
-ImH
+
-Im + H
+
A jak w tym przypadku?
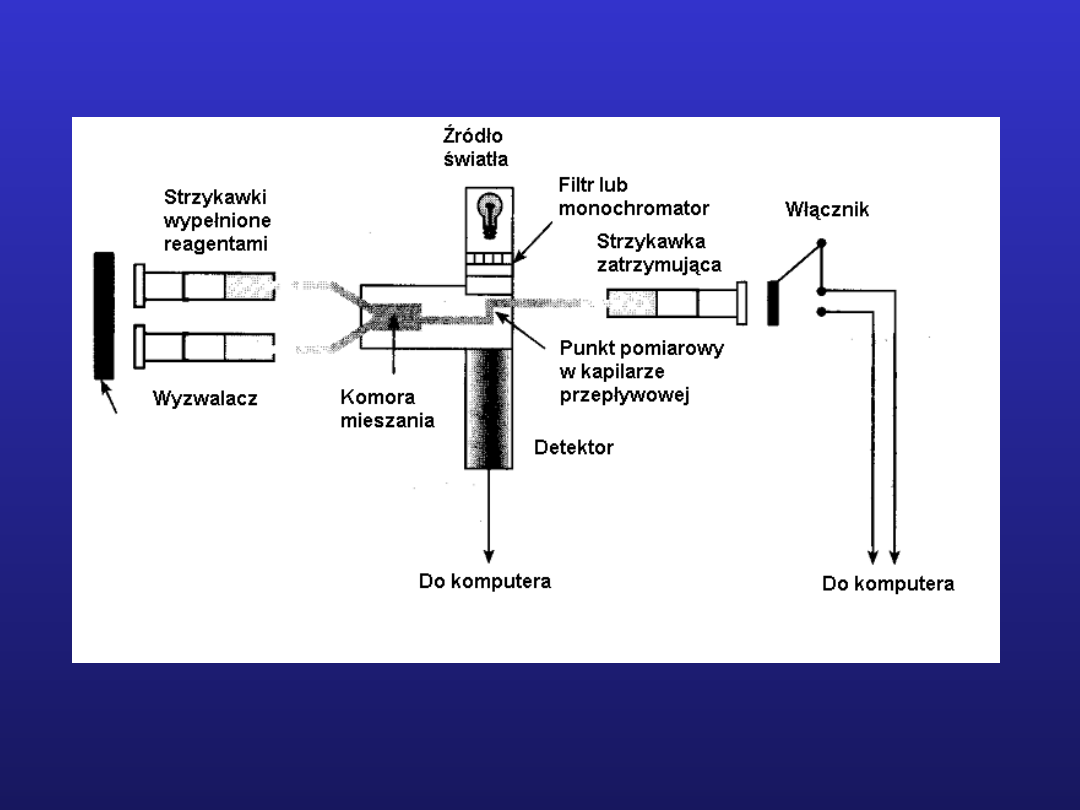
Schemat aparatury do pomiarów kinetycznych metodą
stopped flow
Kinetyka stanów nieustalonych

Kinetyka stanów nieustalonych
Warunki pomiaru:
- stężenia enzymu i substratu na porównywalnym
poziomie
- techniki pomiarowe umożliwiające określanie
niewielkich zmian
stężenia w krótkim czasie (ang. stopped flow)
E + NADH
k
1
k
-1
[E:NAD
H]
Przykład: reakcja wiązania NADH przez
dehydrogenazę mleczanową
. Pomiar zmian stężenia
NADH metodą spektrofluorymetryczną przez 16 ms; Stężenia początkowe enzymu i NADH
identyczne – 8 M.
Reakcja II rzędu, ale ponieważ [E] = [S], to połowiczny czas reakcji można
wyrazić wzorem: = 1/k [S].
Z eksperymentu otrzymano = 2 ms
k = 1/ [S] = 6,7 10
7
M
-1
s
-1
Ponieważ k
1
>> k
-1
, to k = k
1

Chymotrypsyna – triada katalityczna
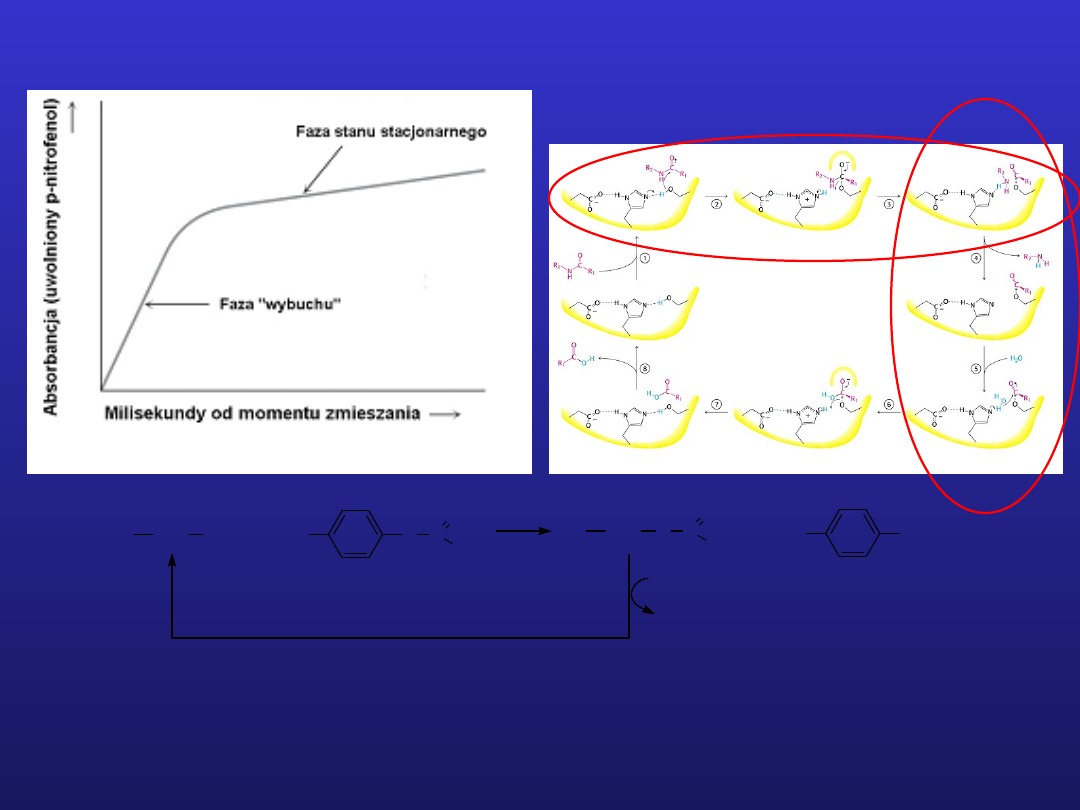
Kinetyka hydrolizy octanu p-nitrofenylu przez chymotrypsynę
Faza I – tworzenie produktu przejściowego - acyloenzymu
Faza II – hydroliza produktu przejściowego
E
CH
2
OH + O
2
N
O C
O
CH
3
Faza I
CH
2
O C
O
CH
3
E
O
2
N
OH
+
H
2
O
CH
3
COOH
Faza II
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
Wyszukiwarka
Podobne podstrony:
06 Kinetyka reakcji enzymatycznych
kinetyka reakcji enzymatycznych I
Wyznaczanie parametrów kinetyki reakcji enzymatycznej za pomocą metod polarymetrycznych 5x
biol-cykl mocznikowy, Cykl mocznikowy jest sekwencją reakcji enzymatycznych w toku których grupy ami
KINETYKA REAKCJI ENZYMATYCZNYCH
Wpływ aktywatorów i inhibitorów na szybkość reakcji enzymatycznej
Kinetyka reakcji enzymatycznej m poteraj
Enzymy 3 Wprowadzenie do reakcji enzymatycznych
Kinetyka reakcji enzymatycznych Nieznany
cwiczenie 4 inwertaza kinetyka reakcji enzymatycznych 05 05 2014
Wpływ inhibitorów i czynników fizycznych na przebieg reakcji enzymatycznych
cwiczenie 2 hydrolazy czynniki wplywajace na szybkosc reakcji enzymatycznych 15 05 2014
5 Kinetyka reakcji enzymatycznych
Kinetyka Reakcji Enzymatycznych
trusek hołownia, procesy membranowe, KINETYKA REAKCJI ENZYMATYCZNYCH
więcej podobnych podstron