
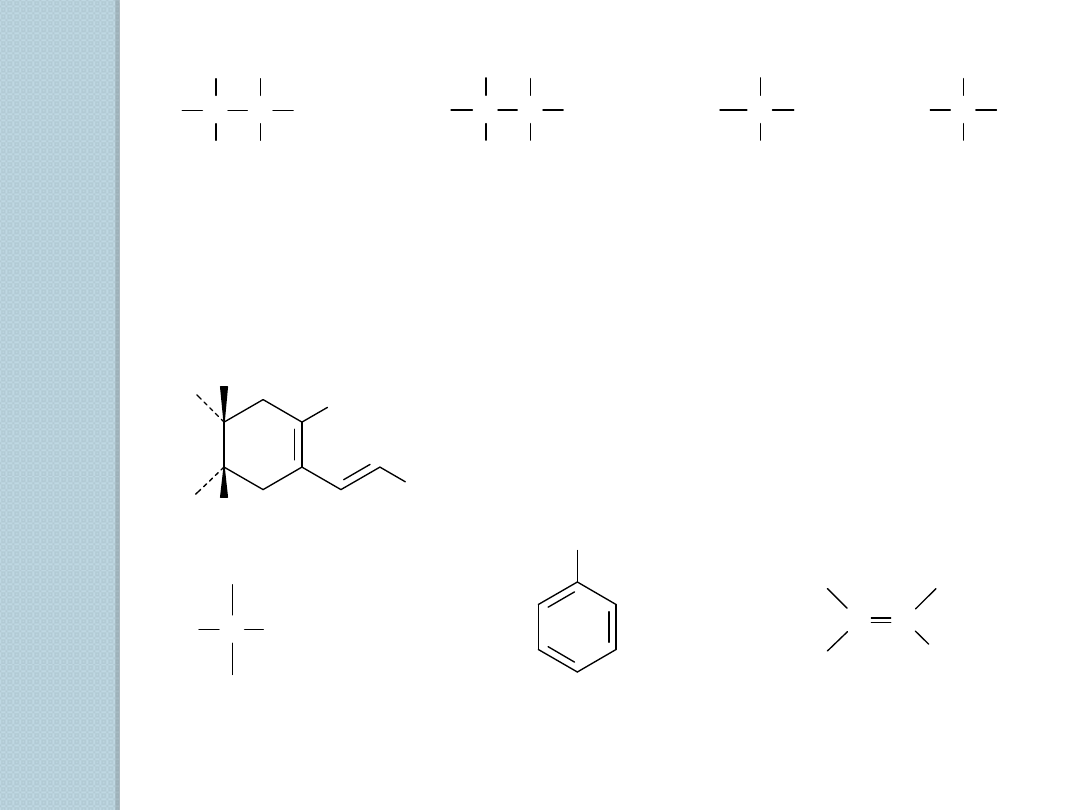
HALOGENKI
ALKILOWE
C C
H
H
H
H
Cl Cl
C C H
Br
F
F
F Cl
C
F
Cl
Cl
F
C
Br
H
H
H
Cl
Cl
CH
3
H
CH
3
Cl
C
R
X
X
C C
X
1,2-dichloroetan
(rozpuszczalnik)
halotan
(anestetyk
wziewny)
dichlorodifluoro
-metan
(chłodziwo)
bromometan
(środek do
odymiania)
plokamen B
(trichloropochodna) –
wyizolowany z czerwonych
glonów, aktywność owadobójcza
halogenek
alkilowy
halogenek
aromatyczny
halogenek
winylowy
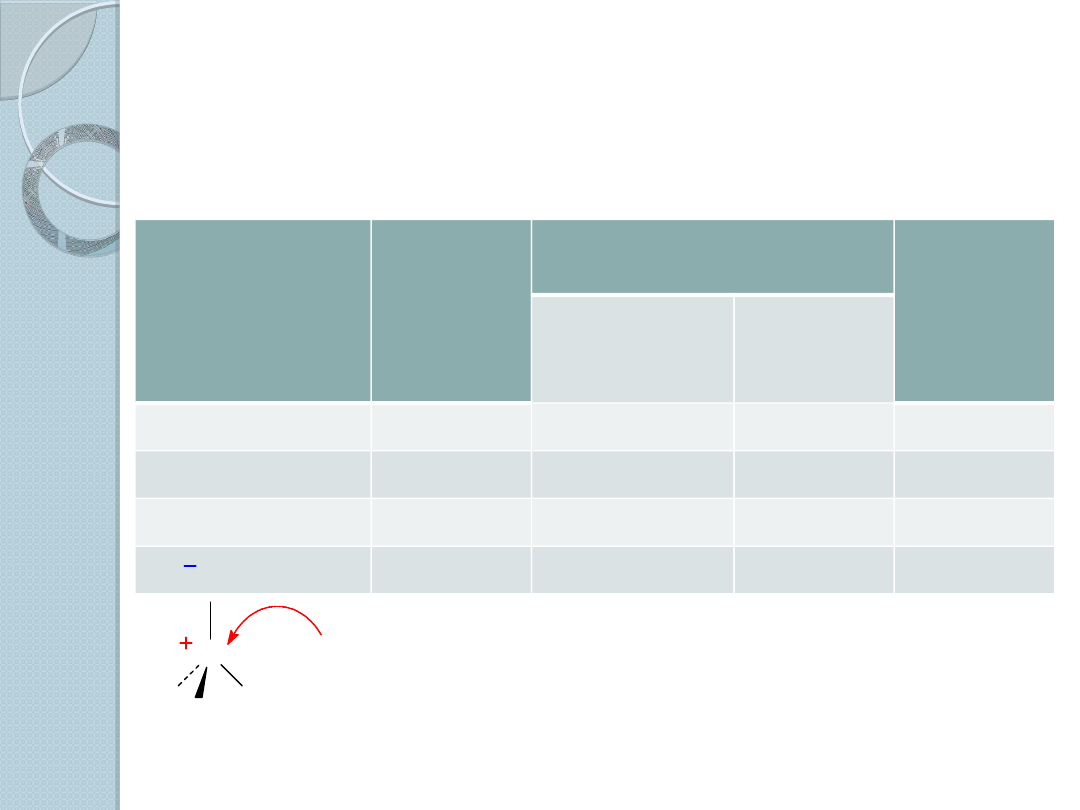
Własności halogenków alkilu
Porównanie właściwości halogenometanów
Halogenometa
n
Długość
wiązania
(Å)
Energia dysocjacji
wiązania
Moment
dipolowy
(D)
(kJ/mol)
(kcal/mol)
CH
3
F
1,39
452
108
1,85
CH
3
Cl
1,78
351
84
1,87
CH
3
Br
1,93
293
70
1,81
CH
3
I
2,14
234
56
1,62
C
X
centrum elektrofilowe
X
jest przyjętym oznaczeniem fluorowca: F, Cl,
Br lub I

Nazewnictwo halogenków alkilu
Halogenki alkilowe nazywamy w taki sam sposób jak
alkany, traktując atom fluorowca jak podstawnik w
łańcuchu macierzystego alkanu.
CH
3
CHCH
2
CHCHCH
2
CH
3
CH
3
CH
3
Br
1
2
3
4
5 6
7
CH
3
CHCH
2
CHCHCH
2
CH
3
Br
CH
3
CH
3
1
2
3
4
5 6
7
5-bromo
-2,4-
dimetylo
heptan
2-bromo
-4,5-dimetylo
heptan
CH
3
CHCHCHCH
2
CH
3
Cl Cl
CH
3
1
2
3
4
5
6
2,3-dichloro
-4-metylo
heksan
1. Wybór i nazwanie łańcucha macierzystego.
2. Numeracja atomów łańcucha macierzystego,
zaczynając od końca bliższego pierwszego
podstawnika, obojętne czy to alkil czy fluorowiec.
3. Jeśli łańcuch macierzysty można zgodnie z regułą 2,
prawidłowo ponumerować poczynając z dowolnego
końca, rozpoczynamy od końca bliższego podstawnika
(alkilowego
lub
halogenowego),
który
ma
pierwszeństwo w porządku alfabetycznym.
Br
CH
2
CH
2
CHCHCH
3
Cl
CH
3
1
2
3
4
5
1-bromo-3-chloro
-4-
metylo
pentan
CH
3
CHCH
2
CH
2
CHCH
3
Br
CH
3
1
2
3
4
5
6
2-bromo
-5-metylo
hehsan
(NIE 5-bromo-2-metyloheksan)
Oprócz nazw systematycznych, wiele prostych halogenków
alkilu nazywa się wymieniając najpierw nazwę fluorowca, a
potem alkilu np.:
CH
3
I
CH
3
CHCH
3
Cl
Br
jodo
metan
(albo jodek
metylu)
2-chloro
propan
(albo chlorek
izopropylu)
bromo
cykloheksan
(albo bromek
cykloheksylu)
Otrzymywanie halogenków alkilu
H
CH
3
CH
3
X
H
X
rodniki
H
Br
H
X
X
2
CH
3
Br
H
H
CH
3
H
Br
H
CH
3
H
H
X
X = Cl lub Br
X = Cl, Br lub I
1. Addycja fluorowców i fluorowcowodorów do alkenów.
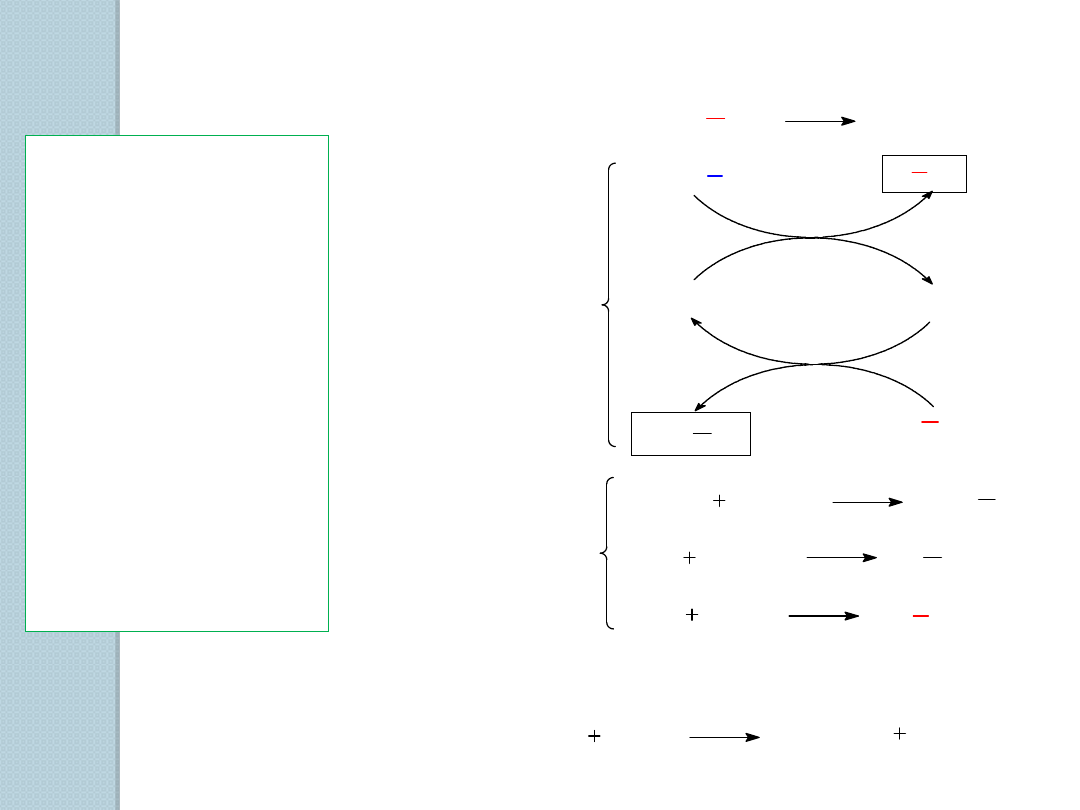
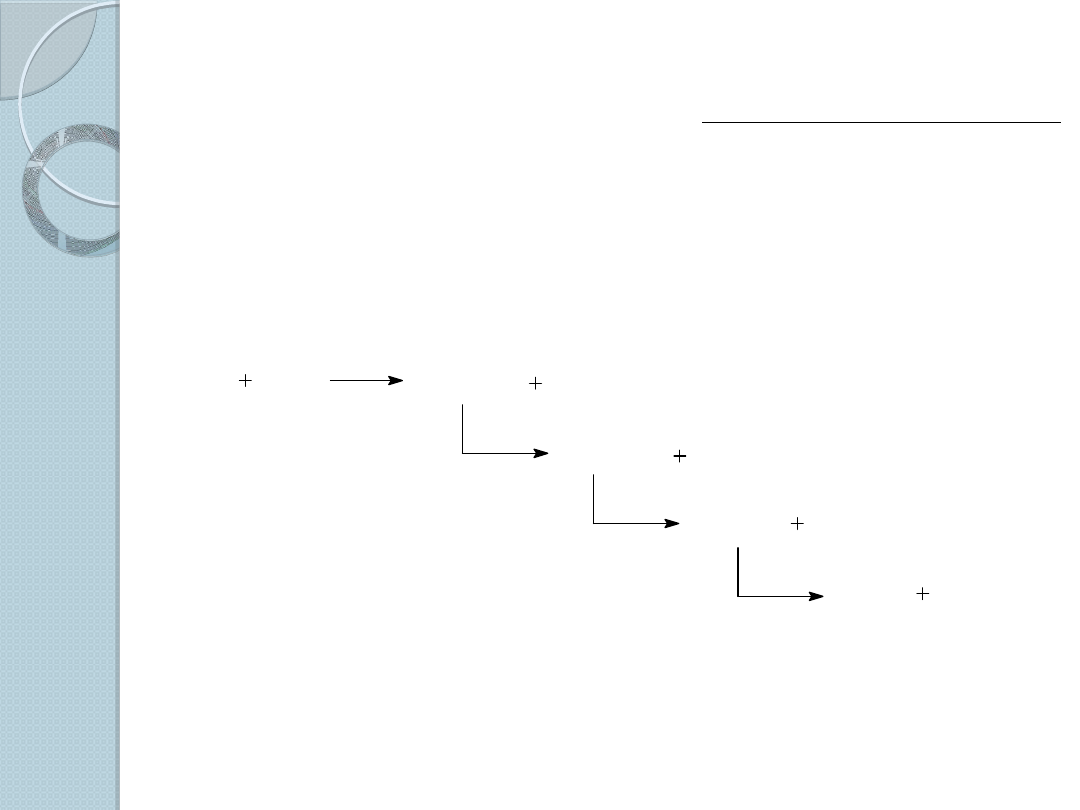
2. Wolnorodnikowe halogenowanie alkanów.
Cl Cl
2Cl
.
hv
etap
inicjacji
H
3
C
.
CH
3
.
H
3
C CH
3
CH
3
.
Cl
.
Cl
CH
3
Cl
.
Cl
.
Cl Cl
etapy
terminacji
sumaryczna
reakcja
CH
4
Cl
2
CH
3
Cl
H
Cl
H
3
C
H
H
Cl
Cl
.
H
3
C
.
Cl Cl
H
3
C
Cl
etapy
propagacji
(powtarzające
się cyklicznie)
Mechanizm
wolnorodnikowego
chlorowania metanu
Niezbędne są trzy
etapy: inicjacja,
propagacja i
terminacja.
Symbol hν,
występujący w
etapie inicjacji jest
powszechnym
sposobem
zaznaczenia
oddziaływania
światła.
etap 1
etap 2
Halogenowanie
alkanów
jest
niekorzystną
metodą
otrzymywania halogenków alkilu, ponieważ prowadzi do
mieszaniny produktów np. chlorowanie metanu nie
zatrzymuje się w stadium monochlorowania lecz biegnie
dalej dając mieszaninę dichloro-, trichloro- a nawet
tetrachlorometanu.
C
H
4
Cl
2
C
H
3
Cl
H
Cl
C
H
2
Cl
2
H
Cl
C
H
Cl
3
H
Cl
C
Cl
4
H
Cl
Cl
2
Cl
2
Cl
2
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH CH
2
NBS
, CCl
4
CH
3
CH
2
CH
2
CH
2
CH
2
CHCH CH
2
Br
CH
3
CH
2
CH
2
CH
2
CH
2
CHCH CH
2
.
CH
3
CH
2
CH
2
CH
2
CH
2
CH CHCH
2
Br
CH
3
CH
2
CH
2
CH
2
CH
2
CH CHCH
2
.
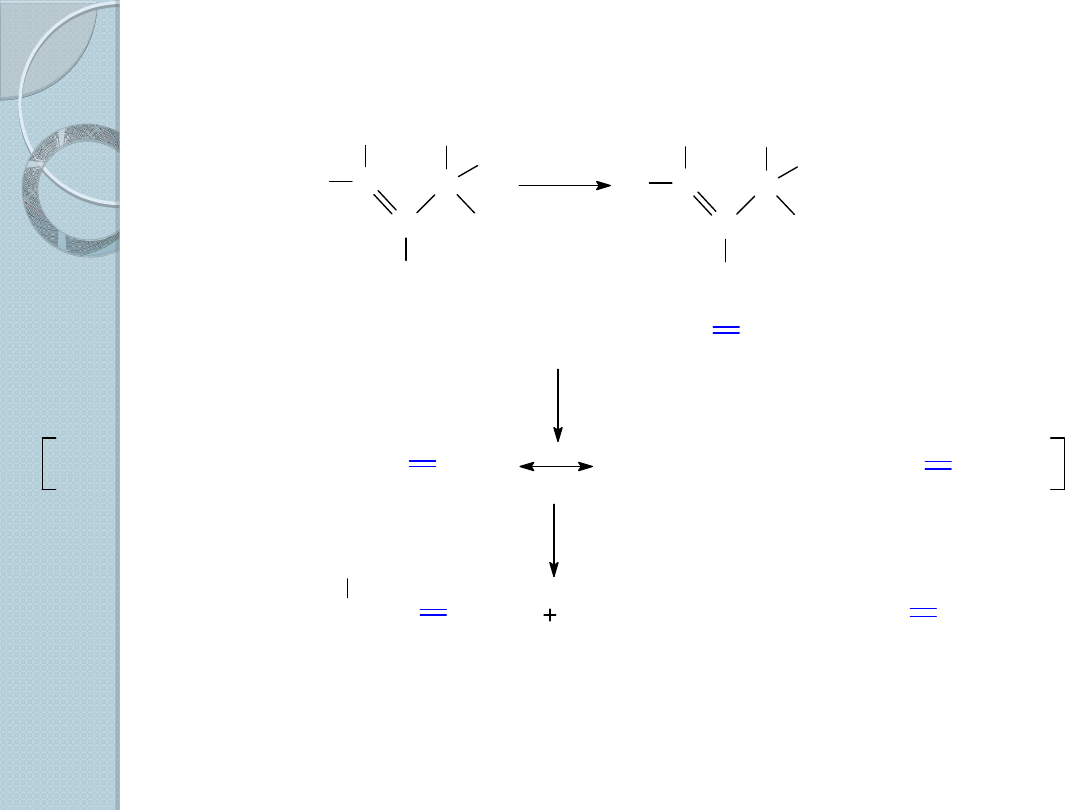
3. Bromowanie allilowe alkenów.
C
C
C
H
C
C
C
Br
NBS
CH
4
1-okten
3-bromo-1-okten (17%)
1-bromo-2-okten
(83%)
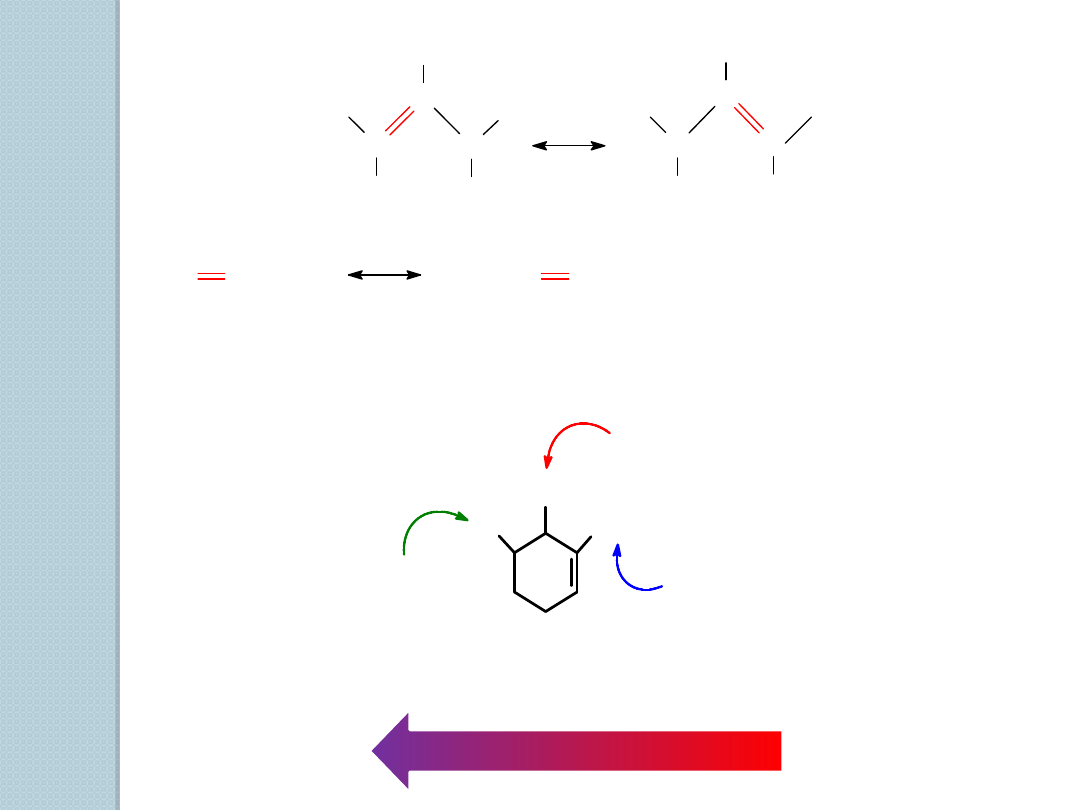
C
C
C
H
H
H
H
H
.
C
C
C
H
H
H
H
H
.
H
2
C CHCH
2
.
CH
2
CH CH
2
.
CH
3
CH
2
CH
2
.
rodnik allilowy
(zdelokalizowany, bardziej trwały)
rodnik propylowy
(zlokalizowany, mniej trwały)
H
H
H
allilowy
360 kJ/mol (87 kcal/mol)
winylowy
445 kJ/mol (106 kcal/mol)
alkilowy
400 kJ/mol (96 kcal/mol)
allilowy > R
3
C
·
> R
2
CH > RCH
2
> CH
3
> winylowy
·
·
·
trwałość
bardziej trwały
mniej trwały
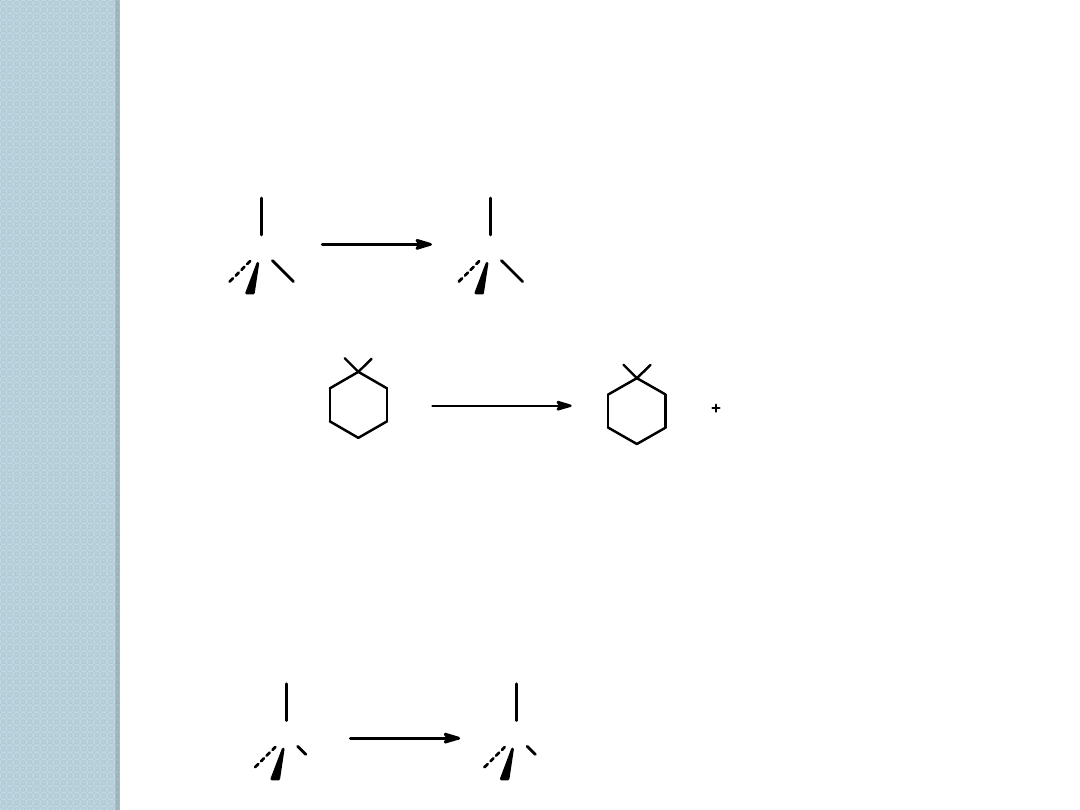
4. Z alkoholi.
1) Reakcja z HX, gdzie X = Cl, Br lub I
2) Reakcja 1
o
i 2
o
alkoholi z SOCl
2
C
OH
C
X
HX
eter
porządek reaktywności: 3
o
> 2
o
>1
o
H
2
O
H
3
C
OH
H
3
C
Cl
HCl(gaz)
eter, O
o
C
C
H
OH
C
H
Cl
SOCl
2
pirydyna
1-metylocykloheksanol
1-chloro-1-metylocykloheksan
(90%)
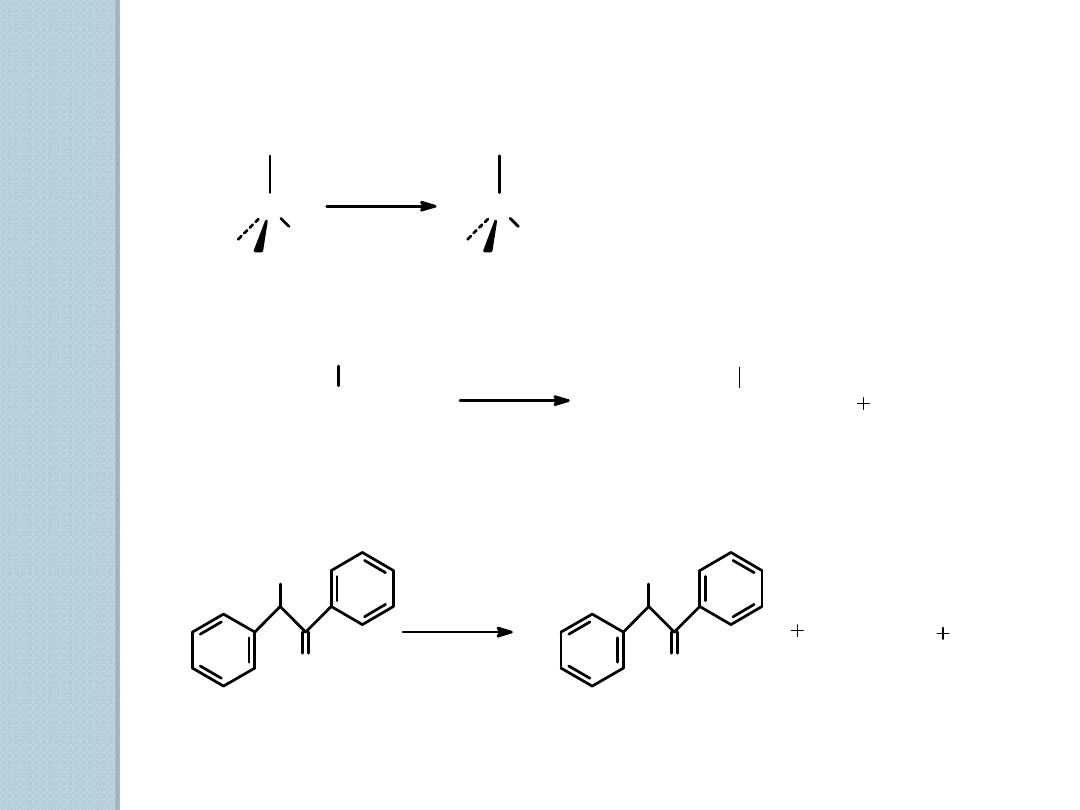
3) Reakcja 1
o
i 2
o
alkoholi z PBr
3
C
H
OH
C
H
Br
PBr
3
eter
CH
3
CH
2
CHCH
3
OH
3
CH
3
CH
2
CHCH
3
Br
3
PBr
3
P
(OH)
3
eter, 35
o
C
2-butanol
2-bromobutan
(86%)
OH
O
Cl
O
SOCl
2
pirydyna
S
O
2
H
Cl
benzoina
chlorek desylu (86%)
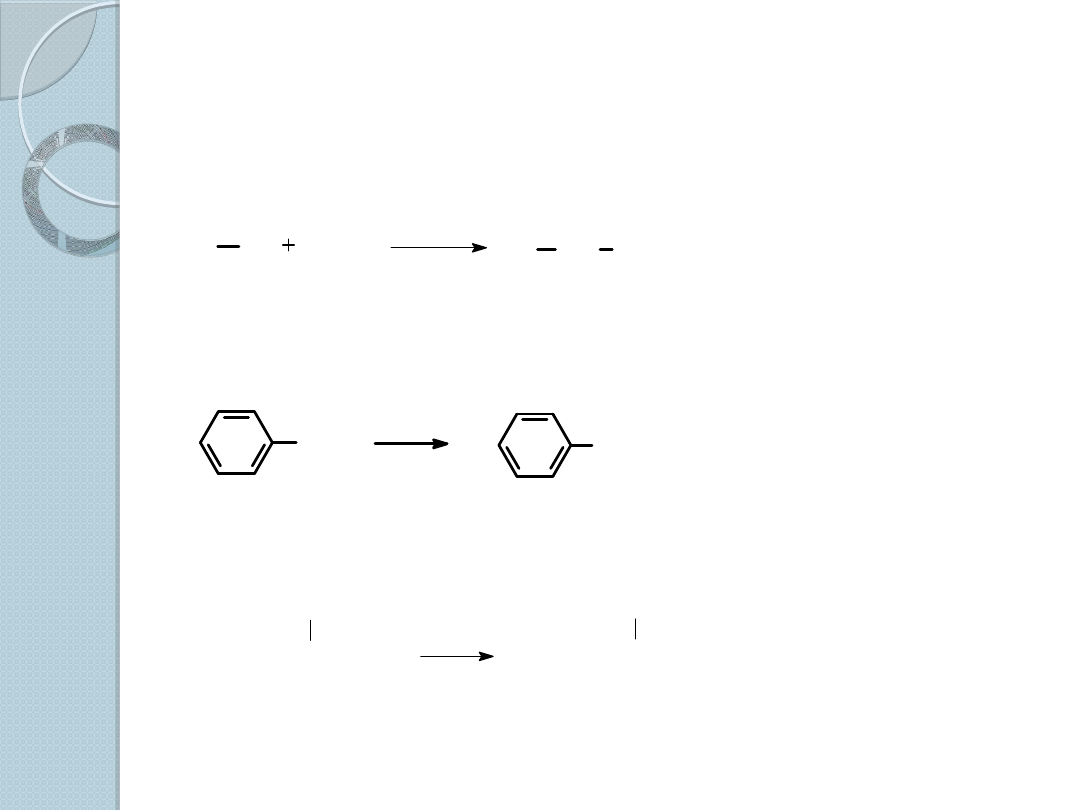
Reakcje halogenków alkilowych
1. Tworzenie odczynników Grignarda.
gdzie R = 1
o
, 2
o
lub 3
o
alkil, aryl lub alkenyl
X = Cl, Br lub I
Br
Mg
eter
Mg
Br
bromobenzen
bromek
fenylomagnezowy
CH
3
CH
2
CHCH
3
Cl
CH
3
CH
2
CHCH
3
Mg
Cl
Mg
eter
R
X
Mg
eter
lub THF
R
Mg
X
2-chlorobutan
chlorek
sec-butylomagnezowy
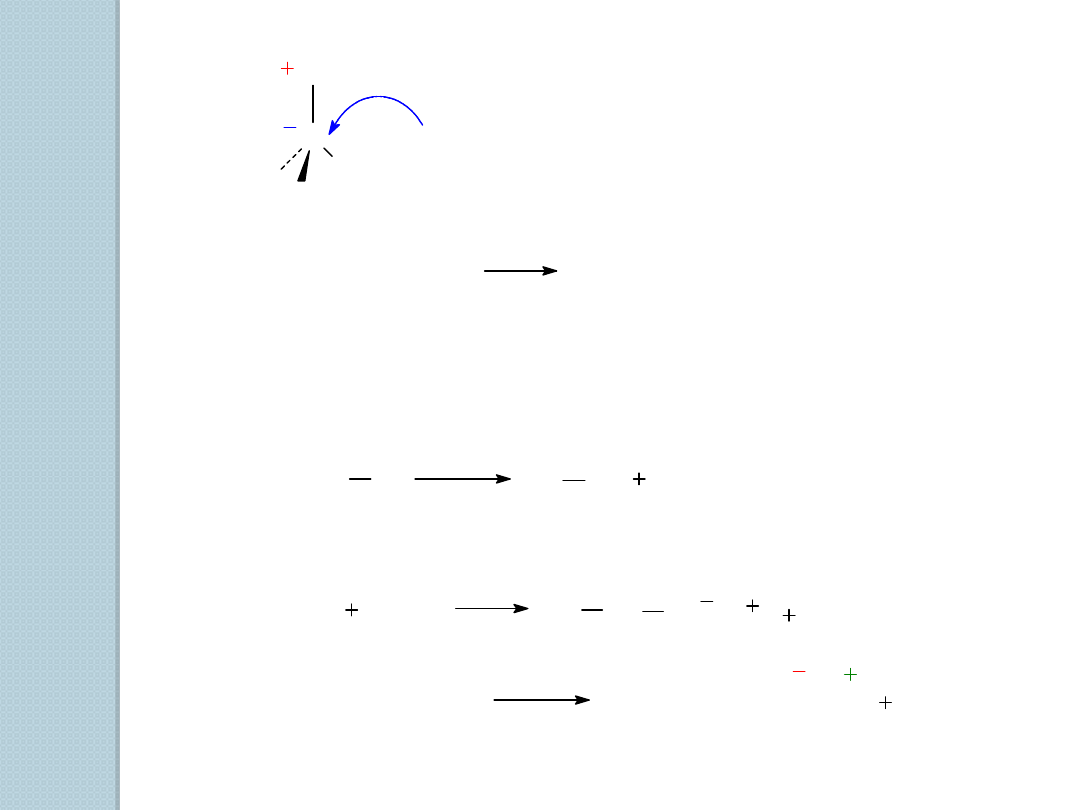
C
H
MgX
miejsce zasadowe i nukleofilowe
CH
3
(CH
2
)
8
CH
2
Br
CH
3
(CH
2
)
8
C
H
3
1.
Mg
2.
H
2
O
1-bromodekan
dekan (85%)
2. Tworzenie diorganomiedzianów (odczynników
Gilmana).
R
X
R
Li
pentan
Li
X
2 Li
gdzie R = 1
o
, 2
o
lub 3
o
alkil, aryl lub winyl
2
R
Li
CuI
eter
R
Cu
R
[
]
Li
Li
I
1-bromobutan
butylolit
2 Li
CH
3
CH
2
CH
2
CH
2
Br
pentan
Li
Br
CH
3
CH
2
CH
2
CH
2
Li

CH
3
Br
2 Li
Li
Br
pentan
CH
3
Li
metylolit
Li
I
eter
CH
3
Li
2
CuI
(CH
3
)
2
Cu
Li
metylolit
dimetylomiedzian(I) litu
(odczynnik Gilmana)
3. Sprzęganie związków metaloorganicznych.
R
2
CuLi
R' X
eter
R
R'
R
Cu
Li
X
(CH
3
)
2
CuLi
CH
3
(CH
2
)
8
CH
2
I
eter
CH
3
(CH
2
)
8
CH
2
CH
3
Li
I
CH
3
Cu
0
o
C
1-jododekan
undekan (90%)
dimetylo-
miedzian(I)
litu
Document Outline
- Slide 1
- Slide 2
- Własności halogenków alkilu
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
halogenki alkilowe
halogenowanie i alkilowanie
Zadania z reakcji substytucji nukleofilowej i eliminacji w halogenkach alkilowych
4 halogenki alkilowe
Halogenki alkilowe – substytucja nukleofilowa – grupa opuszczająca – kwasy i zasady
09 Halogenki alkilowe substytucja eliminacja 26 05 2011 zadania
Halogenki alkilów, studia
09 Halogenki alkilowe substytucja eliminacja materialy dodatkowe
Ściąga ALKOHOLE,?NOLE, ETERY, HALOGENKI ALKILOWE
4 halogenki alkilowe SN materiały [tryb zgodności]
halogenki alkilowe
halogenki alkilowe
ZADANIE 25 halogenki alkilowe
19A 12 05 2014 Ćwiczenie 12 1 KOLOKWIUM wynikiid 18603 pptx
12 dodatki mieszkanioweid 13240 pptx
12 Likwidacja spółkiid 13269 pptx
więcej podobnych podstron