2012-10-31
1
CH
2
CH
2
CH
3
H
2
C
Cl
CH
C
H
H
3
C
Br
CH
CH
3
C
CH
3
H
3
C
Br
CH
3
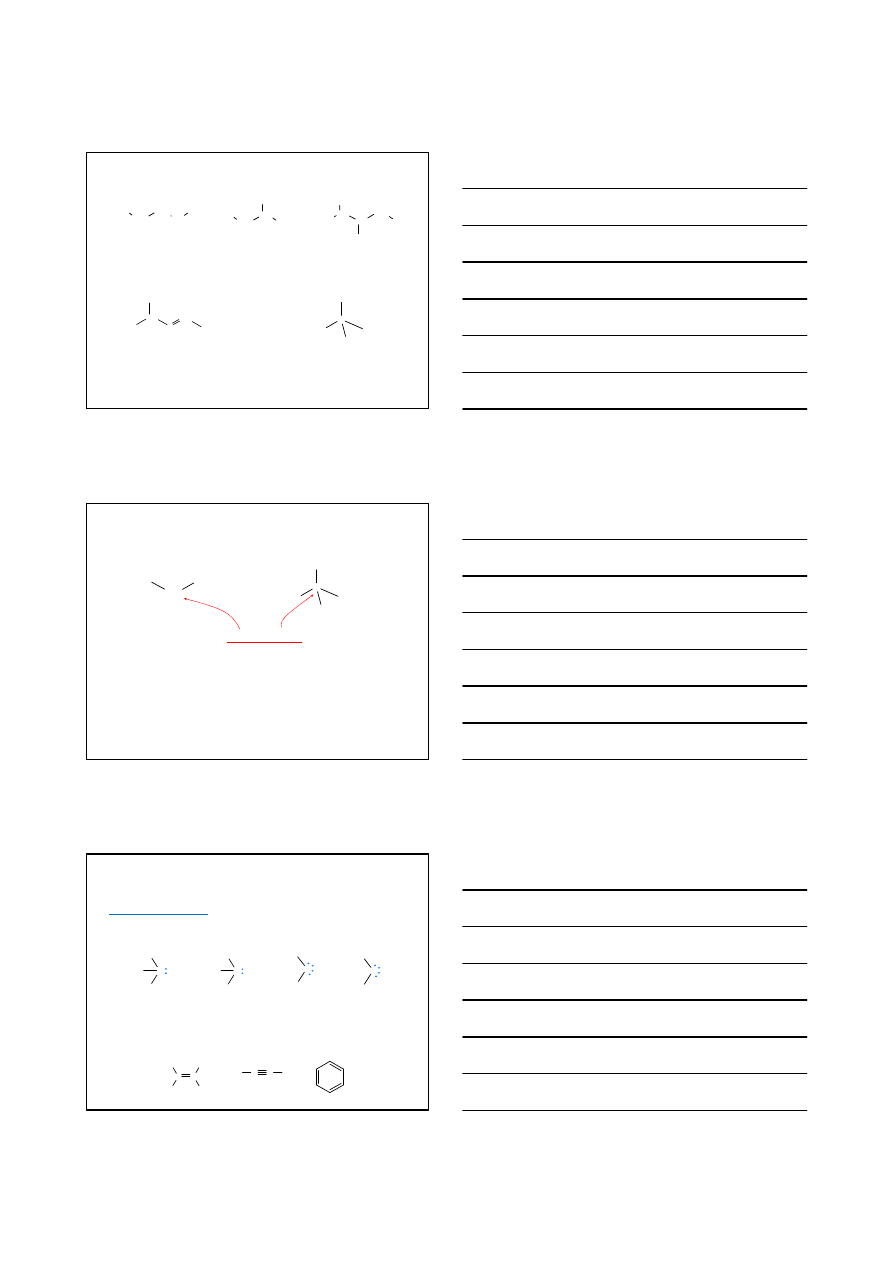
1-chlorobutan
1
o
4-bromobut-2-en
2
o
2-bromo-2-metylopropan
(bromek tert-butylu)
3
o
1-chloro-2-metylopropan
1
o
Halogenki alkilowe
1
1
2
3
4
1
2
3
4
1
2
3
1
2
3
5
CH
CH
3
H
2
C
Cl
CH
3
CH
CH
H
3
C
CH
3
CH
2
CH
3
Br
3-bromo-2-metylopentan
2
o
1
2
3
4
5
C
CH
3
H
3
C
Br
CH
3
δ
−
δ
+
Halogenki alkilowe
CH
3
H
2
C
Cl
δ
−
δ
+
centrum elektrofilowe
(miejsce w cząsteczce o najmniejszej
gęstości elektronowej)
2
Halogenki alkilowe
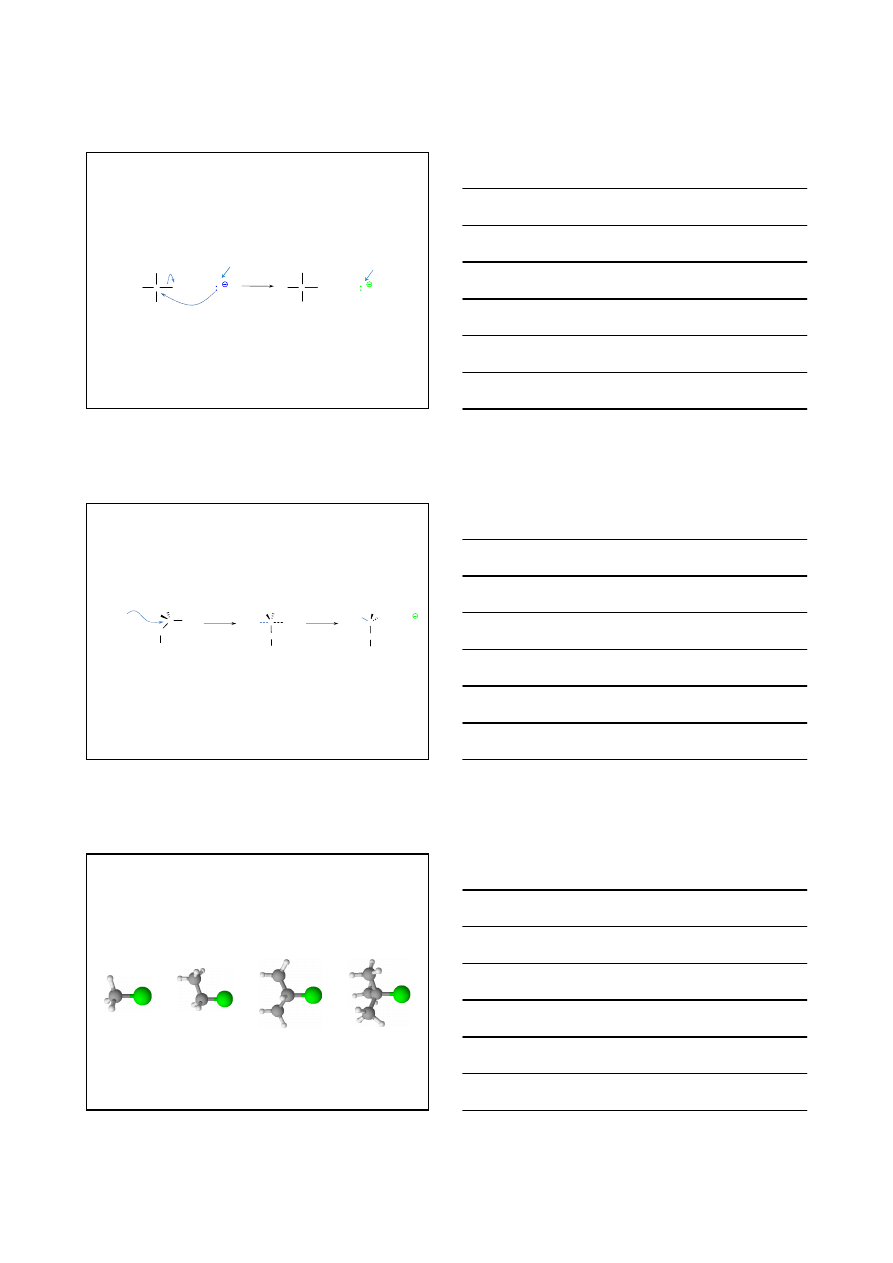
Odczynniki nukleofilowe
to odczynniki, które w reakcji oddają elektrony do
centrum elektrofilowego lub tworzą z tym centrum wiązanie kowalencyjne
kosztem własnych elektronów
H
N
H
H
H
O
H
H
N
H
R
R
O
H
amoniak (
N
H
3
)
aminy (R-
N
H
2
)
woda (H
2
O
)
alkohole (R-
O
H)
X
-
H
O
-
R
O
-
H
S
-
H
3
C
-
C
C
H
H
H
H
C
C
H
H
3
2012-10-31
2
Halogenki alkilowe
Substytucja nukleofilowa polega na ataku
odczynnika nukleofilowego
na
karbokation
lub
miejsce w cz
ąsteczce o najmniejszej gęstości elektronowej
+
Z
C
X
δ
+
δ
−
C
Z
X
+
grupa odchodząca
nukleofil
4
Halogenki alkilowe
Substytucja nukleofilowa dwucz
ąsteczkowa - reakcja S
N
2
Reakcja S
N
2 zachodzi jednoetapowo przez kompleks aktywny,
który rozpada się z wytworzeniem produktów
C
Cl
H
H
2
C
H
CH
3
H
O
-
wolno
szybko
Reakcja zachodzi w wyniku zderzenia cząsteczki 1-chloropropanu z anionem OH
-
V =k[OH
-
] x [CH
3
CH
2
CH
2
-Cl]
Szybkość reakcji zależy od stężenia dwóch reagentów.
+
Cl
1-chloropropan
propan-1-ol
kompleks aktywny
C
Cl
H
CH
2
H
CH
3
H
O
C
H
CH
2
H
CH
3
HO
5
Halogenki alkilowe
reakcja S
N
2 – czynnik steryczny
Szybkość reakcji S
N
2 halogenków z
nukleofilem
zależy od wielkości podstawników
wokół atomu węgla o najmniejszej gęstości elektronowej (
δ
+
);
1
o
2
o
3
o
CH
3
-X
CH
3
-X
>
1
o
2
o
3
o
>
>
Im mniejsze podstawniki wokół centrum elektrofilowego tym reakcja S
N
2 zachodzi szybciej
6
2012-10-31
3
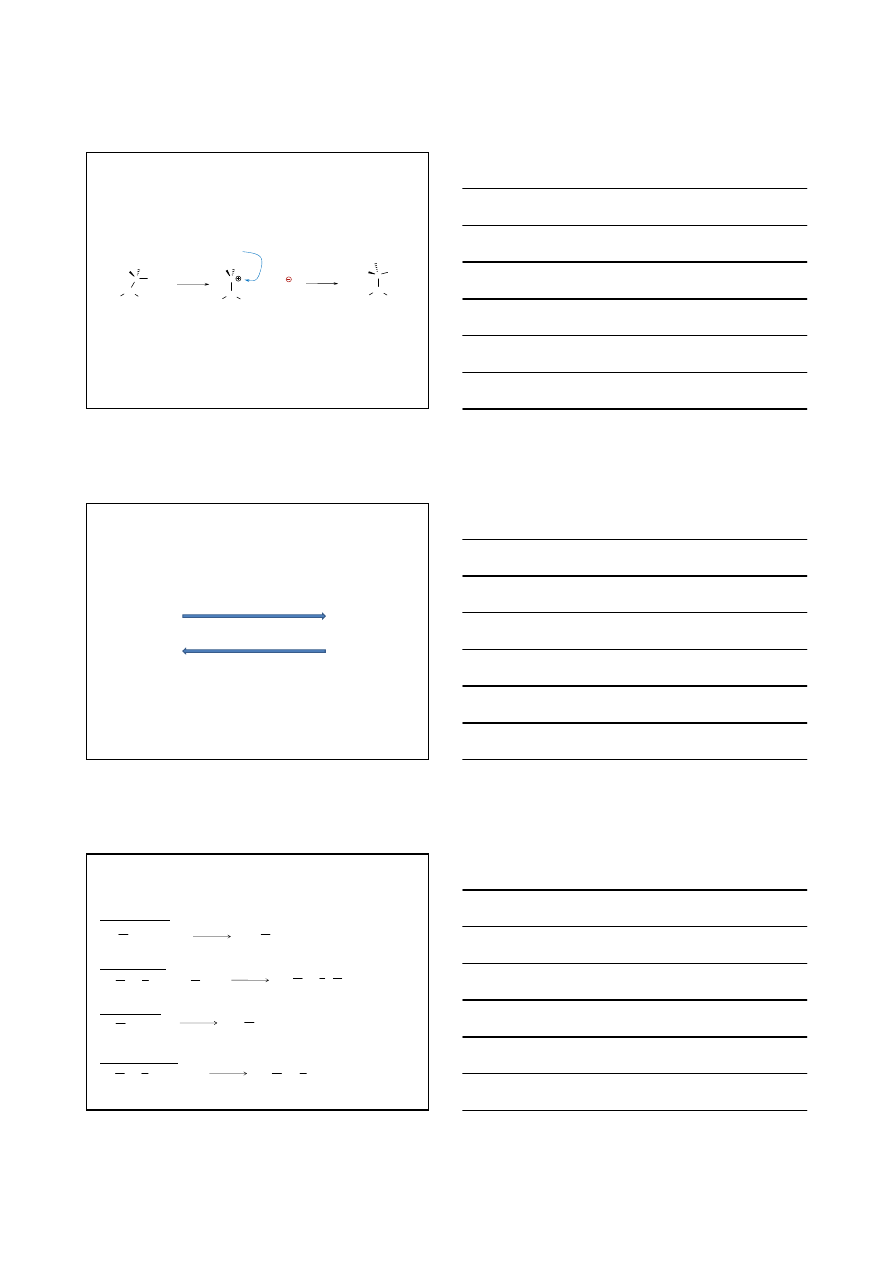
Halogenki alkilowe
Substytucja nukleofilowa jednocz
ąsteczkowa - reakcja S
N
1
W reakcji S
N
1, w najwolniejszym etapie,
tworzy się karbokation
,
który reaguje z
nukleofilem
C
CH
2
CH
3
CH
H
3
C
CH
3
H
3
C
C
Br
CH
2
CH
3
CH
H
3
C
CH
3
H
3
C
+
Br
wolno
H
O
-
szybko
Szybkość reakcji zależy jedynie od stężenia 3-bromo-2,3-dimetylopentanu.
Reakcja jest jednocząsteczkowa.
V = k [3-bromo-2,3-dimetylopentan]
3-bromo-2,3-dimetylopentan
2,3-dimetylopentan-3-ol
C
H
3
CH
2
C
CH
H
3
C
CH
3
H
3
C
O
H
7
karbokation
Halogenki alkilowe
Porównanie reakcji S
N
1 i S
N
2
CH
3
-X
>
1
o
2
o
3
o
>
>
Udział reakcji S
N
1
Udział reakcji S
N
2
8
Halogenki alkilowe
Przykłady reakcji substytucji nukleofilowej
H
3
C
Cl
+
Na
OH
H
3
C
OH
+
Na
Cl
otrzymywanie alkoholi
H
3
C
CH
2
Br
+ H
3
C
O
-
Na
+
H
3
C
CH
2
O
CH
3
+
Na
Br
otrzymywanie eterów
otrzymywanie amin
H
3
C
Cl
+
NH
3
H
3
C
NH
2
+
H
Cl
otrzymywanie tioalkoholi
H
3
C
CH
2
Br
Na
HS
+
H
3
C
CH
2
SH
Na
Br
+
chlorometan
metanol
bromoetan
eter etylowo-metylowy
metanolan sodu
chlorometan
metyloamina
bromoetan
etanotiol
H
2
O
9
2012-10-31
4
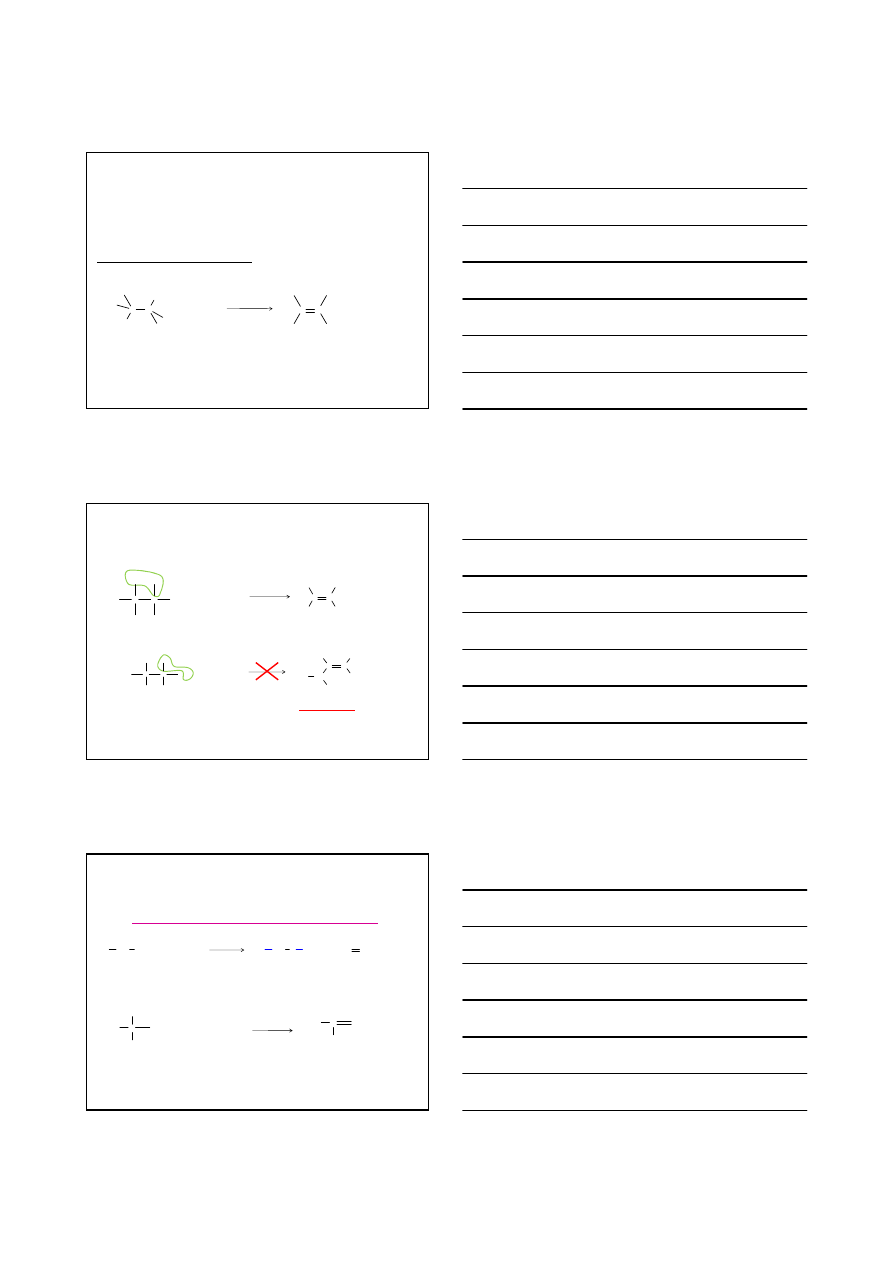
Halogenki alkilowe
Reakcja eliminacji
C
C
H
X
C
C
KOH
etanol
+
K
X
Dehydrohalogenacja halogenków alkilowych
halogenek alkilowy
alken
+
+
H
2
O
10
Halogenki alkilowe
Reakcja eliminacji – reguła Zajcewa
C
C
CH
3
Cl
H
H
CH
3
H
3
C
C
C
H
3
C
H
3
C
H
CH
3
KOH
+
etanol
K
Cl
+
H
2
O
+
2-chloro-3-metylobutan
2-metylobut-2-en
C
C
H
H
C H
H
C H
3
H
3
C
C
C
C H
3
C l
H
H
C H
3
H
3
C
KOH
+
etanol
2-chloro-3-metylobutan
K
Cl
+
H
2
O
+
3-metylobut-1-en
NIE POWSTAJE
11
Halogenki alkilowe
Porównanie reakcji
substytucji
i eliminacji
Z reakcją substytucji nukleofilowej konkuruje reakcja eliminacji
H
3
C
CH
2
Br
+
CH
3
O
-
Na
+
metanol
H
3
C
CH
2
O
CH
3
Na
Br
+
Bromoetan
(1
o
)
eter etylowo-metylowy
produkt substytucji (S
N
2)
90%
metanolan sodu
+
CH
3
O
-
Na
+
metanol
Na
Br
+
2-bromo-2-metylopropan
(3
o
)
2-metylopropen
produkt eliminacji
metanolan sodu
H
3
C
C
CH
3
Br
CH
3
H
3
C
C
CH
2
CH
3
H
2
C
CH
2
+
eten
produkt eliminacji (E)
10%
12
2012-10-31
5
C
C
CH
3
Cl
H
H
CH
3
H
3
C
C
C
H
3
C
H
3
C
H
CH
3
+
K
Cl
+
H
2
O
+
2-chloro-3-metylobutan
2-metylobut-2-en
produkt eliminacji
Halogenki alkilowe
Porównanie reakcji
substytucji
i eliminacji
C
C
CH
3
Cl
H
H
CH
3
H
3
C
K
OH
+
H
2
O
K
Cl
+
2-chloro-3-metylobutan
C
C
CH
3
OH
H
H
CH
3
H
3
C
3-metylobutan-2-ol
produkt substytucji
13
CH
3
O
-
Na
+
metanol
Halogenki arylowe
Reakcja substytucji nukleofilowej
Cl
K
OH
+
H
2
O
OH
K
Cl
+
Cl
NO
2
O
2
N
K
OH
+
H
2
O
OH
NO
2
O
2
N
K
Cl
+
14
Halogenki alkilowe i arylowe
Odczynniki Grignarda
+
H
3
C
CH
2
Br
bromoetan
Mg
eter
H
3
C
CH
2
Mg
Br
bromek etylomagnezowy
δδδδ
+
δ
+
δ
−
δδδδ
−−−−
Związki Grignarda są bardzo reaktywne.
W reakcjach zachowują się jak
nukleofile
.
Br
+
Mg
eter
Mg
Br
bromobenzen
bromek fenylomagnezowy
centrum nukleofilowe
δδδδ
+
δ
−
δ
+
δδδδ
−−−−
15
2012-10-31
6
Mg
Br
Halogenki alkilowe
Odczynniki Grignarda
CH
3
Mg
Br
+
H
2
O
δ
+
δ
−
eter
CH
3
H
+
Mg
(OH)
Br
bromek
metylomagnezowy
metan
+
CO
2
eter
H
+
sól
kwasu karboksylowego
kwas karboksylowy
(kwas benzoesowy)
bromek
fenylomagnezowy
δ
+
δδδδ
−−−−
COO
Mg
Br
COOH
16
CH
3
C
CH
3
H
H
propan
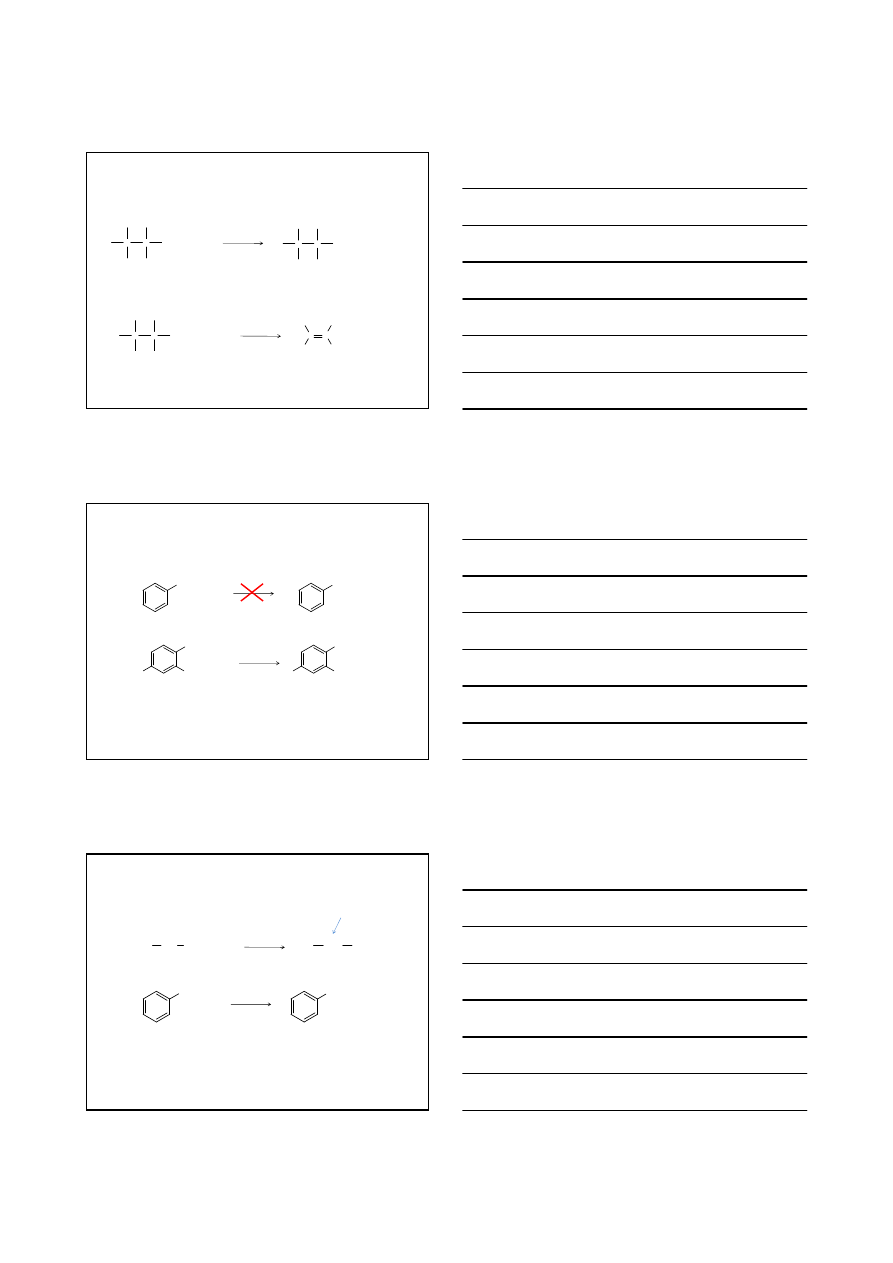
Cząsteczka i jej odbicie
lustrzane są identyczne.
Cl
C
CH
3
H
H
chloroetan
17
Atom węgla związany z czterema
różnymi podstawnikami
2-chlorobutan
Cząsteczka i jej odbicie lustrzane nie są identyczne
Cl
C
CH
3
H
H
3
CH
2
C
Cl
C
CH
3
H
H
3
CH
2
C
Cl
C
H
3
C
H
CH
2
CH
3
dwie różne cząsteczki
18
2012-10-31
7
H
2
C C
CH
2
CH
3
CH
2
H
CH
3
H
3
C
H
3
C C
CH
2
CH
2
Cl
CH
3
H
CH
3
C
CH
3
OH
H
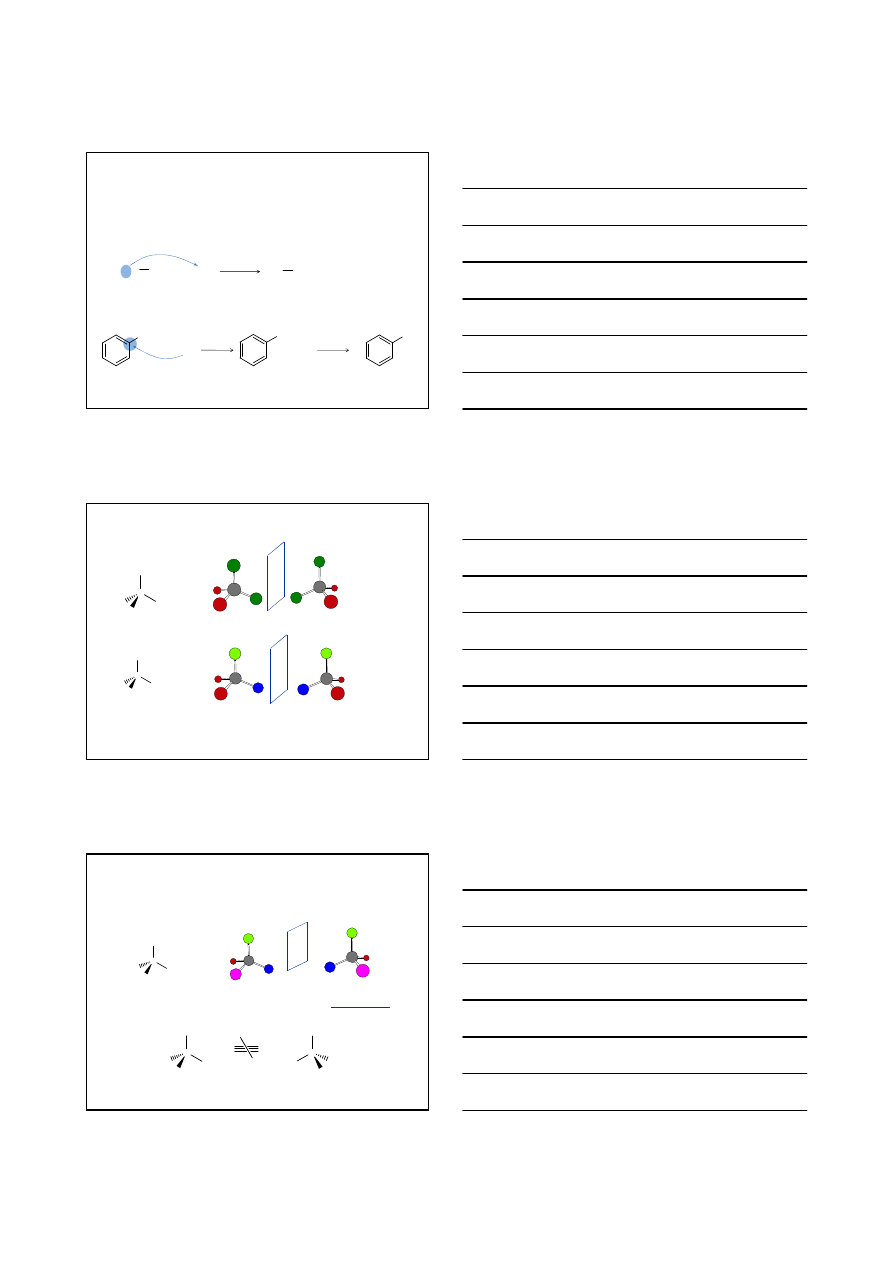
Przykłady cząsteczek chiralnych
1-fenyloetan-1-ol
3-metyloheksan
1-chloro-2-metylobutan
3-metylocykloheksen
HC
HC
C
H
2
CH
2
CH
2
C
CH
3
H
Cząsteczka nie mo
że być chiralna jeśli ma płaszczyznę symetrii!
19
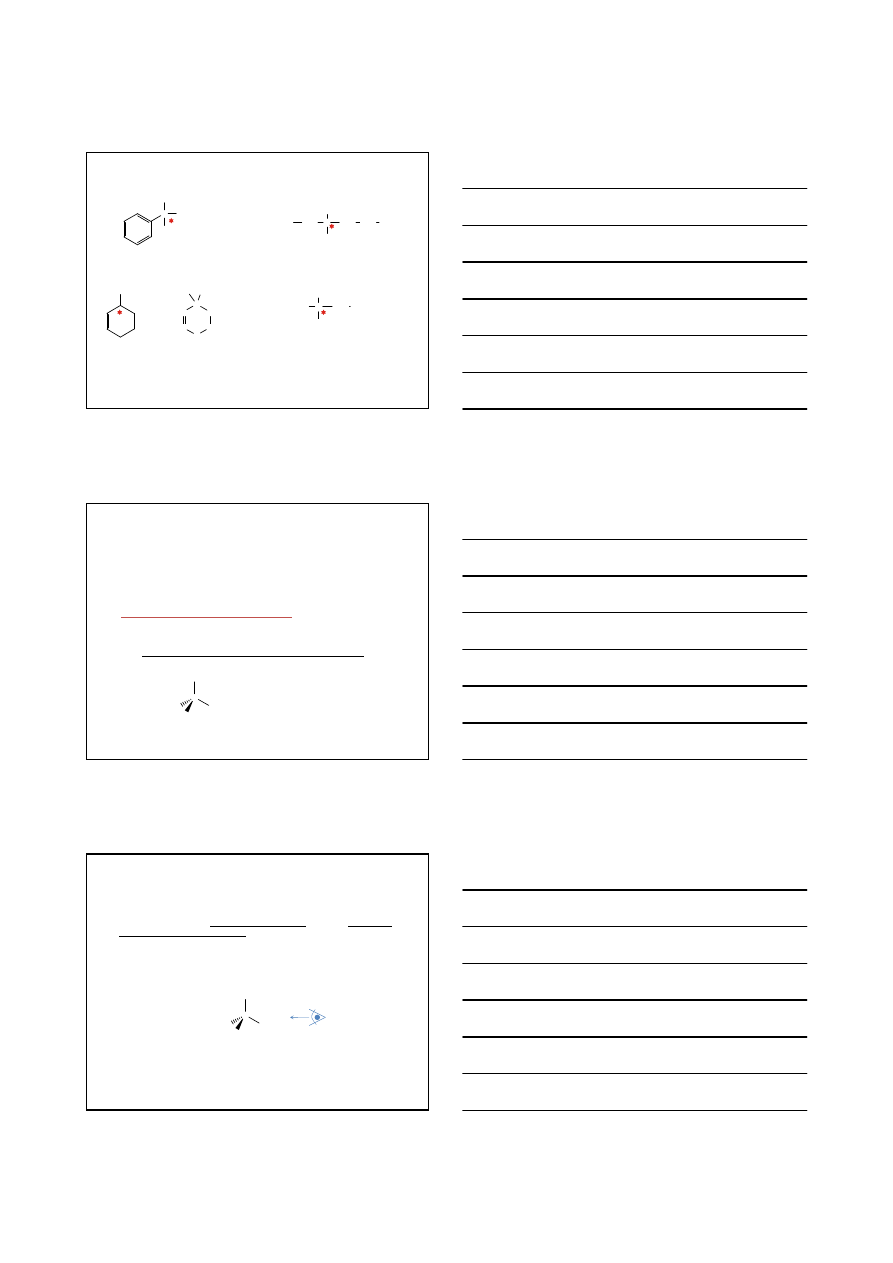
Konfiguracja absolutna R i S
Konwencja ułatwiająca opis trójwymiarowego ułożenia atomów wokół
centrum stereogenicznego
Reguły pierwszeństwa Cahna – Ingolda – Preloga
Cl
C
CH
3
H
I
1.
Rozpatrz atomy bezpośrednio związane z centrum stereogenicznym
i ponumeruj podstawniki zgodnie z malej
ącą liczbą atomową:
1
2
3
4
20
2. Jeśli reguła nr 1 nie rozstrzyga o kolejności, rozpatrz kolejne atomy
3. Narysuj cząsteczkę tak, by grupa najmniej wa
żna znalazła się jak najdalej
od obserwatora (za płaszczyzn
ą)
Cl
C
CH
3
H
I
1
2
3
4
21
2012-10-31
8
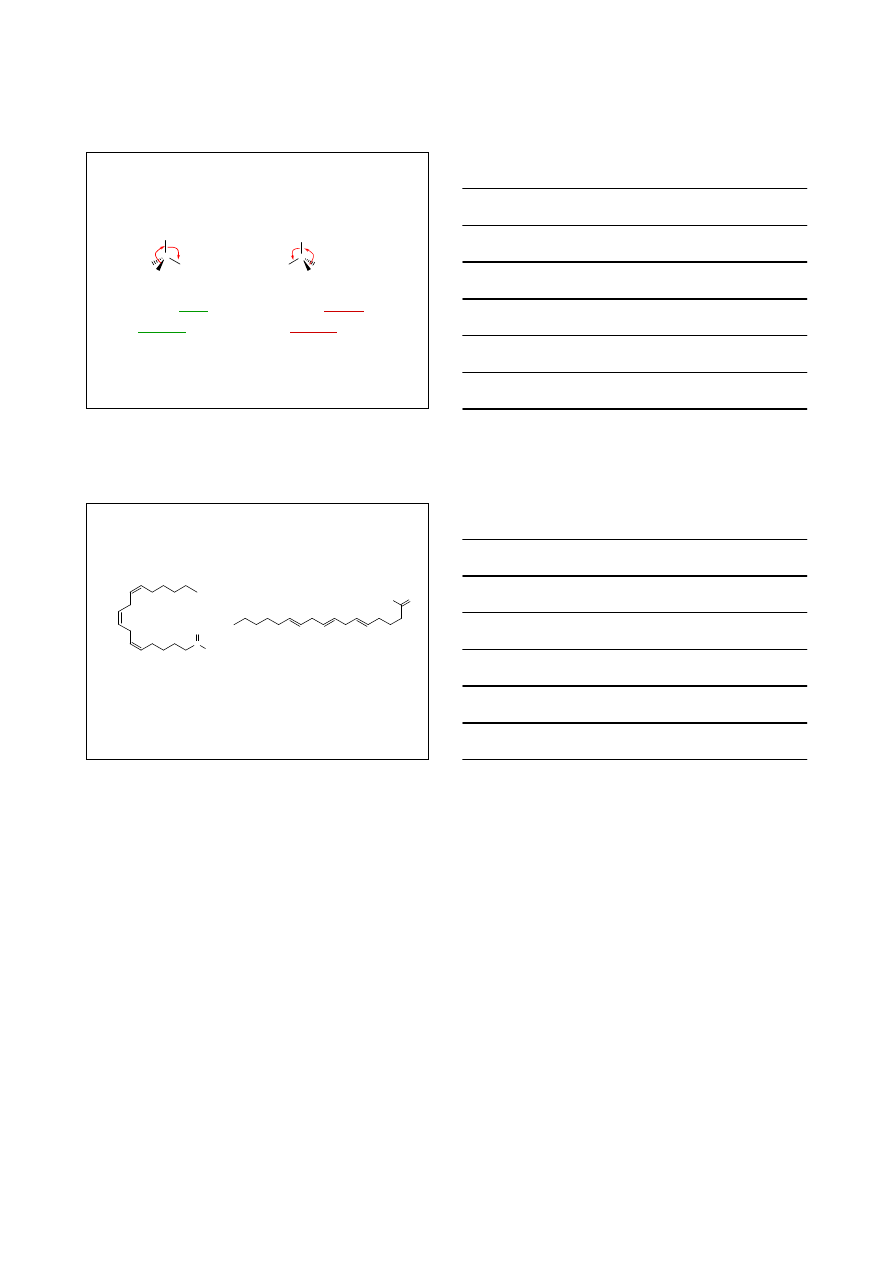
poruszamy się
zgodnie
ze wskazówkami zegara
enancjomer R
poruszamy się
przeciwnie
do wskazówek zegara
enancjomer S
4. Przejdź od podstawnika najważniejszego (1) przez (2), do (3)
Cl
C
CH
3
H
I
1
2
3
4
Cl
C
H
3
C
H
I
2
3
1
4
22
23
C
O
OH
cis
cis
cis
Kwas
γ
-linolenowy C
18
18:3 (n-6)
HO
O
trans
trans
trans
Wyszukiwarka
Podobne podstrony:
00 Podstawy zarzdzania SS i SN Konin [tryb zgodnoci]
Bankowosc materialy 14 [tryb zgodnosci]
3 Materiały półprzewodnikowe, własności, wytwarzanie i ich obróbka mechaniczna [tryb zgodności]
21 materia skondensowana [tryb zgodności]
22 materia skondensowana [tryb zgodności]
Bankowosc materialy 2014 [tryb zgodnosci]
09 Halogenki alkilowe substytucja eliminacja materialy dodatkowe
Sprawozdanie 3 (tryb zgodności), Prywatne, Budownictwo, Materiały, IV semestr, od Beaty, Semestr 4,
Bankowosc materialy 14 [tryb zgodnosci]
3 Materiały półprzewodnikowe, własności, wytwarzanie i ich obróbka mechaniczna [tryb zgodności]
22 materia skondensowana [tryb zgodności]
Microsoft PowerPoint Alergia na materiały protetyczne [tryb zgodności]
Bankowosc materialy 2014 [tryb zgodnosci]
2012 KU W5 tryb dzienny moodle tryb zgodnosci
(W7a Stale do kszta t na zimno cz I [tryb zgodno ci])
2 Sieci komputerowe 09 03 2013 [tryb zgodności]
więcej podobnych podstron