1. Które z poniższych związków maja moment dipolowy różny od zera? Jaki jest jego kierunek? (3)

2. Dorysuj do poniższej struktury brakujące pary elektronowe (1). Określ hybrydyzację poszczególnych atomów węgla i azotu oraz rodzaje wiązań pomiędzy atomami cząsteczki (1). Wskaż parę elektronową (podaj krótkie wyjaśnienie):
a. o najwyższej energii; (1)
b. trzecią pod względem energii. (1)
3. Wskaż wypadkowy moment dipolowy (jeśli taki istnieje) poniższych cząsteczek (2):
a. CH3Cl b. C(CH3)4 C. ClCH2Br
4. Które z poniższych związków mogą tworzyć wiązania wodorowe? (2)
a. CH3CH2OH b. CH2O c. C2H2 d. CH3OCH3
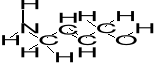
5. W każdym z poniższych związków wskaż wiązanie o najwyższej energii (najsilniejsze) spośród wskazanych strzałkami i podaj uzasadnienie wyboru. (3)
6. Narysuj izomery konstytucyjne dla C5H12. Który z nich ma najwyższą, a który najniższą temperaturę wrzenia? (3)
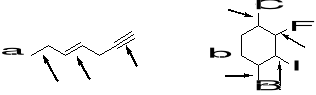
7. Wskaż kierunek momentu dipolowego (jeśli taki istnieje) dla poniższych związków. (3)
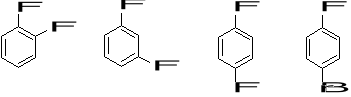
8. Histamina jest ważnym związkiem naturalnym odpowiedzialnym m.in. za reakcje alergiczne. Na których atomach histaminy znajdują się wolne pary elektronowe i na jakich orbitalach są usytuowane? Czy są one zlokalizowane czy zdelokalizowane? (3)
![]()
9. Kwas butanowy jest rozpuszczalny w wodzie. Narysuj jego izomer konstytucyjny nierozpuszczalny w wodzie i wyjaśnij przyczynę jego słabej rozpuszczalności. (2)
![]()
10. Z którego rodzaju oddziaływania orbitali atomowych p może powstać orbital molekularny (jaki?) - równoległego bocznego (a) czy prostopadłego (b)? Podaj wyjaśnienie. (3)
![]()
11. Która z cząsteczek - HeH+ czy HeH- - będzie trwała? Wyjaśnij posługując się wykresem orbitali molekularnych.
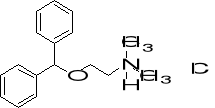
12. Jaki jest ładunek formalny heteroatomów w Benadrylu (lek antyhistaminowy, związek w postaci chlorowodorku)? (3)
13. Poniższe związki ustaw od najbardziej lotnego do najwyżej wrzącej cieczy. Uzasadnij
wybraną kolejność. (3)
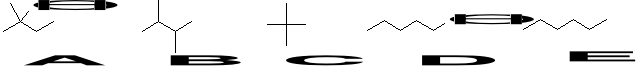
14. Posługując się wiedzą na temat oddziaływań molekularnych wskaż i uzasadnij, który ze związków w poniższych parach ma wyższą temperaturę wrzenia (3):
a. pentan czy oktan;
b. alkohol etylowy czy eter dimetylowy;
c. 2,2-dimetylopropanol czy 1-butanol.
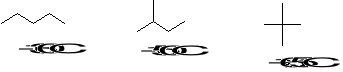
15. Wyjaśnij różnice w temp. topnienia poniższych izomerycznych alkanów. (3)
16. W poniższych związkach zidentyfikuj wolne pary elektronowe (jeśli trzeba, to dorysuj je). Podaj na jakich orbitalach się znajdują. (3)
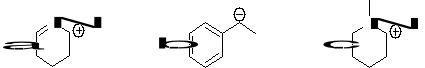
16. Jaka jest hybrydyzacja atomów węgla w poniższym związku: (3)
17. Dlaczego temperatura wrzenia etanotiolu (CH3CH2SH) jest niższa od etanolu (35 w stosunku do 78.5°C), a wyższa od eteru dimetylowego (-24°C)? (3)
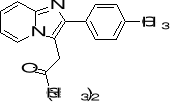
18. Określ hybrydyzację atomów węgla i azotu w Zolpidemie (lek uspokajający). (3)
Wyszukiwarka
Podobne podstrony:
semquiz 13-4, 1
semquiz 13 5 doc
13 ZMIANY WSTECZNE (2)id 14517 ppt
13 zakrzepowo zatorowa
Zatrucia 13
pz wyklad 13
13 ALUid 14602 ppt
pz wyklad 13
ZARZ SRODOWISKIEM wyklad 13
Biotechnologia zamkniete użycie (2012 13)
Prezentacja 13 Dojrzewanie 2
SEM odcinek szyjny kregoslupa gr 13 pdg 1
w 13 III rok VI sem
Wykład 13 UKS
więcej podobnych podstron