
CHEMIA
Tematy prac kontrolnych
ramowy plan nauczania
Klasa II liceum
ogólnokształcącego
Kształcenie w zakresie podstawowym
Warszawa 2009

Zalecany podręcznik: Bożena Kałuża, Feliksa Kamińska część I - Chemia
ogólna i nieorganiczna, część II - Chemia organiczna - dla liceum i
technikum, Wydawnictwo Edukacyjne Zofii Dobkowskiej „ Żak" Warszawa
W klasie drugiej poznamy bliżej roztwory i procesy w nich zachodzące:
dysocjację jonową elektrolitów oraz niektóre typy reakcji między jonami.
Poznamy sposoby wyrażania stężeń roztworów, nauczymy się, jak
określać stężenie danego roztworu. Poznamy pojęcie rozpuszczalności i
zdobędziemy umiejętność odczytywania jej wartości z odpowiedniego
wykresu.
Poszerzymy naszą wiedzę o niemetalach oraz wydzielonej grupie
pierwiastków - najbardziej znanych metalach.
Zajmiemy się również podstawami chemii organicznej. Na przykładzie
najprostszych związków organicznych - węglowodorów - rozpatrzymy
zjawisko izomerii, właściwości homologów, budowę cząsteczek
węglowodorów nasyconych i nienasyconych oraz wynikających z ich
budowy różnic we właściwościach. Poznamy także obowiązujące
nazewnictwo związków organicznych, zalecane przez Polskie Towarzystwo
Chemiczne
Kryteria przeliczania punktów na ocenę :
3 0
- 27 pkt. - celujący
2 6
24 pkt.
- bardzo dobry
2 3
- 2 1 pkt. - dobry
2 0
- 18 pkt. - dostateczny
1 7
1 5 pkt. - dopuszczający
14i
mniej
- niedostateczny

Co powinieneś umieć i wiedzieć:
1.
Roztwory
wyjaśnić istotę równowagi dynamicznej w roztworach,
uzasadnić podział roztworów na nasycone i nienasycone,
wiedzieć, jak sporządzić roztwór nasycony i jak przeprowadzić go w roztwór
nienasycony, a także znać proces odwrotny,
odczytać z wykresu rozpuszczalność danej substancji we wskazanej temperaturze,
obliczyć stężenie procentowe roztworu na podstawie znanej rozpuszczalności, przygotować
roztwór o określonym stężeniu procentowym i molowym, obliczyć stężenie procentowe i
molowe roztworu, przeliczać stężenie roztworu korzystając z jego gęstości, wykorzystać
znajomość stężenia do ustalania masy lub objętości roztworu, masy lub liczby moli
substancji rozpuszczanej.
2.
Dysocjacja elektrolityczna
wskazać elektrolity,
wskazać jony charakterystyczne dla roztworów zasad i kwasów, określić odczyn roztworu
elektrolitu,
wskazać zależność między stężeniem kationów wodorowych w roztworze, a pH tego
roztworu,
ułożyć równania dysocjacji dowolnego elektrolitu, odróżniać elektrolity słabe i mocne na
podstawie stopnia dysocjacji, znać co najmniej trzy rodzaje reakcji zachodzących między
jonami np. zobojętnianie, strącanie osadów, wypieranie gazów, uzasadnić odczyn roztworów
wodnych soli ulegających hydrolizie, układać równania reakcji jonowych, korzystać z tablicy
rozpuszczalności
3.
Właściwości wybranych pierwiastków
opisać właściwości pierwiastka na podstawie położenia w układzie okresowym,
podać wzory i główne właściwości poznanych związków węgla, krzemu i azotu,
wykazać, że związki krzemu są podstawowymi składnikami świata mineralnego,
przedstawić i skomentować obieg węgla w przyrodzie,
uzasadnić przyczyny zastosowań związków poznanych niemetali w życiu i gospodarce
człowieka,
uzasadnić właściwości metali istnieniem wiązań metalicznych,
rozróżniać metale aktywne i bierne chemiczne,
korzystać z szeregu reaktywności metali przy pisaniu równań reakcji.
4. Węglowodory
rozumieć przyczynę istnienia ogromnej liczby związków węgla, podać wzór alkanu, alkenu
lub alkinu mając jego nazwę, nazwać dany węglowodór znając jego nazwę, wyjaśnić istotę
reakcji podstawienia (substytucji), rozumieć pojęcie szeregu homologicznego, wyjaśnić
różnice i podobieństwa we właściwościach homologów, przedstawić wzory strukturalne lub
półstrukturalne izomerów szkieletowych i izomerów położenia podstawnika oraz nadać im
nazwy zgodne z zasadami preferowanymi przez Polskie Towarzystwo Chemiczne, określić
rzędowość atomów węgla w cząsteczce węglowodoru, wykazać różnice i podobieństwa we
właściwościach alkanów i cykloalkanów, przedstawić na wybranym przykładzie reakcję
przyłączania (addycji) jako charakterystyczną dla węglowodorów nienasyconych, podać wzór
i nazwę dowolnego izomeru geometrycznego cis-trans, wyjaśnić istotę polimeryzacji i

depolimeryzacji, wskazać monomer i polimer, wykazać znaczenie tworzyw sztucznych i
syntetycznych w gospodarce i życiu codziennym człowieka,
znać sposoby otrzymywania najprostszych węglowodorów nienasyconych, rozumieć istotę
reakcji eliminacji,
porównać właściwości chemiczne węglowodorów nasyconych i nienasyconych na
przykładzie benzenu omówić budowę cząsteczki związku aromatycznego, - wyjaśnić, jak się
tworzy i czym się charakteryzuje wiązanie zdelokalizowane, co oznacza określenie „sekstet
elektronowy",
ułożyć równania reakcji spalania, nitrowania, bromowania, uwodorniania związków
aromatycznych,
wykazać różnicę w reaktywności benzenu i jego homologów,
ustalić wzór węglowodoru na podstawie jego składu procentowego lub ilości produktów
spalania danej próbki węglowodoru.

T E M A T Y P R A C K O N T R O L N Y C H
P r a c a k o n t r o l n a n r l
Temat: Roztwory
Zadanie 1(4 pkt.) - Jak rozumiesz następujące terminy: a/ składnik mieszaniny, b/ rozpuszczalnik,
c/ rozpuszczalność, d/ roztwór właściwy.
Zadanie 2(3 pkt.) - Ustal, ile składników mają następujące mieszaniny:
a/ woda, olej, cukier, b/ woda, lód, alkohol, c/ para wodna, lód, woda
Zadanie 3(3 pkt.) - Podaj 3 przykłady substancji, w których wodnych roztworach
stwierdzimy efekt Tyndalla.
Zadanie 4(3 pkt.) - Wskaż 3 czynniki, od których zależy rozpuszczalność substancji sta -
łych.
Zadanie 5(4 pkt) - Rozpuszczalność saletry potasowej
KNO3
w temperaturze 25°C wynosi 40 g w 100
g wody, a w temperaturze 75°C - 150 g w 100 g wody Oblicz, ile gramów tej
soli wykrystalizuje z 250 g nasyconego
w temperaturze75°C roztworu
KNO3
po obniżeniu temperatury
do 25°C?
Zadanie 6(5 pkt.) - Ile gramów cukru należ dodać do 250 g 10%-owego roztworu
wodnego tej substancji, aby otrzymać roztwór 15%-owy?
Zadanie 7(4 pkt.) - Jakie jest stężenie molowe wodnego roztworu zasady sodowej, jeśli
w 200 cm
3
zawiera on 0,8 g tej substancji ?
Zadanie 8(4 pkt.) - Ustal wzór sumaryczny związku zawierającego 23,08 % masowych
(dla chętnych)
magnezu i 30,77 % masowych siarki. Trzecim składnikiem jest tlen.
Dwudziestoprocentowy wodny roztwór tego związku jest roztworem
dwumolowym o gęstości 1,04 g«cm"
3
.

P r a c a k o n t r o l n a nr 2
Ułóż równania dysocjacji podanych kwasów uwzględniając
fakt, że dysocjacja kwasów wieloprotonowych zachodzi
stopniowo. Kwasy: a/ azotowy(V), siarkowy(VI) i ortofosforowy(V)
Dlaczego woda destylowana nie przewodzi prądu elektrycznego, podobnie
jak stały chlorek sodu, zaś wodny roztwór chlorku sodu prąd przewodzi ?
Jakie indywidua chemiczne znajdują się w wodnym roztworze sła-Lego
kwasu azotowego(III)
HNO2
i dlaczego?
Na podstawie wartości pH określ odczyn wodnego roztworu substancji:
a/ płynu do prania"Perła" pH = 8,5
b/ napoju Coca Cola pH = 2,8
cl wody sodowej
pH = 5
dl wody destylowanej pH = 7
Ułóż równania jonowe reakcji, w których wyniku otrzymasz: a/
wodorotlenek glinu Al.(OH
)3
b/ siarczan(VI) sodu Na
2SO4
cl siarczek amonu
(NH
4
)2
S dl chlorek srebra AgCl
Wyjaśnij, pisząc równania odpowiednich reakcji, dlaczego wodny roztwór
soli
K2S
ma odczyn zasadowy, a wodny roztwór CuCk -odczyn kwasowy ?
W reakcji sodu z wodą wydzieliło się 11,2 dm
3
wodoru mierzonego w
warunkach normalnych. Oblicz, ile gramów sodu brało udział w tej reakcji i
ile gramów wodorotlenku sodu otrzymano ?
Do 8 gramów NaOH dodano kwas solny i otrzymano tylko sól i wodę. Ile
gramów soli powstało w tej reakcji ?
Korzystając z tablicy rozpuszczalności, spośród podanych substancji : Na
2
S,
AgN0
3
, CuCl
2
. HC1, KOH wybierz substraty trzech reakcji,
w których strącą się osady. Ułóż równania cząsteczkowe i jonowe tych
reakcji.
Temat:
Dysocjacja
elektrolityczna
Zadanie 1(3 pkt.)
Zadanie 2(3 pkt.)
Zadanie 3(2 pkt.)
Zadanie 4(2 pkt.)
Zadanie 5(4 pkt.)
Zadania 6(4 pkt.)
Zadanie 7(5 pkt.)
Zadanie 8(3 pkt.)
Zadanie 9(4 pkt.)
(dla chętnych)

P r a c a k o n t r o l n a nr 3
Temat; Właściwości wybranych pierwiastków
Zadanie 1(2 pkt.) - Określ pH roztworu kwasu azotowego(V) o stężeniu 0,001 mol/dm
3
.
Przyjmij stopień dysocjacji równy 100%.
Zadanie 2(2 pkt.) - Wyjaśnij, dlaczego metale:
a/mają połysk, b/ przewodzą prąd elektryczny
Zadanie 3(4 pkt.) - Opisz właściwości fizyczne i chemiczne żelaza.
Zadanie 4(2 pkt.) - Wskaż sposoby ochrony przed korozją: a/ siatki ogrodzeniowej,
b/ roweru na zimę, c/ maszyny do szycia, d/ przęseł mostu.
Zadanie 5(4 pkt.) - Uzasadnij prawdziwość następujących stwierdzeń:
a/ Tlenek krzemu(IV) jest tlenkiem kwasowym, b/ H
4
Si04 jest kwasem nietrwałym.
c/ Wodne roztwory soli sodowych kwasów krzemowych mają odczyn
zasadowy.
Zadanie 6(4 pkt.) - Do probówek z wodą destylowaną wprowadzono: Si02,
CO2,
NH3, Na
2
CO3, NaN03 .Określ odczyn roztworów i ułóż równania reakcji
potwierdzających odczyn zasadowy i kwasowy.
Zadanie 7(3 pkt.) - Spalono 64 g gazu ziemnego(zakładamy, że był to czysty metan
o wzorze CH
4
) .Otrzymany tlenek węgla(IV) wprowadzono do wody
wapiennej. Strącił się biały osad. Osad osuszono i zważono. Jaka była masa
osadu ?
Zadanie 8(5 pkt.)
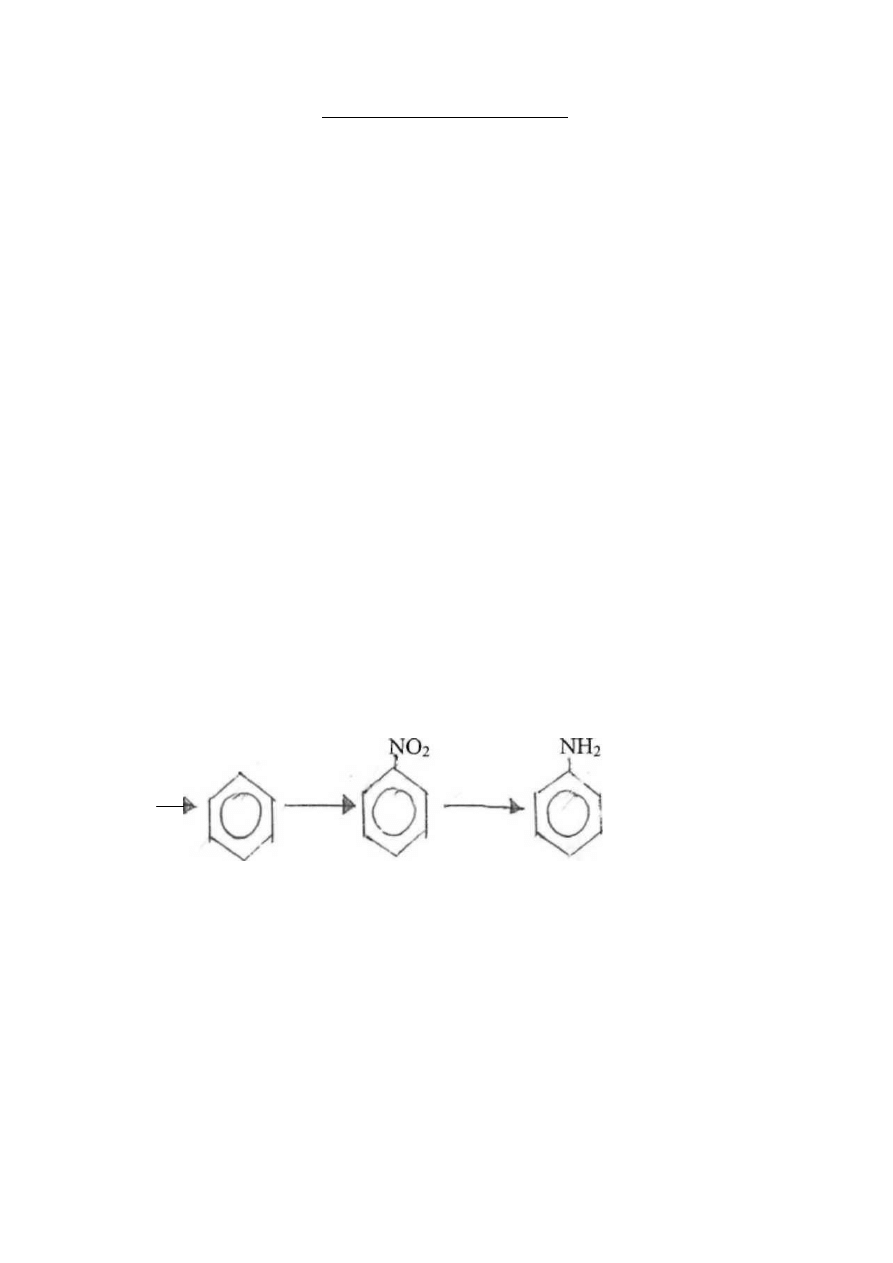
Ułóż równania reakcji przedstawionych za pomocą schematu:
FeCl
3
Fe
→
Fe
2
O
3
→
Fe
2
(S0
4
)
2
→
Fe(OH)
3
FeCl
2
Zadanie 9(4 pkt.)
(dla chętnych)
Na roztwór kwasu siarkowego(VI) podziałano magnezem. Otrzymano 5,6
dm
3
wodoru mierzonego w warunkach normalnych. Oblicz:
a/ ile gramów siarczanu(VI) magnezu powstało jednocześnie ? b/jaka była
masa użytego magnezu /
P r a c a k o n t r o l n a nr 4
Temat: Węglowodory nasycone i nienasycone
Zadanie 1(4 pkt.)
Zadanie 2(7 pkt.)
Zadanie 3(2 pkt.)
Krótko wyjaśnij
Jak
rozumiesz terminy:
a/ izomeria, b/ rzędowość atomów węgla, c/ reakcja podstawienia, d/
homologi.
Narysuj wzory półstrukturalne:
a/ 6 izomerów węglowodoru o wzorze
C7H16
nadaj nazwy tym izomerom
b/ 6 izomerów związku o wzorze
C4H6CI2 1
nazwij je,
c/ dwóch izomerów 3,4-dimetyloheks-3-enu,nazwij te izomery
Jaki alkan otrzymamy, jeżeli w reakcji z sodem wezmą udział
chlorometan i 2-chloropropan? Odpowiedź uzasadnij.
Zadanie 4(6 pkt.) -
Ułóż równania reakcji przedstawionych za pomocą schematu:
CaO → CaC
2
→ C
2
H
2
→ C
2
H
4
→ C
2
H
5
Br
Zadanie 5(2 pkt.)
Zadanie 6(2 pkt.)
Zadanie 7(3 pkt.)
C
2
O
C
2
H4Br
2
-
Przeanalizuj reakcję oznaczoną w schemacie (zad.4) numerem 2
i wyjaśnij, dlaczego w roztworze poreakcyjnym fenoloftaleina barwi się na
malinowo ?
-
Jaką reakcję należałoby przeprowadzić, aby doświadczalnie wykazać
różnice we właściwościach chemicznych alkanów i alkinów ?
Jakie rodzaje reakcji ilustrują równania:
C2H4
+ Br
2
→ C2H4Br
2
oraz C
2
H
5
Br →
C
2
H
4
Br + HBr
Wyjaśnij istotę tych reakcji.
Zadanie 8(4pkt.)
(dla chętnych)
- Ustal wzór sumaryczny węglowodoru nienasyconego o masie molowej
równej 56 g/mol wiedząc, że węgiel stanowi w tym związku 85,7%
masowych.

P r a c a k o n t r o l n a nr 5
Temat: Węglowodory alifatyczne i aromatyczne.
Zadanie 1(3 pkt.) - Czym należy tłumaczyć dużą reaktywność alkinów ?
Zadanie 2(2 pkt.) - Co jest przyczyną występowania izomerii cis - trans ?
Zadanie 3(6 pkt.) - Podaj wzór węglowodoru wiedząc, że w wyniku spalenia 1 mola
tego związku otrzymano:
a/ 3 mole
CO2
i 2 mole wody zużywając 4 mole tlenu cząsteczkowego, b/
5 moli węgla i 6 moli wody, c/ 3 mole tlenku węgla(II) i 3 mole wody.
Zadanie 4(4 pkt.) - Wykaż na przykładzie reakcji benzenu z dowolnym fluorowcem, że
związek ten może reagować jak węglowodór nasycony i jak węglowodór
nienasycony.
Zadanie 5(2 pkt.) - Benzen i benzyna mają podobne nazwy, ale odmienne właściwości
chemiczne. Jaką rekcję chemiczną należałoby przeprowadzić, aby
odróżnić alkan od związku aromatycznego ?
Zadanie 6(3 pkt.) - Ile dm
3
wodoru mierzonego w warunkach normalnych potrzeba
do przeprowadzenia 21 gramów pent-l-enu w alkan ?
Zadanie 7(3 pkt.) - Ułóż równania reakcji przedstawionych za pomocą schematu:
C
2
H
2
Zadanie 8(3 pkt.) - Narysuj wzory strukturalne 3 homologów benzenu.
Zadanie 9(4 pkt.)
(dla chętnych)
- Ustal wzór węglowodoru wiedząc, że po spaleniu 21,2 g tego
związku otrzymano 70,4 grama tlenku węgla(IV ) i 18 gramów wody.

Wyszukiwarka
Podobne podstrony:
17.09.08-Scenariusz zajęć dla klasy II-Dodawanie i odejmowanie do 20, Konspekty
PRZYKŁADOWE TEKSTY PISANIA Z PAMIĘCI DLA KLASY II
plan wynikowy dla klasy II
Sprawdzian z edukacji polonistycznej dla klasy II, szkoła, j,polski, sprawdziany
23.09.08-Scenariusz zajęć dla klasy II-Podziwiamy ogrody kwiatowe, Konspekty
Konspekt zajęć zintegrowanych dla klasy II 23.03, Scenariusze i konspekty
SPRAWDZIAN DLA KLASY II dodawanie i odejmowanie w zakresie , październik
TEST DLA KLASY II LICEUM
ROZKŁAD MATERIAŁU DLA KLASY II GIMNAZJUM ZAJ INDYWID 11 12
PROGRAM Zajęc z muzyki dla klasy II, pliki zamawiane, edukacja
Bawimy się w lustra – na podstawie „Lustereczka” D Gellner (konspekt zajęć dramowych dla klasy II)
5256, Scenariusz zajęć z edukacji środowiskowo-polonistycznej dla klasy II
ROCZNY TEST BADANIA KOMPETENCJI DLA KLASY II, KLASA II POMOCE SZKOLNE, Testy, testy
Test kompetencyjny dla klasy II ZSZ
Scenariusz wycieczki do lasu dla klasy II (Zwiedzanie leśniczówki), Szkoła podstawowa
Roczny plan dla klasy II GIMNAZJUM, RAFAŁ PUDA
Konspekt dla klasy II - Rodzina domowym Kościołem, Bałagan - czas posprzątać i poukładać
ROZKŁAD MATERIAŁU DLA KLASY II GIMNAZJUM BIOL(1)
więcej podobnych podstron