
....................................
kod pracy ucznia
.............................................
pieczątka nagłówkowa szkoły
KONKURS PRZEDMIOTOWY CHEMICZNY
DLA UCZNIÓW GIMNAZJÓW
ETAP SZKOLNY
Drogi Uczniu,
Witaj na I etapie konkursu chemicznego. Przeczytaj uważnie instrukcję i postaraj się
prawidłowo odpowiedzieć na wszystkie pytania.
• Arkusz liczy 7 stron i zawiera 12 zadań.
• Przed rozpoczęciem pracy, sprawdź, czy Twój test jest
kompletny. Jeżeli zauważysz usterki, zgłoś komisji
konkursowej.
• Zadania czytaj uważnie i ze zrozumieniem.
• Pisz tylko czarnym lub niebieskim długopisem lub piórem.
• W zadaniach zamkniętych spośród czterech odpowiedzi A, B,
C, D tylko jedna jest poprawna. Wybierz ją i zakreśl znakiem X
na teście. Jeśli się pomylisz, otocz kółkiem błędną odpowiedź
i zaznacz znakiem X inną.
• Zadania otwarte rozwiązuj w teście w miejscach do tego
przeznaczonych.
• Nie używaj korektora i kalkulatora.
• Możesz korzystać z tablic dołączonych do zestawu zadań.
• Brudnopis nie podlega ocenie.
Pracuj
samodzielnie.
Powodzenia!
Czas pracy:
60 minut
Liczba punktów
możliwych do
uzyskania: 46

Zad. 1. ( 0-5 pkt )
Przeczytaj informacje o pierwiastkach. Jaki to pierwiastek? Wpisz do tabelki jego nazwę.
A. Lekki, dość miękki, łatwo ulega korozji. W 1 km
3
wody morskiej znajduje się prawie
1,5 mln ton tego metalu. W czasie II wojny światowej Niemcy stosowali stop tego
metalu na kadłuby bomb zapalających, które po wypaleniu się ładunku zapalającego
spalały się całe. Jest niezbędny dla roślin zielonych, stanowi bowiem składnik
chlorofilu.
B. Przechowuje się go w nafcie. Jest metalem, którego związki mają szerokie
zastosowanie (kreda, gips, fluoryt). Wchodzi w skład kości człowieka i zwierząt.
C. Znany ludzkości od co najmniej 7 tysięcy lat znalazł szerokie zastosowanie,
początkowo jako czysty metal z którego wytwarzano naczynia, ozdoby, broń a później
w postaci stopów (brąz, mosiądz). W 1957 r. na Dolnym Śląsku odkryto bogate złoża
rud tego pierwiastka.
D. Działa zabójczo na organizmy, wybiela kwiaty (niszczy barwniki), dezynfekuje,
reaguje z metalami. 1 dm
3
tego gazu na 100000 dm
3
powietrza stanowi poważne
zagrożenie dla życia człowieka. Można go otrzymać w procesie elektrolizy soli
kuchennej.
E. Jest bezbarwnym, bezwonnym, nieco cięższym od powietrza gazem. Jego nazwa
pochodzi od greckiego słowa „nieczynny”. Stanowi około 0,93% powietrza. W ciągu
doby człowiek wdycha i wydycha około 20 litrów tego szlachetnego gazu. Profesor
Olszewki był pierwszym, który go skroplił i zestalił.
Przykład Nazwa
pierwiastka
A
B
C
D
E
Zad. 2. (0-3 pkt)
Pierwiastek z zadania 1. punkt A tworzy z tlenem związek typu EO. W jakim stosunku
masowym są połączone pierwiastki w tym związku? Podaj wzór tego związku i wykonaj
obliczenia.
2
Zad. 3. (0-4 pkt)
Pierwiastek z zadania 1. punkt B w reakcji z wodą wydziela wodór. Zapisz równanie tej
reakcji:
......................................................................................................................................................
Oblicz, ile:
a) moli cząsteczek wodoru
b) dm
3
wodoru
wydzieli się, jeżeli do reakcji z wodą użyto 4g tego pierwiastka.
Zad. 4. (0-2 pkt)
Na podstawie położenia w układzie okresowym pierwiastka z zadania 1 punkt D podaj
rozmieszczenie elektronów na powłokach atomu tego pierwiastka. Jaki rodzaj wiązania
występuje w dwuatomowej cząsteczce tego pierwiastka?
Zad. 5 (0-4pkt)
Rozpuszczalność siarczanu (VI) pierwiastka z zadania 1. punkt C w 283 K wynosi 20g. Czy
roztwór otrzymany przez rozpuszczenie 25g tej soli w 125g wody jest roztworem
nasyconym? Podaj wzór siarczanu (VI) tego pierwiastka, jeżeli wiadomo, że jest on II
wartościowy.
Odp.................................................…...
3

Zad. 6. (0-1 pkt)
W reakcji tlenku miedzi (II) z wodorem, w wyniku czego powstaje miedź i woda reduktorem
jest:
A. miedź
B. tlenek miedzi (II)
C. wodór
D. woda
Zad. 7. (0-1 pkt)
W 2 dm
3
roztworu o stężeniu 0,2 [mol/dm
3
] znajduje się:
A. 4
B. 0,4
C. 2
D. 0,2
mola substancji rozpuszczonej.
Zad. 8. (0-7 pkt)
Roztwór wodorotlenku sodu, w którym na jeden jon sodu przypada 19 cząsteczek wody
zobojętniono kwasem siarkowym (VI), w którym na jeden jon siarczanowy (VI) przypada 31
cząsteczek wody. Napisz równanie reakcji zobojętniania o której mowa w zadaniu w formie
cząsteczkowej i jonowej ( bez formy jonowej skróconej) oraz oblicz stężenie procentowe
powstałego roztworu soli.
4

Zad. 9. (0-5 pkt)
Do otrzymania 100cm
3
roztworu kwasu siarkowego (VI) zużyto 0,4g tlenku siarki (VI).
Zakładając, ze powstały kwas ulega całkowitej dysocjacji oblicz, ile moli jonów wodorowych
znajduje się w 100cm
3
tego roztworu. Zapisz równanie reakcji otrzymywania kwasu
siarkowego (VI) oraz równanie dysocjacji 1 cząsteczki kwasu.
Zad. 10. (0-4 pkt)
Jaki wspólny składnik zawierają roztwory wodne otrzymane w następujących procesach ( nie
musisz uzupełniać równań, natomiast uzupełnij luki).
H
2
O + SO
3
→
H
2
O + SO
2
→
Wspólny składnik to.....................
pH obu roztworów jest.......................od.....................
Lakmus w obu roztworach przyjmuje ................................zabarwienie
Zad. 11. (0-5 pkt)
Napisz równania reakcji do schematu. Równanie reakcji nr 3 zapisz również w formie
jonowej pełnej i skróconej
1)
2) 3)
bar→ tlenek baru→ azotan (V) baru→ siarczan (VI) baru
1)......................................................................................
2)......................................................................................
3)......................................................................................
Forma jonowa pełna.........................................................................................................
Forma jonowa skrócona...................................................................................................
5
Zad. 12. (0-5 pkt)
Przyporządkuj fakty do odpowiedniej grupy:
- przyczyny kwaśnych opadów
- skutki kwaśnych opadów
poprzez wpisanie litery „p” (przyczyna) i „s” (skutek)
a) wzrost liczby samochodów, które wydzielają do atmosfery tlenki azotu, węgla, siarki
b) uszkodzenie budowli
c) występowanie szkodliwych związków metali w wodzie pitnej
d) wypalanie traw, wycinanie lasów
e) zakwaszenie gleby
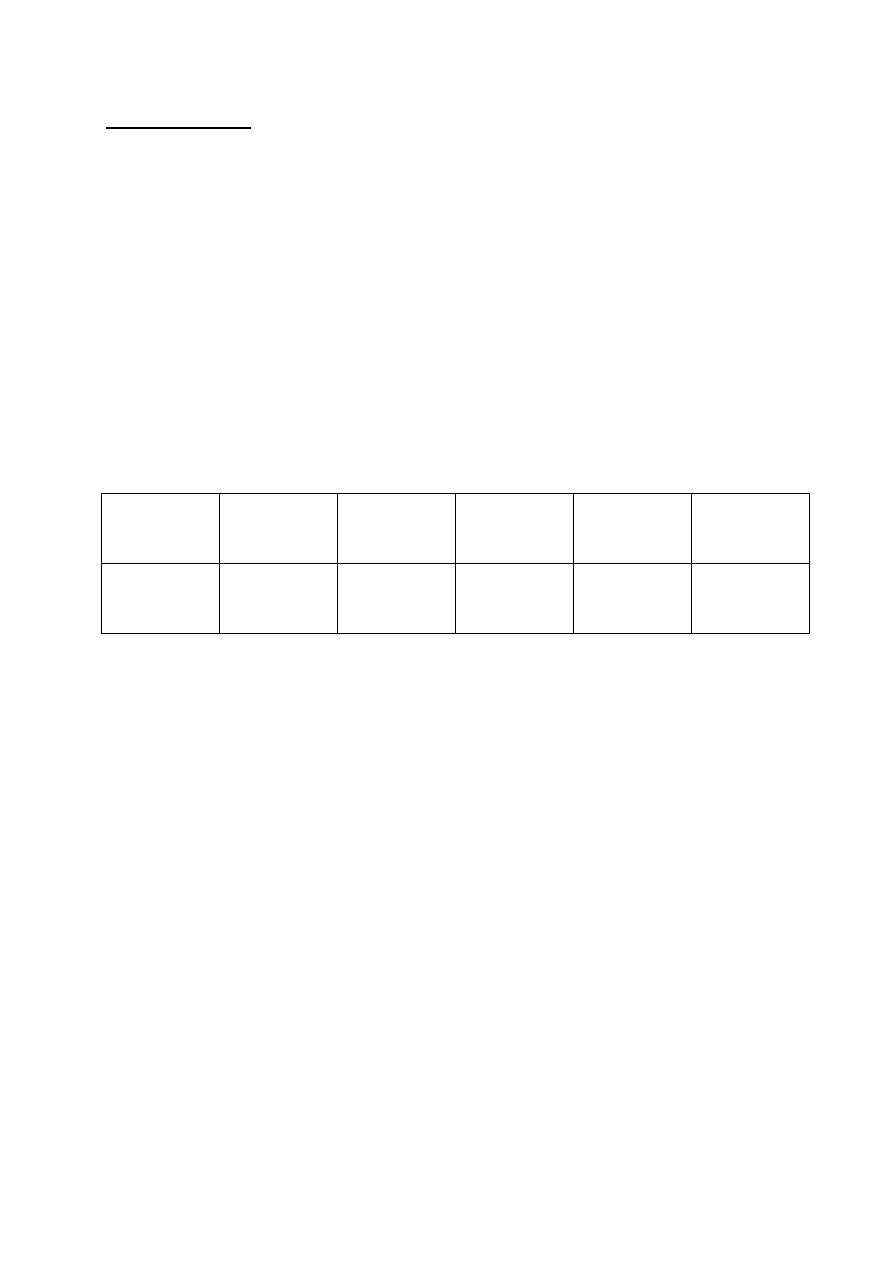
Przykład
a b c d e
Litera „p” lub
„s”
6

BRUDNOPIS
7
Wyszukiwarka
Podobne podstrony:
chemia test 2004
chemia test 2006
Chemia dr inz. Krystyna Kelar [ polimery itp] [ test], chemiaTest, TEST 1
chemia test bialy sciaga, energetyka, 1 rok
Chemia 1 test
chemia test(1) id 113158 Nieznany
chemia test 2005
chemia-test
chemia test
chemia test(2) id 113159 Nieznany
chemia test sciaga
chemia test 2004
chemia test 2005
chemia test
więcej podobnych podstron