2010-01-22
1
Chemia XIII
Iloczyn jonowy wody
Dysocjacja wody
• Woda jako słaby elektrolit, bardzo źle przewodzi prąd
elektryczny, ponieważ niewielka część cząsteczek ulega
dysocjacji:
H
2
O = OH
-
+ H
+
• Jon wodorowy powstający w czasie dysocjacji nie
pozostaje w stanie wolnym, lecz w postaci uwodnionej.
Przyczepienia jonu H
+
do cząsteczki wody powoduje
powstanie jonu hydroniowego H
3
O
+
.
• Wobec niewielkiego stężenia jonów wodorowych
można przyjąć, że [H
+
] = [H
3
O
+
].
2010-01-22
2
Iloczyn jonowy wody
• Dysocjacja wody przebiega zgodnie z równaniem
reakcji:
2H
2
O =
H
3
O
+
+ OH
-
• a
stałą
równowagi
tej
przemiany
przedstawia
wyrażenie
K = [H
3
O
+
][ OH
-
] / [H
2
O]
2
•
K [H
2
O]
2
= [H
3
O
+
][ OH
-
] = K
w
• Wielkość K
w
nazywamy iloczynem jonowym wody.
pH = -log[H
+
]
• W czystej wodzie w temperaturze pokojowej stężenie
jonów wodorowych H
+
wynosi 1x 10
-7
mola/dm
3
• jest równe stężeniu jonów OH
-
,
• iloczyn jonowy wody K
w
=1x 10
-14
.
• Iloczyn jonowy wody, podobnie jak stałe dysocjacji
zależy od temperatury. Wartość K
w
wzrasta ze
wzrostem temperatury od 25
o
do100
o
ponad 100 –
krotnie. Stężenie jonów wodorowych jest często
niewielkie i wyrażane małymi ułamkami 1x 10
-7,
1x 10
-
5
M, wprowadzono tzw. Wykładnik stężenia jonów
wodorowych, oznaczonego jako pH. Jest to ujemny log
ze stężenia jonów wodorowych:
2010-01-22
3
Iloczyn jonowy wody
• podobnie
jak
stałe
dysocjacji
zależy
od
temperatury.
• Wartość K
w
wzrasta ze wzrostem temperatury - od
25
o
do100
o
ponad 100 – krotnie.
• Stężenie
jonów
wodorowych
jest
często
niewielkie i wyrażane małymi ułamkami 1x 10
-7
1x 10
-5
M,
• wprowadzono tzw. Wykładnik stężenia jonów
wodorowych - pH. Jest to ujemny log ze stężenia
jonów wodorowych.
• Ze wzrostem stężenia jonów wodorowych
pH maleje.
• Roztwory kwaśne wykazują pH< 7,
• roztwory zasadowe pH > 7.
• Roztwory, których pH = 7 uważamy za
obojętne. W miarę wzrostu stężenia jonów
H
+
maleje stężenie jonów OH
-
i odwrotnie.
2010-01-22
4
Wartość pH
• można wyznaczyć doświadczalnie przy użyciu pehametru
lub za pomocą wskaźników – indykatorów.
• Wskaźniki to bardzo słabe organiczne kwasy lub zasady,
które zmieniają barwę w charakterystycznym zakresie
jonów wodorowych i odpowiadającym im pH.
• Barwa nie zmienia się skokowo lecz w szerszym zakresie
wynoszącym kilka jednostek. W niektórych przypadkach
wskaźników może posiadać dwa zakresy.
• Wiele naturalnych barwników zawartych w roślinach,
kwiatach zmienia barwę w zależności od pH.
• Przykładem może być barwnik zawarty w herbacie – po
zakwaszeniu jej przez dodatek cytryny.
pH wody
pH
0
3
7
11
14
[H
3
O
+
]
mol/dm
3
10
0
10
-3
10
-7
10
-11
10
-14
2010-01-22
5
Wskaźniki kwasowo-
zasadowe
W celu stwierdzenia, czy roztwór jest kwaśny,
obojętny czy zasadowy można stosować
wskaźniki.
Najprostszym wskaźnikiem, który możemy
zrobić w warunkach domowych jest wywar z
czerwonej kapusty.
Wskaźniki tym charakteryzują się, że zmieniają
swoje zabarwienie przy określonym pH.
Na przykład fioletowe zabarwienie wywaru z
czerwonej kapusty zmienia się na różowe w
obecności kwasu.
Wskaźnikiem (indykatorem)
pH
• są substancje ulegające przemianom
lub modyfikacjom strukturalnym przy
zmianie stężenia jonów H
+
(H
3
O
+
), a w
konsekwencji wykazują zmiany pH w
pewnych określonych granicach.
• Im te granice leżą bliżej siebie, tym
lepszy jest wskaźnik.

2010-01-22
6
Wskaźnik
Zakres zmian barwy
pH
Barwa wskaźnika
pH
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Błękit tymolowy
1,2 - 2,8
Oranż metylowy
3,0 - 4,4
Błękit bromofenylowy
3,0 - 4,6
Czerwień metylowa
4,4 - 6,2
Lakmus
5,0 - 8,0
Błękit bromotymolowy
6,0 - 7,6
Błękit tymolowy
8,0 - 9,6
Fenoloftaleina
8,4 - 10,0
wskaźnik będący słabym kwasem
o ogólnym wzorze HIn
• w zależności od środowiska będzie miał
postać kwasową lub zasadową.
• HIn
<=> H
+
+
In
-
postać kwasowa
postać zasadowa
• Takim wskaźnikiem jest lakmus.
• Postać kwasowa HIn lakmusu ma
zabarwienie
czerwone
, a postać
niebieska
opisana wzorem In
-
ma zabarwienie
niebieskie
.
2010-01-22
7
Działanie wskaźnika
• w roztworach kwaśnych, w których stężenie [H
+
] jest
duże, równowaga przesuwa się w lewo, wskaźnik
przybiera postać kwasową (zabarwienie wskaźnika
jest
czerwone
)
• w roztworach zasadowych, o małym stężeniu [H
+
],
równowaga jest przesunięta w prawo, a wskaźnik
przechodzi niemal całkowicie w postać zasadową
(zabarwienie wskaźnika jest niebieskie).
• Obecnie są dostępne uniwersalne papierki
wskaźnikowe, nasycone mieszaniną wskaźników i
wykazujące szereg zmian barwy.
• Za pomocą tych papierków można ocenić pH
roztworu z dokładnością ok. 1 jednostki w zakresie
pH od 1 do 13.
Roztwory buforowe
• Roztwory buforowe posiadają zdolność
buforowania, tzn. przeciwstawiania się
znacznym zmianom pH po dodaniu do nich
niewielkich ilości mocnego kwasu lub
mocnej zasady.
2010-01-22
8
Buforami są mieszaniny roztworów słabego
kwasu i jego soli z mocną zasadą
lub słabej zasady i jej soli z mocnym kwasem
• (np. CH
3
COOH i CH
3
COONa)
• (np. NH
3
·H
2
O i NH
4
Cl).
Według teorii protonowej roztwory buforowe są
układami zawierającymi sprzężoną parę
kwas-zasada.
• w buforze octanowym kwasem jest kwas
octowy
CH
3
COOH
, zasadą jony
octanowe
CH
3
COO
-
,
• w buforze amonowym zasadą jest amoniak
NH
3
a kwasem jony amoniowe
NH
4
+
.

2010-01-22
9
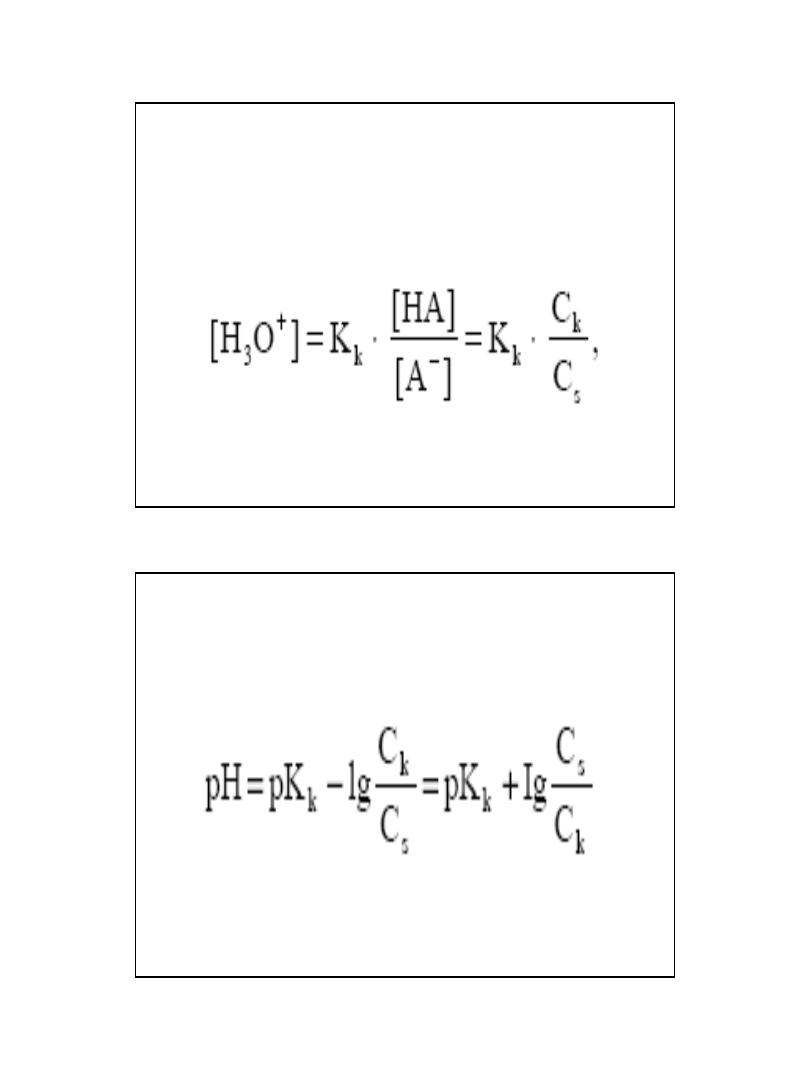
W buforze będącym mieszaniną
• słabego kwasu i jego soli z mocną zasadą
kwas jest słabo zdysocjowany:
• HA + H
2
O → H
3
O
-
+ A
-
• A jego stała protolizy wyraża się wzorem:
• Sól natomiast jest dobrze zdysocjowana,
dlatego stężenie anionu [A-] równa się
całkowitemu stężeniu soli Cs.
• Stężenie niezdysocjowanego kwasu [HA]
równa się praktycznie całkowitemu stężeniu
kwasu Ck, użytego do sporządzenia buforu.
2010-01-22
10
Stężenie jonów wodorowych buforu
złożonego ze słabego kwasu i jego soli
wyraża się równaniem:
Po logarytmowaniu

2010-01-22
11
Wzór na pH buforu
• mieszaniną słabej zasady i jej soli z mocnym
kwasem, można wyprowadzić analogicznie:
• B + H
2
O
BH
+
+ OH
-
Bufor amonowy
2010-01-22
12
Rolę mieszanin buforowych
spełniają
roztwory wodorosoli np. NaHCO
3
, NaH
2
PO
4
lub
Na
2
HPO
4
.
Według teorii Bronsteda i Lowry'ego buforami są
zatem roztwory słabych kwasów i sprzężonych
z nimi zasad
(np. CH
3
COOH i CH
3
COO
-
, HCOOH i HCOO
-
,
HCO
3
-
i CO
2
2-
, H
2
PO
4
-
i HPO
4
2-
lub HPO
4
2-
i
PO
4
3-
) albo roztwory słabych zasad i
sprzężonych z nimi kwasów (np. NH
3
i NH
4
+
).
Cechy charakterystyczne
roztworów buforowych
• praktycznie stałe stężenie jonów wodorowych
podczas rozcieńczania roztworu
• niewielka zmiana stężenia jonów wodorowych
po dodaniu do roztworu niewielkich ilości
mocnego kwasu lub mocnej zasady -
mniejszych niż stężenie składników buforu
(kwasowość roztworu buforowego nie
powinna zmienić się więcej niż o jednostkę
pH).
2010-01-22
13
Przykładowe roztwory buforowe
- bufor octanowy: CH
3
COOH, CH
3
COONa w
zakresie pH = 3,5 - 6
- bufor amonowy: NH
3
* H
2
O, NH
4
Cl w zakresie
pH = 8 - 11
- bufor fosforanowy: KH
2
PO
4
, K
2
HPO
4
w
zakresie pH = 5,5 - 8
- bufor boranowy: H
3
BO
3
, Na
2
B
4
O
7
w zakresie
pH = 7 - 9
Iloczyn rozpuszczalności
• Iloczyn rozpuszczalności jest stałą równowagi
charakteryzującą roztwory nasycone,
praktycznie całkowicie zdysocjowanych, trudno
rozpuszczalnych związków. Umożliwia ona opis
termodynamiczny procesu wytrącania osadów.
2010-01-22
14
Po wytrąceniu osadu trudno rozpuszczalnego
związku A
n
B
m
, pomiędzy roztworem nasyconym a
osadem ustali się stan równowagi dynamicznej,
którą możemy wyrazić następująco:
A
n
B
m
= nA
m+
+ mB
n-
Stan równowagi takiego układu zwykle opisuje
się, wykorzystując pojęcie iloczynu
rozpuszczalności.
Iloczyn rozpuszczalności
• jest to iloczyn stężeń jonów danego trudno
rozpuszczalnego związku w jego roztworze
nasyconym w danej temperaturze i w
danym rozpuszczalniku:
Ir
AnBm
=[A
m+
]
n
[B
n-
]
m
2010-01-22
15
Przez x oznaczamy iloczyn stężeń jonów
związku trudno rozpuszczalnego w roztworze
przy danej temperaturze i w danym
rozpuszczalniku
Jeżeli układ znajduje się w stanie
równowagi dynamicznej to x=Ir i roztwór
jest nasycony
• Jeżeli roztwór jest nienasycony to x<I
• Jeżeli roztwór jest przesycony to x>I i
wtedy będzie się wytrącał osad aż do
momentu, gdy x osiągnie wartość Ir
• Im mniejsza wartość iloczynu rozpuszczalności, tym
związek jest trudniej rozpuszczalny, a tym samym
łatwiej wytrącić jego osad.
• Wykorzystując wartości iloczynów rozpuszczalności
związków, możemy przewidzieć kolejność wytrącania
się różnych (trudno rozpuszczalnych) soli pod
wpływem wspólnego odczynnika wytrącającego.
• W tym celu należy obliczyć, przy jakim stężeniu jonu
strącającego rozpocznie się wytrącanie każdego z
osadów.
• wtedy jako pierwszy zacznie się wytrącać jon, do
którego wytrącenia potrzebne jest najniższe stężenie
odczynnika strącającego czyli jon tworzący z
dodawanym odczynnikiem najtrudniej rozpuszczalny
osad.
2010-01-22
16
Kiedy wszystkie sole są tego samego
typu
• tzn. oddysocjowujące z 1 mola związku taką
samą ilość moli jonów, wówczas określenie
kolejności wytrącania (lub rozpuszczalności)
związków na podstawie Ir jest stosunkowo
proste.
• I w tym przypadku właściwe są zależności:
• Ir
AB
>Ir
CD
>Ir
EF
=> R
AB
>R
CD
>R
EF
(R - oznacza rozpuszczalność związku)
•
Im związek jest trudniej rozpuszczalny, tym
łatwiej go wytrącić
•
W przypadku porównywania rozpuszczalności
czy przewidywania kolejności wytrącania
związków różnych typów konieczne jest
przeprowadzenie odpowiednich obliczeń
2010-01-22
17
AgCl
Ag
+
+ Cl
+
I
r
= [Ag
+
][Cl
-
]
Ag
2
SO
4
= 2 Ag
+
+ SO
4
2-
I
r
= [Ag
+
]
2
[SO
4
2-
]
• stężenia oznaczamy jako R rozpuszczalność
• stężenia jonów są takie same, tylko stężenie jonów
srebra jest równe R
2
, wynika to ze stechiometrii
równania.
Iloczyn rozpuszczalności AgCl, IR=1,1.10-10.
Oblicz: stężenie molowe chlorku srebra w wodzie i
rozpuszczalność chlorku srebra w gramach w
100cm3 wody.
• Dane:
• IR=1,1x10
-10
MAgCl=143,32 g/ Mol
• Z równania reakcji wynika, że
[Cl-]=[Ag+]=[AgCl]
Oznaczmy: [Cl-]=x, więc [Ag+]=x [Cl-]=[Ag+].
• Z definicji iloczynu rozpuszczalności:
• IR=[Cl-][Ag+]=x
2
, czyli 1,1x10
-10
=x
2
•
.
• Stężenie chlorku srebra wynosi 1,049.10-5mol/dm3. W roztworze o objętości
100cm3 (0,1dm3) chlorku srebra będzie dziesięć razy mniej: 1,049x10
-6
mola,
czyli: n.M=1,049x10
-6
mola.143,32g/mol=1,5x10
-4
g.
• Odp. Stężenie molowe chlorku srebra w nasyconym roztworze wynosi 1,049.10-
5mol/dm3, natomiast w 100cm3 wody rozpuszcza się
1,5.10-4g chlorku srebra.

2010-01-22
18
Obliczyć rozpuszczalność Ag
2
CrO
4
w 100cm
3
wody, jeżeli iloczyn rozpuszczalności tej soli
I
R
=2,4x10
-12
.
• Dane:
• IR=2,4.10
-12
M=331,74g/mol
Ag
2
CrO
4
= 2Ag
+
+ CrO
4
2-
IR=[Ag
+
]
2
[CrO
4
2-
]
• Oznaczmy stężenie [CrO
4
-2
]=x, więc [Ag
+
]=2x
IR=(2x)
2
.x=4x3
• W 1000cm3 znajduje się 8,43x10
-5
mola chromianu(VI) srebra, a więc w
100cm3 znajduje się 8,43x10
-6
mola tej soli.
• Po pomnożeniu przez masę molową otrzymamy masę chromianu rozpuszczoną
w 100cm3 wody:
m=8,43x10
-6
mola x 331,74g/mol=2,8.10-3g.
iloczyn rozpuszczalności chromianu(VI) srebra jest mniejszy od iloczynu
rozpuszczalności chlorku srebra, chromian w wodzie jest lepiej rozpuszczalny.
• Odp. Rozpuszczalność chromianu(VI) srebra w wodzie wynosi 0,0028g
Wyszukiwarka
Podobne podstrony:
Chemia labolatorium, chemia gr.B, Iloczyn jonowy wody i jego zal
Iloczyn jonowy wody, CHEMIA, semestr 1, chemia ogólna, wykłady
Chemia labolatorium, Wskaźniki pH, Iloczyn jonowy wody i jego zależność od temperatury
Iloczyn jonowy wody
13 Iloczyn jonowy wody
38 Równowagi jonowe w roztworach wodnych (dysocjacja, iloczyn jonowy wody, pH, indykatory pH, roztwo
ILOCZYN JONOWY id 210758 Nieznany
iloczyn jonowy, Szkoła, penek, Przedmioty, Chemia, Teoria
ILOCZYN JONOWY id 210758 Nieznany
chemia lato 12 07 08 id 112433 Nieznany
Nasze zdrowie a rabunek wody id Nieznany
analiza wody sprawozdanie chemia analityczna SPRAWOZDANIE Analiza wody część 1
chemia nieorganiczna teoria 11 10 id 112510
Powtorka! Chemia Gimnazjum Portal wiedzy o chemii id 37986
chemia proz maj 2011 cke id 112 Nieznany
lanie wody id 263338 Nieznany
więcej podobnych podstron