
dr hab. Andrzej Łukasik
Zakład Ontologii i Teorii Poznania
Instytut Filozofii
Wydział Filozofii i Socjologii
Uniwersytet Marii Curie-Skłodowskiej w Lublinie
lukasik@bacon.umcs.lublin.pl
Ewolucja pojęcia atomu
Gdyby cała nauka miała ulec zniszczeniu w jakimś ka-
taklizmie i tylko jedno zdanie można by uratować i
przekazać następnym pokoleniom, jakie zdanie zawie-
rałoby największą ilość informacji w możliwie najmniej-
szej liczbie słów? W moim przekonaniu byłoby to zda-
nie formułujące h i p o t e z ę (lub r z e c z y w i s t o ś ć,
jeśli wolicie tak to nazwać) a t o m i s t y c z n ą, ż e
w s z y s t k o s k ł a d a s i ę z a t o m ó w .
Richard Phillips Feynman
1
1. WSTĘP
Pojęcie atomu (podobnie zresztą jak związane z nim pojęcia materii,
przestrzeni, czasu i ruchu) ulegało w historii filozofii i historii nauki
wielokrotnym przemianom, czemu towarzyszyły również zmiany pro-
blemów wyjściowych, jakie teoria atomistyczna w danym czasie miała
rozwiązywać oraz zmiany uznawanych za prawomocne metod poznania
przyrody. Wystarczy wspomnieć, że pojęcie atomu pierwotnie należało
do spekulatywnej filozofii przyrody, obecnie natomiast jest jedną z pod-
stawowych kategorii matematycznego przyrodoznawstwa. Same zaś
atomy (i cząstki elementarne) z czysto noetycznych przedmiotów filozo-
fów stały się przedmiotami, którymi można manipulować w laborato-
riach.
Celem artykułu jest analiza głównych etapów rozwojowych pojęcia
atomu – od starożytnej filozofii przyrody, przez naukę klasyczną aż do
współczesnej fizyki atomowej i fizyki cząstek elementarnych. Podjęto

2
próbę ukazania punktów przełomowych w ewolucji tego pojęcia, a także
elementów łączących dawne idee atomistyczne z nauką współczesną. W
zakończeniu postawiony jest problem aktualności atomizmu rozumiane-
go jako redukcjonistyczna ontologia substancjalnych bytów jednostko-
wych.
Ponieważ w filozofii pojęcie atomizmu ma zakres o wiele szerszy niż
w naukach przyrodniczych i wyróżnia się m.in. atomizm psychologicz-
ny, atomizm logiczny czy atomizm społeczny, podkreślić należy, że ar-
tykuł niniejszy ogranicza się wyłącznie do analizy pojęcia atomu w filo-
zofii przyrody i naukach przyrodniczych.
2. POJĘCIE ATOMU W STAROŻYTNEJ FILOZOFII PRZYRODY
2.1. PROTOTYPY POJĘCIA ATOMU
Filozofia przyrody rozpoczęła się z chwilą postawienia przez greckich
myślicieli problemu elementarności, czyli pytania, jaki jest podstawowy
rodzaj ciał, z których zbudowane są wszystkie rzeczy. Pojęcie atomu
wprowadzili Leukippos i Demokryt, jednakże wcześniejsi filozofowie
przyrody także sformułowali koncepcje, w których pojawiają się pewne
prototypy pojęcia atomu lub idee, które odegrały fundamentalną rolę w
rozwoju atomizmu.
Pitagorejczycy, którzy znacząco rozwinęli nauki matematyczne, do-
szli do przekonania, że podstawową rolę w przyrodzie odgrywają sto-
sunki matematyczne. Sądzili, że zasady matematyki „są zasadami
wszystkich rzeczy […], a całe niebo jest harmonią i liczbą”.
2
Postawili
nawet tezę, że „rzeczy są liczbami”. „Liczb” nie pojmowali jednak jako
wielkości abstrakcyjnych, ale rozumieli je jako obiekty fizyczne.
Tworzyli mianowicie cały świat z liczb – pisze Arystoteles – ale nie z liczb
złożonych z abstrakcyjnych jednostek; przypuszczali bowiem, że jednostki
mają wielkość przestrzenną.
3
Postrzegali więc świat na sposób atomistyczny: wszystkie ciała skła-
dają się z „liczb” ułożonych w różne kształty. Materia jest zatem niecią-
gła, a poszczególne „liczby” oddzielone są od siebie próżnią. Przez
„próżnię” rozumieli jednak pitagorejczycy zarówno „nieskończone po-
wietrze”,
4
jak pustą przestrzeń i „to, co nieskończone”. To niezbyt precy-

3
zyjne znaczenie pojęcia próżni zawęził później Parmenides do pojęcia
„pustki–nicości”.
Na powstanie atomizmu zasadniczy wpływ miały dwie tezy Parme-
nidesa: 1) pojęcie próżni jako za warunek konieczny pojęć podziału,
wielości i ruchu;
5
2) przekonanie, że nic nie powstaje z niczego, a to, co
istnieje, nie może przestać istnieć.
[…] to, co istnieje, jest niestworzone i nie ulega zniszczeniu, jest bowiem całe,
nieruchome i nieskończone, nigdy nie było, ani nie będzie, ponieważ teraz
istnieje razem jako coś całego, jednego, ciągłego.
6
Eleaci przeczyli jednak możliwości istnienia próżni,
7
co uniemożli-
wiało sformułowanie teorii bytu zgodnej ze zjawiskami.
Empedokles uczynił również krok w kierunku atomizmu, ponieważ
twierdził, że wszystkie rzeczy złożone, które powstają i giną, składają z
wiecznych i niezmiennych cząstek ziemi, wody, powietrza i ognia – „ko-
rzeni wszechrzeczy”, nazywanych potem „żywiołami” albo „pierwiast-
kami” (στοιχειον). Podobnie jak u Demokryta wszelkie zmiany sprowa-
dzone są do ruchu przestrzennego, mechanicznego łączenia się i roz-
dzielania się niezmiennych cząstek.
8
Nie istnieją narodziny żadnej z rzeczy śmiertelnych ani też żaden koniec
niszczącej śmierci. Istnieje tylko mieszanie i wymiana tego, co zostało z sobą
zmieszane. Narodziny to tylko nazwa używana przez ludzi.
9
Zadaniem Empedoklesa jednak ruch cząstek pierwiastków nie wy-
maga założenia istnienia próżni, ponieważ jedne cząstki po prostu ustę-
pują miejsca drugim.
2.2. ATOMY LEUKIPPOSA I DEMOKRYTA
Podstawowym zagadnieniem, który stanowił punkt wyjścia dla teorii
atomistycznej Leukipposa i Demokryta, było takie rozwiązanie proble-
mu elementarności, które byłoby zgodne z tezą Parmenidesa o absolutnej
niezmienności bytu, ale jednocześnie zgodne ze zjawiskami.
Leukippos zaś był przekonany – pisze Arystoteles – że znalazł rozwiązanie,
które pozostając w zgodzie z doświadczeniem, nie podważa ani stawania się,
ani niszczenia, ani ruchu, ani mnogości bytów.
10

4
Rozwiązanie polegało na: 1) odrzuceniu tezy Parmenidesa, że byt jest
jeden i przyjęciu założenia, że istnieje nieskończenie wiele absolutnie
niezmiennych i zasadniczo niepodzielnych bytów – atomów (gr. άτομος
— niepodzielny); 2) przyjęciu istnienia próżni (κενόν) jako drugiej, rów-
norzędnej z atomami, zasady ontologicznej.
11
W szczególności wprowadzenie przez Leukipposa koncepcji próżni
było wielkim przełomem pojęciowym
12
i miało decydujące znaczenie
powstania atomizmu.
13
Próżnia (pusta przestrzeń) nie jest bytem, ponie-
waż bytem jest tylko to, co jest całkowicie pełne. Wedle Leukipposa ist-
nieje zatem zarówno byt, jak i nie–byt
14
.
Każdy z atomów ma (z wyjątkiem nieruchomości) wszystkie funda-
mentalne cechy, które miał Parmenidejski byt – jest pełny, niepodzielny,
wieczny i absolutnie niezmienny.
Atomy mają (poza wspólną wszystkim własnością nieprzenikliwo-
ści) jedynie cechy geometryczne, nie mają natomiast żadnych jakości
zmysłowych.
Czymś umownym jest słodkie, czymś umownym gorzkie, czymś umownym
gorące, czymś umownym zimne, czymś umownym jest barwa, naprawdę zaś
istnieją tylko atomy i próżnia.
15
Pierwotnymi i obiektywnymi własnościami atomów są więc nieprze-
nikliwość, kształt i wielkość. Ponieważ rodzaje atomów różnią się od
siebie jedynie kształtami, a „kształtów jest nieskończona ilość, dlatego
także istnieje nieskończona ilość ciał prostych”.
16
W ciałach złożonych atomom przysługują również obiektywne cechy
względne (relacyjne): położenie i porządek w przestrzeni, które odróż-
niają od siebie poszczególne układy atomów.
17
Atomy zawsze są w ruchu, dzięki czemu mogą zderzać się ze sobą,
łączyć i tworzyć w nieskończonej przestrzeni nieskończenie wiele ukła-
dów złożonych. Ruchem atomów, a zatem również wszystkimi proce-
sami w przyrodzie, rządzi mechaniczna konieczność (κατ’ άνάγκην).
18
Atomy w sensie filozoficznym to niepodzielne, wieczne, absolutnie
trwałe i niezmienne ostateczne składniki materii. Dlatego też czas, który
wprawdzie uznawał Demokryt za wieczny
19
, w żaden sposób nie wiąże
się z własnościami elementarnych składników materii – zmianom podle-
gają jedynie układy złożone z niezmiennych atomów.

5
2.3. ATOMY EPIKURA
Epikur wprowadził pewne modyfikacje do pojęcia atomu, które miały
być odpowiedzią na krytykę atomizmu przeprowadzoną przez Arysto-
telesa. Arystoteles argumentował, że ciało, które nie ma części (jak atom)
w ogóle nie może się poruszać, chyba, że czas, przestrzeń i ruch miałyby
charakter nieciągły.
20
Epikur przyjął, że atomy są fizycznie niepodziel-
nymi, ale nie są najmniejszymi cząstkami materii. Każdy atom składa się
z określonej liczby „najmniejszych cząstek” (minimae partes), które w po-
szczególnych atomach można wyodrębnić jedynie myślowo, ale nie ist-
nieją one jako odrębne realności fizyczne.
[…] atom posiada wielkość minimalną. Trzeba ponadto uznać minimalne
cząstki niezespolone za granicę długości i za takie, które z siebie jako pierw-
szych dostarczają miary dla większych i mniejszych wielkości, w rozumo-
wym dociekaniu cząstek niepostrzegalnych.
21
Epikurejskie minima są nie tylko najmniejszymi cząstkami składowy-
mi atomów: istnieją również minimalne odległości przestrzenne oraz
minimalne odcinki czasu.
22
Wszelkie wielkości fizyczne mają charakter
dyskretny czy też, używając języka fizyki współczesnej – skwantowany.
Różna liczba minimae partes wchodząca w skład atomu danego rodzaju
wyjaśnia zróżnicowanie wielkości i kształtów atomów.
23
Epikur twier-
dził również, że liczba kształtów atomów jest skończona.
24
Epikur, również w odpowiedzi na krytykę Arystotelesa,
25
że Demo-
kryt nie podał przyczyny ruchu atomów, przyjmując rozróżnienie na
ruch naturalny i wymuszony, uznał ciężar za „uniwersalny atrybut ma-
terii”
26
i jednocześnie za przyczynę naturalnego ruchu atomów „w dół”.
Pogląd ten wymaga przyjęcia – dość osobliwego na gruncie nieskończo-
nego przestrzennie wszechświata – założenia, że przestrzeń w rozumie-
niu jest jednorodna, ale nie jest izotropowa.
27
Pojęcie ciężaru w filozofii
przyrody Epikura jest jeszcze bardzo odległe od przyjmowanego w fizy-
ce współczesnej.
28
2.4. ATOMY GEOMETRYCZNE PLATONA
Osobne miejsce w dziejach pojęcia atomu wypada przypisać Plato-
nowi. Był on autorem koncepcji atomizmu geometrycznego, sformuło-
wanego pod niewątpliwym wpływem myśli pitagorejskiej. Platon, kry-
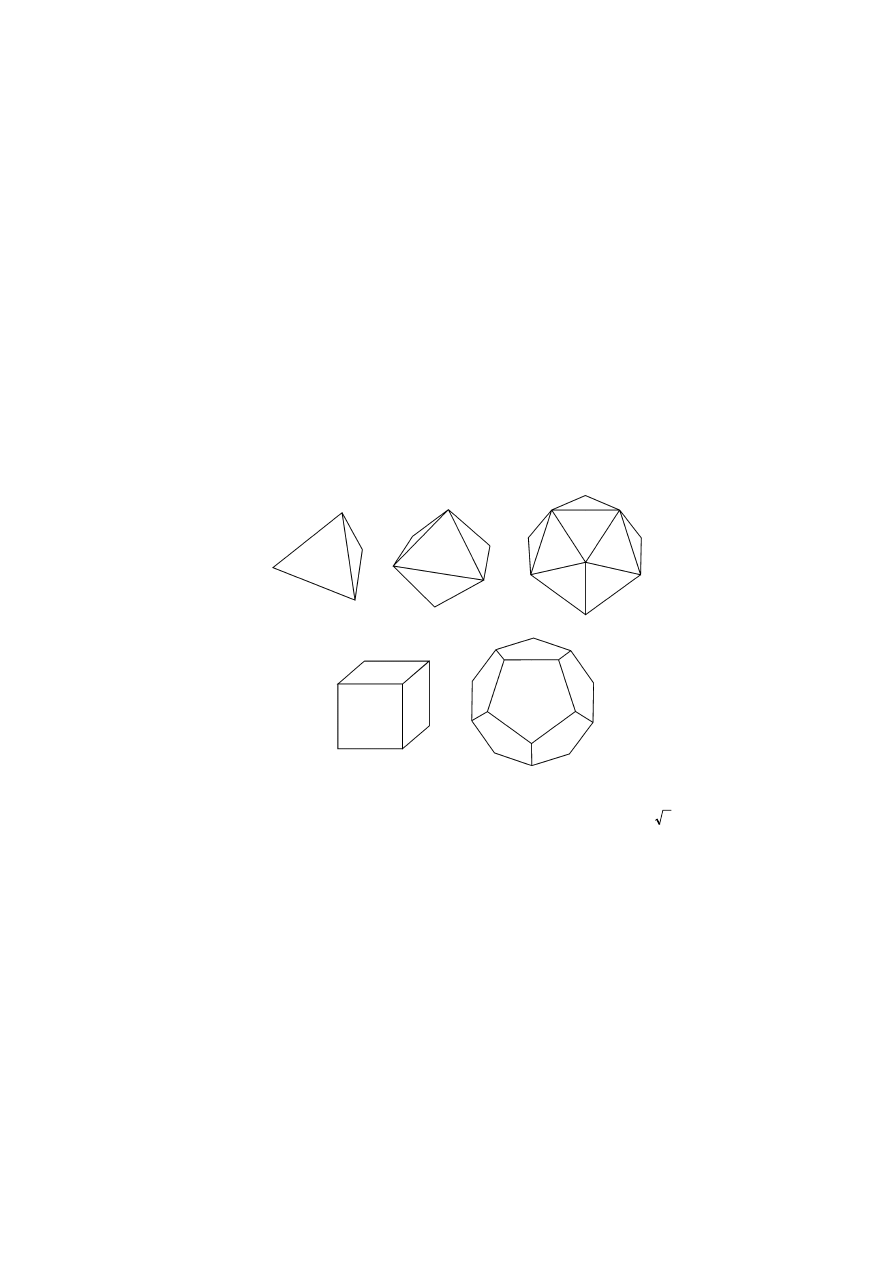
6
tycznie oceniając dotychczasowe systemy filozofii przyrody (nie wspo-
minając jednak ani słowem o Demokrycie) postawił hipotezę, że
[…] wszystkie gatunki ciał […] powstają z brył elementarnych, ich kombina-
cji i wzajemnych przemian.
29
Otóż cząsteczki ognia, powietrza, wody i ziemi mają kształty wielo-
ścianów foremnych (nazywane dziś bryłami platońskimi). Są to odpo-
wiednio: czworościan, ośmiościan, dwudziestościan i sześcian (pozostaje
jeszcze dwunastościan foremny, o którym Platon w Timajosie jedynie
enigmatycznie wspomina). Uszeregowane są one od „najlżejszego” i
„najbardziej ruchliwego” (czworościan – ogień) do „najcięższego” i
„najtrudniejszego do poruszenie” (sześcian – ziemia).
Każda ściana dwudziestościanu, ośmiościanu i czworościanu składa
się z sześciu trójkątów prostokątnych o długościach boków x,
3
x, 2x,
gdzie x jest dowolną liczbą rzeczywistą dodatnią, złączonych wierzchoł-
kami. Każda ściana sześcianu składa się natomiast z czterech trójkątów
prostokątnych równoramiennych o bokach x,√ 2 x.
30
Przyroda ma, według Platona, naturę matematyczną w tym sensie, że
istotne własności materii sprowadzają się do odpowiednich symetrii
geometrycznych. Bryły platońskie nie są jeszcze ostatecznymi, niepo-
dzielnymi elementami świata fizycznego, ponieważ układ trójkątów, z
którego zbudowana jest każdy wielościan w rezultacie zderzenia z in-
nym wielościanem może ulec rozbiciu na trójkąty i utworzyć nowy

7
układ, również w kształcie wielościanu foremnego. Tak więc elementar-
nymi składnikami ciał są obiekty dwuwymiarowe – trójkąty, i to raczej
one pełnią u Platona rolę podobną jak atomy w systemie Demokryta.
Trójkąty są jednak, jeśli można tak powiedzieć, „uwięzione” w wielo-
ścianach foremnych i efektywnie żywioły składają się z odpowiednich
wielościanów. Ponieważ ogień, powietrze i woda zbudowane są z takich
samych elementów matematycznych, to żywioły te mogą przemieniać się
w siebie wzajemnie. Nie mogą przemienić się jednak w ziemię, bo ele-
menty matematyczne, z których jest zbudowany sześcian ziemi, są inne
niż elementy matematyczne pozostałych żywiołów.
Wprawdzie już Arystoteles uznawał koncepcję Platona za „niedo-
rzeczną” i krytykował go za „zerwanie z doświadczeniem”,
31
to jednak
pewne idee znalazły pozytywną recepcję wśród dwudziestowiecznych
fizyków. Na przykład Werner Heisenberg pisał następująco:
Według Demokryta atomy są wiecznymi i niezniszczalnymi cząstkami mate-
rii, żaden atom nie może przekształcić się w inny atom. Fizyka współczesna
zdecydowanie odrzuca tę tezę materializmu Demokryta i opowiada się za
stanowiskiem Platona i pitagorejczyków. Cząstki elementarne na pewno nie
są wiecznymi i niezniszczalnymi cegiełkami materii i mogą się w siebie na-
wzajem przekształcać. […] Podobieństwo poglądów współczesnych do kon-
cepcji Platona i pitagorejczyków nie kończy się na tym. Polega ono jeszcze na
czymś innym. „Cząstki elementarne”, o których mówi Platon w Timajosie, w
istocie nie są materialnymi korpuskułami, lecz formami matematycznymi.
32
3. POJĘCIE ATOMU W FILOZOFII MECHANICYZMU
Atomizm nie miał w starożytności i średniowieczu zbyt wielu zwo-
lenników,
33
odrodził się w czasie rewolucji naukowej XVI–XVII wieku, w
rezultacie której powstało matematyczne przyrodoznawstwo. Zwolenni-
kami atomizmu byli m.in. Giordano Bruno, Pierre Gassendi, Mikołaj Ko-
pernik, Galileusz, Robert Boyle i Isaac Newton.
Od czasów sformułowania przez Newtona zasad dynamiki i prawa
powszechnego ciążenia (Philosophiae naturalis principia mathematica, 1687)
dyskusje na temat atomów (i próżni) sytuowały się w ramach paradyg-
matu wyznaczonego przez mechanikę klasyczną, choć miały one jeszcze
charakter bardziej filozoficzny niż naukowy, a w sporach o realność
atomów odwoływano się głównie do argumentów filozoficznych teolo-
gicznych. Założenie atomowej budowy materii jest bowiem niezależne

8
od ważności praw mechaniki, a takie własności atomów, jak rozciągłość,
nieprzenikliwość, bezwładność i podleganie ruchowi przypisywano im
na podstawie analogii do własności ciał makroskopowych.
3.1. KORPUSKUŁY NEWTONA
Newton przypisał atomom (jak zresztą wszelkim ciałom) nową pod-
stawową cechę – bezwładność, której miarą liczbową jest masa, lecz po-
za tym pojęcie atomu pozostawało w istocie demokrytejskie:
Rozciągłość, twardość, nieprzenikliwość, możliwość poruszania się i bez-
władność całości wynika z rozciągłości, nieprzenikliwości, możliwości poru-
szania się i bezwładności części; w związku z tym dochodzimy do wniosku,
że najmniejsze cząstki wszystkich ciał także są rozciągłe, i twarde, i nieprze-
nikliwe, i podległe ruchowi, i obdarzone bezwładnością.
34
Warto zauważyć, że dla greckich atomistów istotnym było przekona-
nie o wieczności atomów, natomiast Newton łączy atomizm z kreacjoni-
zmem:
[…] wydaje mi się prawdopodobne, że na początku Bóg uformował materię
w postaci stałych, masywnych, twardych, nieprzenikliwych, ruchomych czą-
steczek […]; te pierwotne cząstki, będące ciałami stałymi, są nieporówny-
walnie twardsze od jakichkolwiek porowatych ciał z nich zbudowanych; są
one tak twarde, że nigdy się nie zużyją ani nie rozpadną na kawałki; żadna
zwyczajna siła nie zdoła podzielić tego, co Bóg uczynił całością w pierwszym
akcie stworzenia.
35
3.2. MONADY LEIBNIZA
Wielki rywal Newtona Gottfried Wilhelm Leibniz, który krytykował
atomistyczną koncepcję materii Newtona i teorię przestrzeni absolutnej,
był jednocześnie twórcą pewnej formy atomizmu spirytualistycznego –
monadologii.
Opierając się na zasadzie racji dostatecznej Leibniz twierdzi, że nie ma
racji dostatecznej do przyjęcia, by atomy o skończonej przecież wielkości
były dalej niepodzielne:
Nie istnieje atom, a co więcej, żadne ciało nie jest tak drobne, żeby nie mogło
być aktualnie podzielne.
36

9
Ponadto, gdyby istniały atomy, to istniałoby wiele indywiduów nie
różniących się żadną wewnętrzną cechą, to zaś nie zgadza się ze sfor-
mułowaną przez Leibniza zasadą identyczności nierozróżnialnych,
zgodnie z którą nie istnieją dwa nierozróżnialne indywidua.
37
Na podstawie swojego „prawa ciągłości” zaś Leibniz argumentował
natomiast, że gdyby istniały (absolutnie sztywne) atomy, wówczas pod-
czas zderzenia zachodziłaby nieciągła zmiana prędkości, a to „niedo-
rzeczne […] odbywające się w jednej chwili przejście od ruchu do bezru-
chu, a nie przejście przez stopnie pośrednie”.
38
Odrzucając mechanistyczne pojmowanie atomów, Leibniz przyjmuje,
że jednak pewną formę atomizmu, wedle którego ostatecznymi składni-
kami rzeczy są proste substancje o charakterze duchowym – monady.
39
Monady są, podobnie jak atomy, substancjami pozbawionymi części,
niepodzielnymi, niezniszczalnymi i niepodlegającymi zmianom za
sprawą czynników zewnętrznych.
40
Są jednak – w odróżnieniu od mate-
rialnych atomów – jakościowo zróżnicowane.
Monada, o której będziemy tutaj mówili, nie jest niczym innym, jak tylko
substancją prostą […]. Otóż tam gdzie nie ma części, nie jest możliwa rozcią-
głość ani kształt, ani podzielność. I monady te są prawdziwymi atomami
natury – elementami rzeczy.
41
Przykład Leibniza (i Boškovića, o którym niżej) pokazuje, że nie zaw-
sze w pojęciu atomu zawierała się idea rozciągłości przestrzennej.
3.3. PUNKTY MATERIALNE BOŠKOVIĆA
Ciekawym epizodem w historii pojęcia atomu jest atomizm punkto-
wy Rudera Boškovića. Twierdził on, że wszystkie, nawet niezmiernie
złożone zjawiska można wyjaśnić, przyjmując najprostsze możliwe zało-
żenia, to znaczy, że wszystkie zjawiska są rezultatem różnych prze-
strzennych układów i względnych przemieszczeń identycznych cząstek
punktowych, oddziałujących między sobą parami, zgodnie z prostym
prawem determinującym ich względne przyspieszenia.
42
Według Bošk-
ovića elementarnymi składnikami materii są niezmienne, niepodzielne i
nierozciągłe punkty materialne (puncta materiae, prima elementa – Bošk-
ović nie używał terminu „atom”), stanowiące centra oddziaływań.
Podstawowe elementy materii są, moim zdaniem, doskonale niepodzielnymi
i nierozciągłymi punktami; są one rozproszone w niezmierzonej próżni tak,

10
że każde dwa z nich są oddzielone od siebie pewnym interwałem; interwał
ten może nieskończenie wzrastać lub zmniejszać się, ale nigdy całkowicie nie
może zniknąć, pozwalając na wzajemne przenikanie się punktów, ponieważ
nie jest możliwy między nimi bezpośredni kontakt […]. Jako atrybut tych
punktów przyjmuję właściwą im skłonność do pozostawania w stanie spo-
czynku lub ruchu jednostajnego po linii prostej […].
43
W koncepcji Boškovića puncta nie mają rozciągłości przestrzennej,
nieprzenikliwość nie jest zatem atrybutem elementarnych składników
materii.
*
Podsumowując dotychczasowe rozważania można stwierdzić, że od
czasów Demokryta aż do Daltona atomizm był raczej spekulatywną
metafizyką niż teorią naukową. Filozofowie i uczeni nie dysponowali
metodami pozwalającymi na sprawdzenie hipotezy istnienia atomów, a
ich podstawowe własności (nieprzenikliwość, kształt, wielkość, ciężar
czy masa) nie były cechami dającym się określić empirycznie i przypisy-
wano je atomom jedynie na podstawie analogi z przedmiotami makro-
skopowymi. Pojęcia atomów wypracowane w ramach bardziej abstrak-
cyjnych wersji atomizmu (Platon, Bošković) również były raczej owocem
wyobraźni filozofów niż rezultatem badań empirycznych.
4. POJĘCIE ATOMU W NAUCE XIX WIEKU
4.1. ATOM CHEMICZNY DALTONA
Już u Roberta Boyle’a, który przyjmował istnienie próżni i uważał, że
materia składa się z korpuskuł, których podstawowymi własnościami są
kształt, wielkość i ruch obecna jest wyraźna tendencja do czysto fizykal-
nej teorii atomistycznej, czyli do zastosowania pojęcia atomu raczej do
wyjaśnienia konkretnych zagadnień fizycznych i chemicznych (doświad-
czalne prace nad gazami) niż do formułowania ogólnego filozoficznego
obrazu świata.
Jednak z twórcę naukowej atomistyki uważny jest John Dalton.
Wprowadził on atomizm jako hipotezę wyjaśniającą empiryczne prawa
stosunków wagowych substancji w reakcjach chemicznych. Pojęcie ato-
mu z kategorii filozoficznej staje się kategorią naukową (atom chemicz-

11
ny) i po raz pierwszy w historii uzyskuje treść związaną z laboratoryjną
praktyką badawczą.
Sytuacja teoretyczna, w której została sformułowana teoria Daltona
nie miała żadnego związku z problemami, które zaprzątały uwagę staro-
żytnych filozofów atomistów, ale z zagadnieniem rozważanym przez
osiemnastowiecznych chemików: czy w związkach chemicznych złożo-
nych z dwóch lub większej liczby pierwiastków występują one zawsze w
tych samych stosunkach, czy też stosunki te mogą być różne, w zależno-
ści od warunków, w jakich powstaje dany związek.
Joseph Louis Proust (1799) sformułował doświadczalne prawo sto-
sunków stałych głoszące, że składniki wszystkich związków chemicz-
nych występują zawsze w ściśle określonych stosunkach ilościowych. Na
początku XIX wieku prawo Prousta zostało wielokrotnie potwierdzone
doświadczalnie i uzyskało podstawowe znaczenie dla dalszego rozwoju
chemii. Pojawia się jednak pytanie, dlaczego pierwiastków chemicznych
nie można łączyć w związki chemiczne w dowolnych proporcjach, w
zależności od warunków reakcji?
44
Dalton odkrył, że jeżeli dwa pierwiastki łączą się ze sobą w różnych
stosunkach wagowych, to powstają wówczas różne związki chemiczne, a
stosunki wagowe pierwiastków wyrażają się niewielkimi liczbami cał-
kowitymi. Jest to treść sformułowanego w 1805 roku prawa stosunków
wielokrotnych.
Gdyby materia nie była zbudowana z atomów, wówczas występowa-
nie stałych proporcji wagowych pierwiastków w związkach chemicz-
nych byłoby trudne do wyjaśnienia. Jeśli natomiast pierwiastki chemicz-
ne zbudowane są z atomów o określonym ciężarze, wtedy zarówno
prawo stosunków stałych, jak i prawo stosunków wielokrotnych jest
konsekwencją atomowej budowy materii.
45
Założenia atomistycznej teorii Daltona można streścić następująco:
46
wszystkie ciała składają się z atomów powiązanych ze sobą siłami przy-
ciągania; atomy danego pierwiastka chemicznego mają taki sam ciężar
atomowy, wielkość i pozostałe własności; atomy poszczególnych pier-
wiastków różnią się od siebie ciężarem; pierwiastki, podobnie jak atomy,
z których są zbudowane, są niezmienne i nie mogą się wzajemnie w sie-
bie przekształcać; atomy są niepodzielne chemicznie, a reakcje chemicz-
ne mogą jedynie doprowadzić do zmiany połączeń atomów; tworzenie
się związków chemicznych z pierwiastków zachodzi dzięki tworzeniu
się „złożonych atomów” (compound atoms), zawierających określoną licz-
bę atomów każdego pierwiastka.

12
Założenia te mają charakter zdecydowanie naukowy a nie filozoficz-
ny. Tak więc filozoficzna kwestia istnienia absolutnie ostatecznych i nie-
podzielnych składników materii nie ma w tym wypadku znaczenia,
chodzi jedynie o niepodzielność w procesach reakcji chemicznych:
Analizy i syntezy chemiczne nie wychodzą poza oddzielenie od siebie czą-
steczek i ich połączenie. Żadnego tworzenia ani niszczenia materii nie można
osiągnąć w dziedzinie chemii.
47
Podstawowa własność atomów, jaką jest ciężar (względny ciężar ato-
mowy), jest wielkością określaną za pomocą pomiarów. Dalton mówi
ponadto zarówno o atomach pierwiastków chemicznych (atomach pro-
stych), jak i o atomach związków chemicznych (atomach złożonych, czyli
– we współczesnej terminologii – cząsteczkach chemicznych). Atom
chemiczny Daltona jest więc elementarnym składnikiem substancji che-
micznej, niezależnie od tego, czy jest to pierwiastek, czy związek che-
miczny.
48
4.2. POJĘCIE ATOMU W KINETYCZNEJ TEORII GAZÓW
Do fizyki pojęcie atomu zostało efektywnie wprowadzone w połowie
XIX wieku w kinetycznej teorii gazów. Przyjmowano początkowo bar-
dzo prosty model materii – zakładano, że cząsteczki czy atomy są sztyw-
nymi kulkami, a pogląd taki stanowił „podstawę wszystkich rozważań
ówczesnej teorii gazów […]. Z biegiem czasu teoria zdołała jednak roz-
szerzyć swe koncepcje na cząsteczki o wewnętrznych stopniach swobo-
dy, zakładając obrót i ruch drgający atomów”.
49
Atomistyczna teoria ciepła sformułowana przez Jamesa Clerka
Maxwella, Rudolfa Clausiusa i Ludwiga Boltzmanna pokazała, że cie-
pło jest procesem, który polega na przekazywaniu energii kinetycznej od
jednego ciała do drugiego w rezultacie wzajemnych zderzeń między
cząsteczkami. Istotą nowego podejścia było zastosowanie praw mecha-
niki Newtona do wielkiej liczby cząsteczek i wyjaśnienie zachowania
cząsteczek gazu statystycznie na podstawie rachunku prawdopodobień-
stwa. Teoria kinetyczna pozwoliła na redukcję termodynamiki fenome-
nologicznej do fizyki statystycznej. Okazało się, że temperaturę gazu
można powiązać ze średnią energią kinetyczną ruchu cząsteczek, a ci-
śnienie wywierane przez gaz na ścianki naczynia wynika ze zderzeń
cząsteczek gazu ze ściankami.

13
Ponieważ, zgodnie z dobrze już wówczas potwierdzoną drugą zasadą
termodynamiki, w układach izolowanych, występuje określone ukierun-
kowanie zdarzeń w czasie – stany późniejsze charakteryzują się większą
entropią, a równania Newtona są niezmiennicze względem inwersji w
czasie, co znaczy że możliwe są również procesy, w których entropia
maleje, tacy uczeni jak Wilhelm Ostwald odrzucali myśl o realnym ist-
nieniu atomów.
50
Boltzmann wykazał jednak, że drugą zasadę termody-
namiki można zinterpretować mikroskopowo.
51
Powiązanie przez Bolt-
zmanna entropii z prawdopodobieństwem pozwoliło zrozumieć, dlacze-
go nie obserwujemy procesów, w których entropia maleje, jak na przy-
kład skupienie się cząsteczek gazu w niewielkiej objętości naczynia czy
też przepływ ciepła od ciała zimniejszego do cieplejszego. Zjawiska takie
mają po prostu znikomo małe prawdopodobieństwo.
52
Dla recepcji atomizmu w fizyce kapitalne znaczenie miało również
sformułowanie na podstawie hipotezy atomistycznej teorii ruchów
Browna. Podali je niezależnie od siebie Albert Einstein (1905) i Marian
Smoluchowski (1906). Zjawiska fluktuacyjne stanowią mocny dowód
atomistycznej struktury materii, „dzięki nim wielu sceptycznie usposo-
bionych uczonych przekonało się do atomistyki”.
53
Na gruncie kinetycznej teorii gazów oszacowano również wielkość
atomów. Joseph Loschmidt (1865), przyjmując kulisty kształt atomów,
określił poprawnie ich rząd wielkości na 10
–10
m. Po raz pierwszy w hi-
storii atomizmu wielkość atomów została określona w sposób ilościowy
w opozycji do dotychczasowych czysto jakościowych określeń atomów
jako „niezmiernie małych”.
*
Pomimo sceptycznego nastawienia niektórych uczonych do atomi-
zmu, jako koncepcji zbyt spekulatywnej,
54
w XIX wieku zastosowano
pojęcie atomu do opisu i wyjaśnienia konkretnych procesów chemicz-
nych i fizycznych, całkowicie dystansując się od ogólnych problemów
filozoficznych. W odróżnieniu od starożytnej koncepcji atomów charak-
teryzowanych przez nieprzenikliwość, kształt i wielkość dla nauki XIX
wieku znacznie istotniejsze były takie własności atomów, jak ciężar ato-
mowy, sprężystość, zdolność do oddziaływania na siebie siłami przycią-
gania i odpychania, przez co pojęcie atomu uległo wzbogaceniu, ale jed-
nocześnie stopniowo coraz bardziej oddalało się od pojęcia pierwotnego.

14
Rozwój fizyki w drugiej połowie XIX wieku umacniał atomistyczną
teorię materii, ale jednocześnie podważał wielowiekowe przekonania na
temat niezmienności atomów. Odkrycie dyskretnych linii widmowych,
promieni Röntgena i przemian promieniotwórczych doprowadziły osta-
tecznie do wniosku, że atomy nie są obiektami niezmiennymi.
5. POJĘCIE ATOMU W FIZYCE POCZĄTKÓW XX WIEKU
Odkrycie elektronu, cząstki materii drobniejszej niż atom (Joseph
John Thomson, 1897) otworzyło nowy etap w badaniu atomowej struktu-
ry materii. Odkrycie to związane było m.in. z badaniami nad wyładowa-
niami w gazach podejmowanymi przez fizyków w II połowie XIX wieku
i doprowadziło do wniosku, że atomy nie są obiektami elementarnymi,
jak dotąd przyjmowano. Zatem obok pytań, w jaki sposób materia zbu-
dowana jest z atomów, powstały pytania o charakterze bardziej podsta-
wowym – jak zbudowane są atomy? Stopniowo etymologiczna i realna
treść pojęcia „atom” coraz bardziej zaczęły coraz bardziej się od siebie
różnić.
5.1. MODEL ATOMU THOMSONA
Pierwszym modelem atomu jako obiektu złożonego był model
Thomsona (1902), znany w polskojęzycznej literaturze
55
jako model cia-
sta z rodzynkami.
56
Zgodnie z nim atom to dodatnio naładowana kula
materii wielkości rzędu 10
–10
m, w której – podobnie jak rodzynki w cie-
ście – tkwią ujemnie naładowane elektrony. Ponieważ w normalnych
warunkach atomy są elektrycznie obojętne, przyjmowano, że dodatni
ładunek owej kuli jest równy ujemnemu ładunkowi wszystkich elektro-
nów. Rozmieszczenie i liczba elektronów w atomach nie były jednak
jeszcze znane – sugerowano na przykład, że każdy atom składa się z mi-
liardów fragmentów, z których każdy ma dodatni lub ujemny ładunek
równej wielkości.
57
Podstawową wadą modelu atomu Thomsona było to, że trudno było
wyjaśnić trwałość atomów, ponieważ ujemnie naładowane elektrony
działają na siebie siłami odpychania elektrycznego i wyprowadzają taki
układ ze stanu równowagi. Nie wiadomo było również, jakie właściwo-
ści atomów tłumaczą okresowość pierwiastków i naturę wiązań che-

15
micznych i dlaczego każdy pierwiastek posiada charakterystyczne dla
siebie linie spektralne.
5.2. PLANETARNY MODEL ATOMU RUTHERFORDA
Kolejnym ważnym modelem atomu był planetarny model atomu Er-
nesta Rutherforda (1911).
58
Jego sformułowanie umożliwiły nowe tech-
niki eksperymentalne wynalezione przez fizyków na początku XX wie-
ku, z których najważniejsze dla nas mają eksperymenty rozproszeniowe.
Eksperymenty Rutherforda polegały na przepuszczaniu cząstek alfa
przez cienką warstwę złota (około 10
–7
m, czyli około 400 warstw ato-
mów) i analizie kątów ich odchyleń, co pozwalało na zbadanie rozkładu
ładunków elektrycznych wewnątrz atomu.
Rezultaty eksperymentu były zdumiewające. Rutherford stwierdził,
59
że znakomita większość cząstek przelatywała przez folię prawie bez
żadnych odchyleń lub też ulegała odchyleniu o bardzo niewielki kąt, tak
jakby składająca się z 400 warstw atomowych złota folia była całkowicie
przenikliwa dla cząstek alfa. Jednak zdarzały się również cząstki rozpro-
szone do tyłu, tzn. odchylone o kąty większe niż 90 stopni (około jedna
na 20 000).
60
W celu wyjaśnienia rezultatów eksperymentu Rutherford sformuło-
wał planetarny model atomu, zgodnie z którym ładunek dodatni znaj-
duje się w centrum, stanowiąc jądro atomowe, w którym skoncentrowa-
na jest prawie cała masa atomu.
61
Wokół jądra, analogicznie jak planety
wokół Słońca, po kołowych orbitach krążą elektrony. Oszacowania roz-
miarów jądra atomowego dają wielkość rzędu zaledwie 10
–15
m, czyli sto
tysięcy razy mniejszą niż rozmiar całego atomu (10
–10
m) – między elek-
tronem i jądrem jest tylko pusta przestrzeń. Ciała sprawiające na naszych
zmysłach wrażenie ciągłych i nieprzenikliwych substancji „zbudowane
16
są” przede wszystkim z próżni. Trzeba było więc porzucić atrybut nie-
przenikliwości tradycyjnie przypisywany atomom.
Rutherford odkrył jądro atomowe, a jego model atomu dawał całko-
wicie nowy obraz materii. Analogia między układem planetarnym a
atomem jednak zawiodła, ponieważ z elektrodynamiki Maxwella wyni-
ka, że elektrony poruszając się wokół jądra powinny emitować promie-
niowanie elektromagnetyczne, a więc tracić energię i spaść na jądro w
ciągu ułamka sekundy (ok. 10
–8
s). Model ten nie wyjaśniał więc stabilno-
ści atomów. Druga trudność związana jest z faktem, że w modelu pla-
netarnym elektron może krążyć w dowolnej odległości od jądra. Ozna-
cza to, że model Rutherforda nie wyjaśnia, dlaczego rozmiary wszyst-
kich atomów są rzędu 10
–10
m. Po trzecie, jeżeli elektrony mogą krążyć w
dowolnej odległości od jądra, to energia elektronu na orbicie może zmie-
niać się w sposób ciągły. Zatem przy zmianie promienia orbity widmo
promieniowania atomów byłoby ciągłe, co jednak nie zgadza się z ob-
serwacjami dyskretnych linii widmowych.
5.3. MODEL ATOMU WODORU BOHRA
Rozważane poprzednio modele atomów oparte były na fizyce kla-
sycznej i charakteryzowały się poglądowością. Niezależnie od tego, czy
pojmowano atomy jako obiekty elementarne czy też jako układy złożone,
filozofowie i przyrodnicy kształtowali swoje wyobrażenia na temat ato-
mów na podstawie analogii z własnościami obiektów makroskopowych.
Rozwój fizyki atomowej w XX wieku prowadził jednak do coraz bardziej
abstrakcyjnych i niepoglądowych, a nawet sprzecznych z fizyką klasycz-
ną i naszą intuicją pojęć elementarnych składników materii.
17
Model atomu wodoru Nielsa Bohra (1913)
62
opiera się na planetar-
nym modelu Rutherforda uzupełnionym sprzecznymi z elektrodynami-
ką klasyczną warunkami kwantowymi, zwanymi postulatami Bohra.
Podstawowym problemem było dla Bohra wyjaśnienie stabilności
atomów. Na podstawie studiów nad wzorem Balmera wysunął on hipo-
tezę, że elektron krążąc wokół jądra po takich orbitach kołowych, na któ-
rych wartość momentu pędu elektronu jest całkowitą wielokrotnością
kreślonej stałej Plancka h (mvr = nh/2
π
, n = 1, 2, 3…) znajduje się w stanie
stacjonarnym i nie promieniuje energii. Elektron emituje lub absorbuje
energię tylko podczas przeskoku z jednej orbity stacjonarnej na drugą,
przy czym związek energii z częstością promieniowania wyraża się ta-
kim wzorem, jak w teorii Plancka (E
n
– E
m
= hν).
Orbity elektronów w modelu Bohra są skwantowane – ich promienie
(zatem i wartości energii) mogą przybierać tylko ściśle określone, dys-
kretne wartości. Każdemu przeskokowi elektronu między orbitami od-
powiada zaś ściśle określona wartość wypromieniowanej lub pochłonię-
tej energii, a zatem i ściśle określona linia spektralna w widmie promie-
niowania elektromagnetycznego danego pierwiastka.
Teoria Bohra wyjaśniała jednak tylko położenie linii wodoru i zjoni-
zowanego helu, ale już nie cięższych pierwiastków. Postawiła również
nowe problemy: dlaczego tylko niektóre orbity są dozwolone? Gdzie
znajdują się elektrony podczas przejść?
Odkrycie subtelnej struktury widma, czyli faktu, że obserwowane li-
nie widmowe nie są pojedyncze, ale składają się z dwóch lub kilku linii
n=1 n=2 n=3 n=4
18
widmowych o zbliżonej długości fali, wymagało modyfikacji teorii
Bohra. Arnold Sommerfeld sformułował teorię atomu, w której elektro-
ny poruszają się po orbitach eliptycznych, a jądro znajduje się w jednym
z ognisk elipsy. Teoria ta była nieco bardziej skomplikowana niż teoria
Bohra: wymagała dwóch warunków kwantowych i wprowadzenia, obok
głównej liczby kwantowej n, azymutalnej liczby kwantowej l. Sommer-
feld uwzględnił również relatywistyczną zmianę masy elektronu pod-
czas jego ruchu na orbicie.
Aż do odkrycia neutronu (1932) wysuwano wiele modeli atomów z
różnymi konfiguracjami ładunków w jądrach,
63
które jednak nie stano-
wiły znaczącego przełomu w badaniach struktury atomu.
6. POJĘCIE ATOMU W MECHANICE KWANTOWEJ
Podstawą współczesnego rozumienia atomów i cząstek elementar-
nych jest mechanika kwantowa. Jej zręby sformułowali niezależnie od
siebie (wychodząc z całkowicie odmiennych założeń) Werner Heisen-
berg (mechanika macierzowa, 1925) i Erwin Schrödinger (mechanika
falowa, 1926).
Opis atomu polega na rozwiązaniu równania Schrödingera, które jest
podstawowym równaniem opisującym dynamikę układu w (nierelaty-
wistycznej)
64
mechanice kwantowej:
)
,
(
)
(
)
,
(
2
)
,
(
2
2
t
r
r
V
t
r
m
t
r
t
i
v
r
v
h
r
h
Ψ
+
Ψ
∇
−
=
Ψ
∂
∂
Wielkim sukcesem mechaniki kwantowej było obliczenie poziomów
energetycznych atomów, wyjaśnienie budowy atomów i okresowości
tablicy Mendelejewa pierwiastków chemicznych. Sukcesy te przyszło
jednak opłacić całkowitym zerwaniem z poglądowym charakterem mo-
delu atomu. Stan atomu (i dowolnego innego układu kwantowomecha-
nicznego) reprezentuje pewne wyrażenie matematyczne funkcja falowa
Ψ (wektor z abstrakcyjnej przestrzeni Hilberta). Wprawdzie zgodnie z
równaniem Schrödingera ewolucja w czasie funkcji Ψ ma charakter cią-
gły i deterministyczny, to jednak może być powiązana z doświadcze-
niem jedynie wówczas, gdy nastąpi pomiar danej wielkości fizycznej.
Aparat matematyczny mechaniki kwantowej pozwala na obliczenie je-
dynie prawdopodobieństw rezultatów pomiarów (Max Born, 1926) i w

19
tym sensie jest ona teorią indeterministyczną. Tak więc możemy na
przykład obliczyć prawdopodobieństwo znalezienia elektronu w danym
obszarze wokół jądra atomowego w atomie w rezultacie wykonanego
pomiaru, lecz z uwagi na zasadę superpozycji stanów, nie możemy
przypuszczać, że elektron był w danym miejscu również przed wykona-
niem pomiaru.
Co więcej, z uwagi na obowiązujące w mechanice kwantowej relacje
nieoznaczoności Heisenberga
65
dla pewnych par wielkości fizycznych
(zwanych sprzężonymi), takich jak pęd i położenie, elektrony nie poru-
szają się wokół jądra po orbitach – pojęcie orbity traci na gruncie mecha-
niki kwantowej sens. Atomy według pojęć mechaniki kwantowej nie-
wątpliwie składają się z jądra atomowego i elektronów, lecz ruch elek-
tronów wokół jądra wymyka się poglądowym wyobrażeniom i jedyny
dostęp poznawczy do świata atomów daje wyrafinowany formalizm
matematyczny (oczywiście w połączeniu z całym zapleczem fizyki do-
świadczalnej). Model atomu w mechanice kwantowej jest więc modelem
czysto matematycznym, zaś wszelkie analogie z przedmiotami makro-
skopowymi, znanymi z codziennego doświadczenia, należy uznać za
chybione.
Dalsze badania wzbogaciły kwantowomechaniczne pojęcie atomu:
wprowadzono nową charakterystykę elektronów (i innych cząstek ele-
mentarnych) – spin (Georg Uhlenbeck i Samuel Goudsmit, 1925); od-
kryto, że jądra również atomowe również mają złożoną strukturę – zbu-
dowane są z dodatnio naładowanych protonów (Rutherford i James
Chadwick),
66
których liczba determinuje rodzaj pierwiastka i tym samym
jego miejsce w układzie okresowym oraz obojętnych elektrycznie neu-
tronów (Chadwick, 1932).
67
Współcześnie przyjmuje się, że również
protony i neutrony składają się z bardziej elementarnych obiektów –
kwarków (Murray Gell-Mann, 1964).
68
Atomy nie są więc obiektami pro-
stymi, lecz jest układami złożonymi czyli systemami.
Atomy nie są również obiektami absolutnie niezmiennymi i trwałymi,
lecz jedynie układami względnie niezmiennymi i względnie trwałymi. Z
uwagi na skwantowanie poziomów energetycznych elektronów atomy
są relatywnie niezmienne w tym sensie, że kwant energii o wartości
mniejszej niż różnica poziomów energetycznych, charakterystyczna dla
atomu danego rodzaju, nie powoduje zmiany polegającej na wzbudzeniu
atomu. Niektóre atomy (ściślej nuklidy, czyli jądra atomowe o określo-
nych wartościach liczby atomowej i masowej) są względnie trwałe w tym
znaczeniu, że bez ingerencji czynników zewnętrznych (jak na przykład

20
bombardowanie neutronami) mogą trwać dowolnie długi czas. Niektóre
nuklidy jednak podlegają spontanicznemu rozpadowi promieniotwór-
czemu, a naturalne i sztuczne przemiany promieniotwórcze prowadzą
do wzajemnych przekształceń atomów (szeregi promieniotwórcze).
Atomy nie są również niepodzielne (do jonizacji atomu wystarczy
niewielka energia – rzędu kilku eV), ale można dokonać rozszczepienia
jądra atomowego (Otto Hahn i Lise Meitner, 1939), w rezultacie czego
wyzwala się olbrzymia energia. Możliwa jest nawet sztuczna przemiana
atomów jednych pierwiastków w inne i produkcja takich, które nie wy-
stępują w stanie naturalnym w przyrodzie.
69
Atomy nie są również obiektami wiecznymi — powstały w trakcie
ewolucji wszechświata, gdy w rezultacie ekspansji ciśnienie i temperatu-
ra spadły do odpowiednio niskich wartości, umożliwiających powstanie
w przestrzeni kosmicznej atomów wodoru i helu. Atomy cięższych
pierwiastków powstały w gwiazdach, dzięki zachodzącym w nich proce-
som nukleosyntezy.
7. FILOZOFICZNE POJĘCIE ATOMU A CZĄSTKI
FUNDAMENTALNE
Powstaje naturalnie pytanie, czy odpowiednimi kandydatami na ato-
my filozofów, czyli ostateczne składniki materii są cząstki elementarne i
zagadnienie istnienia podstawowych składników materii należy przesu-
nąć poziom niżej w hierarchii struktur fizycznych.
70
Z jednej strony, na powyższe pytanie można odpowiedzieć twierdzą-
co, ponieważ według modelu standardowego fizyki cząstek elementar-
nych najprostszymi składnikami materii są kwarki i leptony, które na-
zywane są cząstkami fundamentalnymi (właściwie wszystkie otaczające
nas rzeczy zbudowane są ostatecznie z kwarków górnego i dolnego oraz
z elektronów).
71
Z drugiej jednak stromy, model standardowy fizyki cząstek elemen-
tarnych, pomimo wielu sukcesów, jest współcześnie dość fragmenta-
ryczny i daleki od stanu dojrzałości. Formalizm grupy SU(3) nie daje
kompletnego i spójnego opisu procesów fundamentalnych, dlatego for-
mułuje się odmienne koncepcje, takie jak teoria wielkiej unifikacji i teoria
strun.
72
Podstawową wadą modelu standardowego jest to, że nie
uwzględnia on oddziaływania grawitacyjnego.
73
Ponadto, jeżeli już na-
wet pominiemy setki nietrwałych cząstek elementarnych, lub cząstki

21
takie jak protony i neutrony, o których wiemy, że złożone są z kwarków,
a zatem nie są obiektami elementarnymi i skupimy uwagę na cząstkach
fundamentalnych, to okazuje się, że nie wykazują one cech, które przypi-
sywano atomom w sensie filozoficznym.
Cząstki fundamentalne nie są odwieczne, ponieważ nasz Wszech-
świat miał początek w czasie – około 13,7 miliarda lat temu powstał w
gorącym Wielkim Wybuchu. We wczesnym etapie ewolucji, zwanym erą
Plancka,
74
panowały tak ekstremalne warunki fizyczne, że materia w
znanej nam postaci (ani atomy, ani nawet cząstki elementarne) nie mogły
wówczas istnieć.
Cząstki fundamentalne nie są absolutnie trwałe. Wprawdzie elektron
jest cząstką trwałą w tym sensie, że nie ulega spontanicznemu rozpado-
wi, ale w rezultacie zderzenia z antycząstką (pozytonem) następuje ani-
hilacja – cząstki te przestają istnieć, a powstają kwanty promieniowania
elektromagnetycznego (fotony):
e
+
+ e
–
→ 2
γ
.
Procesy anihilacji dotyczą również par kwark – antykwark.
W pobliżu jądra atomowego możliwy jest również proces odwrotny
do anihilacji, czyli kreacja par cząstka – antycząstka z wysokoenerge-
tycznego fotonu:
γ
→ e
+
+ e
–
.
Elektrony (i pozostałe leptony) powstają również w innych procesach,
jak na przykład w rozpadzie neutronu na proton elektron i antyneutrino
elektronowe:
n
0
→ p
+
+ e
–
+⎯
ν
e
.
Powstające w tym rozpadzie cząstki nie są jednak składnikami neu-
tronu w takim sensie, jak elektrony, protony i neutrony są składnikami
atomów. Procesy te polegają raczej na przekształcaniu się jednych czą-
stek elementarnych w inne cząstki. Jednak w filozoficznym pojęciu ato-
mu przyjmowano, że żaden atom (cząstka elementarna) nie może ani
powstać, ani przestać istnieć, ani też przekształcić się w żaden inny atom.
Fizyka cząstek elementarnych nie potwierdza tego założenia. Na funda-

22
mentalnym poziomie struktury materii nie znajdujemy absolutnie trwa-
łych składników.
Cząstki fundamentalne, takie jak elektron, uważa się, podobnie jak
atomy filozofów niepodzielne. Nigdy dotąd nie zaobserwowano na
przykład części elektronu, lecz zawsze całą cząstkę o określonej masie i
ładunku. Jednak zgodnie z kwantową teorią pola, każda cząstka kwan-
towa otoczona jest chmurą cząstek wirtualnych i nie istnieje bez swego
wirtualnego otoczenia.
75
Mechanizmy kreacji i absorpcji cząstek wirtual-
nych sprawiają, że w określonym sensie cząstka elementarna „składa
się” z tejże cząstki i swego wirtualnego otoczenia.
76
Cząstkom kwantowym nie możemy również przypisywać „prostego
umiejscowienia w przestrzeni”.
77
Zgodnie z mechaniką kwantową, jeżeli
wykonamy pomiar położenia elektronu i znajdziemy go w pewnym
miejscu, to nie możemy stąd wnosić, że elektron znajdował się w tym
miejscu również przed wykonaniem pomiaru i niezależnie od niego.
Zasada nieoznaczoności Heisenberga dla pędu i położenia oraz sławny
eksperyment na dwóch szczelinach, w którym obserwuje się interferen-
cję elektronów,
78
skutecznie uniemożliwiają również przypisanie cząst-
kom kwantowym ściśle określonych trajektorii w przestrzeni.
W pewnych przypadkach cząstki kwantowe nie są niezależnie od sie-
bie istniejącymi obiektami nawet wówczas, gdy są odseparowane prze-
strzennie. Wniosek ten wynika z eksperymentu (początkowo jedynie
myślowego) Einsteina, Podolskiego i Rosena,
79
(EPR) a ściślej – z empi-
rycznej falsyfikacji nierówności Bella
80
w doświadczeniach Aspecta.
81
Eksperymenty Aspecta prowadzą do wniosku, że cząstki, które kiedyś
oddziaływały ze sobą, pozostają w jakiś sposób częściami jednego syste-
mu nawet wówczas, gdy obecnie dzieli je znaczna odległość przestrzenna
i wobec tego trudno traktować je jako całkowicie od siebie niezależne real-
ności fizyczne. Nielokalność (non-separability) mechaniki kwantowej uka-
zuje holistyczne aspekty tej teorii, które są zdecydowanie niezgodne z
podstawowymi założeniami atomizmu.
Trudno również traktować cząstki kwantowe jako indywidua, do któ-
rych można by stosować wyrażenia „ta oto” w odróżnieniu od „tamtej”.
Zgodnie z mechaniką kwantową wszystkie cząstki elementarne danego
gatunku („cząstki identyczne”) nie różnią się od siebie żadną we-
wnętrzną cechą i – zgodnie ze statystykami kwantowymi Bosego–Ein-
steina i Fermiego Diraca – są nierozróżnialne. Przykładem może być
pierwsza „orbita” w atomie, na której mogą znajdować się co najwyżej
dwa elektrony: wiadomo, że muszą one mieć skierowane przeciwnie

23
spiny, ale „nie istnieje eksperymentalna metoda, pozwalająca stwierdzić,
że ten elektron ma spin w górę, a tamten ma spin w dół”.
82
Dodajmy na zakończenie, że pojęcie kwantowej próżni współczesnej
fizyki jest również bardzo odległe zarówno od starożytnego pojęcia nie-
bytu, jak i od nowożytnego pojęcia przestrzeni absolutnej. Nie jest ona
po prostu pustą przestrzenią o czysto geometrycznych właściwościach,
ale ośrodkiem dynamicznym, w którym – dzięki kwantowej nieoznaczo-
ności energii i czasu – zachodzą nieustanne procesy kreacji i anihilacji
par cząstek wirtualnych. Znanym dowodem realności fluktuacji kwan-
towych próżni jest efekt Casimira.
83
8. WNIOSKI
Pojęcie atomu, rodem ze spekulatywnej filozofii przyrody, przez poję-
cie atomu chemicznego przekształciło się w pojęcie złożonego układu,
jakim jest atom według mechaniki kwantowej. Współczesne pojęcie ato-
mu jest więc bardzo odległe od intuicji starożytnych greków i teorii na-
uki klasycznej – łączy je właściwie tylko wspólna nazwa. Rozwój fizyki
w XX wieku przyniósł tak spektakularne potwierdzenie tezy o atomowej
strukturze materii — od bomby atomowej po możliwość manipulowania
pojedynczymi atomami — że w istnienie atomów i cząstek elementar-
nych trudno dziś wątpić. W tym sensie redukcjonistyczny paradygmat
badawczy filozofii atomizmu okazał się niezwykle owocny i bliższy na-
uce współczesnej niż jakikolwiek inny system filozofii przyrody –
wszystko składa się z atomów.
Z drugiej jednak strony, kwarki i leptony trudno uznać za współcze-
sne odpowiedniki filozoficznych atomów. Jeśli już pominiemy fakt, że
właściwości pierwotnie przypisywane elementarnym składnikom mate-
rii w kategoriach pojęciowych zaczerpniętych z doświadczenia makro-
skopowego (nieprzenikliwość, kształt, wielkość, ciężar) zastąpiono abs-
trakcyjnymi i niepoglądowymi cechami (np. spin, dziwność, powab),
które mogą być wyrażone jedynie w języku formalizmu matematyczne-
go, to na poziomie elementarnych składników materii nie znajdujemy
wiecznych, absolutnie niezmiennych, trwałych, substancjalnych ele-
mentów. Z uwagi na wzajemne przekształcenia się w siebie cząstek ele-
mentarnych, zmian zachodzących w przyrodzie nie można już zreduko-
wać jedynie do ruchu przestrzennego. Zasada nieoznaczoności nie po-
zwala myśleć o cząstkach kwantowych jako obiektach jednoznacznie

24
zlokalizowanych w przestrzeni niezależnie od dokonywanych pomia-
rów. Korelacje EPR prowadzą zaś do wniosku, że dwie cząstki, które
kiedyś ze sobą oddziaływały, tworzą jeden niepodzielny układ, nawet
gdy znajdują się w odległych miejscach przestrzeni. Statystyki kwanto-
we, z których wynika, że cząstek kwantowych nie można traktować jako
indywiduów i dualizm korpuskularno-falowy prowadzą zaś do wnio-
sku, że zastosowanie samego pojęcia „cząstki” do fundamentalnych
składników materii według fizyki współczesnej staje się wysoce proble-
matyczne.
Można zatem powiedzieć, że rozwój fizyki atomowej w XX wieku
potwierdził wprawdzie tezę o atomowej budowie materii, podważył
jednak podstawowe założenia atomizmu.

25
Ewolucja pojęcia atomu
STRESZCZENE
W artykule przeanalizowano główne etapy rozwojowe pojęcia atomu
– od starożytnej filozofii przyrody, przez naukę klasyczną aż do współ-
czesnej fizyki atomowej i fizyki cząstek elementarnych. Podjęto próbę
ukazania punktów przełomowych zarówno w pojmowaniu atomów, jak
również w charakterze sytuacji problemowych, jakie stanowiły punkt
wyjścia dla atomistów poszczególnych epok i przyjmowanych metod
poznania przyrody.
Pojęcie atomu należało pierwotnie do spekulatywnej filozofii przyro-
dy i związane było z rozważanym przez starożytnych myślicieli zagad-
nieniem elementarności, to jest pytaniem o najbardziej podstawowy ro-
dzaj obiektów, z których zbudowane są wszystkie rzeczy. Omówione są
koncepcje, które miały istotny wpływ na powstanie atomizmu (pitago-
rejczycy, Parmenides, Empedokles) a następnie pojęcie atomu w filozofii
przyrody Leukipposa i Demokryta oraz pewne modyfikacje wprowa-
dzone przez Epikura. Uwzględniono również atomizm geometryczny
Platona.
Powstanie nowożytnego matematycznego przyrodoznawstwa sprzy-
jało renesansowi atomizmu, który zarzucono niemal całkowicie na dwa
tysiąclecia, a od powstania mechaniki klasycznej dyskusje na temat ato-
mów (i próżni) sytuowały się w paradygmacie filozofii mechanicyzmu.
Miały one jednak bardziej filozoficzny niż naukowy charakter, ponieważ
nie dysponowano metodami pozwalającymi na sprawdzenie hipotezy
atomistycznej. Poglądy na temat atomów były jeszcze bardziej dziełem
wyobraźni uczonych i filozofów (np. Newton, Leibniz, Bošković), niż
rezultatem badań empirycznych.
Naukowy charakter uzyskało pojęcie atomu w pracach Daltona w
chemii, a następnie zostało wprowadzone do fizyki w kinetycznej teorii
materii. W XIX wieku zostało ono zastosowane do wyjaśnienia konkret-
nych problemów chemicznych i fizycznych a kwestie filozoficzne, istotne
dla atomistów dawnych epok, stały się całkowicie drugorzędne.
Odkrycie elektronu (Thomson) otworzyło nowy etap w rozwoju poję-
cia atomu, ponieważ pokazało, że atomy nie są obiektami elementarny-
mi. W związku z powyższym obok pytań, w jaki sposób materia jest
zbudowana z atomów, powstały pytania o charakterze bardziej funda-
mentalnym – jak zbudowane są same atomy. Odkrycie jądra atomowego

26
(Rutherford) ukazało całkowicie nowy obraz materii na poziomie ato-
mowym i jednocześnie dowiodło nieadekwatności aparatury pojęciowej
mechaniki klasycznej do opisu struktury atomu.
Częściowo trudności, przed jakimi stanęli fizycy, pokonał Bohr (mo-
del atomu wodoru), ale w pełni zgodny z doświadczeniem opis atomów
dała dopiero mechanika kwantowa (Schrödinger, Heisenberg i inni).
Dalsze badania doprowadziły do odkrycia złożonej struktury jądra ato-
mowego (protony i neutrony) oraz złożonej budowy samych nukleonów
(kwarki). Po rozbiciu jądra atomowego etymologiczna i realna treść na-
zwy „atom” całkowicie przestały sobie odpowiadać. Atomy okazały się
układami złożonymi i podzielnymi.
Współcześnie – zgodnie z modelem standardowym fizyki cząstek
elementarnych – za podstawowe składniki materii uznaje się leptony i
kwarki. Powstaje zatem pytanie, czy cząstki te, zwane cząstkami funda-
mentalnymi, można uznać za obiekty, które stanowiłyby odpowiednik
atomów w sensie filozoficznym, czyli ostatecznych, trwałych, niepo-
dzielnych i niezmiennych bytów. Osobliwości mikroświata ukazywane
przez mechanikę kwantową prowadzą jednak do nieco paradoksalnego
wniosku, że choć trudno dziś wątpić w realność atomów (i cząstek ele-
mentarnych), to jednak obiekty te nie spełniają kryteriów, które uznawa-
no za konstytutywne dla pojęcia ostatecznych składników materii. Roz-
wój fizyki atomowej w XX wieku potwierdził więc tezę, że istnieją atomy
i próżnia, podważył jednak podstawowe filozofii atomizmu. Redukcjoni-
styczna ontologia substancjalnych bytów jednostkowych nie jest już ade-
kwatnym obrazem świata, ale jak dotąd nie udało się sformułować jed-
nolitego obrazu materii na poziomie fundamentalnym.

27
1.Wstęp .................................................................................................................................... 1
2.Pojęcie atomu w starożytnej filozofii przyrody............................................................... 2
2.1. Prototypy pojęcia atomu........................................................................................... 2
2.2. Atomy Leukipposa i Demokryta ............................................................................. 3
2.3. Atomy Epikura........................................................................................................... 5
2.4. Atomy geometryczne Platona .................................................................................. 5
3.Pojęcie atomu w filozofii mechanicyzmu......................................................................... 7
3.1. Korpuskuły Newtona................................................................................................ 8
3.2. Monady Leibniza ....................................................................................................... 8
3.3. Punkty materialne Boškovića................................................................................... 9
4.Pojęcie atomu w nauce XIX wieku .................................................................................. 10
4.1. Atom chemiczny Daltona ....................................................................................... 10
4.2. Pojęcie atomu w kinetycznej teorii gazów............................................................ 12
5.Pojęcie atomu w fizyce początków XX wieku ............................................................... 14
5.1. Model atomu Thomsona......................................................................................... 14
5.2. Planetarny model atomu Rutherforda .................................................................. 15
5.3. Model atomu wodoru Bohra .................................................................................. 16
6.Pojęcie atomu w mechanice kwantowej ......................................................................... 18
7.Filozoficzne pojęcie atomu a cząstki fundamentalne.................................................... 20
8.Wnioski ............................................................................................................................... 23

28
PRZYPISY
1
R. P. Feynman, R. B. Leighton, M. Sands, Feynmana wykłady z fizyki, t. 1, cz. 1, tłum.
R. Gajewski, Z. Królikowska, M. Grynberg, T. Buttler, PWN, Warszawa 1974, s. 21.
2
Arystoteles, Metafizyka, I, 985 b–986 a, tłum. K. Leśniak, [w:] Arystoteles Dzieła
wszystkie, t. 2, Fizyka. O niebie. O powstawaniu i niszczeniu. Meteorologika. O świecie. Metafi-
zyka, PWN, Warszawa 1990.
3
Arystoteles, Metafizyka, XIII, 1080 b.
4
Por. M. Jammer, Concepts of Space. The History of Theories of Space in Physics, Harvard
University Press, Cambridge, Massachusetts 1957, s. 7.
5
Por. A. Krokiewicz, Zarys filozofii greckiej. Od Talesa do Platona, PWN, Warszawa
1975, s. 176.
6
H. Diels, Die Fragmente der Vorsokratiker. Griechisch und Deutschich, Weidmennsche
Buchhandlung, Berlin 1903, B 7, tłum. B. Kupis, [w:] J. Legowicz (red.), Filozofia starożytna
Grecji i Rzymu, PWN, Warszawa 1970, s. 82–83. U Lukrecjusza czytamy: „Rzecz zacznie-
my wywodzić z tego założenia, że nigdy nic nie powstaje z niczego przez boskie zrzą-
dzenie” (Lukrecjusz, O rzeczywistości. Ksiąg sześć, tłum. A. Krokiewicz, De Agostini Pol-
ska, Warszawa 2003, I, 146–158).
7
Melissos twierdził, że „nic nie jest próżne. Próżnia jest nicością, a to, co jest nicością,
nie istnieje”. [To, co istnieje] nie porusza się także, nie ma bowiem gdzie się przesunąć,
ale jest pełne. Gdyby istniała próżnia, mogłoby przesunąć się w próżnię. Ponieważ próż-
nia nie istnieje, nie ma się gdzie przesunąć (H. Diels, Die Fragmente…, B 7, [w:] J. Lego-
wicz (red.), Filozofia starożytna…, s. 88)
8
Dzieje się to za sprawą dwóch „sił”, zwanych miłością i waśnią, czyli, we współcze-
snej terminologii, sił przyciągania i siły odpychania.
9
H. Diels, Die Fragmente…, B 8, [w:] J. Legowicz (red.), Filozofia starożytna…, s. 91.
10
Arystoteles, O powstawaniu…, I, 325 a.
11
Por. H. J. Johnson, Three Ancient Meanings of Matter: Democritus, Plato, and Aristotle,
„Journal of the History of Ideas” 1967, Vol. 28, nr 1, s. 7.
12
Por. D. Sedley, Two Conceptions of Vacuum, „Phronesis” 1982, nr 27, s. 175–193, s.
175.
13
Por. M. Jammer, Concepts of Space. The History of Theories of Space in Physics, Harvard
University Press, Cambridge, Massachusetts 1957, s. 11.
14
Por. C. Bailey, The Greek Atomists and Epicurus, Russell & Russell Inc., New York
1964, s. 75 i n. „[…] elementami są pełnia i próżnia (τό πληρες καί τό κενόν), nazywając
jedno bytem, a drugie niebytem; pełnia i ciała stałe to byt, próżnia to niebyt (z tego też
względu mówili, że byt nie więcej istnieje niż niebyt, ponieważ ciało stałe nie bardziej
istnieje niż próżnia); i to były materialne przyczyny rzeczy” (Arystoteles, Metafizyka, I,
985 b).
15
Sekstus Empiryk, Adversus mathematicos, VII 135; FVS 68 B 9, [w:] W. F. Asmus, De-
mokryt. Wybór fragmentów Demokryta i świadectw starożytnych o Demokrycie, tłum. B. Kupis,
Książka i Wiedza, Warszawa 1961.
16
Arystoteles, O niebie, III, 303 a, tłum. P. Siwek, [w:] Arystoteles, Dzieła…, t. 2.
17
„Twierdzili, że są trzy różnice [w elementach]: kształt, porządek i położenie […]; bo
A różni się od N kształtem, AN od NA porządkiem, Z od N położeniem” (Arystoteles,
Metafizyka, I, 985 b).

29
18
Diogenes Laertios, Żywoty i poglądy słynnych filozofów, tłum. I. Krońska, K. Leśniak,
W. Olszewski, PWN, Warszawa 1984, IX, 44–46.
19
„[…] Demokryt chciał wykazać, iż niemożliwe jest, by wszystkie rzeczy miały po-
czątek; bo właśnie czas jest niestworzony” (Arystoteles, Fizyka, VIII, 251 b, tłum. K. Le-
śniak, [w:] Arystoteles, Dzieła…, t. 2).
20
Argument Arystotelesa jest następujący: „Załóżmy mianowicie, że rzecz bez części
zmienia się, przechodząc ze stanu AB do BΓ – bądź z jednej wielkości w inną, bądź z
jednego kształtu w inny, bądź wreszcie z jednego stanu w przeciwny – i niechaj Δ będzie
pierwszą chwilą, w której zachodzi zmiana. Wobec tego w czasie, w którym się dokonuje
zmiana, owa rzecz musi być albo w AB, albo w BΓ, albo częściowo w A, częściowo w B;
bo tak, jak widzieliśmy, można zgodnie z prawdą powiedzieć to o wszystkim, co się
zmienia. Ale przecież nie może być częściowo w tym, a częściowo w tamtym, bo musia-
łoby być podzielne. Nie może też być w BΓ, gdyż to by znaczyło, że proces zmiany został
już zakończony, a zakłada się, że zmiana się dokonuje. Pozostaje zatem, że w czasie
zmiany [rzecz] znajdowała się w AB. Jeżeli tak, to spoczywała; bo jak widzieliśmy, znaj-
dować się w tym samym stanie przez pewien czas, to tyle, co spoczywać. Tak więc jest
niemożliwe, by to, co nie ma części, mogło się poruszać lub zmieniać w jakikolwiek spo-
sób. Pod jednym tylko warunkiem ruch tego, co nie ma części, byłby możliwy, pod tym
mianowicie, że czas składałby się z szeregu «teraz»” (Arystoteles, Fizyka, VI, 240 b).
21
Diogenes Laertios, Żywoty…, X, 59.
22
Por. A. Krokiewicz, Nauka Epikura, Aletheia, Warszawa 2000, s. 216.
23
Por. C. Bailey, The Greek Atomists and Epicurus, Russell & Russell Inc., New York
1964, s. 287.
24
Por. Epikur, List do Herodota, [w:] Diogenes Laertios, Żywoty…, X, 43.
25
Por. Arystoteles, Metafizyka, I, 985 b.
26
M. Jammer, Concept of Mass in Classical and Modern Physics, Harvard University
Press, Cambridge, Massachusetts 1961, s. 26.
27
Por. M. Jammer, Concepts of Space…, s. 11.
28
Epikur wprowadził również modyfikacje do deterministycznego systemu Demo-
kryta, przyjmując, że atomy ulegają przypadkowym odchyleniom podczas wiecznego
ruchu (parenkliza), lecz pogląd ten dotyczy raczej teorii ruchu, niż samego pojęcia ato-
mu, zatem jego szersze omówienie nie mieści się w ramach niniejszego artykułu.
29
Platon, Timajos. Kritas albo Atlantyk, tłum. P. Siwek, PWN, Warszawa 1986, 61 c.
30
Zagadnienie, dlaczego Platon wybrał trójkąty o takich kształtach, doczekało się
wielu interpretacji, lecz omówienie tej kwestii wykracza poza ramy tego artykułu.
31
Arystoteles, O powstawaniu i niszczeniu, tłum. L. Regner, [w:] Arystoteles, Dzieła…, t.
2, I, 316 a.
32
W. Heisenberg, Fizyka a filozofia, tłum. S. Amsterdamski, Książka i Wiedza, War-
szawa 1965, s. 56–57.
33
Do czego przyczyniły się zarówno względy naukowe, jak i pozanaukowe – etyczne
i religijne. Por. A. Łukasik, Filozofia atomizmu. Atomistyczny model świata w filozofii przyro-
dy, fizyce klasycznej i współczesnej a problem elementarności, Wyd. UMCS, Lublin 2006, s.
108–115.
34
I. Newton, Mathematical Principles of Natural Philosophy, transl. by A. Motte, [w:]
R. M. Hutchins (ed.), Great Books of The Western World, t. 34, Mathematical Principles of
Natural Philosophy. Optics, by sir Issac Newton, Treatise on Light, by Christian Huygens,
Encyclopaedia Britannica Inc., Chicago – London – Toronto 1952, s. 270. Newton bronił

30
również poglądu o istnieniu próżni, co jest równie istotnym, jak teza o dyskretnej budo-
wie materii, składnikiem atomizmu.
35
I. Newton, Optics, [w:] R. M. Hutchins (ed.), Great Books …, t. 34, s. 541.
36
G. W. Leibniz, Prawdy pierwotne metafizyki, tłum. J. Domański, [w:] idem, [w:] idem,
Wyznanie wiary filozofa. Rozprawa metafizyczna. Monadologia. Zasady natury i łaski oraz inne
pisma filozoficzne, tłum. S. Cichowicz, J. Domański, H. Krzeczkowski, H. Moese, PWN,
Warszawa 1969, s. 92.
37
G. W. Leibniz, Polemika z Clarkiem. Czwarte pismo Leibniza, [w:] idem, Wyznanie…, s.
347.
38
Ibidem.
39
Wszystkie monady są natury duchowej, ale „nie ma dusz całkiem o d d z i e l o -
n y c h ani też duchów pozbawionych ciała. Jeden tylko Bóg jest całkowicie odeń odłą-
czony” (G. W. Leibniz, Zasady filozofii, czyli monadologia, [w:] idem, Wyznanie…, s. 312).
40
Por. R. Bregman, Leibniz and Atomism, „Nature and System” 1984, nr 6, s. 237–248, s.
242.
41
G. W. Leibniz, Zasady filozofii, czyli monadologia, [w:] idem, Wyznanie…, s. 297.
42
Por. L. L. Whyte, Boscovich’s Atomism, [w:] L. L. Whyte (ed.), Roger Joseph Boscovich.
Studies on His Life and Work on the 250
th
Anniversary of His Birth, George Allen & Unwin
Ltd., Ruskin House Musseum Street, London 1961, s. 117.
43
R. J. Boscovich, A Theory of Natural Philosophy, trans. J. M. Child, Open Court Pub-
lishing, Chicago – London 1922, http://dbhs.wvusd.k12.ca.us/webdocs/Chem-
History/Boscovich-1763.html. Bezwładność w rozumieniu Boškovića nie jest jednak, w
przeciwieństwie do teorii Newtona, związana z masą, rozumianą jako absolutna wła-
sność elementarnych składników materii.
44
Dla pewnych związków, zwanych bertolidami, zachodzą odstępstwa od powyż-
szego prawa. Związki spełniające prawa stechiometryczne określa się jako daltonidy
(por. Struktura materii. Poradnik encyklopedyczny, tłum. zbiorowe, PWN, Warszawa 1980, s.
11).
45
Dalton porównywał nawet chemię przed sformułowaniem przez niego teorii ato-
mistycznej z astronomią przed sformułowaniem przez Newtona prawa powszechnego
ciążenia i twierdził, że bez teorii atomistycznej prawa stosunków stałych i wielokrotnych
są równie „mistyczne”, jak prawa Keplera bez dynamiki Newtona (por. W. H. Brock, D.
M. Knight, The Atomic Debates, [w:] W. H. Brock (ed.), The Atomic Debates. Brodie and the
Rejection of the Atomic Theory, Leicester University Press, Leicester 1967, s. 5).
46
New System of Chemical Philosophy (1808). Por. J. Dalton, New System of Chemical Phi-
losophy, cz. 1, Manchester – London 1808, from fascimile edition W. Dawson, London
1953, [w:] http://web.lemoyne.edu/~giunta/dalton.html, cz. 1, rozdz. 2, On the Constitu-
tion of Bodies, [w:] http://web.lemoyne.edu/~giunta/dalton.html; G. Holton, S. G. Brush,
Introduction to Concepts and Theories in Physical Science, Addison–Wesley Publishing Com-
pany, Reading, Massachusetts, Menlo Park, California – London – Don Milis, Ontario
1973, s. 313–320.
47
J. Dalton, New System…, cz. 1, rozdz. 3, On Chemical Synthesis, [w:]
http://web.lemoyne.edu/~giunta/dalton.html.
48
Dalton w New System… przedstawił tablicę 37 elementów, wśród których, obok
symboli pierwiastków chemicznych we współczesnym rozumieniu, figurują również
„atomy” wody i innych związków chemicznych.
49
M. von Laue, Historia fizyki, tłum. A. Teske, PWN, Warszawa 1957, s. 154.

31
50
Por. R. Mierzecki, Historyczny rozwój pojęć chemicznych, PWN, Warszawa 1987, s.
135.
51
Druga zasada termodynamiki stwierdza, że w układzie izolowanym mogą zacho-
dzić jedynie takie procesy, w których entropia S rośnie (dla procesów nieodwracalnych)
lub pozostaje stała (dla procesów odwracalnych):
0
≥
dt
dS
.
Wzrost entropii w procesach nieodwracalnych oznacza, że układy te ewoluują od
stanów bardziej uporządkowanych do stanów mniej uporządkowanych. Stan równowagi
termodynamicznej jest zatem stanem o maksymalnej entropii, czyli największego w da-
nych warunkach braku uporządkowania. Ponieważ entropia wyraża się wzorem
S = k
B
lnP, gdzie k
B
jest stałą Boltzmanna, P jest wyrażeniem proporcjonalnym do praw-
dopodobieństwa danego stanu, to wzrost entropii oznacza, że wszelkie układy izolowane
zdążają do stanów bardziej prawdopodobnych, a zatem mniej uporządkowanych. Druga
zasada termodynamiki stwierdza zatem, że w przyrodzie, w układach izolowanych,
występuje określone ukierunkowanie zdarzeń w czasie – stany późniejsze charakteryzują
się większą entropią. Pojęcie entropii wprowadził w 1865 roku Clausius, interpretację
statystyczną entropii i II zasady termodynamiki Boltzmann podał w 1877 roku (por. L. N.
Cooper, Istota i struktura fizyki, tłum. J. Kozubowski, Z. Majewski, A. Pindor, J. Procho-
row, PWN, Warszawa 1975, s. 375).
52
Por. L. Boltzmann, On Certain Questions of the Theory of Gases, „Nature” 1895, Vol.
51, s. 413–415, [w:] B. McGuiness (ed.), Ludwig Boltzmann. Theoretical Physics and Philo-
sophical Problems. Selected Writings, transl. by P. Foulkes, D. Reidel Publishing Company,
Dordrecht – Holland, Boston – USA 1974, s. 204–205.
53
M. von Laue, Historia fizyki, s. 158.
54
Atomizm odrzucali na przykład Jöns Jakub Berzelius, Friedrich August Kekulé,
Benjamin Brodie, Wilhelm Ostwald i Ernst Mach (por. D. M. Dallas, The Chemical Calculus
of Sir Benjamin Brodie, [w:] W. H. Brock, The Atomic Debates. Brodie and the Rejection of the
Atomic Theory, Leicester University Press, Leicester 1967, s. 31–90.
55
W literaturze anglojęzycznej stosuje się zwykle nazwę „plum pudding model”.
56
Koncepcję te wysunął William Thomson (Lord Kelvin), lecz nie opracował jej ilo-
ściowo. O innych, podobnych modelach atomów Philippa Lenrda i Hantaro Nagaoki por.
A. K. Wróblewski, Historia fizyki od czasów najdawniejszych do współczesności, Wydawnic-
two Naukowe PWN, Warszawa 2006, s. 443–446.
57
Por. G. Holton, S. G. Brush, Introduction to Concepts and Theories in Physical Science,
Addison–Wesley Publishing Company, Reading, Massachusetts, Menlo Park, California –
London – Don Mills, Ontario 1973, s. 458.
58
Hipotezę, że atomy mogą wyglądać jak miniaturowe układy planetarne wysunął
już w 1901 roku Jean Perrin (por. A. K. Wróblewski, Historia fizyki, s. 443).
59
Por. E. Rutherford, The Scattering of and Particles by Matter and the Structure of the
Atom, „Philosophical Magazine” 1911, Series 6, Vol. 21 (May), s. 669–688, [w:]
http://dbhs.wvusd.k12.ca.us/webdocs/Chem-History/Rutherford-1911/Rutherford-
1911.html.
60
Rutherford napisał wiele lat później: „Była to z pewnością najbardziej niewiary-
godna rzecz, która wydarzyła mi się w życiu. Było to tak samo niewiarygodne, jakby 15-
calowy pocisk, który wystrzeliliście w kierunku kawałka bibułki, wrócił i trafił w was”

32
(E. Rutherford, The Development of The Theory of Atomic Structure, cyt. za: G. Holton, S. G.
Brush, Introduction to Concepts…, s. 459).
61
Masa jądra wynosi około 99,975% masy atomu.
62
Por. N. Bohr, On the Constitution of Atoms and Molecules, „Philosophical Magazine”
1913, Series 6, Vol. 26, [w:] http://dbhs.wvusd.k12.ca.us/webdocs/Chem-
History/Bohr/Bohr-1913a.html.
63
Por. A. K. Wróblewski, Historia fizyki, s. 485–489.
64
W przypadku relatywistycznym jest to równanie Diraca.
65
Iloczyn nieoznaczoności składowej pędu cząstki elementarnej i odpowiadającej jej
składowej położenia jest nie mniejszy niż wielkość rzędu stałej Plancka:
2
h
≥
Δ
⋅
Δ
x
p
x
,
gdzie Δx jest nieoznaczonością x-owej składowej współrzędnej cząstki elementarnej,
Δp
x
— nieoznaczonością x-owej składowej pędu. Nieoznaczoność Δx i Δp
x
oznacza tu
pierwiastek ze średniego kwadratu odchylenia od wartości średniej, gdzie wartość śred-
nia rozumiana jest jako wartość oczekiwana.
66
Por. E. Rutherford, Nuclear Constitution of Atoms, „Proceedings Royal Society” 1920,
A, Vol. 97, facsimile from S. Wright, Classical Scientific Papers: Physics, American Elsevier,
New York 1965, [w:] http://home.tiscali.nl/physis/.
67
Por. J. Chadwick, Possible Existence of a Neutron, „Nature” 1932, s. 312 (Feb. 27),
[w:] http://dbhs.wvusd.k12.ca.us/webdocs/Chem-History/Chadwick-neutron-
letter.html. Niekiedy w skład jąder atomowych mogą wchodzić jeszcze inne cząstki ele-
mentarne, np. hiperony. Wówczas mamy do czynienia z hiperjądrami.
68
Początkowo Gell-Mann traktował kwarki jako obiekty czysto matematyczne (por.
M. Gell-Mann, A Schematic Model of Baryons and Mesons, „Physics Letters” 1964,
Vol. 8, nr 3, s. 214–215).
69
W warunkach laboratoryjnych możliwa jest przemiana rtęci w złoto według sche-
matu:
α
4
2
197
79
1
1
200
80
+
→
+
Au
p
Hg
lub
α
4
2
197
79
2
1
199
80
+
→
+
Au
d
Hg
.
70
Eksperymentalne metody fizyki cząstek elementarnych wymagają zastosowania
niezwykle skomplikowanych urządzeń, takich jak akceleratory i detektory cząstek ele-
mentarnych, zatrudniających niekiedy tysiące pracowników. Z uwagi na wysokie koszty
przedsięwzięć budowa akceleratorów wymaga współpracy międzynarodowej wielu
państw. W chwili pisania tego artykułu (10.09.2008) uruchomiono największy w historii
akcelerator cząstek elementarnych LHC w laboratorium CERN pod Genewą.
71
Leptony to: elektron (e), neutrino elektronowe (
ν
e
), mion (
μ
), neutrino mionowe (
ν
μ
),
taon (
τ
) i neutrino taonowe (
ν
τ
). Do każdek cząstki istnieje odpowiednia antycząstka. Do
cząstek fundamentalnych zalicza się również cząstki przenoszące oddziaływania (bozony
cechowania). Są to foton (przenoszący oddziaływania elektromagnetyczne), 8 gluonów
(silne oddziaływania jądrowe), oraz bozony przenoszące oddziaływania słabe: W
+
, W
–
i
Z
0
. Model standardowy przewiduje ponadto istnienie pewnego rodzaju cząstek, nazy-
wanych bozonami Higgsa, nieznalezionych dotychczas eksperymentalnie.
72
Por. M. Tempczyk, Stabilność fizycznego obrazu świata, [w:] A. Łukasik, M. Kuszyk-
Bytniewska (red.), Filozofia przyrody współcześnie, Universitas, Kraków (w przygotowa-
niu).
73
Hipotetycznym kwantem oddziaływania grawitacyjnego jest cząstka nazywana
grawitonem.

33
74
Czas, odległość i gęstość Planka wynoszą odpowiednio: t
p
= √hG/c
5
≈ 5,4 × 10
-44
s,
l
p
= √hG/c
3
≈ 1,6 × 10
-35
m, ρ
p
= c
5
/hG
2
≈ 5,2 × 10
96
kg/m
3
.
75
Wynika to z zasady nieoznaczoności dla energii i czasu:
2
h
≥
Δ
⋅
Δ
t
E
,
gdzie ΔE jest nieoznaczonością energii, Δt — nieoznaczonością czasu.
76
„Możemy więc powiedzieć, że fizyczny elektron składa się z prawdopodobień-
stwem (na jednostkę czasu) bliskim jedności z jednego elektronu bez struktury, z praw-
dopodobieństwem rzędu (1/137)
2
z pozbawionych struktury elektronu i fotonu oraz z
prawdopodobieństwem rzędu (1/137)
4
z elektronu i pary elektron–pozyton itd.” (M.
Święcicki, Struktura cząstek elementarnych, [w:] Encyklopedia fizyki współczesnej, PWN, War-
szawa 1983, s. 98). W elektrodynamice kwantowej prawdopodobieństwo emisji cząstki
wirtualnej jest proporcjonalne do stałej struktury subtelnej (α
el
≈ 1/137).
77
Por. A. N. Whitehead, Nauka i świat nowożytny, tłum. M. Kozłowski, M. Pieńkowski
OP, Znak, Kraków 1987, s. 79.
78
Nie tylko elektronów: w 1999 roku zaobserwowano interferencję dla cząsteczek fu-
lerenów, złożonych z 60 albo 70 atomów węgla, czyli, biorąc pod uwagę, że same atomy
węgla są systemami złożonymi, dla bardzo skomplikowanych układów.
79
Por. A. Einstein, B. Podolsky, N. Rosen, Can Quantum-Mechanical Description of
Physical Reality by Considered Complete?, „Physical Review” 1935, vol. 47, s. 777–780; tłum.
polskie: Czy opis kwantowomechaniczny rzeczywistości fizycznej można uznać za zupełny?, [w:]
S. Butryn (red.), Albert Einstein. Pisma filozoficzne, tłum. K. Napiórkowski, Wydawnictwo
IFiS PAN, Warszawa 1999, s. 117–123. Einstein twierdził, że teorie fizyczne muszą się
wiązać z założeniem, że poszczególne rzeczy istnieją całkowicie niezależnie od siebie o
ile „leżą w różnych częściach przestrzeni” (A. Einstein, Mechanika kwantowa a rzeczywi-
stość, [w:] S. Butryn (red.), Albert Einstein. Pisma filozoficzne, tłum. K. Napiórkowski, Wy-
dawnictwo IFiS PAN, Warszawa 1999, s. 163). W pracy EPR rozważa się układ dwóch
cząstek, które uprzednio oddziaływały ze sobą — a zatem są opisane przez wspólną funk-
cję falową Ψ, następnie oddaliły się od siebie na znaczną odległość — i pokazuje się, że
wykonując pomiar na układzie I, można przewidzieć w sposób pewny stan przestrzennie
oddalonego układu II bez jego zakłócania, nawet wówczas, gdy mierzy się wielkości
wchodzące w relacje nieoznaczoności, a zatem należy uznać, że wielkości te są realne (co
miało dowodzić niekompletności mechaniki kwantowej), chyba że przyjmiemy, iż stan
układu II zależy od procesu pomiaru przeprowadzonego na układzie I, co w żaden spo-
sób nie zakłóca stanu układu II. „Nie można oczekiwać — twierdzi jednak Einstein — by
jakakolwiek rozsądna definicja rzeczywistości na to pozwalała” A. Einstein, B. Podolsky,
N. Rosen, Czy opis kwantowomechaniczny rzeczywistości fizycznej można uznać za zupełny?,
[w:] S. Butryn (red.), Albert Einstein…, s. 117–123, s. 122).
80
Por. J. S. Bell, On the Einstein Podolsky Rosen Paradox, „Physics” 1964, t. 1, s. 195–200,
[w:] http://www.drchinese.com/David/Bell_Compact.pdf.
81
Por. A. Aspect, J. Dalibard, G. Roger, Experimental Test of Bell’s Inequalities Using Time
Varying Analyzers, „Physical Review Letters” 1982, vol. 49, nr 25, s. 1804–1807.
82
M. Redhead, P. Teller, Particles. Particle Labels, and Quanta: The Toll of Unacknow-
ledged Metaphysics, „Foundation of Physics” 1991, vol. 21, nr 1, s. 204.

34
83
Polega on na przyciąganiu się dwóch nienaładowanych płytek wykonanych z
przewodnika i spowodowany jest różnicą ciśnień oddziałujących na nie cząstek wirtual-
nych.
Wyszukiwarka
Podobne podstrony:
18 Ewolucja modelu atomu
Ewolucja pojęcia jakości
18 Ewolucja modelu atomu
Waldemar Żarski Pies ewolucja pojęcia i jego realizacji leksykalnych w polszczyźnie
polityka ewolucja pojecia
Ontologia, 18. Analiza i konstrukcja pojęcia przyczyny, Jan Łukasiewicz - „Analiza i konstrukc
Ewolucja i typologia pojęcia terroryzm
Historyczny rys rozwoju pojęcia budowa materii atomu
Łukasiewicz Analiza i konstrukcja pojęcia przyczyny
1 Pojęcie, geneza i ewolucja pieniądza Funkcje pieniądza Cechy współczesnego pieniądza
Ewolucja i typologia pojęcia terroryzm
Historyczny rys rozwoju pojęcia budowa materii atomu
Ewolucja i typologia pojęcia terroryzm
więcej podobnych podstron