© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej 2010/2011
OGÓLNOTECHNICZNE
PODSTAWY BIOTECHNOLOGII
Z GRAFIKĄ INŻYNIERSKĄ
Wykład X
Zasady termodynamiki
Proste przemiany termodynamiczne
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
I ZASADA TERMODYNAMIKI
I zasada termodynamiki jest to w swojej istocie prawo zachowania
energii sformułowane dla dowolnej przemiany układu termodynamicznego.
I zasadę można formułować dla układów zamkniętych i otwartych.
Istnieje bardzo wiele matematycznych zapisów tej zasady. Przykładowo
napiszmy tą zasadę dla całkowej (nieróżniczkowej) przemiany układu
zamkniętego bazując na energii wewnętrznej.
Stan 1
U
1
Stan 2
U
2
ΔU=U
2
-U
1
Q
W
W
Q
U
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
I ZASADA TERMODYNAMIKI –
Bilans entalpii
Stosunkowo często I zasada jest formułowana na bazie entalpii.
W takim przypadku w bilansie energetycznym zamiast pracy
objętościowej używa się pracy technicznej
Stan 1
H
1
Stan 2
H
2
ΔH=H
2
-H
1
Q
W
t
t
W
Q
H
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
INNE SFORMUŁOWANIA PIERWSZEJ
ZASADY TERMODYNAMIKI
dh=δq-δw
t
Δh=q-w
t
dH=δQ-δW
t
ΔH=Q-W
t
Baza:
Entalpia
du=δq-δw
Δu=q-w
dU=δQ-δW
ΔU=Q-W
Baza:
Energia
wewnętrzna
Przem. różnicz.
Przem. całk.
Przem. różniczk.
Przem.
całkowa
Wielkości właściwe
Wielkości ekstensywne
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
II ZASADA TERMODYNAMIKI
II zasada termodynamiki posiada ogromną liczbę bardzo różnych sformułowań.
Jedno ze sformułowań oparte jest na na tzw. nierówności Clausiusa.
Sformułowanie to opisuje zjawisko nieodwracalności przemian
termodynamicznych oraz uwzględnia klasyczną definicję entropii.
Załóżmy, że układ ulega dowolnej (odwracalnej lub nieodwracalnej) różniczkowej
przemianie termodynamicznej. W tej przemianie układ wymienia z otoczeniem
ciepło δq. W czasie przemiany zmieniać się mogą wszystkie parametry stanu.
Zmiana entropii wyniesie ds.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
II ZASADA TERMODYNAMIKI
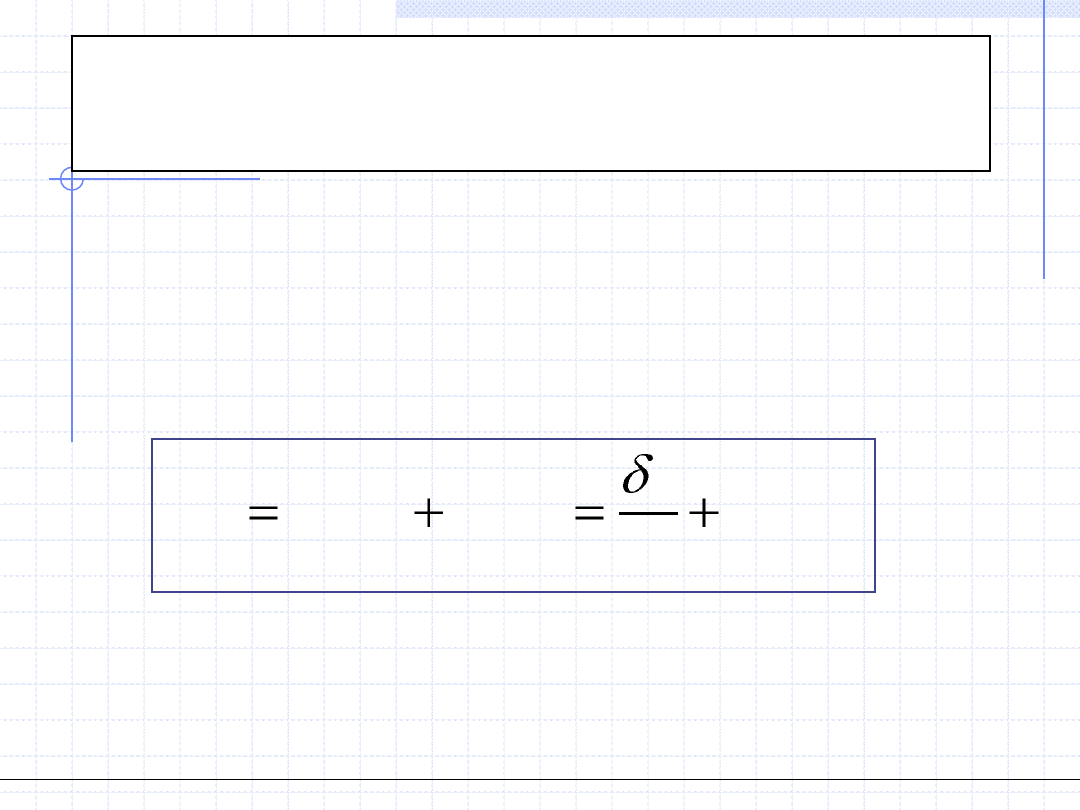
Istnieją dwie przyczyny zmiany entropii:
1 - zmiana stanu energetycznego układu związana z wymianą ciepła,
2 - zmiana liczby dostępnych stanów energetycznych związana z
nieodwracalnymi efektami przemiany. Fakt ten można zapisać równaniem:
i
i
r
ds
T
q
ds
ds
ds
)
(
)
(
)
(
r – oznacza zmiany związane z odwracalnością przemiany (reversible)
i – oznacza zmiany związane z nieodwracalnością przemiany (irreversible)
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
II ZASADA TERMODYNAMIKI cd.
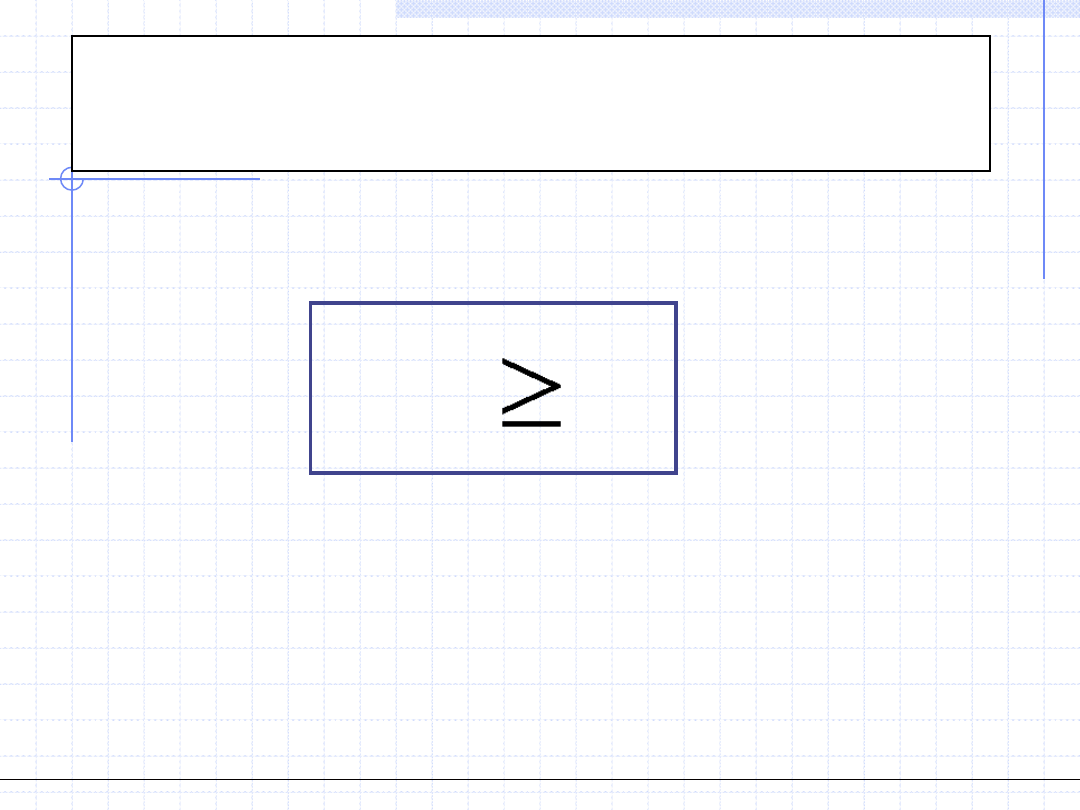
Nierówność Clausiusa dotyczy tej części zmiany entropii, która jest związana
z nieodwracalnością przemian i stanowi jedno z wielu sformułowań II zasady
termodynamiki.
0
i
ds
Słownie oznacza to, że każda nieodwracalność powoduje wzrost entropii.
Ponieważ wszystkie przemiany samorzutne (odbywające się bez ingerencji
z zewnątrz) są nieodwracalne, z nierówności Clausiusa wynika, że w takich
przemianach entropia rośnie osiągając wartość maksymalną w stanie
równowagi, w którym mogą zachodzić tylko przemiany odwracalne.
Równość zachodzi tylko
w przypadku przemian
odwracalnych
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
Proste przemiany
termodynamiczne
Spośród bardzo wielu możliwych przemian termodynamicznych szczególną
rolę odgrywają przemiany spełniające pewien prosty warunek. Warunek
ten najczęściej określa stałość określonego parametru lub funkcji stanu.
W nazwie stałość ta jest opisana za pomocą przedrostka „izo”.
Mamy zatem następujące przemiany proste:
1. Przemiana izochoryczna – V=const.
2. Przemiana izobaryczna – p=const.
3. Przemiana izotermiczna – T=const.
4. Przemiana izentropowa – S=const. (przemiana adiabatyczna)
5. Przemiana politropowa – C=const.
Teraz omówimy po kolei omówimy poszczególne przemiany.
Przemiany te będziemy ilustrować wykresami w układzie p – v
tzn. ciśnienie – objętość właściwa (będziemy zakładać przemiany
w układach zamkniętych czyli n=const.)
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
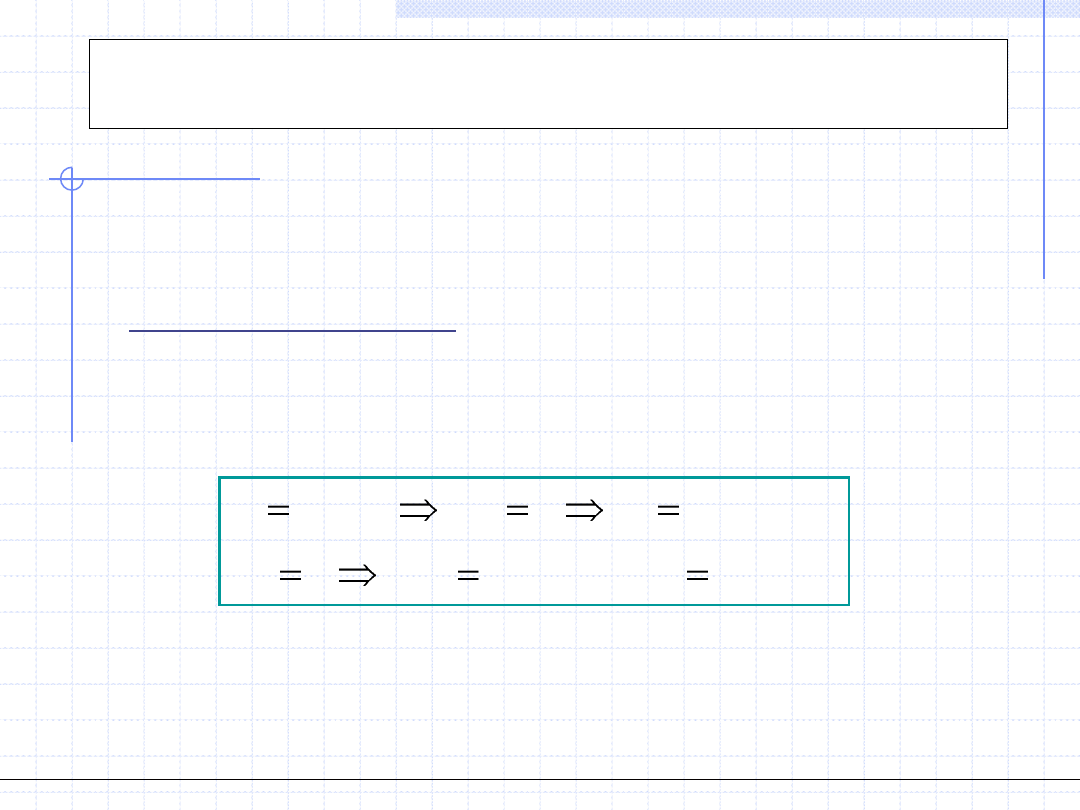
Przemiana izochoryczna
.)
(
0
0
.
1
2
1
2
const
n
dla
v
v
dv
V
V
dV
const
V
Przemiana izochoryczna odbywa się przy stałej objętości:
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
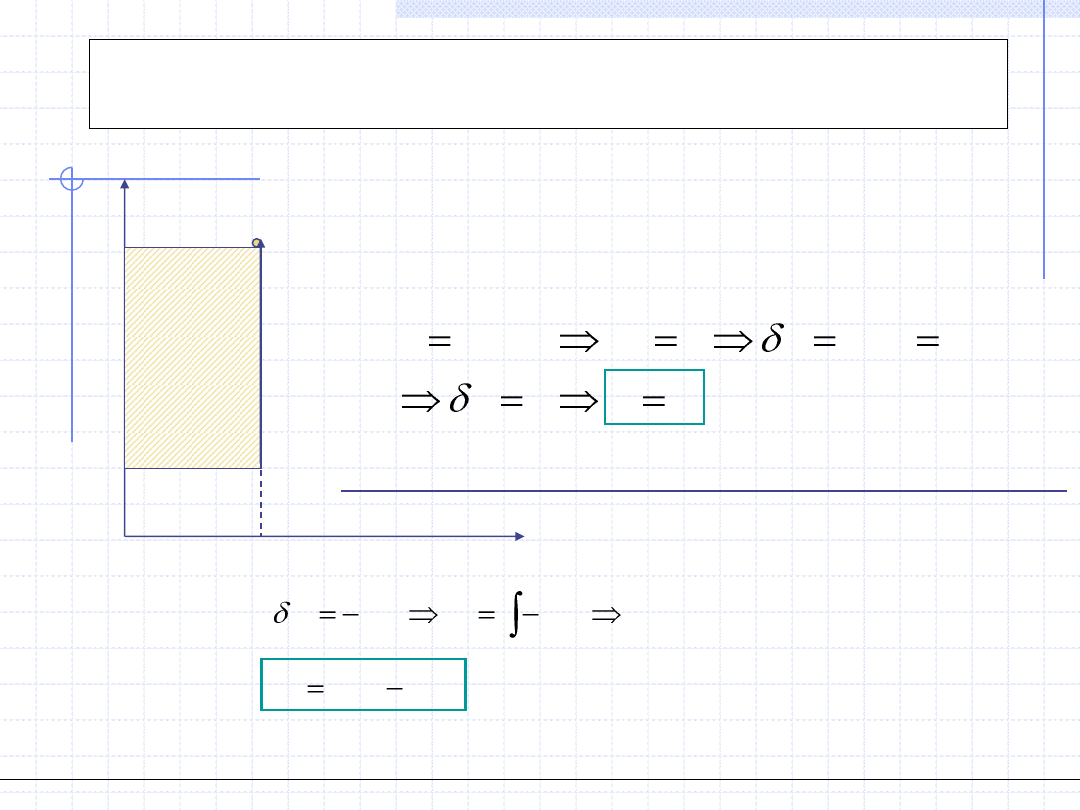
Przemiana izochoryczna
0
0
0
0
.
w
w
pdv
w
dv
const
v
p
v
w
t
v=const.
p
1
,T
1
p
2
,T
2
Praca objętościowa w przemianie izochorycznej jest równa 0.
)
(
2
1
2
1
p
p
v
w
vdp
w
vdp
w
t
p
p
t
t
Wartość pracy technicznej przemiany izochorycznej jest równa polu zakreskowanego prostokąta.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
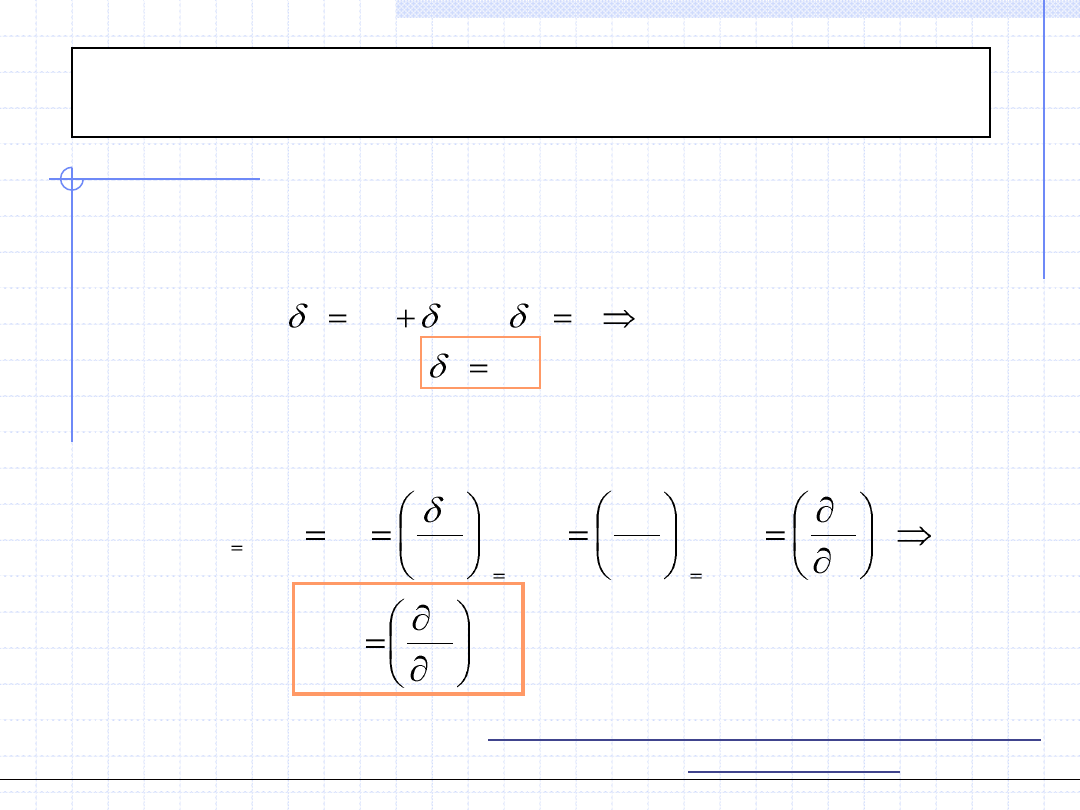
Przemiana izochoryczna cd.
du
q
w
w
du
q
0
Rozpatrzmy teraz pojemność cieplną układu podczas przemiany
izochorycznej. Na mocy I zasady termodynamiki dla różniczkowej
przemiany można napisać:
Przypomnijmy teraz definicję właściwej pojemności cieplnej dla
rozważanej przemiany:
v
v
v
const
v
const
v
v
const
v
T
u
c
T
u
dT
du
dT
q
c
c
.
.
.
)
(
Wzór powyższy dowodzi, że pojemność cieplna w przemianie izochorycznej
jest pochodną funkcji stanu a zatem również jest funkcją stanu.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
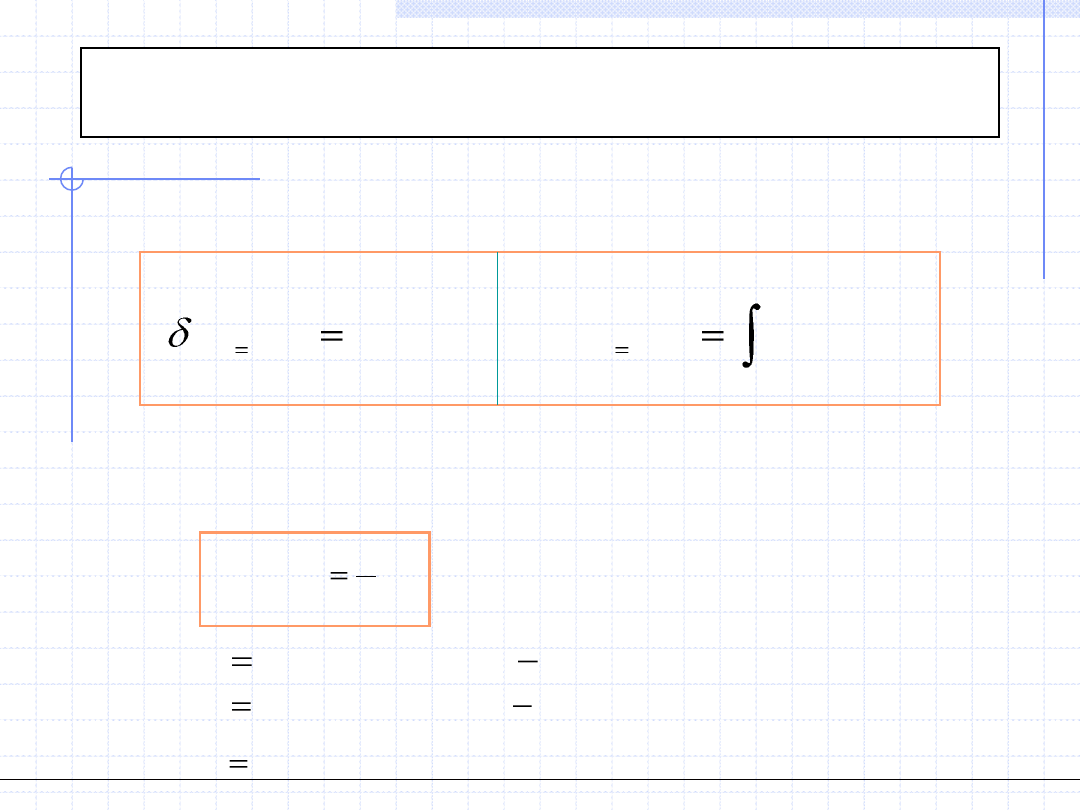
Przemiana izochoryczna cd.
2
1
)
(
)
(
)
(
.
.
T
T
v
const
v
v
const
v
dT
T
c
q
dT
c
q
:
2
)
(
)
(
gdzie
R
k
c
GD
v
atomowych
gazów
dla
k
1
3
Wielkość c
v
zależy od temperatury, ciśnienia i rodzaju ośrodka. Zależność
od temperatury pozwala na wyznaczenie ciepła przemiany izochorycznej:
Dla gazów doskonałych, z teorii kinetycznej wynika że wielkość c
v
powinna
być stała i równa:
atomowych
gazów
dla
k
2
5
wych
wieloatomo
gazów
dla
k
6
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
Przemiana izochoryczna cd.
2
2
2
2
1
1
1
1
RT
v
p
v
p
RT
v
p
v
p
Rozpatrzmy jeszcze dokładniej przemianę izochoryczną gazów doskonałych.
W każdy punkcie takiej przemiany musi być spełnione równanie stanu gazu
doskonałego. Dla punku początkowego i końcowego mamy:
Dzieląc stronami otrzymujemy tzw. równanie przemiany izochorycznej
uzależniające ciśnienie i temperaturę w skrajnych punktach przemiany:
1
2
1
2
T
T
p
p
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
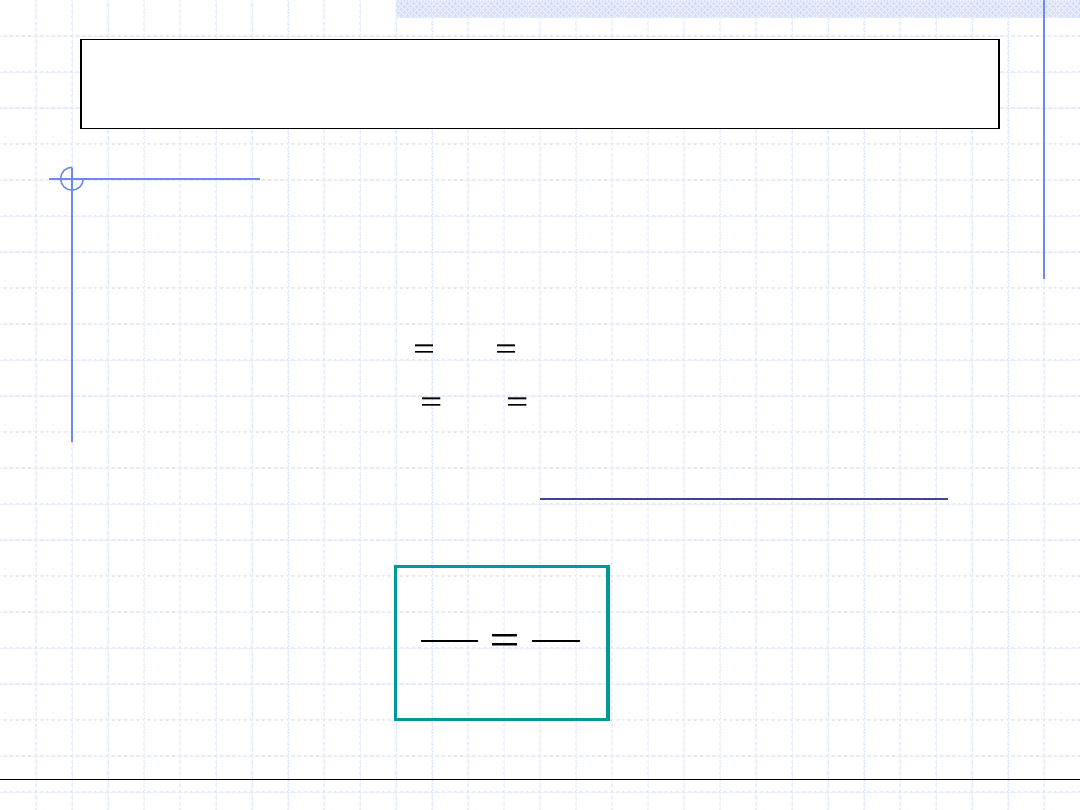
Przemiana izochoryczna cd.
2
1
.
)
(
s
s
const
v
Tds
q
T
s
1
2
s
1
s
2
v
v
const
v
c
T
ds
dT
Tds
dT
c
q
.
)
(
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
Przemiana izobaryczna
1
2
0
.
p
p
dp
const
p
Przemiana izobaryczna odbywa się przy stałym ciśnieniu:
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
Przemiana izobaryczna
0
0
0
0
.
t
t
t
w
w
vdp
w
dp
const
p
p
v
p=const.
v
1
,T
1
v
2
,T
2
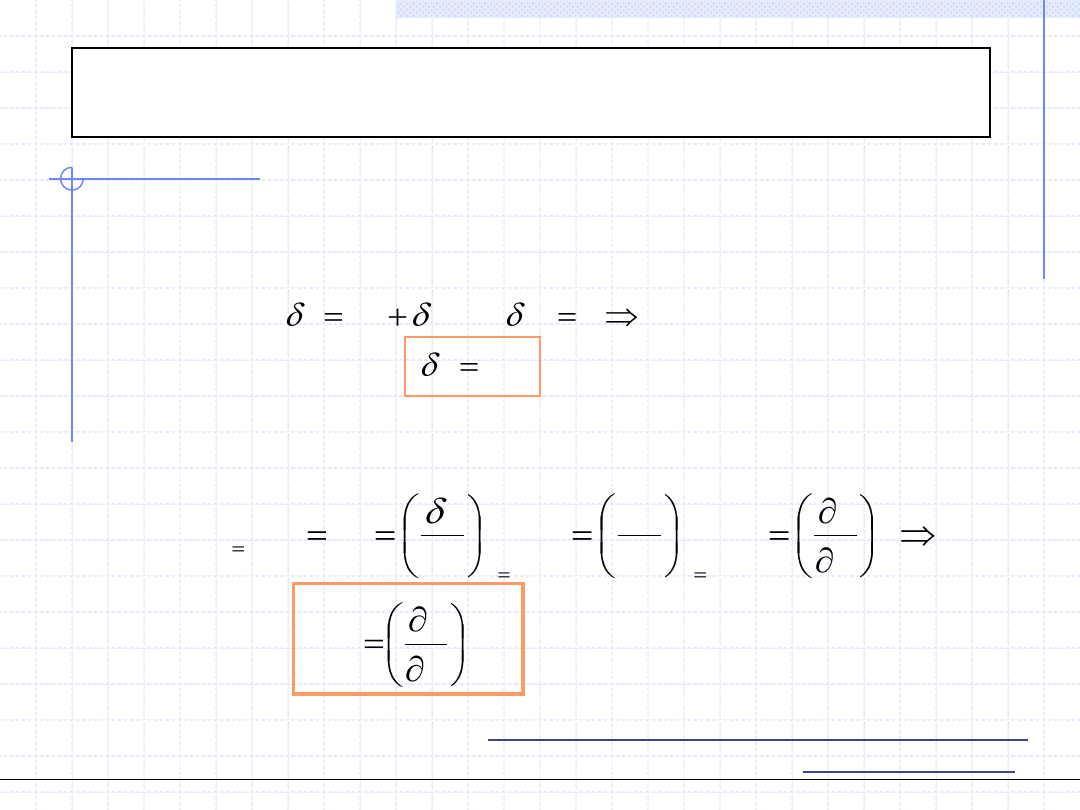
Praca techniczna w przemianie izobarycznej jest równa 0.
)
(
1
2
2
1
v
v
p
w
pdv
w
pdv
w
v
v
Praca objętościowa przemiany izobarycznej jest równa polu zakreskowanego prostokąta.
w
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
Przemiana izobaryczna cd.
dh
q
w
w
dh
q
t
t
0
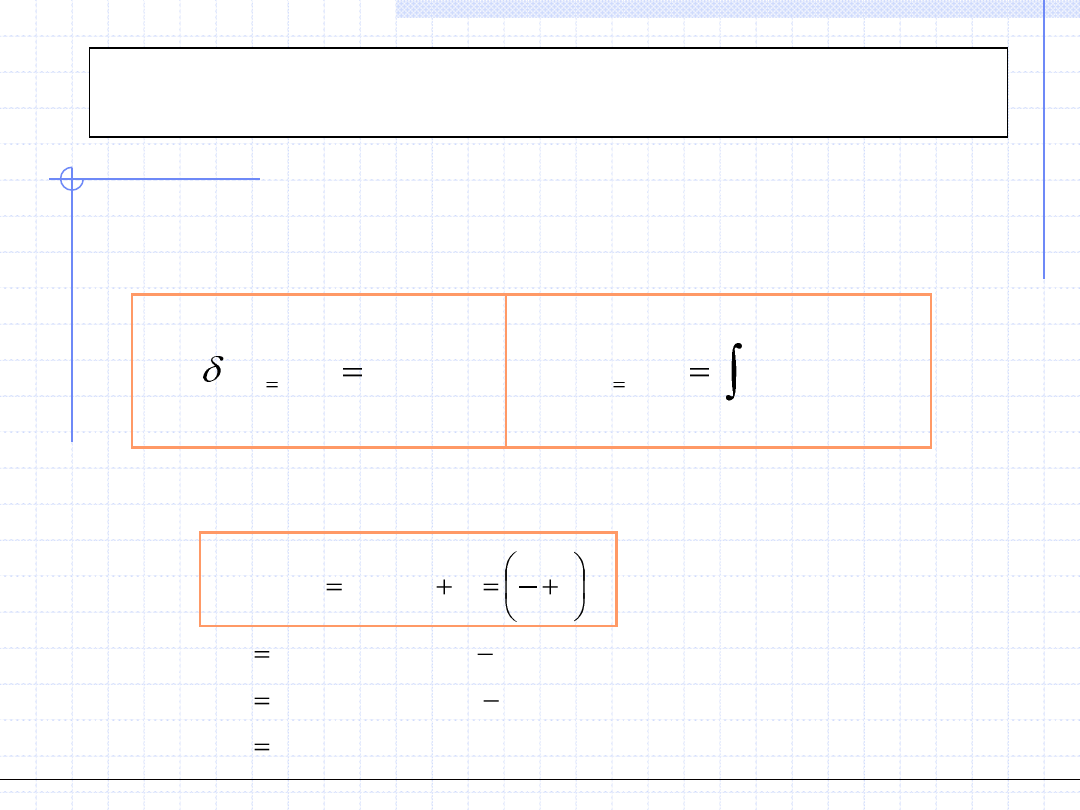
Rozpatrzmy teraz pojemność cieplną układu podczas przemiany
izobarycznej. Na mocy I zasady termodynamiki dla różniczkowej
przemiany można napisać:
Przypomnijmy teraz definicję właściwej pojemności cieplnej dla
rozważanej przemiany:
v
p
p
const
p
const
p
p
const
p
T
h
c
T
h
dT
dh
dT
q
c
c
.
.
.
)
(
Wzór powyższy dowodzi, że pojemność cieplna w przemianie izobarycznej
jest pochodną funkcji stanu (entalpii) a zatem również jest funkcją stanu.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
Przemiana izobaryczna cd.
2
1
)
(
)
(
)
(
.
.
T
T
p
const
p
p
const
p
dT
T
c
q
dT
c
q
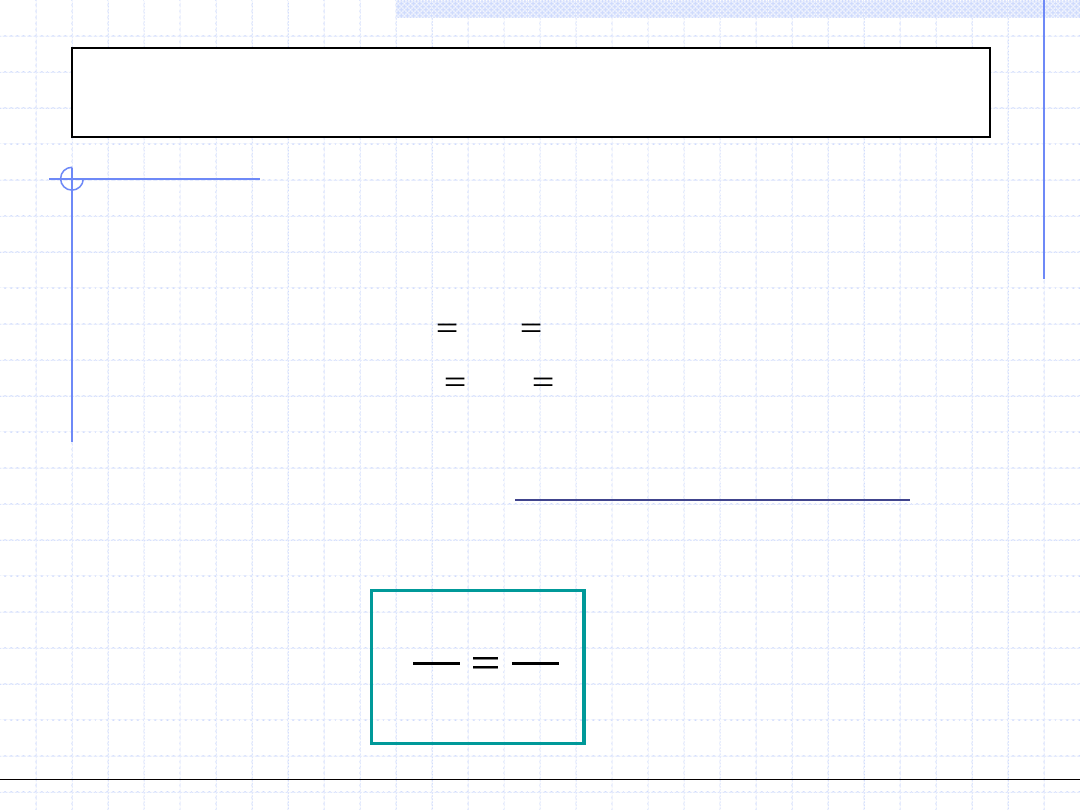
Wielkość c
p
zależy od temperatury, ciśnienia i rodzaju ośrodka. Zależność
od temperatury pozwala na wyznaczenie ciepła przemiany izobarycznej:
Dla gazów doskonałych, z teorii kinetycznej wynika że wielkość c
p
powinna
być stała i równa:
wych
wieloatomo
gazów
dla
k
atomowych
gazów
dla
k
atomowych
gazów
dla
k
gdzie
R
k
R
c
c
GD
v
GD
p
6
2
5
1
3
:
1
2
)
(
)
(
)
(
)
(
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
Przemiana izobaryczna cd.
2
2
2
2
1
1
1
1
RT
pv
v
p
RT
pv
v
p
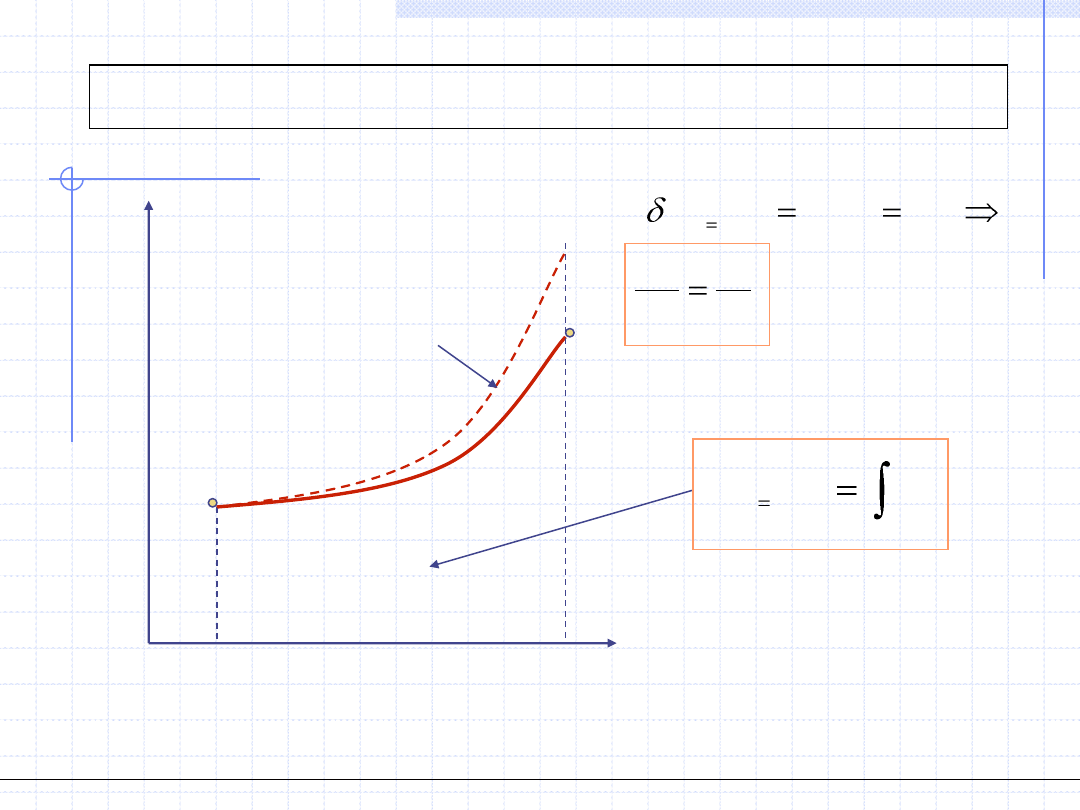
Rozpatrzmy jeszcze dokładniej przemianę izobaryczną gazów doskonałych.
W każdy punkcie takiej przemiany musi być spełnione równanie stanu gazu
doskonałego. Dla punku początkowego i końcowego mamy:
Dzieląc stronami otrzymujemy tzw. równanie przemiany izobarycznej
uzależniające objętość i temperaturę w skrajnych punktach przemiany:
1
2
1
2
T
T
v
v
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
2
1
.
)
(
s
s
const
p
Tds
q
T
s
1
2
s
1
s
2
p
p
const
p
c
T
ds
dT
Tds
dT
c
q
.
)
(
v=const.
Przemiana izobaryczna cd.
Ale c
p
>c
v
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
21
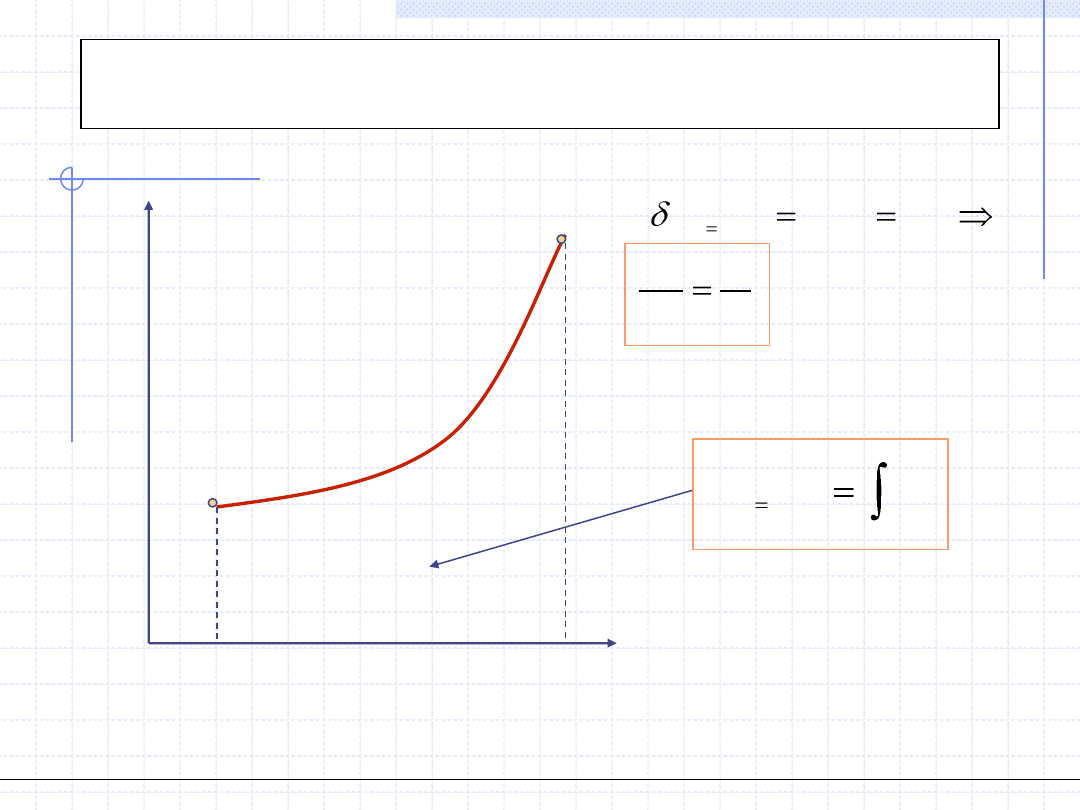
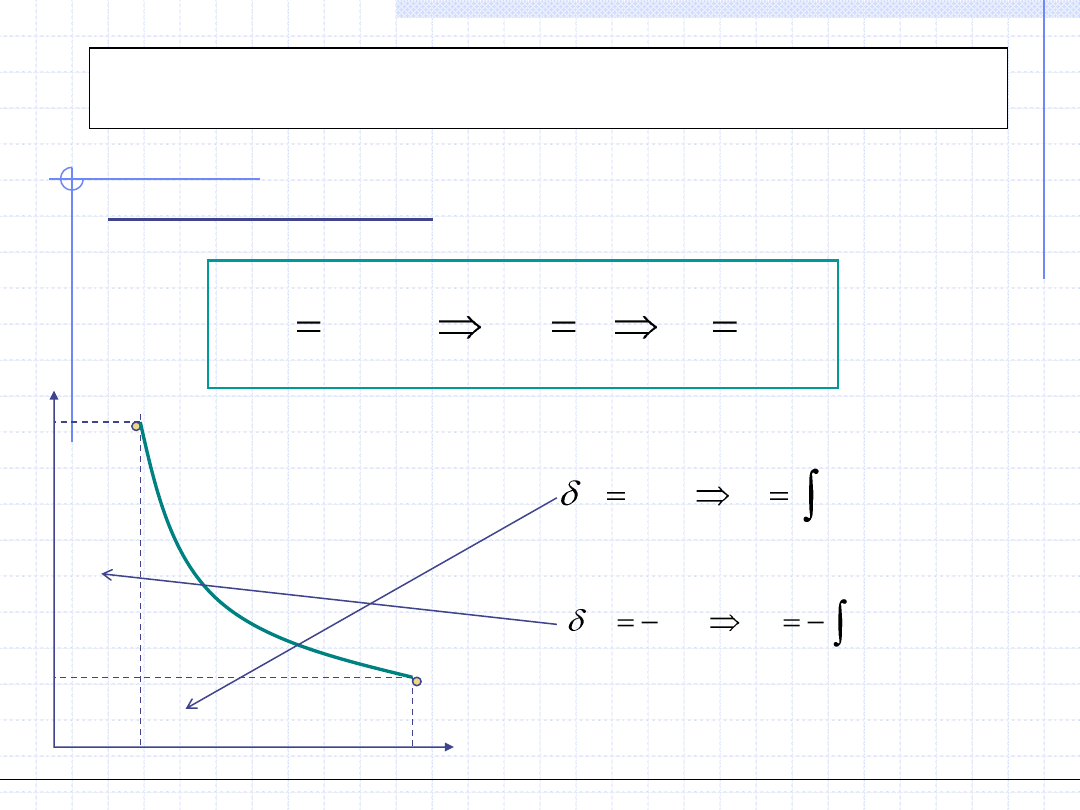
Przemiana izotermiczna
1
2
0
.
T
T
dT
const
T
2
1
)
(
v
v
dv
v
p
w
pdv
w
Przemiana izotermiczna odbywa się w stałej temperaturze:
p
v
v
1
,p
1
v
2
,p
2
2
1
)
(
p
p
t
t
dp
p
v
w
vdp
w
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
22
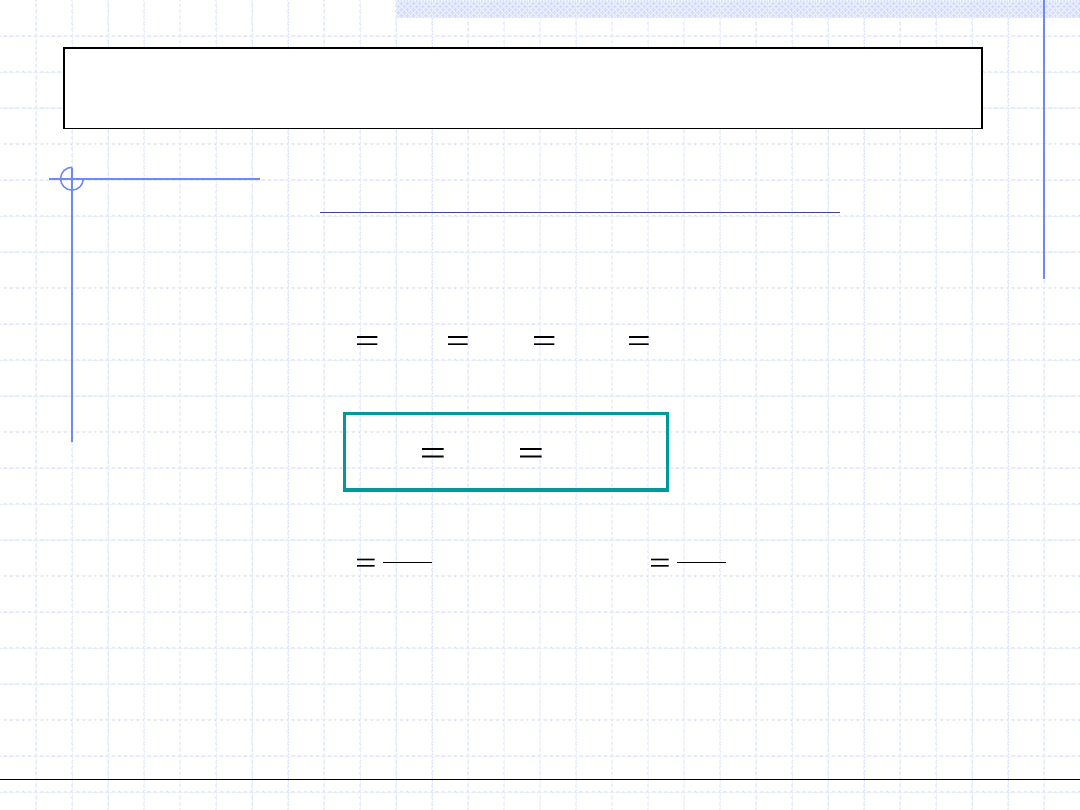
Przemiana izotermiczna cd.
2
2
2
1
1
1
v
p
RT
RT
RT
v
p
p
RT
p
v
v
RT
v
p
GD
GD
)
(
)
(
)
(
)
(
Rozpatrzmy teraz przemianę izotermiczną gazów doskonałych.
W każdy punkcie takiej przemiany musi być spełnione równanie stanu gazu
doskonałego. Dla punku początkowego i końcowego mamy:
Wyrażenia powyższe pozwalają na wyprowadzenie wzorów określających
pracę oraz pracę techniczną w przemianie izotermicznej gazów doskonałych:
.
const
RT
pv
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
23
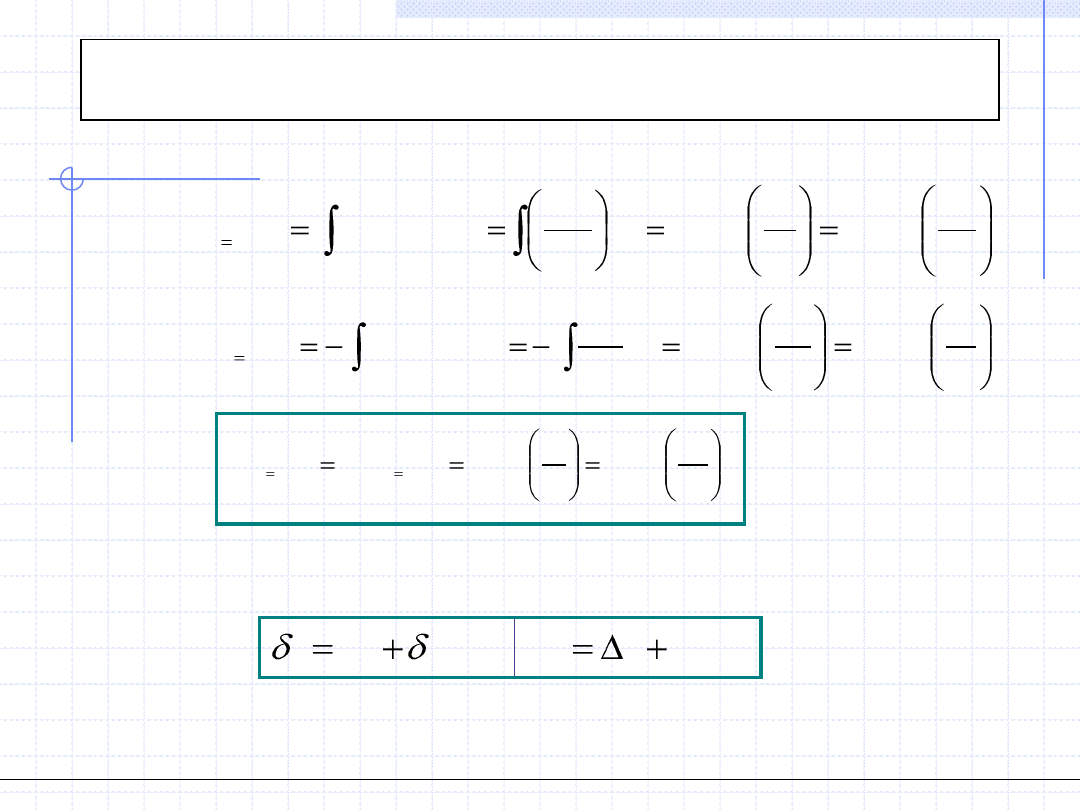
Przemiana izotermiczna cd.
w
u
q
w
du
q
2
1
1
2
)
(
)
(
.
ln
ln
)
(
)
(
2
1
2
1
p
p
RT
v
v
RT
dv
v
RT
dv
v
p
w
v
v
v
v
GD
GD
const
T
2
1
1
2
)
(
.
)
(
.
ln
ln
)
(
)
(
p
p
RT
v
v
RT
w
w
GD
const
T
t
GD
const
T
W celu wyznaczenia ciepła przemiany izotermicznej należy zastosować
I zasadę termodynamiki:
1
2
2
1
)
(
)
(
.
ln
ln
)
(
)
(
2
1
2
1
v
v
RT
p
p
RT
dp
p
RT
dp
p
v
w
p
p
p
p
GD
GD
const
T
t
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
24
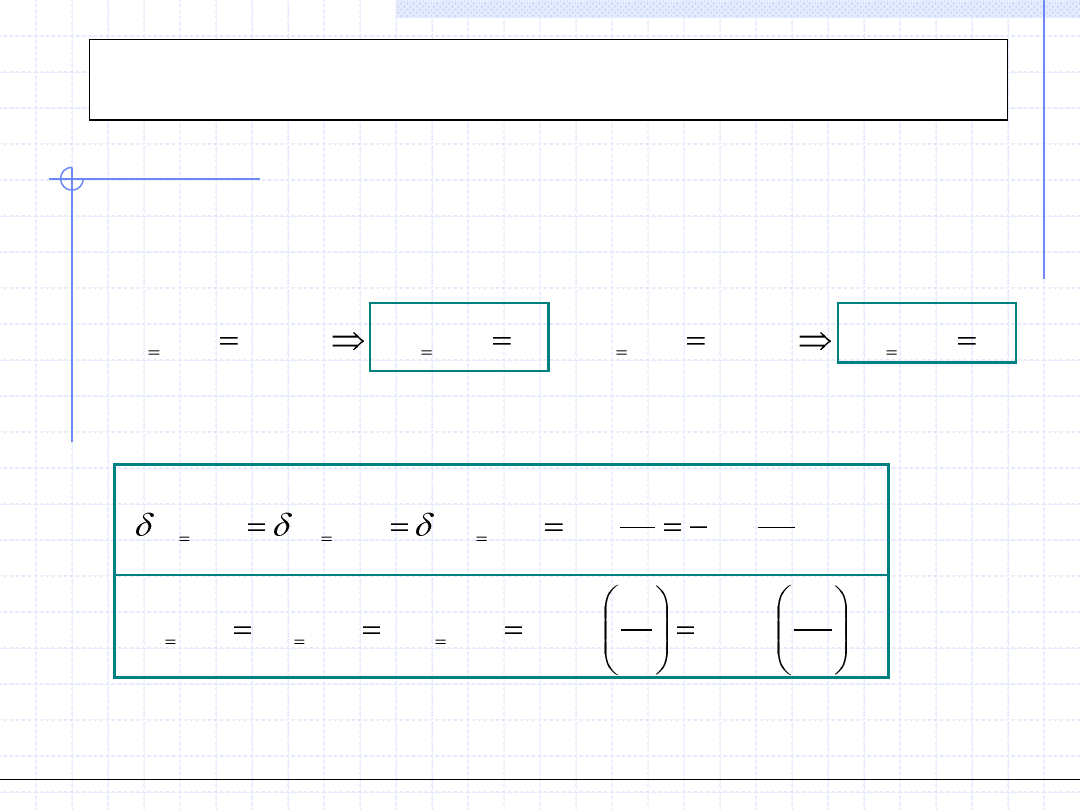
Przemiana izotermiczna cd.
2
1
1
2
)
(
.
,
)
(
.
)
(
.
)
(
.
,
)
(
.
)
(
.
ln
ln
p
p
RT
v
v
RT
w
w
q
p
dp
RT
v
dv
RT
w
w
q
GD
const
T
t
GD
const
T
GD
const
T
GD
const
T
t
GD
const
T
GD
const
T
W przypadku przemiany gazu doskonałego można zauważyć, że jego
energia wewnętrzna i entalpia zależą tylko od temperatury. Zatem w stałej
temperaturze zarówno „u” jak i „h” są stałe czyli:
0
.
0
.
)
(
.
)
(
.
)
(
.
)
(
.
GD
const
T
GD
const
T
GD
const
T
GD
const
T
dh
const
h
du
const
u
Uwzględniając I zasadę termodynamiki otrzymujemy wzory określające
ciepło przemiany izotermicznej gazów doskonałych:
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
25
)
(
)
(
1
2
.
2
1
s
s
T
Tds
q
s
s
const
T
T
s
1
2
s
1
s
2
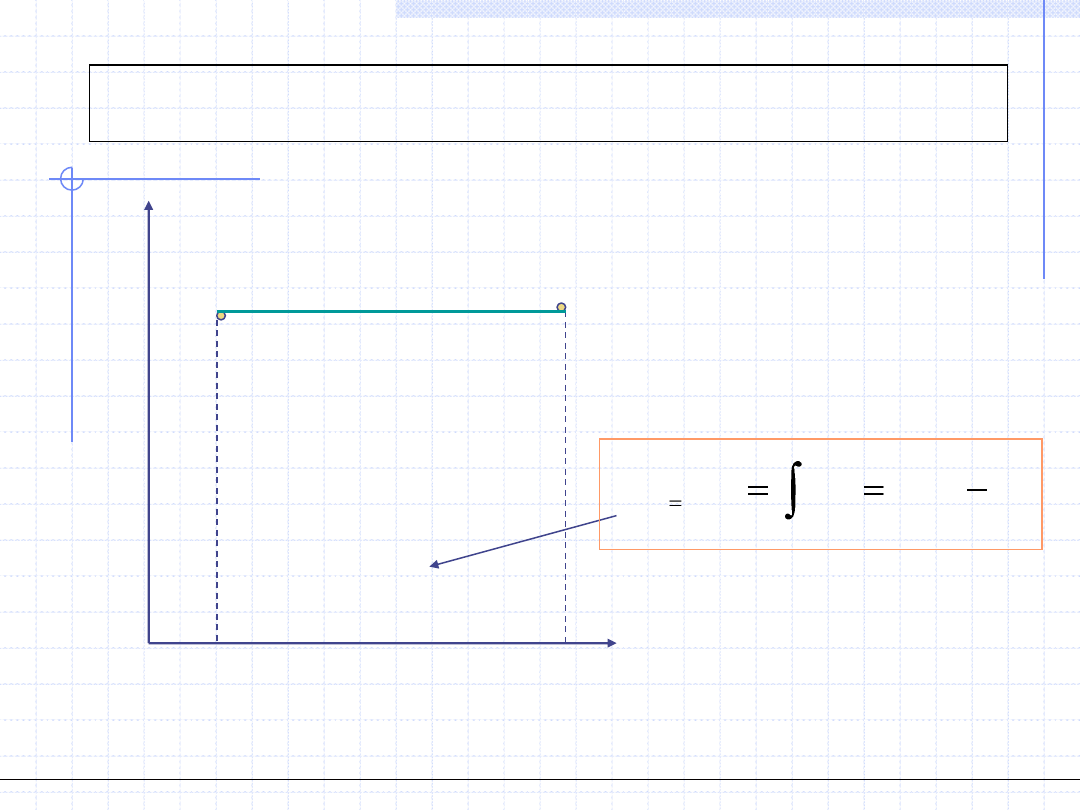
Przemiana izotermiczna cd.
T=const.
Wykres przemiany izotermicznej w układzie T – s jest
szczególnie prosty:
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
26
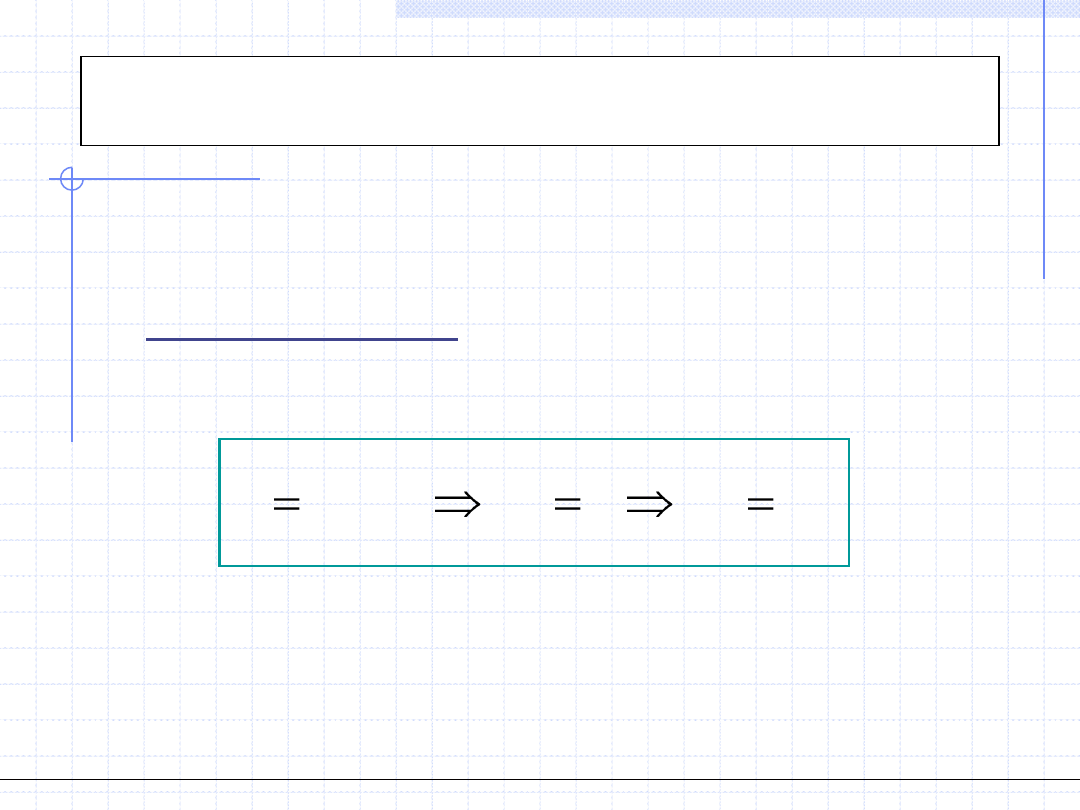
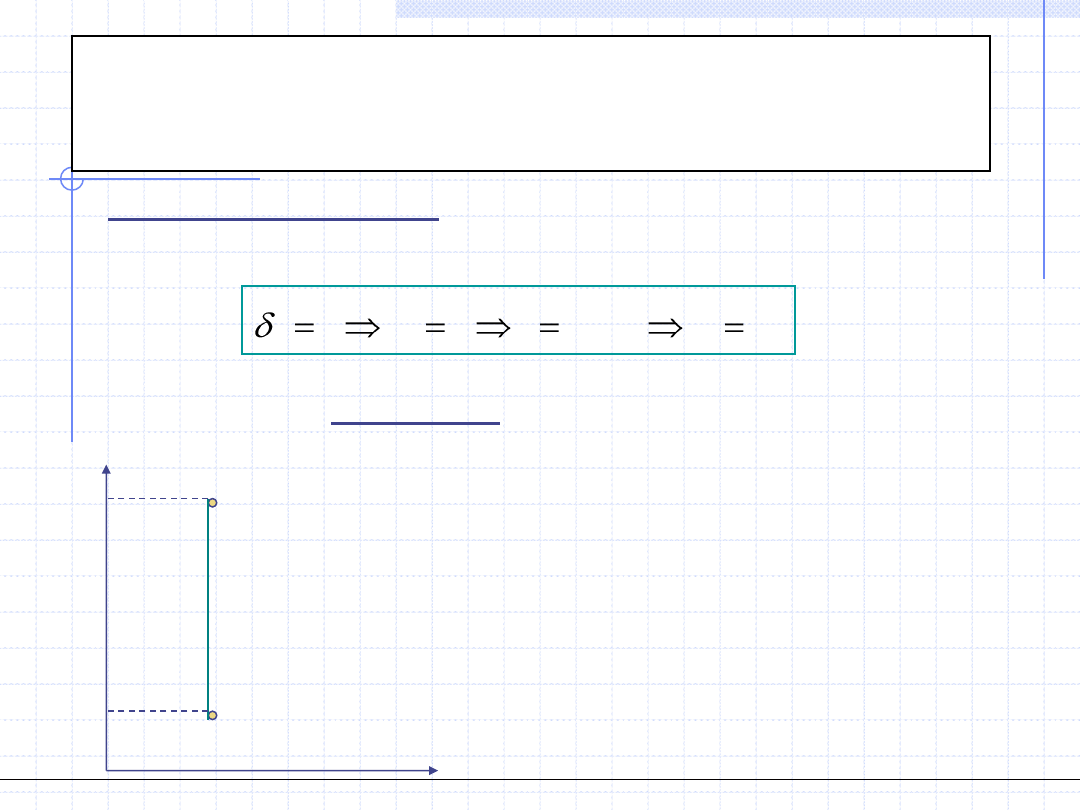
Przemiana adiabatyczna
(izentropowa)
1
2
0
0
s
s
const
s
ds
q
Przemiana adiabatyczna odbywa się w układzie adiabatycznym tzn. bez
wymiany ciepła z otoczeniem. Jeżeli jednocześnie jest to przemiana
odwracalna to wtedy:
Oznacza to, że odwracalna przemiana adiabatyczna odbywa się przy stałej
entropii czyli jest izentropowa. Wykres przemiany izentropowej jest
szczególnie prosty w układzie T – s.
T
s
1
2
W przemianie adiabatycznej układ może
wymieniać z otoczeniem energię mechaniczną
czyli wykonywać pracę (lub praca może być
wykonana na układzie). W celu wyznaczenia
tej pracy konieczna jest znajomość zależności
ciśnienia od objętości czyli konieczna jest
znajomość tzw. równania przemiany. Równanie
to można wyprowadzić dla gazu doskonałego.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
27
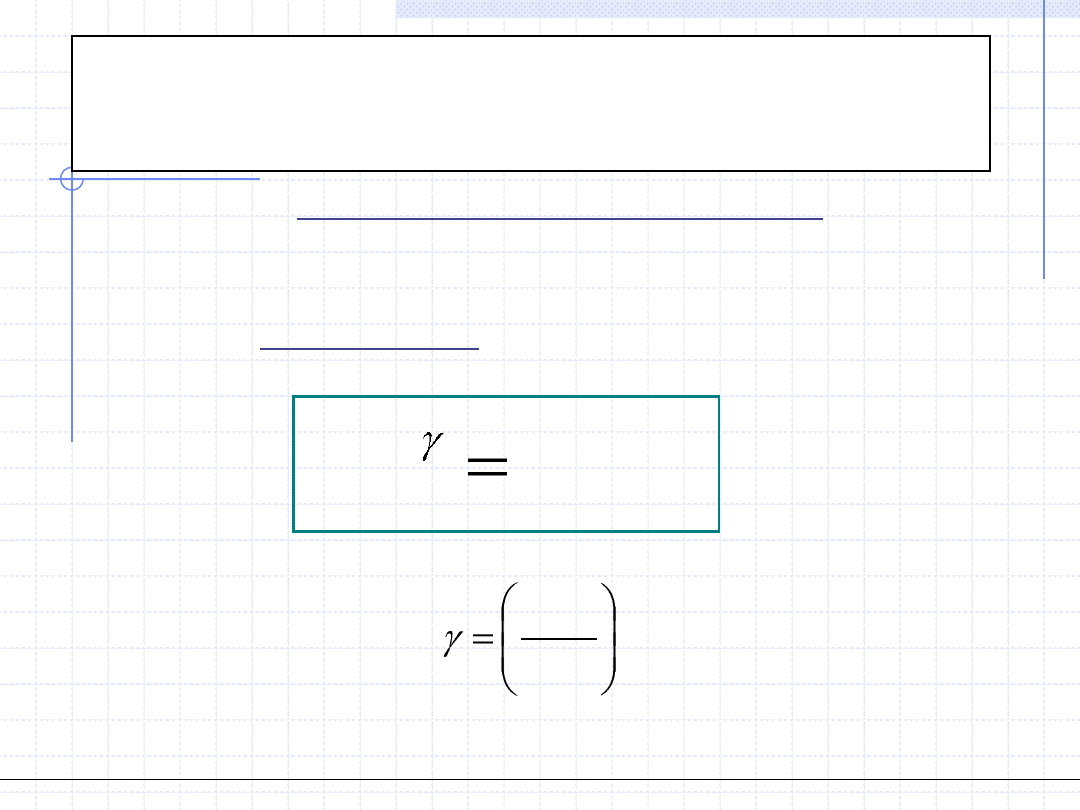
Przemiana adiabatyczna gazu
doskonałego
Rozpatrzmy teraz przemianę adiabatyczną gazów doskonałych.
Wychodząc z I zasady termodynamiki oraz uwzględniając własności gazów
doskonałych można wyprowadzić zależność między ciśnieniem a objętością
w postaci tzw. równania adiabaty:
const
pv
)
(
)
(
GD
v
GD
p
c
c
gdzie
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
28
Przemiana adiabatyczna gazu
doskonałego
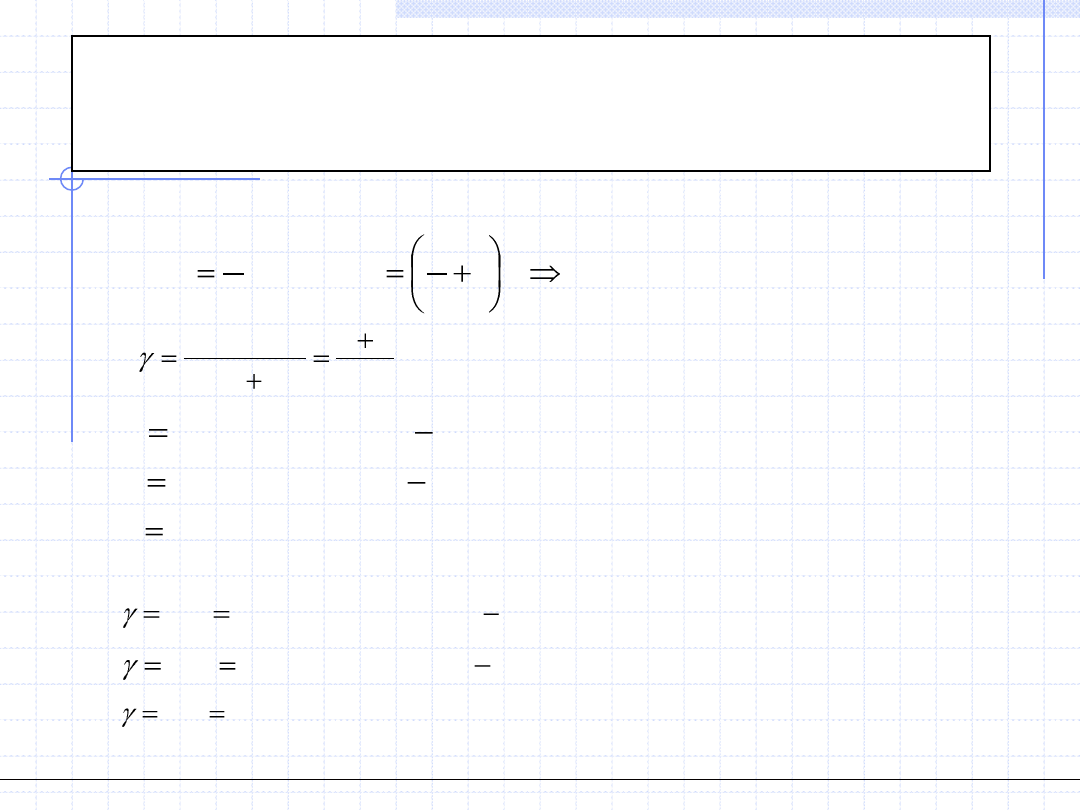
Wielkość γ dla gazów doskonałych jest stała i wynosi:
R
k
c
R
k
c
GD
p
GD
v
1
2
2
)
(
)
(
:
2
)
1
2
/
(
)
2
/
(
gdzie
k
k
R
k
R
k
atomowych
gazów
dla
k
1
3
atomowych
gazów
dla
k
2
5
wych
wieloatomo
gazów
dla
k
6
atomowych
gazów
dla
1
667
.
1
3
/
5
atomowych
gazów
dla
2
4
.
1
5
/
7
wych
wieloatomo
gazów
dla
333
.
1
6
/
8
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
29
)
(
)
(
)
(
)
(
2
1
)
(
.
)
(
2
1
T
T
c
u
dv
v
p
w
v
GD
const
s
v
v
GD
const
s
p
v
1(p
1
,v
1
,T
1
)
2(p
2
,v
2
,T
2
)
Przemiana adiabatyczna cd.
.
const
RT
pv
.
const
pv
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
30
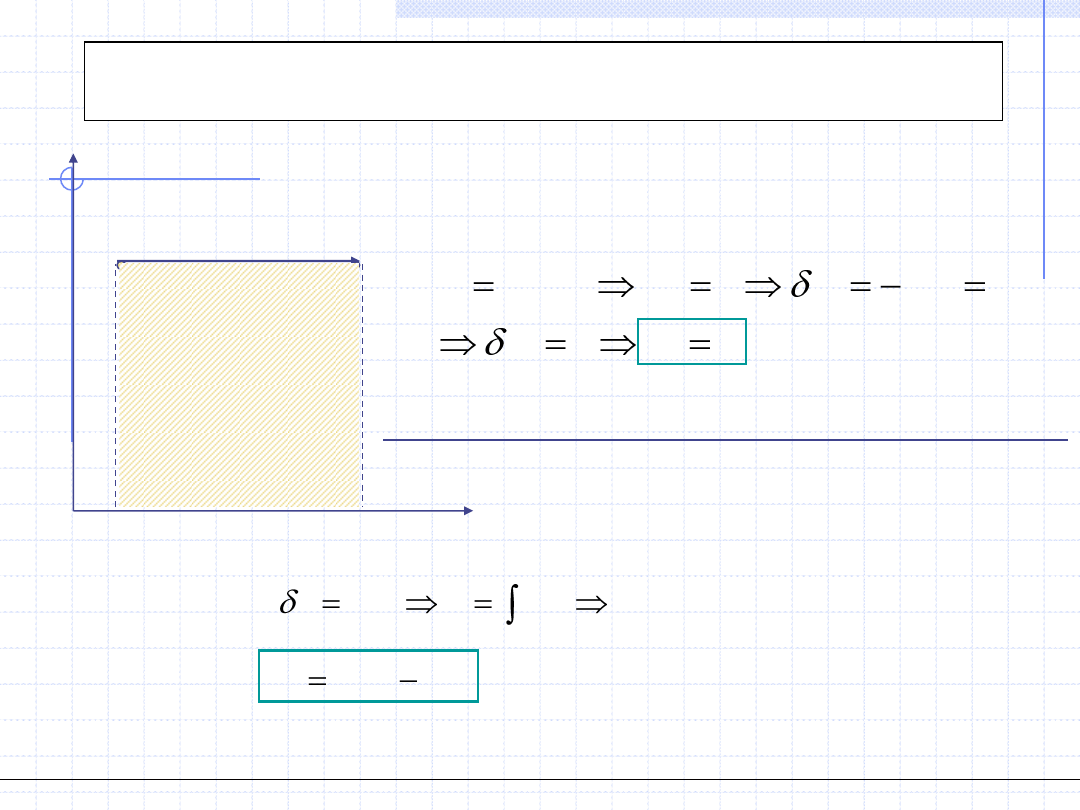
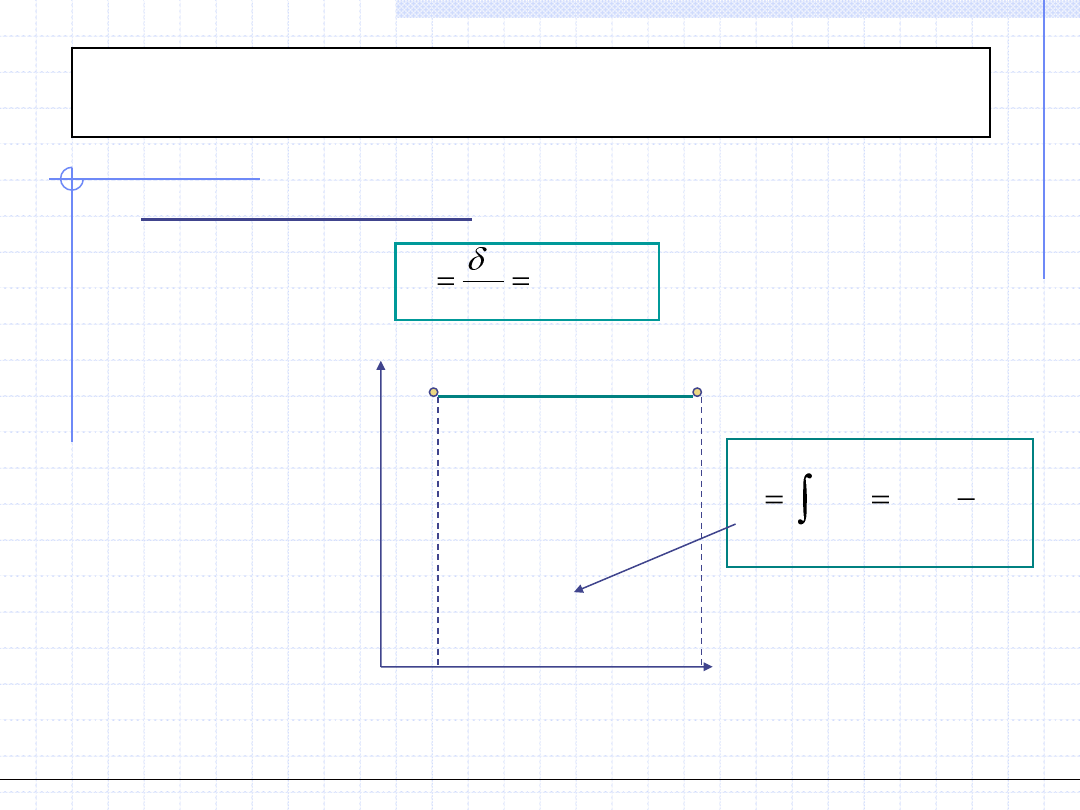
Przemiana politropowa
.
const
dT
q
c
W przemianie politropowej stała jest pojemność cieplna układu:
T
1(p
1
,v
1
,T
1
)
2(p
2
,v
2
,T
2
)
c
2
1
)
(
1
2
T
T
T
T
c
cdT
q
Szczególnie proste do obliczenia w przemianie politropowej jest ciepło przemiany,
które jest równe polu prostokąta na wykresie c – T.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
31
Przemiana politropowa gazu
doskonałego
Rozpatrzmy teraz przemianę politropową gazów doskonałych.
Podobnie jak dla przemiany adiabatycznej wychodząc z I zasady termodynamiki
i uwzględniając własności gazów doskonałych oraz definicję pojemności cieplnej
można wyprowadzić tzw. równanie politropy:
const
pv
m
)
(
)
(
)
(
)
(
GD
GD
v
GD
GD
p
c
c
c
c
m
gdzie
Bezwymiarowa wielkość „m” jest to wykładnik politropy i ma znaczenie
analogiczne jak wykładnik adiabaty.
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
32
)
(
.
m
const
pv
m
p
1(p
1
,v
1
,T
1
)
2(p
2
,v
2
,T
2
)
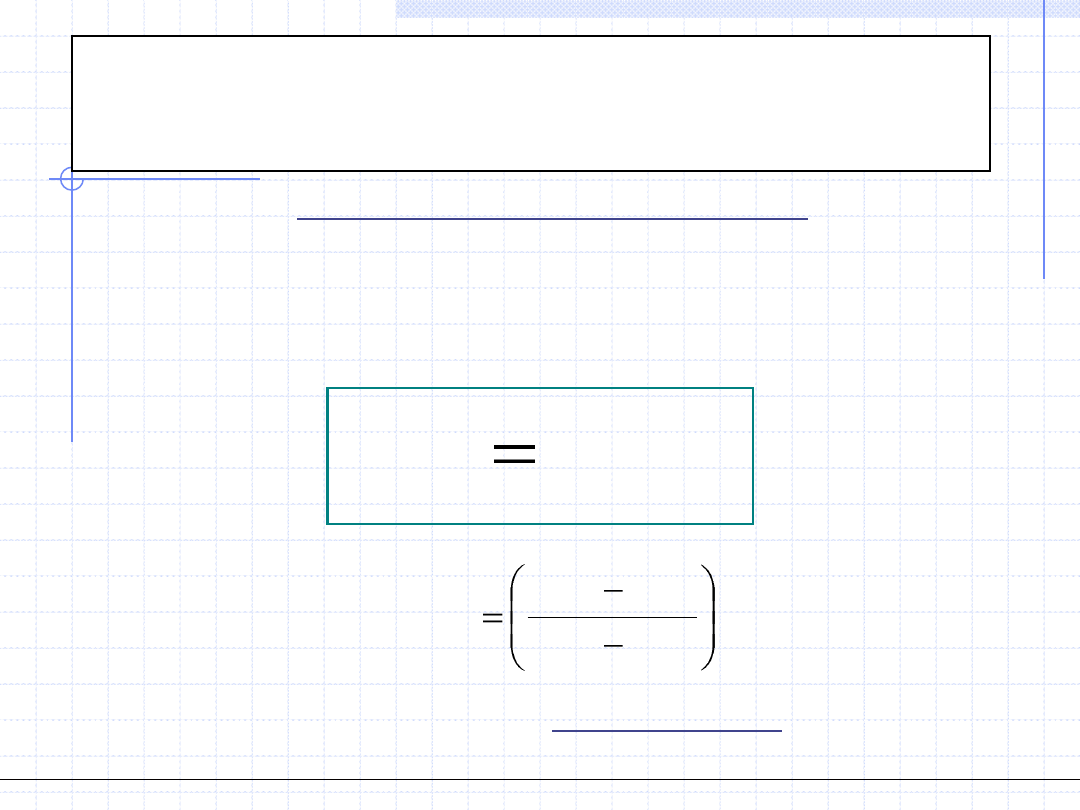
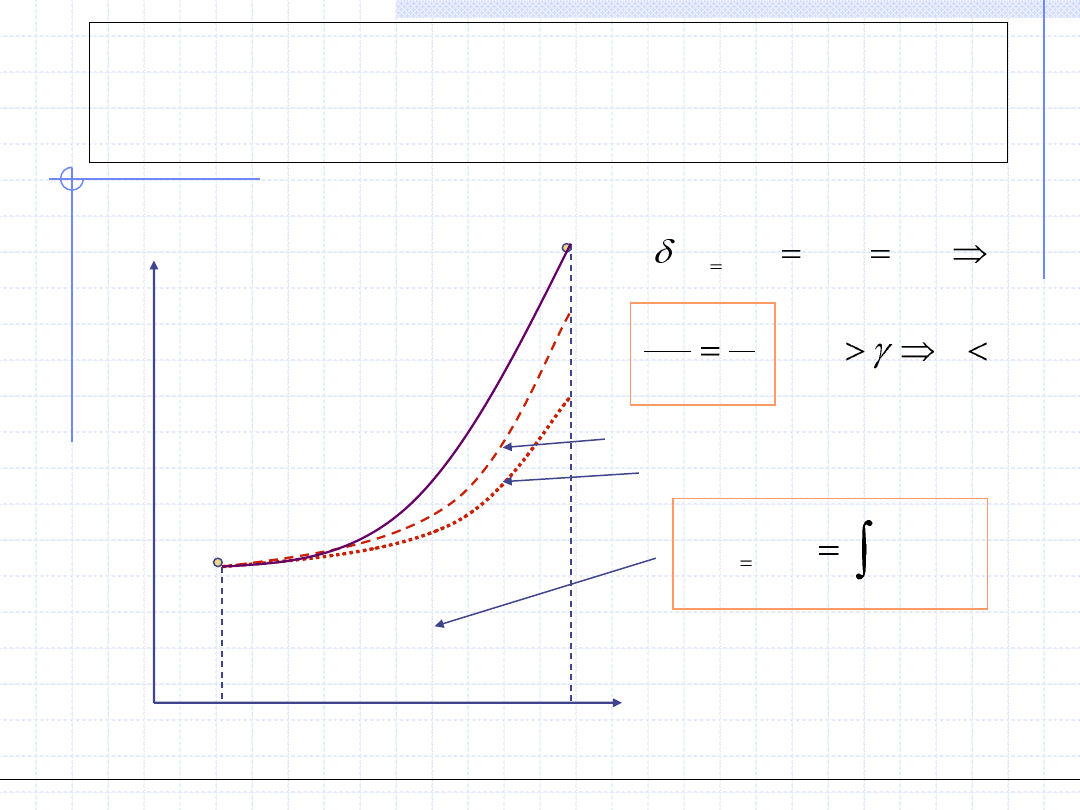
Przemiana politropowa
Wykres w układzie p - v
.
const
RT
pv
.
const
pv
v
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
33
2
1
)
(
)
(
.
s
s
const
c
ds
s
T
q
T
s
1
2
s
1
s
2
Tds
cdT
q
const
c
.
)
(
v=const.
Przemiana politropowa
Wykres w układzie T - s
p=const.
v
c
c
m
c
T
ds
dT
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
34
p
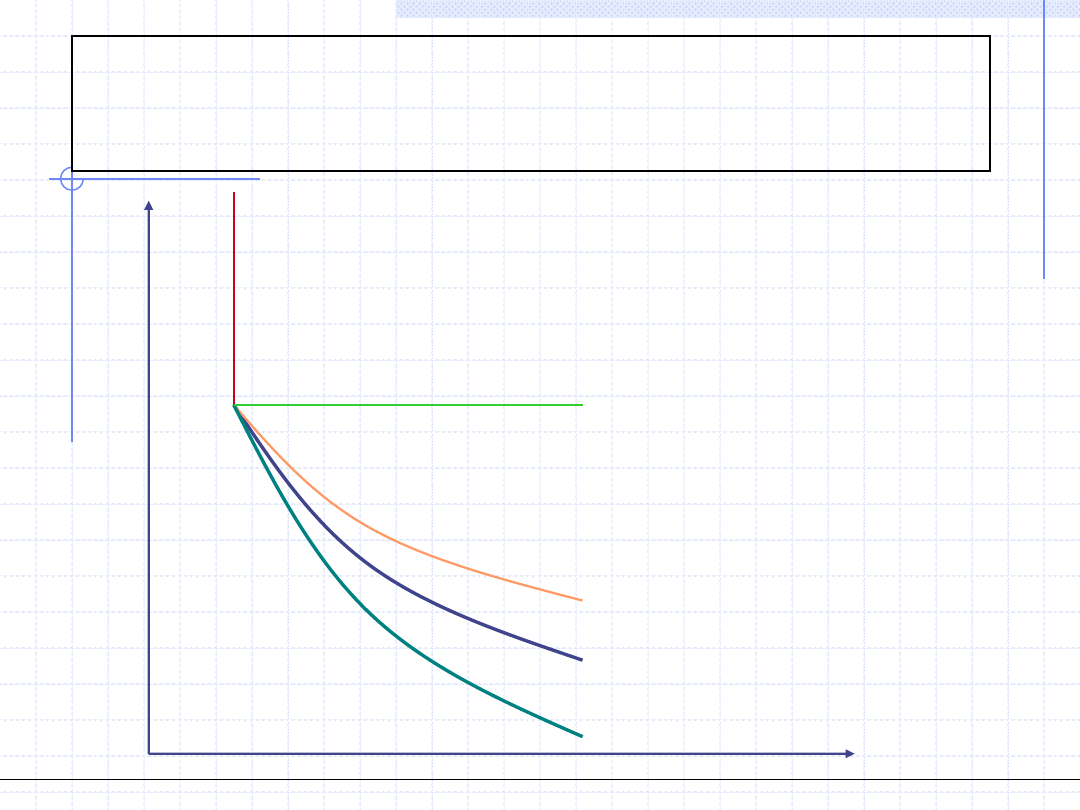
Porównanie przemian na
wykresie p -v
v
v=const., izochora
p=const., izobara
T=const., izoterma
s=const., izentropa(adiabata)
c=const., politropa (m>γ)
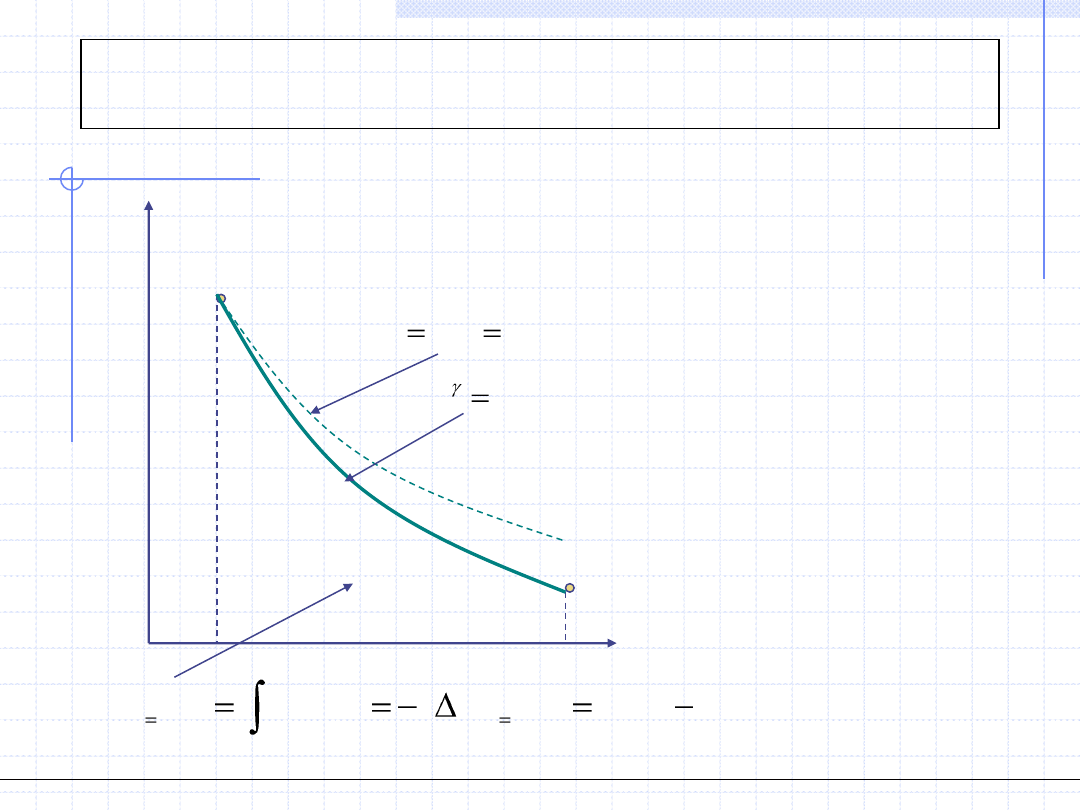
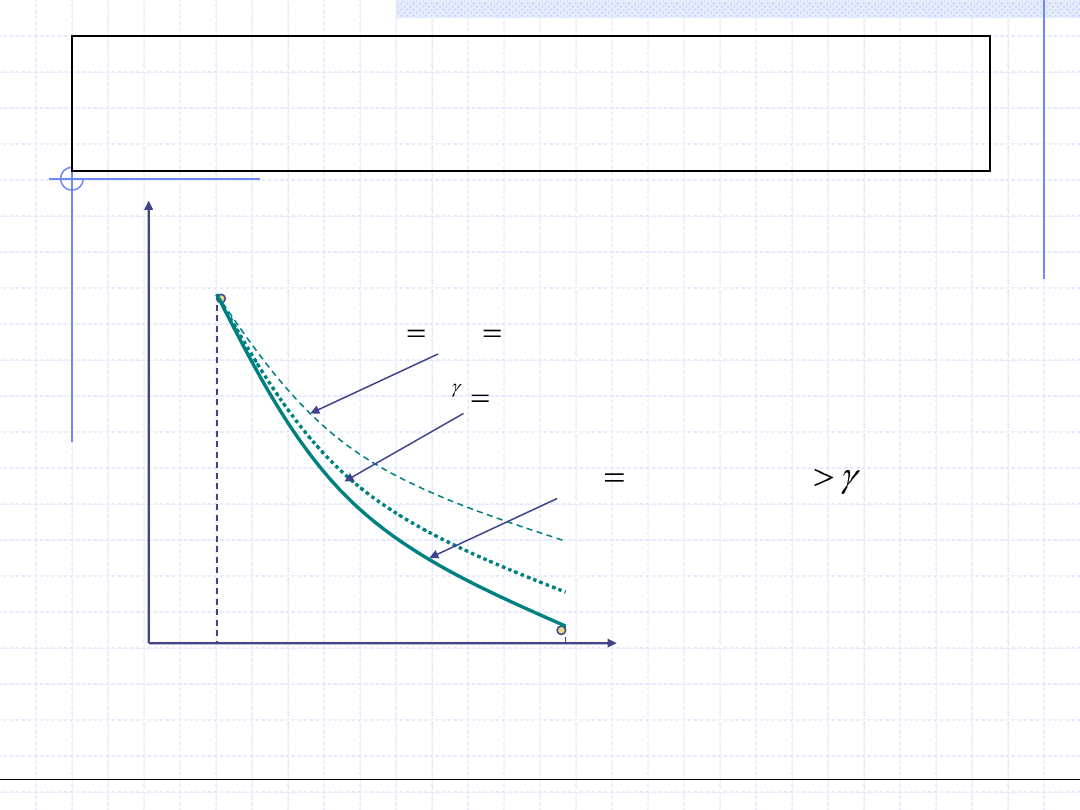
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
35
T
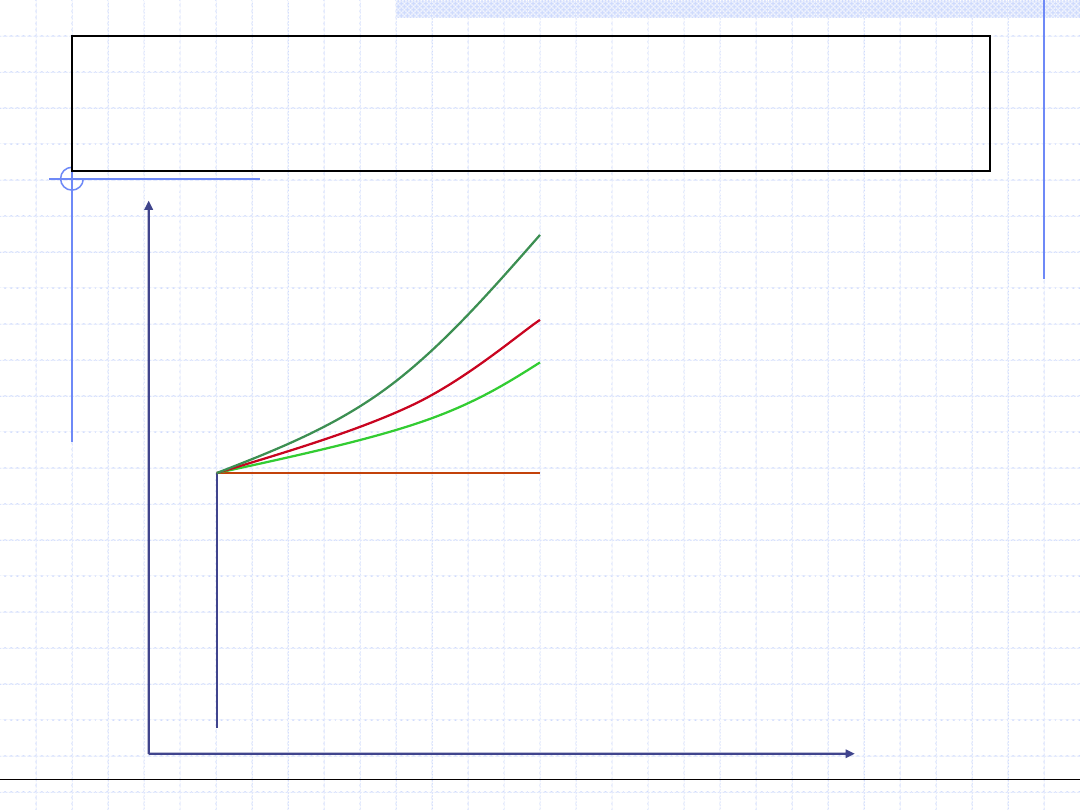
Porównanie przemian na
wykresie T - s
s
v=const., izochora
p=const., izobara
T=const., izoterma
s=const., izentropa(adiabata)
c=const., politropa (m>γ)
© Prof. Antoni Kozioł, Wydział Chemiczny Politechniki Wrocławskiej, 2010/2011
36
Dziękuję bardzo Państwu za uwagę
Wyszukiwarka
Podobne podstrony:
Ogolnotech dla Bio Ir WYKLAD IX
Ogolnotech(dla Bio Ir) WYKLAD XI
Ogolnotech dla Bio IV WYKLAD VII
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech dla Bio WYKLAD VI
Ogolnotech(dla Bio I) WYKLAD I
Ogolnotech(dla Bio I) WYKLAD V
Ogolnotech dla Bio I WYKLAD III
Ogolnotech(dla Bio I) WYKLAD IX
Ogolnotech dla Bio I WYKLAD IV
Ogolnotech(dla Bio I) W VI
Ogolnotech(dla Bio I) W X
Ogolnotech(dla Bio I) W VI
więcej podobnych podstron